альфазокс курс лечения сколько дней
Бакулина Н.В., Тихонов С.В., Лищук Н.Б. Альфазокс – инновационное медицинское изделие с доказанным эзофагопротективным потенциалом. Consilium Medicum. Гастроэнтерология | Хирургия | Интенсивная терапия. (Прил.) 2019; 02: 17-23.
Альфазокс – инновационное медицинское изделие с доказанным эзофагопротективным потенциалом
Н.В. Бакулина, С.В. Тихонов, Н.Б. Лищук
Аннотация. Статья посвящена инновационному медицинскому изделию с доказанным эзофагопротективным потенциалом – Альфазоксу, в состав которого входят гиалуроновая кислота и хондроитина сульфат, нанесенные на биоадгезивный носитель полоксамер 407. Проведенные доклинические и клинические исследования с применением Альфазокса продемонстрировали высокую эффективность и безопасность данного медицинского изделия у пациентов с гастроэзофагеальной рефлюксной болезнью.
Ключевые слова: гастроэзофагеальная рефлюксная болезнь, эзофагопротектор, Альфазокс, гиалуроновая кислота, хондроитина сульфат, полоксамер 407.
Для цитирования: Бакулина Н.В., Тихонов С.В., Лищук Н.Б. Альфазокс – инновационное медицинское изделие с доказанным эзофагопротективным потенциалом. Гастроэнтерология. Хирургия. Интенсивная терапия. Consilium Medicum. 2019; 2: 17–23. DOI: 10.26442/26583739.2019.2.190404
Alfasoxx is an innovative nonprescription medication with proven esophagoprotective potential
Natalya V. Bakulina, Sergey V. Tikhonov, Nadezhda B. Lishchuk
I.I. Mechnikov North-Western State Medical University, Saint Petersburg, Russia sergeyvt2702@ gmail.com
Abstract. The article presents the innovative nonprescription medication with proven esophagoprotective potential. Alfasoxx is consist of a mixture of hyaluronic acid and chondroitin sulfate with poloxamer 407, which facilitates the product adhesion on the esophageal mucosa. Conducted preclinical and clinical studies of Alfasoxх demonstrated the high efficacy and safety of this nonprescription medication in patients with gastroesophageal reflux disease.
Key words: gastroesophageal reflux disease, esophagoprotector, Alfasoxx, hyaluronic acid, chondroitin sulfate, poloxamer 407.
For citation: Bakulina N.V., Tikhonov S.V., Lishchuk N.B. Alfasoxx is an innovative nonprescription medication with proven esophagoprotective potential. Gastroenterology. Surgery. Intensive care. Consilium Medicum. 2019; 2: 17–23. DOI: 10.26442/26583739.2019.2.190404
Введение
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) является наиболее распространенным гастроэнтерологическим заболеванием, при этом эффективность стандартных подходов к терапии ГЭРБ нельзя признать удовлетворительной, так, различные комбинации ингибиторов протонной помпы (ИПП), антацидов и альгинатов недостаточно эффективны у 25% больных [1]. ГЭРБ относится к часто рецидивирующим заболеваниям, данное положение подтверждается тем, что более чем у 80% пациентов рефлюкс-эзофагит (РЭ) рецидивирует в течение года, возобновление симптомов рефлюкса встречается у 75% пациентов с неэрозивной рефлюксной болезнью (НЭРБ) на фоне прекращения медикаментозной терапии [2].
В 2018 г. в Российской Федерации был зарегистрирован первый эзофагопротектор. Медицинское изделие Альфазокс включает в свой состав гиалуроновую кислоту (ГК), хондроитина сульфат (ХС) и поверхностно-активное вещество полоксамер 407, обладающее выраженными биоадгезивными свойствами. Полоксамер 407 опосредует надежный и длительный контакт комплекса ГК–ХС со слизистой оболочкой (СО) пищевода, способствуя ее защите от воздействия агрессивного желудочного рефлюктата. Альфазокс обеспечивает дополнительную защиту пищевода на преэпителиальном и эпителиальном уровнях, что способствует снижению воспаления и заживлению эрозивных повреждений СО пищевода [3, 4].
Патогенез ГЭРБ
ГЭРБ является гетерогенным заболеванием со сложным патогенезом, в основе которого, согласно классическим представлениям, лежит патологический гастроэзофагеальный рефлюкс (ГЭР) [5]. Патологические ГЭР могут возникать вследствие:
Оценка рН-импедансометрии проводилась в соответствии с Лионским консенсусом от 2018 г. – последним согласительным документом, посвященным диагностическим критериям суточной рН-импедансометрии в диагностике ГЭРБ [6]. У пациентки время с рН 6% является патологией), также в пределах физиологической нормы было и количество ГЭР в течение суток – менее 40 (>80 ГЭР является патологией). Количество эпизодов ГЭР является дополнительным показателем, который следует использовать, когда время с рН
Экспертно о заболевании
Что такое ГЭРБ?
Агрессивное содержимое желудка повреждает слизистую оболочку пищевода, что приводит к возникновению изжоги (чувство жжения за грудиной), которая может усиливаться при погрешностях в диете, приеме алкоголя, газированных напитков, физическом напряжении и в горизонтальном положении.
А знаете ли вы, что многие понимают под изжогой ощущения, которые изжогой не являются: отрыжка воздухом, отрыжка кислым, чувство комка в горле?
Также ГЭРБ может прятаться под маской других заболеваний и проявляться не совсем типичными симптомами: кашель, осиплость голоса, эрозии зубной эмали. При этом классического симптома изжоги может и не быть.
ГЭРБ является хроническим заболеванием, даже после полного курса лечения симптомы заболевания могут возвращаться.
ГЭРБ накладывает негативный отпечаток на все сферы жизни: по ночам нарушается сон; физическая активность вызывает усиление симптомов. Зачастую ГЭРБ вынуждает человека отказаться от привычного образа жизни и ухудшает его психологическое состояние.
Причины возникновения заболевания
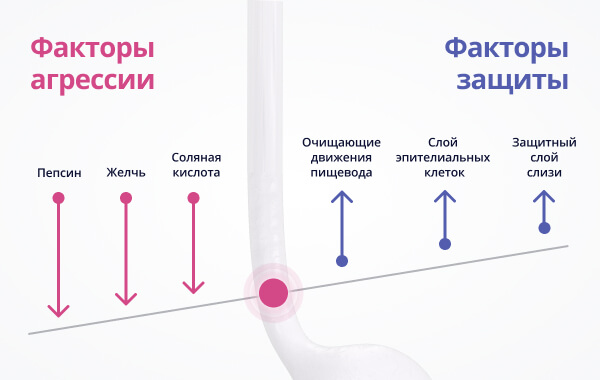
Факторы защиты:
Факторы повреждения:
Результатом длительного действия повреждающих факторов на эпителий пищевода является повреждение слизистой оболочки пищевода, появление на ней эрозий и язв.
А знаете ли вы, что источником неприятных симптомов при ГЭРБ является повреждение слизистой оболочки пищевода?
Развитию ГЭРБ также способствуют избыточная масса тела, курение, прием алкоголя.
Чем опасна ГЭРБ?
Многие пациенты с симптомами ГЭРБ, к сожалению, не знают, к каким последствиям может привести данное состояние, если его не лечить, а лишь устранять симптомы.
Регулярные забросы в пищевод агрессивного содержимого желудка и двенадцатиперстной кишки вызывают:
В последние десятилетия наблюдается рост заболеваемости рака пищевода, который развивается у 0,4-0,6% больных с пищеводом Баррета.
Диагностика
Обычно диагноз ставится на основании жалоб, которые врач выявляет во время опроса.
В большинстве случаев врач направит пациента на гастроскопию для подтверждения диагноза и выявления возможных осложнений.
Перед проведением эндоскопического исследования потребуется сдать анализы.
Пациентам с наличием осложнений, а также в случае неэффективности назначенного врачом лечения потребуются дополнительные обследования:
Лечение
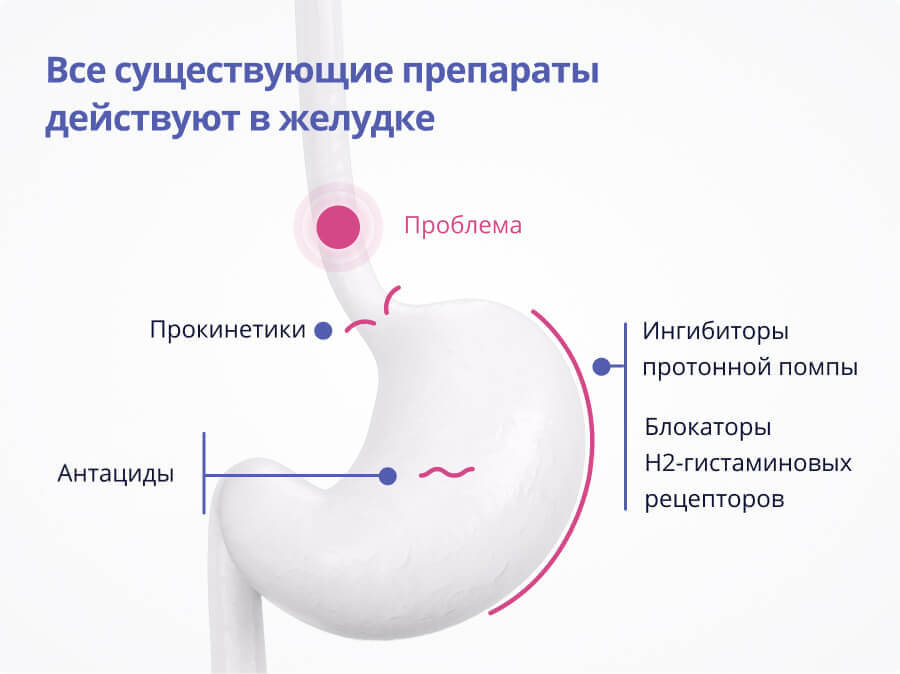
Существует несколько основных групп препаратов для лечения ГЭРБ:
А знаете ли вы, что все существующие препараты для лечения ГЭРБ действуют в желудке, при том, что симптомы ГЭРБ вызваны повреждением слизистой пищевода?
Базовыми препаратами в лечении ГЭРБ признаны ИПП. Для эффективного устранения симптомов ГЭРБ на продолжительный срок требуется длительная терапия в течение 6-12 недель, длительность лечения определяет врач.
А знаете ли вы, если прекратить назначенный врачом курс терапии раньше времени, вероятность рецидива симптомов в течение года составляет 90-98%?
Почему существующая терапия бывает неэффективна (нерешенные вопросы в лечении ГЭРБ)
Традиционная терапия ГЭРБ направлена на нейтрализацию агрессивного желудочного содержимого. Перечисленные выше препараты «работают» в желудке и никак не защищают слизистую оболочку пищевода. Более того, данные препараты снижают агрессивность воздействия соляной кислоты, но никак не защищают, например, от пепсина, который обладает более сильным повреждающим действием на пищевод.
А ведь именно повреждение слизистой пищевода является причиной появления изжоги, жжения, боли и развития осложнений.
Целенаправленная защита и восстановление слизистой пищевода – одна из целей в лечении ГЭРБ, но до сегодняшнего дня не существовало препаратов, способных решить эту задачу.
Защита слизистой оболочки пищевода — недостающее звено в лечении ГЭРБ
Эзофагопротекция или защита слизистой оболочки пищевода – это абсолютно новый подход к лечению, который расширяет возможности помощи страдающим от симптомов ГЭРБ, позволяет существенно повысить эффективность терапии и изменить естественное течение заболевания.
Альфазокс способен фиксироваться на слизистой оболочке пищевода и механически защищать ее от агрессивного повреждающего действия желудочного содержимого. Он оказывает прямое заживляющее и восстанавливающее действие на поврежденную слизистую пищевода.
Адаптация образа жизни
Изменение образа жизни — это важная часть эффективного лечения рефлюксной болезни*, которая столь же необходима для стойкого результата, как и лекарственные препараты, назначенные врачом.
Российское общество гастроэнтерологов дает следующие рекомендации:
Рекомендации по диете всегда индивидуальны: отказ от шоколада, кофе, кислых соков, острой и жирной пищи, газированных напитков и пр. не всегда приводит к уменьшению неприятных симптомов и отказываться от любимых продуктов бывает совсем не оправданно. Исключать эти продукты из рациона нужно в том случае, если вы заметили, что они способствуют появлению или усилению симптомов ГЭРБ 8
Современные препараты для лечения язвы
Поделиться:
Язвенная болезнь желудка и двенадцатиперстной кишки по-прежнему остается одной из самых частых проблем ЖКТ. В последние годы подходы к лечению язвы постепенно изменяются в связи с выдающимися достижениями микробиологии, физиологии и анатомии.
Что такое язва
Морфологический субстрат — язва — представляет собой дефект слизистой оболочки, который образуется под агрессивным воздействием желудочного содержимого на фоне сниженной способности слизистой к восстановлению и защите самой себя. Все направления терапии сводятся к устранению этих факторов агрессии и повышению защитных свойств слизистой.
Ингибиторы протонной помпы и их действие
В лечении язвы на первом месте стоит проблема повышенной кислотности, и пути решения этой проблемы были разработаны десятки лет назад, после открытия в 1973 году особого белкового «насоса» — протонной помпы, поставляющей протоны водорода для образования соляной кислоты в желудке.
Читайте также:
Как лечить язву желудка
Ингибиторы протонной помпы (ИПП) впервые заявили о себе в 1974 году, когда был синтезирован первый представитель этого ряда. А уже через 5 лет он появился на рынке в виде широко известного сегодня омепразола.
В настоящее время существует уже 5 поколений ИПП, а в России зарегистрированы 6 таких препаратов: омепразол, пантопразол, лансопразол, рабепразол, эзомепразол, декслансопразол.
Лекарства различаются в основном по их фармакокинетике — т. е. «пути» по организму к органу-мишени. Традиционно используемый омепразол прочно занимает лидирующие позиции, но фармацевтическое производство не стоит на месте, и другие препараты из этой же группы на данный момент представляют большой интерес.
К примеру, у лансопразола минимальная действующая доза особенно мала. Он начинает действовать быстрее, чем всем известный омепразол, но и стоит дороже. Декслансопразол имеет модифицированное высвобождение и длительное действие, которое продолжается даже ночью, что позволяет избежать так называемого «ночного кислотного прорыва» (повышения кислотности ночью).
Еще одной проблемой, которую позволяют решить современные ингибиторы, является устойчивость к ним — например, рабепразол не зависит от действия ферментов, вызывающих эту самую устойчивость. Он также не влияет на метаболизм других лекарственных средств, что нередко бывает проблемой при использовании омепразола. В отношении безопасности взаимодействия с другими препаратами хорошие результаты также дает пантопразол.
Для подбора наиболее подходящего препарата используют 24-часовую pH-метрию. Она нужна, чтобы отследить состояние среды в ЖКТ и ее изменение под действием лекарства. Обычно лекарства применяют месяцами для того, чтобы язва «зажила» — т. е. образовался рубец. Но, по данным некоторых исследований, эпителизация язвы под действием омепразола в 95 % случаев происходит уже через 8 недель.
Для того чтобы отследить процесс рубцевания, целесообразно провести ФГДС через 1–1,5 месяца после начала лечения, поскольку, во-первых, ИПП, как и все лекарства, имеют свои побочные эффекты, и длительное бесконтрольное их применение нежелательно, а во-вторых, это позволит оценить эффективность терапии вообще и снять с повестки вопрос о необходимости замены препарата или, наоборот, искать замену.
Последние рекомендации и вовсе рекомендуют принимать ИПП в пределах эрадикационной схемы (7–14 дней в зависимости от ее эффективности). Но если язва образовалась вне связи с Helicobacter рilori, имеет смысл поддерживать кислотность ингибиторами протонной помпы до заживления язвы.
Блокаторы Н2-гистаминовых рецепторов
Другая группа препаратов, которая снижает кислотность желудка, действует опосредованно, блокируя рецепторы гистамина. Гистамин повышает образование соляной кислоты, пепсина. За открытие эффектов этого вещества в 1936 году была присуждена Нобелевская премия по медицине.
Препараты, соответственно, называются блокаторы Н2-гистаминовых рецепторов. Кроме основного эффекта — уменьшения кислотообразования — они также усиливают защитные свойства слизистой, повышая образование бикарбонатов и простагландинов, которые являются ее естественными защитниками.
Основными представителями этой группы являются ранитидин, фамотидин, циметидин. До появления ИПП эти препараты были лидерами в кислотоподавлении, но с приходом омепразола им пришлось потесниться. В настоящее время данная группа препаратов применяется как альтернатива или дополнение к терапии ИПП. Особенно эффективны внутривенные формы препаратов, которые позволяют быстро купировать болевой синдром при обострении язвенной болезни.
Борьба с бактериями
Роль Helicobacter рilori в развитии язвенной болезни была доказана в 1990-х годах американскими учеными Робином Уорреном и Барри Маршаллом, которые в 2005-м получили за это Нобелевскую премию по медицине. Эта бактерия обладает прямым повреждающим действием на эпителий желудка, поселяясь на нем и фактически его и разрушая.
Однако, по мнению некоторых ученых, колонизация Helicobacter рilori не всегда означает развитие язвы, а в случае, если это все же произошло, говорит скорее о сбоях в иммунной системе. Тем не менее бактерию необходимо ликвидировать.
Сообществом гастроэнтерологов выработаны схемы по эрадикации, которые основаны на международных соглашения экспертов Маастрихтской согласительной конференции. Поскольку эти схемы включают в себя антибиотики, которые применяются уже достаточно длительное время, необходимо учитывать возможную резистентность микроорганизмов к препаратам первой линии и желательно контролировать эффективность терапии на всем ее протяжении. Для этого можно использовать большой арсенал современных методов — как ФГДС с прямой биопсией и микроскопией, так и дыхательный тест.
В случае неэффективности первой линии нужно приступать к смене антибиотика следующим же курсом. Современные диагностические центры обладают необходимой аппаратурой для проведения проб на чувствительность к антибиотику, а также определения минимальной концентрации лекарства, необходимой для подавления бактерии: возможно, доза, которую вы получаете, недостаточна для ликвидации микроба.
Пробиотики
Еще одним перспективным направлением в лечении язвы является использование пробиотиков, которые не только нормализуют микрофлору после агрессивного действия антибиотиков, но и способствуют укреплению иммунитета, как местного, так и общего.
Поскольку в желудке среда кислая, разнообразие штаммов микроорганизмов, которые могут там успешно выживать и помогать организму бороться с язвой, ограничено. Фактически таким микроорганизмам может требоваться подкрепление, которое и приходит в виде пробиотиков. Здесь имеет значение форма выпуска препарата — кислотоустойчивые капсулы будут иметь большое преимущество.
Средством, успешно сочетающим эти характеристики, является бифиформ, который был исследован в 2005 году в рамках противоязвенной терапии как дополнительный компонент к стандартной схеме. У больных, которые его принимали, удалось исправить иммунные нарушения и добиться более высокого процента ликвидации бактерии Helicobacter pilori и заживления дефекта. Препарат включал в себя 2 штамма — Bifidobacterium longum и Enterococcus faecium.
В ряде исследований нашел эффективное применение другой штамм — Saccharomyces boulardii, применение пробиотика на его основе улучшило как результаты лечения, так и его переносимость. Что важно, прием пробиотиков необходимо осуществлять более длительно, чем саму эрадикационную схему, — на 2 и более недели дольше.
Препараты ближайшего будущего
Патогенез язвенной болезни довольно сложен и включает в себя также и влияние стресса, лекарственных препаратов (к примеру, НПВС достоверно ухудшают течение язвенной болезни и могут послужить причиной самостоятельной патологии — лекарственной язвы). В рамках решения этой проблемы были исследованы препараты, которые защищают слизистую от этих воздействий: мексидол, гипоксен, диосмин.
Все они относятся к разным группам по своему строению, но имеют общие свойства — антигипоксическое и антиоксидантное. Данные препараты пока не вошли в клиническую практику для лечения язвенной болезни, они еще только рекомендуются к клиническим испытаниям, но первую фазу — эксперименты на животных — эти средства уже успешно прошли.
Среди препаратов, которые в практике используются для защиты желудка, стоит упомянуть о гевисконе. В своем составе он имеет альгинат натрия (добывается из водорослей), который при взаимодействии с кислотой образует защитную пленку. В отличие от других лекарств гевискон не имеет системного действия и может использоваться длительное время без побочных эффектов.
Еще одна группа лекарств — защитников слизистой — это препараты простагландинов. Они улучшают кровоток в оболочке желудка, стимулируют образование защитной слизи и бикарбонатов.
Хорошо зарекомендовали себя синтетические аналоги простагландинов, поскольку они обладают более продолжительным эффектом: мизопростол, арбопростил, риопростил. Их терапевтическую эффективность можно сравнить с блокаторами Н2-гистаминовых рецепторов.
Для заживления язв будут полезны другие вещества — «репаранты». Они способствуют заживлению уже образовавшихся дефектов, однако механизм действия их еще недостаточно изучен и довольно сложен. Среди репарантов выделяются метилурацил (метацил) и пентоксил. Оба лекарства стимулируют процесс заживления и регенерации. Форма выпуска — таблетки.
Современная медицина располагает большими возможностями и в диагностике, и в лечении язвенной болезни благодаря научным открытиям в практической медицине и развитию фармацевтической промышленности. Это предоставляет возможность подходить к терапии язвы индивидуально, подбирая препараты с учетом их эффективности у конкретного человека.
Наряду с традиционными схемами эрадикации исследуются способы восстановления защитных свойств желудка, ускорения заживления язв. Соответствующие препараты следует иметь в виду при назначении комплексной противоязвенной терапии.
Товары по теме: [product strict=» омепразол»]( омепразол), [product strict=» пантопразол»]( пантопразол), [product strict=» лансопразол»]( лансопразол), [product strict=» РАБЕПРАЗОЛ-СЗ»]( рабепразол) [product strict=» эзомепразол»]( эзомепразол) [product strict=» ранитидин»]( ранитидин) [product strict=» фамотидин»]( фамотидин) [product strict=» бифиформ»]( бифиформ) [product strict=» метилурацил»]( метилурацил) [product strict=» мексидол»]( мексидол) [product strict=» гипоксен»]( гипоксен) [product strict=» диосмин»]( диосмин)
Альфазокс, раствор для приема внутрь, 10 мл, 20 шт.
Инструкция на Альфазокс раствор для приема внутрь, 10 мл, 20 шт.
Состав
Раствор для приема внутрь Альфазокс, пакетики – саше 10 мл, в упаковке 20 пакетиков – саше.
Ингредиенты: натрия гиалуронат, хондроитина сульфат натрия, ксилитол С, полоксамер 407, поливинилпирролидон, бензоат натрия, сорбат калия, ароматизатор, вода.
Описание
ОПИСАНИЕ МЕДИЦИНСКОГО ИЗДЕЛИЯ
Прозрачная жидкость янтарно-жёлтого цвета с фруктовым запахом. рН: 5,00 ± 0,2. Плотность: 1,10 ± 0,05. Вязкость: 0-150 ц/с
ПРИНЦИП ДЕЙСТВИЯ:
Медицинское изделие Альфазокс действует механически, обеспечивая быстрое устранение симптомов, обусловленных гастроэзофагеальным рефлюксом (ГЭР).
Гастроэзофагальная рефлюксная болезнь (ГЭРБ) характеризуется такими симптомами как изжога, кислотный рефлюкс либо некислотный (смешанный, щелочной) рефлюкс, кашель и дисфония, которые могут быть связаны с наличием эрозивных дефектов слизистой пищевода. Выраженность симптомов ГЭРБ часто усиливается в положении на спине, поэтому состояние пациентов ухудшается в ночное время.
Комбинация гиалуроновой кислоты и хондроитина сульфата обеспечивает защиту слизистой оболочки желудка и пищевода. Наличие в составе Альфазокс компонента «Полоксамер 407», обладающего высокой способностью к биоадгезии, обеспечивает надёжный контакт комплекса «гиалуроновая кислота – хондроитина сульфат» с поверхностью стенки пищевода, способствуя её защите от агрессивного воздействия соляной кислоты желудка. Хондроитина сульфат также способствует восстановлению слизистой оболочки пищевода и желудка. Альфазокс способствует снижению воспаления и заживлению эрозий слизистой при эзофагитах и гастродуоденитах.
ПОКАЗАНИЕ К ПРИМЕНЕНИЮ
Лечение гастроэзофагеального рефлюкса
Способ применения и дозы
Пакетики-саше: по 1 пакетику (10 мл) после основных приёмов пищи и перед сном или в соответствии с рекомендациями врача.
Альфазокс: Противопоказания
Не рекомендуется применять Альфазокс в случаях известной или подозреваемой повышенной чувствительности к любому его компоненту.
Не рекомендуется применять Альфазокс беременным и кормящим женщинам, так как соответствующие исследования не проводились.
Меры предосторожности
УКАЗАНИЯ ПО БЕЗОПАСНОСТИ
Нельзя превышать рекомендованную дозу. Если симптомы ГЭР сохраняются, или возникли нежелательные явления, необходимо обратиться к врачу. Нельзя применять после истечения срока годности, указанного на упаковке. Не замораживать. Хранить в недоступном для детей месте.
Условия хранения
При температуре от +5 °C до +30 °C. Не замораживать.
УТИЛИЗАЦИЯ ИЗДЕЛИЯ: утилизируется как домашний мусор.
Новый подход к лечению гастроэзофагеальной рефлюксной болезни: защита слизистой оболочки пищевода
Расширение межклеточных пространств обнаруживается у всех больных гастроэзофагеальной рефлюксной болезнью (ГЭРБ) независимо от наличия эрозий пищевода. В связи с этим расширение межклеточных пространств принято считать гистологическим маркером ранних повреждений слизистой оболочки вследствие рефлюкса. В лечении больных ГЭРБ используется комплексный подход с применением препаратов, снижающих повреждающие свойства рефлюктата, улучшающих пищеводный клиренс и защищающих слизистую оболочку пищевода. Недостаточное уменьшение выраженности симптомов на фоне адекватной терапии ингибиторами протонной помпы (ИПП) может быть связано с сохранением микроскопических изменений слизистой оболочки, вызванных слабокислым рефлюксом, пепсином или другими компонентами рефлюктата. Новым современным подходом признана терапия ИПП с добавлением препаратов, способных усиливать защиту слизистой оболочки пищевода.
Расширение межклеточных пространств обнаруживается у всех больных гастроэзофагеальной рефлюксной болезнью (ГЭРБ) независимо от наличия эрозий пищевода. В связи с этим расширение межклеточных пространств принято считать гистологическим маркером ранних повреждений слизистой оболочки вследствие рефлюкса. В лечении больных ГЭРБ используется комплексный подход с применением препаратов, снижающих повреждающие свойства рефлюктата, улучшающих пищеводный клиренс и защищающих слизистую оболочку пищевода. Недостаточное уменьшение выраженности симптомов на фоне адекватной терапии ингибиторами протонной помпы (ИПП) может быть связано с сохранением микроскопических изменений слизистой оболочки, вызванных слабокислым рефлюксом, пепсином или другими компонентами рефлюктата. Новым современным подходом признана терапия ИПП с добавлением препаратов, способных усиливать защиту слизистой оболочки пищевода.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – одна из самых распространенных патологий в структуре кислотозависимых заболеваний. Распространенность ГЭРБ в странах Западной Европы колеблется от 10% в Испании и Великобритании до 17% в Швеции, в США – от 13 до 29% [1]. Данный показатель в Москве составляет 23,6%, в городах России, согласно результатам исследования МЭГРЕ, – 11,3–14,3% [2].
Высокая распространенность, тенденция к увеличению заболеваемости на всех континентах, хроническое рецидивирующее течение, негативное влияние на качество жизни и психологический статус, сложности лечения выделяют ГЭРБ среди других заболеваний органов пищеварения и обусловливают необходимость разработки новых алгоритмов ведения этой группы больных.
В основе патогенеза заболевания лежат моторные нарушения, приводящие к дисфункции антирефлюксных механизмов и возникновению патологического гастроэзофагеального рефлюкса (ГЭР), источником которого является «кислотный карман» [3]. Результат воздействия ГЭР на слизистую оболочку пищевода зависит от состава, длительности воздействия (определяется адекватностью пищеводного клиренса) и собственной резистентности слизистой оболочки пищевода [4]. Прослеживается четкая связь между риском развития рефлюкс-эзофагита и длительностью закисления пищевода. Сама по себе соляная кислота характеризуется незначительным повреждающим потенциалом на многослойный плоский эпителий пищевода. На ситуацию влияет наличие в содержимом желудка пепсина, особенно желчных кислот, с экспозицией которых в пищеводе связывают его воспалительно-деструктивные изменения.
В экспериментальных моделях с использованием биоптатов из пищевода пациентов с ГЭРБ изучали влияние различных химических раздражителей (соляной кислоты при рН 1, желудочного содержимого при рН 1–3 и рН 7, желчных кислот при рН 1–3 и рН 7) на состояние эпителия. Наиболее тяжелое повреждение пищеводного эпителия наблюдалось при воздействии желудочного сока и неконъюгированных желчных кислот при рН 1–3. Минимальное негативное влияние оказывал желудочный сок при рН 7 [5]. Показано, что содержание в рефлюктате желчи повышает риск развития пищевода Барретта и рака пищевода [6].
К настоящему времени накоплена серьезная доказательная база, свидетельствующая о том, что не только кислый, но и некислый рефлюкс способен вызывать гистопатологические изменения, выявляемые при электронной и световой микроскопии [7–9]. Отличительной особенностью микроскопического эзофагита является расширение пространства между прилегающими клетками многослойного плоского эпителия пищевода. Вследствие этого повышается проницаемость, и ионы водорода и другие вещества (включая пепсин и желчь), проникая в подслизистый слой пищевода, стимулируют нервные волокна, вызывая типичный симптом изжоги.
В ряде исследований [10] продемонстрирован синергический эффект кислоты и компонентов дуоденального содержимого в развитии очагов поражения. Подтверждена роль пепсина в патогенезе внепищеводных проявлений ГЭРБ [11].
Впервые межклеточные пространства слизистой оболочки пищевода были изучены в 1970-е гг. D. Hopwood и соавт. с помощью электронного микроскопа как у здоровых лиц [12], так и больных ГЭРБ [13]. В межклеточных пространствах поверхностных слоев содержатся в основном мукополисахариды, обеспечивающие защиту пищевода от физических и химических повреждений. При воспалении расстояние между клетками увеличивается, накапливаются разрушенные частицы нейтральных мукосубстанций, обнаруживаются лимфоциты и нейтрофилы. Впоследствии было установлено, что расширение межклеточных пространств обнаруживается у всех пациентов с ГЭРБ независимо от наличия эрозий в пищеводе. В связи с этим расширение межклеточных пространств принято считать гистологическим маркером ранних повреждений слизистой оболочки пищевода вследствие рефлюкса. В отличие от больных ГЭРБ у пациентов с функциональной изжогой межклеточные пространства не расширены [14].
С. Calabrese и соавт. [15] предложили считать верхней границей нормы расстояние между клетками 0,74 микрон. Значения выше этого уровня могут свидетельствовать о рефлюксном повреждении. Среднее расстояние у пациентов с ГЭРБ увеличивается как минимум в три раза независимо от характера рефлюксов, как кислых, так и некислых. При высоких рефлюксах в пищеводе также может иметь место расширение межклеточных промежутков [16].
По мнению других исследователей, верхний порог нормы межклеточного пространства, позволяющий отличить больных от здоровых, составляет 2,4 микрометра с чувствительностью 73% и специфичностью 100% [17].
До 2000 г. оценка межклеточных промежутков проводилась только с использованием электронной микроскопии. В настоящее время аналогичные изменения можно определить с помощью светового микроскопа при окраске гематоксилин-эозином. Большинство изменений локализуется в базальном слое, но может обнаруживаться как в поверхностных слоях, так и промежуточном слое [18]. Так же, как и при электронной микроскопии, световая микроскопия не выявляет значимой разницы в расширении межклеточных промежутков между больными эрозивной и неэрозивной ГЭРБ и пациентами с пищеводом Барретта [19]. Световой микроскоп позволяет выделять нулевую стадию – отсутствие расширений межклеточных промежутков, первую степень – наличие единичных незначительно расширенных межклеточных пространств, вторую – среднее количество расширенных промежутков и третью – наличие множества очень больших межклеточных пространств [20].
В лечении больных ГЭРБ используется комплексный подход, традиционно включающий диету и модификацию образа жизни, снижение повреждающих свойств рефлюктата, улучшение пищеводного клиренса и защиту слизистой оболочки пищевода. Медикаментозная терапия предполагает использование лекарственных препаратов, обладающих кислотонейтрализующей способностью (антацидов), физически препятствующих рефлюксу желудочного содержимого в пищевод (альгинатов) и уменьшающих кислотопродукцию в желудке в целях повышения pH и уменьшения объема рефлюктата (ингибиторов протонной помпы (ИПП)) [21]. ИПП признаны препаратами первого выбора в лечении ГЭРБ.
Метаанализ клинических исследований медикаментозного лечения изжоги показал, что вероятность ее устранения возрастает по мере угнетения секреции кислоты: относительный риск изжоги при назначении прокинетиков 0,86, при использовании блокаторов Н2-рецепторов – 0,77, ИПП – 0,37 [22]. ИПП обеспечивают восстановление слизистой оболочки пищевода, включая эпителизацию язв, в 80–85% – поддержание симптоматической и эндоскопической ремиссии, снижают частоту осложнений [23].
Систематические обзоры продемонстрировали достижение контроля или облегчение симптомов в 56–76% случаев на фоне применения стандартных доз ИПП [24, 25]. Вместе с тем, по данным P.O. Katz и соавт., у пациентов с неэрозивной рефлюксной болезнью (НЭРБ) в отличие от пациентов с эрозивным эзофагитом облегчение симптомов при приеме ИПП менее выражено, а терапевтическая эффективность снижена приблизительно на 20%.
В обширном исследовании AGA [26], несмотря на использование ИПП более чем у 55% пациентов с симптомами ГЭРБ (при неэрозивной и эрозивной форме), отмечалось снижение качества жизни.
В целом ИПП считаются безопасным классом препаратов. В то же время обсуждаются риски их длительного использования [27]. ИПП рекомендуется назначать по показаниям, длительность их применения зависит от ситуации, но после достижения клинического эффекта необходимо подбирать минимальные эффективные дозы [28, 29].
Оптимальное лечение больных ГЭРБ должно быть направлено не только на подавление секреции кислоты, но и на повышение эффективности защитных патофизиологических механизмов, которые обеспечивают барьерные свойства и/или связывают остаточные агрессивные компоненты рефлюктата (пепсин, желчные кислоты, лизолецитин и др.) и стимулируют восстановление слизистой оболочки. Для достижения этих целей разработано новое медицинское изделие Альфазокс – смесь (в соотношении 1:2,5) низкомолекулярной (80–100 кДа) гиалуроновой кислоты и низкомолекулярного (10–20 кДа) хондроитина сульфата, растворенных в биоадгезивном носителе (полоксамер 407). Этот макромолекулярный комплекс покрывает слизистую оболочку пищевода и создает механический барьер в отношении повреждающих компонентов рефлюкса. Как известно, время транзита жидкости по пищеводу крайне ограниченно (менее 16 с) даже в положении лежа [30]. Вязкий состав, обволакивающий слизистую оболочку, ограничивает контакт компонентов рефлюктата с поверхностью эпителия [31], оказывая защитное действие.
Действующие компоненты Альфазокса – два хорошо известных вещества. Гиалуроновая кислота – биологически активное вещество, регулирующее клеточную функцию за счет взаимодействия с определенными рецепторами [32]. Это многофункциональный высокомолекулярный гликозаминогликан, компонент большинства внеклеточных матриксов, участвующий в различных ключевых физиологических процессах, включая заживление ран и регенерацию, морфогенез и организацию матрикса [33]. Биологическая роль гиалуроновой кислоты отчасти обусловлена ее гидрофильными и гидродинамическими свойствами, которые позволяют ей удерживать воду и играть структурирующую роль. Гидрогели (поперечно связанные гидрофильные полимеры) используют для восстановления или регенерации тканей в местах повреждения, после чего они распадаются под воздействием ферментов ткани [32]. Низкомолекулярная гиалуроновая кислота является проангиогенной, она стимулирует формирование новых кровеносных сосудов и активирует путь передачи сигнала, что приводит к пролиферации и миграции эндотелиальных клеток. Препараты гиалуроновой кислоты для местного применения используются для лечения рецидивирующих афтозных язв слизистой оболочки рта [34, 35] и обеспечивают быстрое облегчение симптомов, чему также может способствовать дозозависимое противовоспалительное действие данного соединения [36].
Хондроитина сульфат – естественный гликозаминогликан, присутствующий в окружающем клетки внеклеточном матриксе, в частности хрящах, коже, кровеносных сосудах, связках и сухожилиях, где он формирует важный компонент протеогликанов [37].
Имеющиеся данные свидетельствуют о том, что хондроитина сульфат выполняет важную биологическую функцию при воспалительных процессах, в пролиферации, дифференциации, миграции клеток, морфогенезе тканей, органогенезе, при инфекционных процессах и заживлении ран [38]. Такое действие связано со способностью хондроитина сульфата взаимодействовать с различными молекулами, включая молекулы матрикса, факторы роста, ингибиторы протеазы, цитокины, хемокины и адгезивные молекулы, за счет неспецифичных/специфичных сахаридных доменов внутри цепей. Это соединение обладает иммуномодулирующими [39], противовоспалительными и антиоксидантными [40] свойствами. Помимо неспецифичных взаимодействий хондроитина сульфат способен специфически связываться с биоактивными молекулами, например с пепсином. При этом его пептическая активность снижается in vitro [41] и in vivo [42, 43]. Не случайно ранее предпринимались попытки лечения язвы желудка и двенадцатиперстной кишки хондроитина сульфатом [44].
Полоксамер 407 (блоки этиленоксида и пропиленоксида) – гидрофильное неионное поверхностно активное вещество с адгезивными свойствами, которое может выступать в качестве носителя для доставки лекарственных препаратов местного действия в пищеводе [45].
Формулы, содержащие полоксамер 407, помогают увеличить растворимость плохо растворимых в воде лекарственных препаратов и обеспечивают пролонгированное высвобождение различных лекарственных форм [46]. Адгезивные свойства полоксамера 407 используют для увеличения времени удерживания препаратов в желудочно-кишечном тракте. Хорошая адгезия в пищеводе и выраженная диффузия лекарственного препарата в слизистой оболочке определялись у мышей с помощью оптоволоконного спектрофлуорометрического метода [46].
Результаты экспериментального исследования ex vivo на модели свиней показали, что перфузия данного медицинского изделия в просвете пищевода способна предотвращать повышение проницаемости слизистой оболочки. Повреждение слизистой оболочки пищевода вызывали путем орошения соляной кислотой с добавлением или без добавления пепсина. Затем было выполнено гистологическое исследование 30 образцов слизистой оболочки пищевода. Для оценки проницаемости слизистой оболочки пищевода после его химического повреждения использовали краситель Эванса синий. На фоне применения Альфазокса снижалась проницаемость поврежденной слизистой оболочки пищевода. На основании полученных данных авторы пришли к предварительному выводу о перспективности применения Альфазокса у больных ГЭРБ [47].
В двойном слепом плацебоконтролируемом исследовании, результаты которого были опубликованы в 2009 г., участвовало 40 пациентов с изжогой, болью в эпигастральной области, симптомами диспепсии, метеоризмом и отрыжкой. Десяти из них был установлен диагноз рефлюксной болезни. Пациенты получали Альфазокс (сироп) или плацебо по одной столовой ложке (10 мл) каждые восемь часов (между приемами пищи) и по две столовые ложки перед сном в течение двух недель. После недельного «периода отмывки» больным назначали иной вид терапии (плацебо или действующее вещество), затем оценивали динамику симптомов. Альфазокс и плацебо продемонстрировали статистически значимые различия в степени уменьшения выраженности симптомов. При эндоскопическом исследовании до и после лечения также отмечались уменьшение явлений воспаления и улучшение процесса заживления слизистой оболочки у пациентов с патологией пищевода или гастродуоденальной зоны. Исследователи сделали заключение, что применение Альфазокса считается целесообразным для контроля симптомов рефлюкса и воспаления пищевода и желудка. В ходе исследования нежелательных явлений не зарегистрировано [48].
В 2013 г. те же авторы провели двойное слепое рандомизированное плацебоконтролируемое исследование эффективности Альфазокса у больных НЭРБ, у которых сохранялись симптомы, несмотря на терапию ИПП. В исследовании участвовало 20 пациентов (17 мужчин, три женщины; средний возраст – 55 ± 18 лет; среднее значение индекса массы тела – 28,3 ± 5 кг/м 2 ) с жалобами на изжогу и (или) отрыжку кислым в течение минимум трех дней на протяжении семидневного вводного периода в отсутствие эндоскопических признаков повреждения слизистой оболочки. Пациенты получали четыре суточные дозы Альфазокса или плацебо 14 дней. По завершении семидневного «периода вымывания» схема лечения менялась – пациентам назначали Альфазокс или плацебо в течение дополнительных 14 дней. На протяжении всего периода исследования больные получали поддерживающую терапию ИПП в стандартной дозе. Пациенты вели дневники, в которых ежедневно отмечали интенсивность изжоги и/или отрыжки кислым. Для оценки выраженности симптомов использовалась четырехбалльная рейтинговая шкала (0 – симптомы отсутствуют; 1 – симптомы выражены незначительно и практически не вызывают дискомфорта; 2 – симптомы доставляют некоторый дискомфорт, однако не влияют на сон или повседневную деятельность, возможно применение антацидов; 3 – выраженные симптомы, влияющие на повседневную деятельность и (или) сон, постоянное применение антацидов). В качестве основных показателей эффективности использовали суммарную оценку интенсивности симптомов (SSSI) за 14-дневный терапевтический период, которая выражалась в виде разницы в степени интенсивности симптомов (SSID). Значение SSID оценивали как разницу между исходным значением и SSSI в каждой временной точке. На момент окончания терапии Альфазоксом получен значимо более низкий абсолютный показатель SSSI по сравнению с группой плацебо (от 4,5 ± 1,4 до 1,8 ± 2,2 и от 4,0 ± 2,1 до 3,4 ± 1,9 соответственно; p



 Читайте также:
Читайте также: 




