азитромицин при цистите у женщин сколько дней принимать
Фармакокинетика азитромицина при урогенитальных инфекциях
Опубликовано в журнале:
Инфекции и антимикробная терапия »» Том 3/N 6/2001 Р.В. Комаров, И.И. Деревянко, С.В. Яковлев, Г.Н. Изотова, В.П. Яковлев
Госпиталь Ветеранов войн №2, НИИ урологии Минздрава РФ, ММА им.И.М.Сеченова, Институт хирургии им. А.В.Вишневского, Москва
Урогенитальные инфекции являются частыми заболеваниями как в амбулаторной, так и в стационарной практике. Возбудителями этих инфекций является широкий круг различных микроорганизмов, причем имеются существенные различия в этиологии в зависимости от вовлечения различных отделов мочеполовой системы. В частности, в этиологии цистита и пиелонефрита преобладают типичные бактерии: кишечная палочка и другие энтеробактерии, стафилококки, энтерококки. В то же время при инфекции нижних отделов урогенитального тракта – уретрите и простатите – возрастает роль атипичных микроорганизмов с преимущественно внутриклеточной локализацией: Chlamydia trachomatis, Mycoplasma spp., Ureaplasma urealyticum. Определенное значение также имеет Neisseria gonorrhoeae. Указанные микроорганизмы передаются половым путем.
Лечение инфекций, передаваемых половым путем (ИППП), связано с определенными сложностями. Во-первых, многие антибактериальные препараты неактивны в отношении атипичных микроорганизмов (в частности, бета-лактамы, аминогликозиды, нитрофураны), а сульфаниламиды и ко-тримоксазол проявляют только слабую активность in vitro. Во-вторых, не все антибактериальные препараты хорошо проникают в ткань и секрет предстательной железы. Так, концентрации бета-лактамов в ткани предстательной железы составляют менее 10% от их концентраций в крови, что ниже значений минимально подавляющих концентраций (МПК) основных возбудителей бактериального простатита. Недостаточное проникновение антибиотиков в ткань воспаленной предстательной железы объясняется барьерной функцией простатического эпителия, увеличением рН секрета железы и местными нарушениями микроциркуляции [1].
Таблица 1. С
редние концентрации азитромицина в крови, секрете и ткани предстательной железы после однократного приема внутрь в дозе 500 мг
Концентрации, мкг/мл или мкг/г
Таблица 2.
Проникновение азитромицина в секрет и ткань предстательной железы
Время после приема, ч
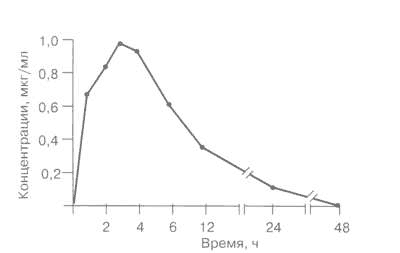
Рис. 1.
Динамика концентраций азитромицина в крови после однократного приема внутрь 500 мг.
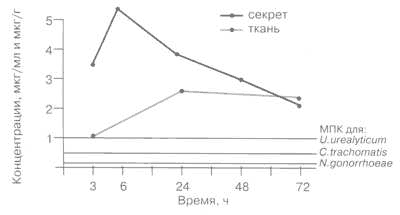
Рис. 2.
Концентрации азитромицина в секрете и ткани предстательной железы после однократного приема внутрь 500 мг.
В последние годы для лечения инфекций нижних отделов мочеполовых путей применяются макролидные антибиотики, которые проявляют активность против атипичных возбудителей и гонококков и проникают в ткань предстательной железы. Эритромицин, наиболее хорошо известный из них, не лишен недостатков: препарат не стабилен в кислой среде желудка, имеет низкую биодоступность, плохо переносится. Кроме того, частое дозирование ограничивает применение этого антибиотика, так как эти инфекции требуют, как правило, длительного лечения.
Азитромицин, относящийся к 15-членным макролидам, является полусинтетическим препаратом с улучшенной фармакокинетикой. Высокая активность против атипичных возбудителей и редкое дозирование позволяют считать его оптимальным в ряду макролидов для лечения ИППП.
Целью настоящего исследования было изучение проникновения азитромицина в ткань и секрет предстательной железы для изучения возможности его применения при лечении простатита, вызванного атипичной микрофлорой и установления оптимального режима дозирования.
Материал и методы
У 15 пациентов изучены концентрации азитромицина в ткани предстательной железы. С этой целью пациенты получали препарат в дозе 500 мг за 3, 24 или 48 ч до предстоящей операции. Ткань предстательной железы получали интраоперационно во время трансуретральной резекции предстательной железы (8 пациентов) или при “открытой” аденомэктомии (7 пациентов).
Концентрации азитромицина в крови, моче, секрете и ткани предстательной железы определяли микробиологическим методом диффузии в агар на твердой питательной среде (стрептомициновый агар). В качестве тест-штамма использовали Bacillus mucoides HB.
Результаты и обсуждение
Динамика сывороточных концентраций азитромицина в крови после однократного приема внутрь в дозе 500 мг представлена на рис. 1. Максимальные концентрации в крови достигались через 3 ч после приема. Затем концентрации азитромицина в крови плавно снижались к 24 ч, в последующие сроки препарат в крови не определялся.
Средние значения концентраций азитромицина в крови, секрете и ткани предстательной железы представлены в табл. 1.
Концентрации азитромицина в секрете предстательной железы определялись через 3 ч после приема, максимальные концентрации отмечены через 6 ч, в последующие сроки концентрации медленно снижались, причем через 3 дня сохранялись достаточно высокими, хотя препарат в крови уже не определялся.
Концентрации азитромицина в ткани предстательной железы нарастали, и максимальный уровень зарегистрирован спустя 24 ч, а через 72 ч было достигнуто равновесное состояние (одинаковые концентрации в секрете и ткани железы).
Коэффициент проникновения азитромицина в секрет и ткань предстательной железы был рассчитан у 3 пациентов, у которых производился одномоментный забор биологических образцов (табл. 2). Степень проникновения азитромицина в секрет предстательной железы увеличивалась с 3 до 6 ч и максимальное соотношение концентраций составило около 4. Через 3 ч после приема препарата соотношение концентраций в крови и ткани было примерно одинаковым. В последующие сроки (24–72 ч) коэффициент проникновения рассчитать не удалось, так как препарат в крови уже не определялся.
Полученные данные свидетельствуют о хорошей тканевой фармакокинетике азитромицина – препарат в высокой степени накапливается в ткани и секрете предстательной железы и длительно там сохраняется.
Для антибактериальных препаратов важен не только уровень препарата в крови и тканях, но в большей степени соотношение тканевых концентраций и значений МПК для возбудителей инфекций. На рис. 2 представлены концентрации азитромицина в секрете и ткани предстательной железы и значения МПК основных возбудителей ИППП. Средние значения МПК90 азитромицина в отношении этих микроорганизмов следующие [2, 3]:
Концентрации азитромицина в секрете и ткани предстательной железы превышали значения МПК90 указанных микроорганизмов во все сроки наблюдения вплоть до последней точки (72 ч).
В эксперименте и исследованиях на животных было показано, что клинический и бактериологический эффект макролидных антибиотиков прямо зависит от времени превышения их концентраций значений МПК90 возбудителей, причем условием положительного эффекта является превышение концентрациями МПК в течение как минимум 40% интервала дозирования. Учитывая, что через 3 дня после приема концентрации азитромицина в секрете/ткани предстательной железы в 2–16 раз превышали значения МПК, и принимая это значение времени за 40%, можно прогнозировать сохранение эффекта азитромицина в течение как минимум 7 дней после однократного приема. Это подтверждает возможность назначения азитромицина при хламидийных и микоплазменных инфекциях с интервалом 7 дней.
В отличие от других макролидов азитромицину присущ также концентрационно-зависимый эффект, поэтому основным фармакодинамическим параметром, определяющим эрадикацию возбудителей, является отношение площади под фармакокинетической кривой “концентрация-время” (AUC) в интервале 24 ч к значению МПК90 микроорганизмов. При этом предиктором эффекта является значение этого показателя 25 и выше. Расчетные значения AUC/МПК90 для C.trachomatis составили 866, U.urealyticum – 108, N.gonorrhoeae – 3610, что еще раз подтверждает выраженный бактерицидный эффект азитромицина при этих инфекциях.
Сходные высокие концентрации азитромицина в секрете предстательной железы отмечены и в других исследованиях. В исследовании M. LeBell и соавт. [4] концентрации азитромицина в секрете простаты через 48 ч после однократного приема внутрь 1 г составили 1,8–2 мкг/мл. Хотя значения МПК90 азитромицина в отношении C.trachomatis в среднем составляют 0,125–0,25 мкг/мл [5], имеются данные, что для полного подавления этого микроорганизма требуются концентрации 1 мкг/мл [6]. Полученные нами данные свидетельствуют, что наблюдаемые концентрации азитромицина в секрете/ткани простаты с большим запасом превышают это значение.
Высокие и длительно сохраняющиеся концентрации азитромицина в ткани предстательной железы наблюдали M. LeBell и соавт. [7]: после однократного приема внутрь 1 г концентрации азитромицина в простате составили 5,31 мкг/г через 1 нед и 1,7 мкг/г через 2 нед. G. Foulds и R. Johnson [8] показали, что после трехкратного приема азитромицина (500 мг с интервалом 24 ч) концентрации в предстательной железе превышали 2 мкг/мл в течение 3 дней, а 1 мкг/мл в течение 5 дней. По данным других исследований [9, 10], после приема азитромицина внутрь в дозе 250 мг с интервалом 12 ч концентрации препарата в предстательной железе составили 1 мкг/г через 12 ч и превышали 1 мкг/г в течение 60 ч после последней дозы. Полученные данные позволили сделать заключение, что благодаря уникальной тканевой фармакокинетике азитромицин может назначаться при урогенитальных ИППП короткими курсами либо с длительными интервалами между приемами [11].
Полученные в эксперименте данные нашли клиническое подтверждение. В частности, G. Ridgway [12] подчеркивает, что при хламидийных урогенитальных инфекциях 100% эрадикация возбудителя достигается при однократном приеме азитромицина в дозе 2 г, а клинический эффект азитромицина в этом режиме равен применению доксициклина в дозе 200 мг в сутки в течение 1 нед.
Заключение
Проведенные исследования свидетельствуют о хорошем проникновении азитромицина в секрет предстательной железы, при этом там создаются концентрации препарата, в 2–4 раза превышающие сывороточные. Азитромицин в высоких концентрациях накапливается в ткани предстательной железы. Концентрации азитромицина в секрете/ткани предстательной железы превышают терапевтический уровень (МПК90 для основных возбудителей ИППП) в течение всего периода наблюдения (72 ч).
Полученные данные обосновывают практику редкого дозирования азитромицина при урогенитальных инфекциях. Фармакодинамический анализ показывает возможность назначения азитромицина при хламидийной инфекции с интервалом как минимум 7 дней.
Уретрит у женщин под маской хронического цистита. Современный выбор терапии
Показаны эффективность и безопасность комбинации этиотропного препарата (азитромицин) с лактулозой, у пациенток с уретритом, ассоциированным с внутриклеточными инфекциями. Показано, что препарат потенцирует восстановление собственного микробиоценоза пацие
Efficiency and safety of the combination of etiotropic preparation (azitromitsin) with the laktulose, in women patients with urethritis associated with intracellular infections are shown. It is stated that the preparation contributes to the restoration of personal microbiocenosis of patient and prevents the relapse of infections.
Цистит у женщин — одно из наиболее частых заболеваний в урологической и терапевтической практике. Однако насколько истинна заболеваемость бактериальным циститом? До того, как попасть к специалисту, пациентка, как правило, пытается поставить диагноз и подобрать лечение самостоятельно, руководствуясь советами подруг и интернета, где любое нарушение мочеиспускания может быть однозначно расценено как «цистит».
Уретриту у женщин незаслуженно уделяется крайне мало внимания, зачастую эта проблема вообще игнорируется. Тем не менее следует отметить, что воспаление слизистой мочеиспускательного канала не является гендерно-детерминированным заболеванием и может встречаться как у мужчин, так и у женщин.
Второй аспект, на котором хотелось бы остановиться, — негативные последствия антибактериальной терапии. Длительный бесконтрольный прием антибиотиков закономерно приводит к дисбиозу кишечника и влагалища. Клинические проявления нарушения кишечного микробиоценоза по степени тяжести варьируют от легкой диареи до тяжелейшего колита со смертельным исходом и могут проявляться отсроченно: зафиксированы случаи развития псевдомембранозного колита спустя 2 месяца после завершения курса антибактериальной терапии [1, 2].
Этот феномен явился обоснованием к назначению самостоятельно или в комплексе с противомикробной терапией так называемых пробиотиков, которые Всемирная Организация Здравоохранения определила как «микроорганизмы, которые, будучи принятыми в живом состоянии в соответствующем количестве, обеспечивают хорошее самочувствие и здоровье организма хозяина» [3]. Наиболее часто в урологии и гинекологии применяют различные штаммы лактобацилл — как вагинально, так и орально. [4]. В рандомизированном плацебо-контролируемом исследовании по оценке эффективности Lactobacillus crispatus интравагинально как средства профилактики возвратных циститов у женщин было показано, что в течение 10 недель по завершении курса лечения обострение цистита возникло у 15% женщин, получавших препарат Lactin-V по сравнению с 27% рецидивов в группе плацебо [5]. В двойном слепом рандомизированном исследовании, включавшем 252 пациентки с рецидивным течением урогенитальной инфекции (УГИ), применяли орально L. rhamnosus GR1 и L. reuteri RC-14, что привело к снижению обострений на 50%, хотя эффективность длительного приема триметоприм-сульфаметоксазола была еще выше [6]. Применение пробиотиков для профилактики рецидивов УГИ у женщин рекомендовано рекомендациями Европейской ассоциации урологов European Association of Urology (EAU) с уровнем доказательности «C» [7].
Мы можем вылечить пациентку с УГИ посредством эрадикации возбудителя или подсаживания полезной микрофлоры (пробиотики) — и позволить ей выздороветь за счет создания адекватных условий для нормального функционирования организма, в первую очередь — иммунной системы. Назначение пробиотиков лечит больного, но эффект может оказаться кратковременным, так как подсаженные чужеродные лактобациллы не всегда приживаются и через некоторое время отторгаются. Выход из такой, казалось бы, тупиковой ситуации есть — использование пребиотиков, то есть препаратов, обеспечивающих благоприятные условия существования собственной микрофлоре. Пребиотики — вещества немикробного происхождения, селективно стимулирующие рост, метаболическую активность и размножение собственной нормальной микрофлоры человека. Пребиотики являются питательным субстратом и источником энергии для бифидобактерий и лактобацилл, составляющих основу нормальной кишечной микрофлоры. Наиболее эффективным из известных пребиотиков является лактулоза, пребиотическое действие которой начинается с дозы от 0,3 г в сутки.
Таким образом, комбинация этиотропного препарата с лактулозой позволит избежать стандартных для антибиотикотерапии осложнений. Чтобы проверить эту гипотезу, мы провели прямое открытое проспективное несравнительное исследование по оценке эффективности и безопасности Экомеда, включающего азитромицин и лактулозу, у пациенток с уретритом, ассоциированным с внутриклеточными инфекциями.
Материалы и методы исследования
В исследование были включены 14 пациенток, обратившихся в МЦ «Биовэр» с жалобами на нарушение мочеиспускания. Критериями включения были:
Таким образом, для включения в исследование целенаправленно отбирались молодые небеременные женщины без тяжелых соматических заболеваний, страдающие хроническим (непрерывно-рецидивирующим) уретритом, плохо переносящие антибактериальную терапию, с нестабильностью кишечного и влагалищного микробиоценоза. Влагалищный дисбиоз в настоящем исследовании мы определяли по характерным изменениям при микроскопии влагалищного мазка и по результатам посева на микрофлору, а кишечный дисбиоз оценивали по характеру и частоте стула, без микробиологической верификации.
Возраст больных составил в среднем 28,7 ± 4,2 года (колебания от 22 до 43 лет), то есть все участницы исследования были репродуктивного возраста; на момент обращения небеременные.
Больным проводился осмотр в гинекологическом кресле с пальпацией уретры, общий анализ крови, общий анализ мочи (двухстаканная проба), исследование соскоба уретры и цервикального канала на наличие ДНК Chlamydia trachomatis, Mycoplasma genitalium, Ureaplasma urealyticum методом полимеразной цепной реакции (ПЦР); посев этого же материала на бактериальную микрофлору и внутриклеточные инфекции, а также микроскопия окрашенного по Граму влагалищного мазка для выявления сопутствующего вагинита и кандидоза влагалища. Пациентки самостоятельно заполняли визуальную аналоговую шкалу (ВАШ) по оценке интенсивности боли/дизурии (от 0 баллов — боли нет, до 10 баллов — боль нестерпимая) и качества жизни (от 0 баллов — невыносимо плохо, до 5 баллов — отлично). Исследования проводили при поступлении, через 2 недели от начала лечения и через 6 недель.
Все пациентки принимали препарат Экомед в первоначальной дозе 750–1000 мг (в зависимости от массы тела) с последующим ежедневным приемом в дозе 500 мг один раз в сутки в течение семи дней (курсовая доза — до 4,5 г азитромицина). Более длительный, чем указано в инструкции, прием препарата обусловлен течением заболевания (хроническое, непрерывно-рецидивирующее) и безуспешностью предшествующих курсов терапии, что позволяет предположить переход возбудителя в персистирующую форму, нечувствительную к стандартной терапии. Учитывая особенности фармакокинетики действующего антибактериального вещества, сохраняющегося в очаге воспаления в эффективных концентрациях до недели после приема последней дозы, пациентки находились под действием противомикробной терапии в течение двух недель, после чего проводилось первое контрольное обследование. Помимо этиотропной терапии все больные принимали препарат Канефрон Н по 50 капель трижды в день в течение месяца — с целью элиминации продуктов распада микробных клеток, стимуляции диуреза и потенцирования действия антибиотика.
Результаты исследования
Спектр предъявляемых в момент обращения жалоб был следующий: постоянная ноющая боль в области уретры — у всех 14 пациенток; усиление боли в момент мочеиспускания — у 8 женщин; усиление боли при наполнении мочевого пузыря — у 7 больных. Диспареунию отмечали все пациентки, равно как и влагалищные выделения, которые у 9 были транзиторными, а у 5 — постоянными. Связь ухудшения состояния с половым актом отмечали 12 пациенток. Интенсивность боли колебалась от 5 до 9 баллов (в среднем 7,4) по ВАШ; качество жизни было оценено в среднем на 1,8 балла (от 1 балла до 3).
Продолжительность заболевания (от появления первых симптомов до обращения к врачу) составила 5,2 года (от 2 до 11 лет). В среднем пациентки получили по 7,6 курса антибактериальной терапии, 6 человек принимали антибиотики длительное время в сниженных дозах с профилактической целью. Считаем важным отметить, что только в 64,2% лечение назначал врач (терапевт, уролог, гинеколог, венеролог), а в 35,8% пациентки занимались самолечением.
В анамнезе у всех были инфекции, передающиеся половым путем: трихомониаз у 6 больных, хламидиоз — у 7, уреаплазмоз — у 12, ассоциация возбудителей — у 11 пациенток. Все больные получали по поводу этих заболеваний соответствующую терапию с контролем излеченности.
У всех 14 пациенток преобладала лейкоцитурия в первой порции двухстаканного теста. ДНК Chlamydia trachomatis в соскобе уретры/соскобе цервикального канала была обнаружена у 6/2 пациенток, ДНК Mycoplasma genitalium — у 6/3, ДНК Ureaplasma urealyticum — у 8/2. Таким образом, у всех пациенток в соскобе уретры присутствовали внутриклеточные возбудители, причем почти у половины из них (6 больных) выявлена сочетанная инфекция. В то же время в цервикальном канале выявляемость инфекционного агента была значительно ниже — возможно, как следствие предшествовавшего местного лечения у гинеколога. Рост внутриклеточных возбудителей в отделяемом цервикального канала был получен только у одной больной, в отделяемом уретры — у 9 пациенток. Такая ситуация опять же объясняется многократными предшествующими курсами терапии, приведшими к развитию персистенции микроорганизмов.
Рост кишечной палочки в диагностически значимом титре (10 4 КОЕ/мл) был получен только у одной пациентки, у двух выявлен гемолитический стафилококк, еще у одной — коринебактер, также в титре 10 4 КОЕ/мл. У остальных 10 больных моча была стерильна. В отделяемом влагалища, напротив, микробный пейзаж отличался значительным разнообразием. У 10 больных выявлен рост Candida albicans, у двух — Staphylococcus spp., у 3 трех — Enterobacter. Во влагалищном мазке число лейкоцитов колебалось от 25 до 60, палочки Додерляйна не были выявлены ни в одном случае, у половины (7 пациенток) обнаружены ключевые клетки. Таким образом, у всех включенных в исследование пациенток имелся дисбиоз влагалища.
Все пациентки получали однотипную терапию, определенную протоколом настоящего исследования; переносимость лечения была хорошая, ни в одном случае не развился сколько-нибудь значимый побочный эффект.
Через две недели отмечены отличные результаты (прекращение боли, восстановление качества жизни до 5 баллов по ВАШ, нормализация анализов мочи, прекращение роста возбудителя) у половины женщин (7 пациенток), хорошие результаты (снижение интенсивности боли до 1 и меньше, повышение качества жизни до 4 и выше, существенное улучшение анализов мочи, прекращение роста возбудителя) у 5 больных, у двух результат был расценен как удовлетворительный, поскольку боль держалась на уровне 3 баллов, сохранялась диспареуния, умеренная лейкоцитурия). У 11 пациенток отмечена положительная тенденция в течении вагинита, ни у одной не было ухудшения с этой стороны, как во время любого предшествующего курса антибиотиков. Ни у одной пациентки не развилась диарея, равно как и не изменился характер стула.
У 9 пациенток прослежены ближайшие отдаленные результаты (через 6 недель) после начала терапии. У всех сохранялся достигнутый эффект, более того, из пяти женщин с «хорошим» результатом лечения трое перешли в разряд «отличного» результата, ни у одной не было прогрессирования дисбиоза влагалища и кишечника.
Обсуждение
Экоантибиотики биоэквивалентны обычным антибиотикам по противомикробной активности, а по профилю безопасности — значительно превосходят их, поскольку сохраняют баланс кишечной микрофлоры в процессе лечения, препятствуют развитию антибиотик-ассоциированной диареи и Clostridium difficile-ассоциированной диареи; поддерживают иммунный статус и обладают лучшей терапевтической переносимостью, чем обычные антибиотики [8].
Пробиотики — это живые микроорганизмы, которые, будучи в достаточном количестве в кишечнике, оказывают положительное действие на здоровье макроорганизма. К пробиотикам относят Lactobacillus rhamnosus GG, L. reuteri, Bifidobacteria; некоторые штаммы L. casei и L. acidophilus. Пробиотики предупреждают или купируют ротавирус-индуцированную или антибиотик-ассоциированную диарею, снижают концентрацию канцерогенных энзимов в кишечнике, снижают ирритацию желудочно-кишечного тракта, уменьшают воспаление, вызванное дисбиозом, нормализуют стул, уменьшают аллергизацию организма, предотвращают развитие острых инфекций респираторного тракта и мочеполовой системы [8].
Пребиотики — это частично ферментированные ингредиенты, создающие условия наибольшего благоприятствования развитию гастроинтестинальной микрофлоры и оказывающие тем самым все перечисленные выше эффекты. Синергичное сочетание пробиотика и пребиотика называется синбиотиком. К пребиотикам относят инулин, олигофруктозу, галактоолигосахариды (лактулозу). Это диетические волокна с хорошо доказанным благотворным влиянием на кишечную микрофлору. Есть убедительные данные о положительном опосредованном воздействии пребиотиков на липидный и минеральный метаболизм, профилактику рака, иммунный ответ на воспаление [9].
При оптимальном соотношении видов микроорганизмов, населяющих кишечник человека (так называемая микробиота) формируется истинный симбиоз (нормобиоз), обеспечивающий хорошее самочувствие и здоровье организма-хозяина. При изменении микробного пейзажа в ту или иную сторону развивается дисбиоз, приводящий к разбалансировке многих органов и систем. Предложена идея пребиотического эффекта, который определяют как «выборочная стимуляция роста и/или активности определенной части кишечной микробиоты для обеспечения хорошего самочувствия и здоровья макроорганизма». Пребиотический эффект, обусловленный приемом ряда продуктов, пищевых волокон, является хорошо изученным фактом. Доказан пребиотический эффект инулина, олигофруктозы, лактулозы (стимуляция роста и активности Bifidobacterium) [10].
Выводы
Назначение экоантибиотиков, содержащих пребиотик лактулозу, потенцирует восстановление собственного микробиоценоза пациента, создает предпосылки для полного выздоровления, профилактирует рецидив инфекций урогенитального тракта. Добавление лактулозы к антибиотику никоим образом не сказывается на его антимикробной активности, не оказывает негативного влияния на переносимость препарата. Проведение после курса экоантибиотиков фитотерапии оптимально сбалансированным препаратом (Канефрон Н) закрепляет достигнутый эффект.
Получены первые весьма обнадеживающие данные об эффективности и безопасности Экомеда, содержащего комбинацию азитромицина и лактулозы, необходимо продолжать исследования по этому направлению.
Литература
* ГБОУ ВПО НГМУ МЗ РФ,
** ООО МЦ «Биовэр», Новосибирск