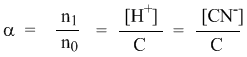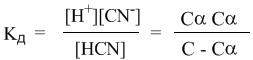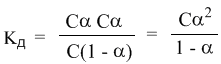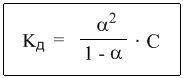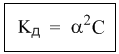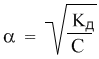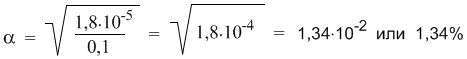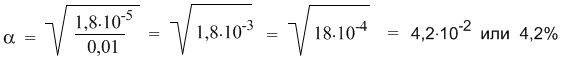Чем больше разбавление раствора тем выше степень диссоциации
Чем больше разбавление раствора тем выше степень диссоциации
§10.2.** Зависимость степени диссоциации от концентрации. Закон разбавления Оствальда.
В предыдущем параграфе мы качественно, на основе принципа Ле Шателье установили, что разбавление раствора должно приводить к увеличению степени диссоциации α. Но эту взаимосвязь можно выразить и количественно.
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X + ] моль/л, и αC = [Y – ] моль/л.
К физическому смыслу произведения αС можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN 
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H + ] и n1 = [CN – ]. В этом случае:
Отсюда следует, что
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:
Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
Или, в другой записи:
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:

Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Рекомендуем решить приведенные ниже задачи на разбавление растворов – они тоже дают представление о сфере применимости только что рассмотренного закона.
10.5. **(ФМШ). Сколько воды надо прибавить к 300 миллилитрам 0,2 М раствора уксусной кислоты СН3СООН (Кд = 1,8·10 –5 ), чтобы степень диссоциации кислоты удвоилась?
10.6. **(ФМШ). Сколько воды надо прибавить к 200 мл 0,27 М раствора муравьиной кислоты НСООН (Кд = 1,8·10 –4 ), чтобы степень диссоциации увеличилась в 3 раза?
Подсказка к задаче 10.5. Эта задача проще, чем может показаться на первый взгляд. Численное значение константы диссоциации кислоты при решении вам не потребуется. В задаче оно приведено для того, чтобы было понятно, что кислота слабая и к ее растворам применим закон разбавления Оствальда в виде: Кд = α 2 С. По условию задачи степени диссоциации после разбавления и до разбавления соотносятся как α2 = 2α1. Если выразить обе α через закон разбавления, то при дальнейшем решении значения Кд сокращаются. Есть способ решения, в котором значение концентрации раствора 0,2 М тоже не обязательно использовать (напомним, что большая буква «М» означает «моль/л»). Попробуйте найти это решение.
Степень диссоциации электролита. Закон разбавления Оствальда



Количественную характеристику равновесного состояния электролита дает его степень диссоциации (a), т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
a измеряется в % (долях). N – общее число молекул в растворе, n – число диссоциированных молекул.
Степень диссоциации электролита зависит от ряда факторов, среди которых:
Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации.
Природа растворителя также оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Диэлектрическая проницаемость (ξ) показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в вакууме. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Самое высокое значение ξ=81 имеет вода. Замена воды на растворитель с меньшей диэлектрической проницаемостью, например, на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют.
Изменение концентрации раствора будет различно отражаться на процессах диссоциации и моляризации. Степень диссоциации электролита при разбавлении раствора увеличивается.
Все соли являются сильными электролитами. К сильным электролитам принадлежат следующие кислоты: HNO3, HClO4, HClO3, H2SO4, HCl, HBr, HI, HMnO4. К слабым кислотам относятся все органические кислоты, а также H2CO3, H2S, HCN, H2SiO3 и некоторые другие. К сильным основаниям относятся KOH, NaOH, Ca(OH)2, Ba(OH)2. К слабым основаниям принадлежат NH4OH, Al(OH)3, Zn(OH)2, Mg(OH)2, Cu(OH)2 и др.
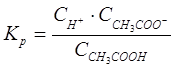
Чем меньше Кд, тем слабее электролит проявляет способность к диссоциации. Если молекула слабого электролита может диссоциировать на два и на большее число ионов, то диссоциация проходит по стадиям (ступенчатая диссоциация). При этом каждая стадия характеризуется своей константой диссоциации. Например, H3PO4 диссоциирует по уравнениям
Значение констант изменяется в ряду К1 > К2 > К3. Это положение имеет общее значение, т.к. отщепление второго и третьего ионов водорода требует большей энергии (приложение, табл. 1).
Константа полной диссоциации слабого электролита равна произведению констант его диссоциации по ступеням.
Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет
Константу диссоциации для уксусной кислоты можно представить следующим образом:
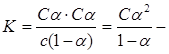
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
При прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации влево, т.е. в сторону уменьшения степени диссоциации. Так, если к раствору уксусной кислоты добавить немного ацетата натрия, то добавленные ацетат-ионы смещают равновесие диссоциации кислоты
влево и степень диссоциации уксусной кислоты уменьшается. Об этом свидетельствуют приведенные ниже данные:
[СН3СООNa], моль/л 0,0 0,001 0,002 0,005 0,010 0,020
α СН3СООН, % 4,1 1,5 0,84 0,35 0,18 0,09
Подавление диссоциации под влиянием одноимённого иона называется “репрессией ионизации”. С репрессией ионизации связаны многие процессы, имеющие практическое значение. Так, её используют для уменьшения растворимости тех или иных соединений.
Степень диссоциации. Сильные и слабые электролиты
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:

где α— степень диссоциации;
п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α Читайте также: Углекислый газ – формула, молярная масса, физические свойства
В растворах слабых электролитов процесс диссоциации протекает обратимо и его можно представить в виде обратимой химической реакции. Так, для процесса диссоциации уксусной кислоты:
константа равновесия этого процесса будет равна:

где [СНзСОО-], [Н+] — концентрация ионов;
[СН3СООН] — концентрация непродиссоциированных молекул.
Константа равновесия, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации показывает устойчивость молекул вещества к диссоциации. Чем меньше значение константы диссоциации в данном растворе, тем слабее диссоциирует электролит.
Степень диссоциации a изменяется с изменением концентрации раствора. Рассмотрим эту зависимость на примере слабого электролита уксусной кислоты:
Принимая исходную концентрацию кислоты равной с, а степень диссоциация a, получаем, что концентрация части кислоты, которая диссоциирована, будет равна aс. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СНзСОО-, то их концентрации будут равны aс. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с — aс = с(1 — a). Подставив значения равновесных концентраций ионов и кислоты в уравнение (5.2), получим:

Уравнение (5.3) было получено В. Ф. Оствальдом и называется законом Оствальда. Если a Читайте также: Основные понятия
Пример 3. Вычислите степень диссоциации хлорноватистой кислоты и концентрацию ионов водорода в растворе с молярной концентрацией 0,05 моль/дм3.
Решение. НСlO — слабый электролит: HCIO « Н+ + СlO-. Следовательно, в соответствии с законом разбавления Оствальда (5.4, б), определяем степень диссоциации:
Кдис(НСlO) = 5×10-8 моль/дм3.
Молярную концентрацию определяем по формуле (5.5). Так как при диссоциации НС1О « Н++ СlO- образуется один ион Н+ (k(Н+) =1), то
с(Н+) = 
Ответ: a(HClO) = 1 ×10-3; с(Н+) = 5×10 5 моль/дм3.
Решение. В уравнение закона разбавления Оствальда (5.3) подставим данные:
Ионное произведение воды, водородный показатель (рН). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением:
Константа диссоциации будет равна:
Преобразуем выражение (5.7) к следующему виду:
Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля:
Произведение двух постоянных величин есть величина постоянная <Кдис[HгО] = const = KH20), тогда уравнение (5.8) принимает вид:
Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная.
Эта постоянная величина называется ионным произведением воды.
Численное значение ионного произведения равно:

Таким образом, произведение концентрации ионов водорода и гидроксильных ионов в растворе при температуре 295 К равно 10-14.
Отсюда, для чистой воды концентрация ионов при температуре 295 К равна:

Допустим, что концентрация ионов водорода при добавлении кислоты увеличилась в 1000 раз и стала [Н+] = 10-4 моль/дм3, тогда концентрация ионов [ОН-] в растворе будет равна:

Мы получаем, что в растворах с различной средой всегда присутствуют ионы Н+ и ОН-.
[Н+] Читайте также: Классификация окислительно- восстановительных реакций
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:
Следовательно, если рН = 7 — нейтральная среда;
Урок №9. Слабые и сильные электролиты. Степень диссоциации
Степень электролитической диссоциации
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита : с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры : степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации ( памятка )
Электролитическая диссоциация
Материалы портала onx.distant.ru
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Ассоциированные электролиты подразделяются на три типа:
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура t, о С | Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Решение. Уравнение диссоциации электролита:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03 ) = 0,024 или 2,4 %
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
α = [Н + ] / Сисх(CH3CОOH)
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Решение.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.