Чем больше валентность тем
Как определить валентность химического элемента по таблице
Когда мы говорим о химии, мы подразумеваем строительные блоки Вселенной. Все элементы действуют как кирпичи конструктора Лего, присоединяясь друг к другу, пока не создадут нечто большее, например, металлы, воду, химические соединения и даже живых существ. Иногда они не стыкуются и разваливаются или взрываются, ухудшая свои основные формы. Именно эти связи и реакции составляют Вселенную, какой мы ее знаем и видим.
Хотя все вещи на нашей планете состоят из отдельных атомов и элементов, различия между объектами и видами заключаются в способности элементов сочетаться с другими элементами. Как вы, наверное, уже знаете, валентность элемента измеряет его способность сочетаться с другими, а число электронов внутри внешней оболочки элемента называется валентностью.
Как определить валентность элемента
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.
Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
Определение по таблице Менделеева
С помощью этого метода вы не можете найти валентность меди, золота или железа, потому что у них много активных электронных оболочек. Это справедливо для всех переходных металлов в колонках 3–10, более тяжелых элементов в колонках с 11 по 14, лантаноидов (элементы 57–71) и актинидов (элементы 89–103).
Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Видео
Из этого видео вы узнаете, как определять валентность элементов по формулам.
Чем больше валентность тем
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
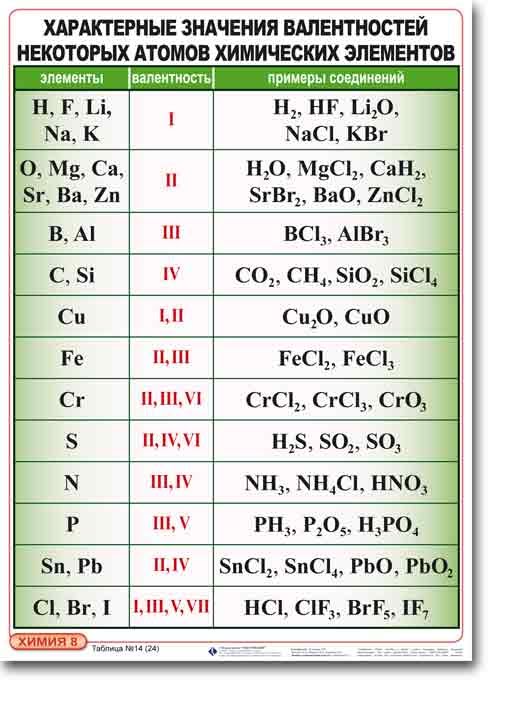
Валентность химических элементов
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента; научитесь составлять химические формулы по валентности.
I. Понятие “валентность”
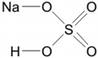
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
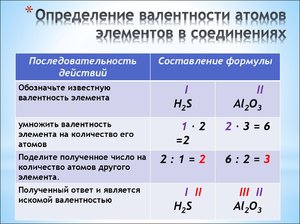
Пример 1. Определим валентность углерода в веществе СН4.
Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:
Чем больше валентность тем
Для бинарных соединений, т. е. образованных двумя элементами типа 
Если в формуле бинарного соединения нет индексов, то валентности элементов одинаковые. Зная валентность одного элемента, можно написать валентность другого, например:
Если валентность одного элемента равна единице, то валентность другого элемента равна индексу при одновалентном элементе, например:
Определение возможной валентности элемента по его положению в таблице Менделеева
Чтобы составить химическую формулу бинарного соединения, надо знать последовательность элементов в формуле (какой элемент первый) и их валентность.
Правила очередности элементов в формул е и проявляемая валентность следующие.
Примеры определения валентности
Пример 1. Составьте формулу соединения (т.е. вещества) алюминия с кислородом (оксида алюминия).
Решение. Алюминий — металл, поэтому он 1-й в формуле: АlаОb. Валентности кислорода (II) и алюминия (III) — постоянные, следовательно, вид формулы:
Минимальные целые числа, удовлетворяющие равенству а • III = b • II, это а = 2, b = 3. Здесь валентность одного элемента равна индексу при другом элементе, х = b, у = а. Следовательно, искомая формула: Аl2O3.
Пример 2. Составьте формулу соединения серы с кислородом при условии, что сера проявляет свою высшую валентность.
Решение. Сера и кислород — неметаллы. В таблице Менделеева сера находится ниже кислорода, она 1-я в формуле SaOb. Высшая валентность серы равна номеру ее группы (VI) в таблице Менделеева:
Минимальные целые числа, удовлетворяющие равенству а • VI = b • II, это а = 1, b = 3. Здесь валентность одного элемента не равна индексу при другом элементе, х ≠ b, у ≠ а. Искомая формула: SO3.
Пример 3. Составьте формулу соединения серы с фосфором, в котором валентность фосфора — V.
Решение. Оба элемента S и Р — неметаллы. Первым в формуле записываем фосфор, так как он находится левее, чем сера, в таблице Менделеева: PaSb.
Валентность фосфора P(V) указана в задании. Сера (2-й элемент в формуле) проявляет свою низшую валентность S(II). Чтобы удовлетворялось равенство ах = by для соединения 
Пример 4. Составьте химические формулы бинарных соединений с кислородом (оксидов) следующих элементов: a) Li; б) Са; в) Sn(IV); г) С(II); д) Р(III); е) P(V).
Решение. Во всех этих формулах кислород — 2-й в формуле. Там, где валентности элементов нечетные, индекс при кислороде равен валентности соответствующего элемента, а индекс при элементе равен двум — валентности кислорода. В формулах оксидов веществ б) и г) индексов нет, т.к. валентности элементов одинаковые и равны II. В формуле оксида олова, чтобы суммарная валентность кислорода равнялась валентности олова, пишем при кислороде индекс «2». Формулы оксидов:
Конспект урока «Определение валентности на примерах».
Валентность. Определение валентности. Элементы с постоянной валентностью.
Необходимо четко усвоить следующие принципы:
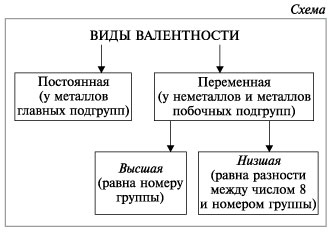
Существуют элементы с постоянной валентностью (их относительно немного) и элементы с переменной валентностью (коих большинство).
Элементы с постоянной валентностью необходимо запомнить:
Остальные элементы могут проявлять разную валентность.
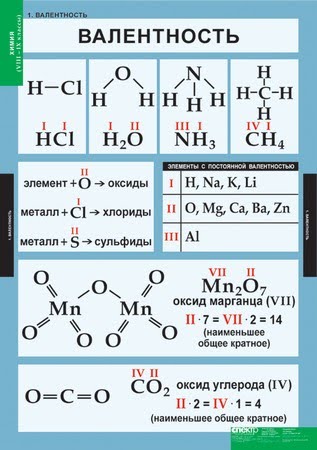
Высшая валентность элемента в большинстве случаев совпадает с номером группы, в которой находится данный элемент.
Например, марганец находится в VII группе (побочная подгруппа), высшая валентность Mn равна семи. Кремний расположен в IV группе (главная подгруппа), его высшая валентность равна четырем.
Следует помнить, однако, что высшая валентность не всегда является единственно возможной. Например, высшая валентность хлора равна семи (убедитесь в этом!), но известны соединения, в которых этот элемент проявляет валентности VI, V, IV, III, II, I.
Если известна валентность одного из элементов в бинарном соединении, можно найти валентность другого.
Зная валентности двух элементов, можно составить формулу бинарного соединения.
Ответ прост: берите минимально возможные значения х и у. В приведенном примере эти минимальные (натуральные!) значения как раз и равны 1 и 2.
Несмотря на все сказанное, в большинстве случаев можно руководствоваться правилом: берите наименьшие значения индексов.
Вот, собственно, и все основные моменты.
Хотите узнать, почему «классическое» определение валентности часто не «работает»? Почему валентность железа в FeO не равна двум? Почему для описания комплексных веществ используется понятие «координационное число»?
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.