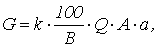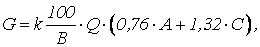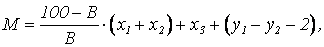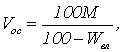Чем гасится серная кислота
Что делать при ожоге серной кислотой
Ожог серной кислотой – опасная химическая травма, часто приводящая к летальному исходу. Маслянистая жидкость без запаха и цвета относится к сильным окислителям. При контакте со слизистыми оболочками и кожными покровами моментально разрушает клетки эпителия. Вдыхание испарений кислоты приводит к ларингиту, бронхиту, геморрагической пневмонии. Степень повреждения тканей зависит от процентного содержания реагента в растворе. Принципы лечения ожогов едкими кислотами отличаются от мер, к которым прибегают при химических травмах другими веществами.
Чем опасен ожог серной кислотой
Ожоги от серной кислоты чреваты глубоким поражением мягких и костных тканей. Попадание реагента на кожу приводит к:
При контакте с кислотой происходит некроз кожи, а в случае поражения больших участков тела наблюдается ожоговый шок. Особенно опасными являются испарения жидкости, которые проникают в органы дыхания. Ожог вызывает сильную боль, внутренние кровотечения. Попадание реагента в глаза в 80% случаев заканчивается частичной или полной потере зрения.
Степени повреждения кожи
Ожоги получают из-за неаккуратного обращения с реагентами на производстве и в быту. Серьезность химической травмы определяется концентрацией кислоты в растворе:
При воздействии вещества на живые ткани разрушается внутриклеточный белок с образованием органических и неорганических соединений – альбумоз, протеиногенных аминокислот, пептонов и т.д.

По глубине повреждений выделяют 4 степени ожогов:
Ожоги едкой кислотой приводят к формированию белой рыхлой корки с четкими границами, которая со временем темнеет. Внешне кажется, что травма поверхностная и не представляет опасности. Но под струпом образуются язвы, а отмирание тканей повышает риск инфекционного воспаления.
Первая помощь при ожоге серной кислотой
Чтобы оказать пострадавшему медицинскую помощь, необходимо иметь представления о свойствах едких кислот. Неправильные действия чреваты углублением ожога, опасными для жизни осложнениями. В определенных ситуациях нельзя даже находиться рядом с потерпевшим без средств защиты – респиратора, резиновых перчаток, защитных очков. Вдыхание испарений серной кислоты приводит к разрушению слизистых оболочек дыхательных путей.
Первая помощь при ожогах серной кислотой предполагает:
При обширных ожогах проводят противошоковые и дезинтоксикационные мероприятия, которые направлены на уменьшение токсического действия химического вещества на организм.
При повреждении кожи
Алгоритм оказания доврачебной помощи при попадании реагента на кожные покровы включает в себя такие шаги:
В завершение накладывают стерильную повязку и вызывают на дом врача или отправляются в больницу.
При попадании в глаза
Попадание серной кислоты на слизистую глаза или роговицу чревато слепотой. Чтобы предупредить такие осложнения, следует:
После оказания экстренной помощи вызывают специалиста или отправляются в ожоговый центр. Дальнейшая терапия определяется офтальмологом в зависимости от глубины проникновения реактива в глаз.
При поражении слизистой оболочки рта и пищевода
Наибольшую опасность для жизни представляют ожоги слизистой ЖКТ, желудка, пищевода. Случайный прием более 5 мг вещества приводит к летальному исходу.

При повреждении внутренних органов необходимо:
Чтобы предотвратить еще большее поражение ЛОР-органов, в комнате открывают окна для поступления свежего воздуха. Промывание желудка эффективно только в первые 5-6 часов после получения травмы.
Категорически нельзя провоцировать рвоту, так как это чревато разрывом пищевода.
Дальнейшее восстановление
Едкая кислота редко вызывает поверхностные травмы, не требующие госпитализации. Необходимо обратить к врачу, если:
Местной терапией ограничиваются при повреждении только поверхностных слоев кожи. Обычно в схему лечения включаются:
Для антисептической обработки пораженных участков используют раствор коллоидного серебра. При пузырьковых высыпаниях и отторжении тканей накладывают повязки с такими препаратами:
Ожоги кислотой 3 степени опасны гнойными осложнениями. В случае заражения раны кокковой инфекцией используют Мирамистин, Хлоргексидин. При обширных поражениях проводится системная противомикробная терапия полусинтетическими пенициллинами, аминогликозидами или цефалоспоринами – Гентамицином, Цефуроксимом, Амоксициллином, Уназином и т.д.
Разрушение базального слоя кожи является показанием к оперативному вмешательству. Метод хирургического лечения зависит от степени и обширности повреждений – ампутация, кожная пластика. Даже после успешного лечения кислота оставляет заметные рубцы в виде подтеков.
При ожоге ЖКТ проводится бужирование на 7 день после начала терапии. Суть процедуры заключается во введении в пищевод дилататоров – трубок разного диаметра. Они препятствуют уменьшению просвета пищевода и рубцеванию слизистой.
Опасные осложнения
Разрушающее воздействие кислоты обусловлено обезвоживанием тканей, расщеплением в них белковых компонентов. Последствия определяются концентрацией едкого вещества, его объемом и длительностью контакта с кожей или слизистыми. Высокоактивная кислота сразу же провоцирует глубокие ожоги с обугливанием тканей.
К возможным осложнениям химической травмы относят:
Если вовремя не оказать пострадавшему помощь, это приведет к отказу почек или печени. В 93% случаев такие осложнения заканчиваются летальным исходом. В зону риска входят пациенты с пиелонефритом, циррозом печени, гломерулонефритом и т.д. Химически активная жидкость провоцирует отсроченные осложнения. В 7% случаев на месте рубцов возникает плоскоклеточный рак.
Меры предосторожности во время работы с химическими агентами
Ожоги едкими кислотами в 67% случаев встречаются у людей, работающих на химических производствах. Чтобы минимизировать риск травмы, нужно соблюдать технику безопасности при работе с концентрированными окислителями:
Химические вещества нельзя хранить на одной полке с продуктами или лекарствами. Кислота должна быть недоступна для детей.
Прогноз выживаемости
Серьезность травмы определяется концентрацией реагента, локализацией ожога. Прогноз заживления определяют по правилу сотни – суммируют проценты ожоговой площади по отношению к сохранившимся тканям с возрастом пострадавшего:
Прогноз выздоровления зависит от локализации ожоговых ран, глубины проникновения реагента. Исход химической травмы ухудшается при ожоговом шоке, интоксикации. Ожоги концентрированными кислотами сопровождаются продолжительным воспалением. Во время заживления в очагах поражения образуется много грануляционной ткани. Поэтому у обожженных возникают заметные рубцы, которые ограничивают подвижность суставов.
Чем гасится серная кислота
Химические реакции
Нейтрализация кислоты происходит, когда она объединяется с основанием для производства соли и воды. Соляная кислота состоит из положительно заряженных ионов водорода и отрицательно заряженных ионов хлора. Основная жидкость, такая как едкий натр (гидроксид натрия), состоит из положительно заряженных ионов натрия и отрицательно заряженных гидроксильных ионов. Во время реакции ионы водорода и гидроксила объединяются, образуя воду, в то время как ионы хлора и натрия объединяются, образуя хлорид натрия, известный как поваренная соль. Более слабые основные вещества, такие как пищевая сода (бикарбонат натрия), кальцинированная сода (карбонат натрия) и известь (карбонат кальция) распадаются на положительные ионы натрия или кальция и отрицательные ионы карбоната в кислоте. Водород и карбонат-ионы объединяются, чтобы произвести газ углекислого газа в эффекте шипения вместе с водой. Ионы металла и хлорида объединяются, чтобы произвести соль хлорида натрия или кальция.
Тепло от химической реакции
Кислотная нейтрализация является сильно экзотермической реакцией, что означает, что она производит большое количество тепла, которое может испарять любую произведенную воду. Любой углекислый газ, который образуется в результате небольшой реакции нейтрализации, может раздражать ваши глаза и горло, хотя он не будет в достаточно больших объемах, чтобы быть смертельным. Чтобы свести к минимуму тепло и углекислый газ, медленно и постепенно добавляйте базовый материал в соляную кислоту.
Защитная одежда
Небольшие разливы
Большие разливы
Известняк и доломит (карбонат кальция-магния) являются распространенными нейтрализующими агентами для крупных разливов соляной кислоты и других кислот в естественных водоемах и в потоках воды из угольных шахт. Оба материала реагируют с кислотой в течение примерно 15 минут с образованием солей в шламе, с которыми легко обращаться и удалять. Известняк является лучшим реагентом из двух.
Как действовать в аварийных ситуациях, связанных с кислотами и щелочами
При строгом соблюдении техники безопасности при хранении и транспортировке кислот и щелочей, а также при работе с ними, вероятность аварийной ситуации крайне мала. Тем не менее, знать, как действовать в случае ее возникновения, надо обязательно. Это может спасти чье-то здоровье или даже жизнь!
Чем опасны кислоты и щелочи
Контакт с кислотами и щелочами может вызвать химические ожоги; 
Все сотрудники лабораторий, имеющих дело с едкими реактивами, обязаны уметь оказывать первую помощь при химических ожогах; знать, где расположены аптечка, нейтрализующие растворы, песок и опилки. По технике безопасности в аптечке должны находиться по 1 л раствора борной или лимонной кислоты и раствора соды, или комплект PLUM с нейтрализующими растворами.
Приготовление нейтрализующего раствора
Для приготовления нейтрализующего раствора берут 1 литр воды и 10 г реактива (лимонной кислоты, борной кислоты, соды). Размешивают до полного растворения всех твердых частиц и переливают в пластиковые сосуды подходящего размера. Потом на них наклеивается этикетка с хорошо читаемым указанием названия, концентрации и назначения («нейтрализующий раствор для кислоты», «нейтрализующий раствор для щелочи»).
Приготовленные растворы должны храниться в аптечке или рядом с ней.
Что делать при химических ожогах
Место поражения щелочью обильно поливают 1%-ным раствором лимонной или борной кислоты.
Для химических ожогов специально предназначена нейтрализующая жидкость из комплекта PLUM (выливается весь флакон).
• Если кислота или щелочь попали в глаза, то они промываются нейтрализующим раствором, разведенным вдвое.
• После этого место ожога промывают водой, мылом и снова водой. Промывание водой должно длиться не менее 15 минут.
• Пострадавшего должен осмотреть врач для определения дальнейшего лечения. При необходимости вызывают «Скорую помощь».
Что делать при разливах
При разливе едкого хим. реактива крайне важно знать характер 
После того, как вся жидкость впиталась, песок или опилки сметают и утилизируют (захоранивают или передают на утилизацию сертифицированным организациям). Место пролива заливают нейтрализующим раствором (раствором соды или лимонной, борной кислоты), промывают водой и вытирают насухо.
Что делать при пожарах
Сами кислоты и щелочи, как правило, относятся к негорючим веществам, но они могут разлагаться при нагревании или вступать в реакции с металлами или органическими материалами, выделяя токсичные и горючие газы и вещества.
Если в зоне пожара оказались кислоты или щелочи, то все участвующие в тушении должны быть об этом проинформированы. Следует принять меры предосторожности, необходимые при контакте с кислотами или щелочами; использовать резиновую обувь, перчатки и респираторы, очки.
Пожар, в зоне которого оказались кислоты или щелочи, тушат песком, химической пеной, углекислым газом, мелкораспыленной водой.
Серная кислота: ожоги и пары – в чем их опасность
Серная кислота (H2SO4) – одно из самых известных химических соединений, знакомых каждому ещё со времён школьной скамьи. В неразбавленном виде, она представляет собой бесцветную маслянистую жидкость без какого-либо запаха. Особые свойства соединения делают его востребованным в промышленности и сельском хозяйстве. Как получают серную кислоту и какие правила безопасности при работе с ней существуют? Обо всём по порядку.
Как получают серную кислоту
Химическое соединение могут получать из различной минеральной основы – квасцов, железной руды, купороса. Однако, все исходные реагенты содержат в составе серу, поэтому процесс получения кислоты заключается в сжигании основы путём химических реакций.
Самый распространённый метод получения серной кислоты в промышленности – контактный. Он имеет ряд преимуществ перед другими способами получения, так как даёт минимальный выброс токсичных веществ в атмосферу. Процесс осуществляется путём обжига влажного пирита, в результате чего выделяется водяной пар, сернистый газ и кислород. Далее, эти вещества проходят специальную обработку в электрофильтре и сушильной камере, где их избавляют от примесей, а также остатков водяных паров. Окисление с помощью катализатора при оптимальных условиях (повышенном давлении и температуре 420-500С) даёт оксид серы, который растворяют с 2% воды и получают серную кислоту.
Свойства и применение
Серная кислота – один из основных продуктов в химической промышленности. Она имеет свойство окислять, а также растворять некоторые металлы, что позволяет активно использовать её в металлургии и быту. Ещё одно важное свойство H2SO4 – гигроскопичность (поглощение влаги из воздуха). Это помогает при обугливании органических веществ и осушке газа, что ещё больше расширяет сферу применения кислоты, а относительно низкая цена делает её незаменимой.
Сферы применения
| Сфера | Описание |
| Сельское хозяйство | Моногидрат из серной кислоты используют, как основной компонент минеральных, азотных и фосфорных удобрений для сельскохозяйственных культур. |
| Металлургия | С помощью 25% раствора H2SO4 проверяют качество стальных изделий, производят очистку металла для дальнейшего покрытия медью, хромом или никелем. |
| Пищевая промышленность | Пищевая добавка Е513 имеет в составе серную кислоту. |
| Добывающая промышленность | Для выделения элементов (урана, циркония) из руд. |
| Медицина | Соединения с серной кислотой активно используют для изготовления лекарственных препаратов. Особенно популярен раствор магний сульфата, который вводят роженицам для облегчения процесса родов. |
| Нефтяная промышленность | Для очистки нефтепродуктов. |
| Строительство | Входит в состав скрепляющих и отделочных материалов. |
| Производство | Из вещества производят красители, пластмассу, аккумуляторы, текстиль, моющие и взрывчатые вещества. |
| Применение в быту | Серная кислота активно используется для очищения металла от ржавчины и популярна среди автомобилистов. |
Класс опасности для человека
Существует несколько видов концентрации раствора H2SO4. Для одних целей используют 100% раствор, для других – его сильно разбавляют. От этого напрямую зависит и степень опасности кислоты для человека. Например, 10% раствор может вызвать лёгкое отравление серной кислотой, а вещество в чистом виде вызывает химические ожоги и повреждения внутренних органов.

Случается, что пренебрежение мерами безопасности при работе с химическим веществом приводит к попаданию серной кислоты на кожу, что становится причиной получения тяжёлых травм. Разбавленные растворы этого вещества вызывают ожоги первой или второй степени, в то время, как более концентрированная кислота может вызвать более тяжелые травмы.
Ожог серной кислотой может случиться не только на производстве, но и в быту. Поэтому важно знать, какие меры необходимо принять в первую очередь, ведь химический ожог кислотой сильно отличается от термической травмы.
Первая помощь при ожоге серной кислотой:
Лечение
В первую очередь больного нужно доставить в больницу, где лечащий врач назначит необходимое лечение. Оно состоит из уменьшения болевых симптомов и восстановления кожного покрова. Для окончательно выздоровления назначаются различные препараты:
Отравление парами

Первая помощь
При первых признаках отравления больному нужно выпить средство, обволакивающее желудок. Это поможет притупить боль в области живота и временно сведёт воздействие кислоты к возможному минимуму. Для этого отлично подойдёт известковая вода, стакан подсолнечного или оливкового масла. Другим способом избавления от химиката является экстренная очистка желудка путём провоцирования рвоты, при этом пить воду строго запрещено. Глаза необходимо промыть слабым раствором марганцовки и закапать Новокоином.
Лечение
Лечение интоксикации должно проводиться только в стационаре. Повреждение внутренних органов и слизистых оболочек крайне опасно и может стать причиной летального (смертельного) исхода, достаточно 5 мг вещества, попавшего внутрь организма. Поэтому избегать скорейшего обращения в больницу не рекомендуется.
Правила работы с серной кислотой (профилактика)
Работа с серной кислотой требует особых мер предосторожности:
Нейтрализация путем добавления реагентов
Если на промышленном предприятии имеются только кислые или щелочные воды или невозможно обеспечить их взаимную нейтрализацию применяется реагентный метод нейтрализации. Этот метод наиболее широко используется для нейтрализации кислых сточных вод. Выбор реагента зависит от вида кислот, их концентрации, растворимости солей, образующихся в результате химической реакции.
Для нейтрализации минеральных кислот применяется любой щелочной реагент, чаще всего известь-пушонка, известковое молоко, карбонаты кальция и магния в виде суспензии. Эти реагенты сравнительно дешевы и общедоступны, но имеют ряд недостатков: обязательно устройство усреднителей перед нейтрализационной установкой; затруднительно регулирование дозы реагента по рН нейтрализованной водой; сложное реагентное хозяйство.
Скорость реакции между раствором кислоты и твердыми частицами суспензии относительно невелика и зависит от размеров частицы и растворимости образующегося в результате реакции нейтрализации соединения. Поэтому окончательная активная реакция устанавливается не сразу, а по истечении некоторого времени – 10-15 мин. Сказанное выше относится к сточным водам, содержащим сильные кислоты (H2SO4, H2SO4), кальциевые соли которых труднорастворимы в воде.
При нейтрализации сточных вод, содержащих серную кислоту (H2SO4), реакция в зависимости от применяемого реагента протекает по уравнениям:
H2SO4+Ca (OH)2 = CaSO4+2H2O,
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4·2H2O. Растворимость этой соли при температуре 0-40 0С колеблется от 1,76 до 2,11 г/л.
При более высокой концентрации сульфат кальция выпадает в осадок, поэтому при нейтрализации сильных кислот, кальциевые соли которых труднорастворимы в воде, необходимо устраивать отстойники-шламонакопители. Существенным недостатком метода нейтрализации серной кислоты известью является образование пресыщенного раствора гипса (коэффициент пресыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Присутствие в сточных водах многих химических производств высокомолекулярных органических соединений усиливает устойчивость пресыщенных растворов гипса, поскольку эти соединения сорбируются на гранях кристаллов сульфата кальция и препятствуют их дальнейшему росту.
Для уменьшения коэффициента пресыщения используется метод рециркуляции образующегося в результате нейтрализации осадка сульфата кальция. Концентрация ионов кальция в сточной воде уменьшается при увеличении дозы рециркулирующего осадка: продолжительность перемешивания этой воды должна быть не менее 20-30 мин. Для уменьшения зарастания трубопроводов, по которым транспортируются нейтрализованные известью сернокислотные стоки, применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Поскольку в кислых и щелочных сточных водах практически всегда присутствуют ионы тяжелых металлов, то дозу реагентов следует определять с учетом выделений в осадок тяжелых металлов.
Количество реагента, необходимого для нейтрализации сточных вод определяется по формуле
где k – коэффициент запаса расхода реагента по сравнению с теоретическим k = 1,1 – для известкового молока, k = 1,5 – для известкового теста и сухой извести; В – количество активной части в товарном продукте, %; Q – количество сточных вод подлежащих нейтрализации, м3; а – расход реагента для нейтрализации (табл. 1.7), г/кг
Расход реагентов для нейтрализации 100 % кислот и щелочей
каустическая
0,67/1,5
При нейтрализации кислых и щелочных сточных вод содержащих соли тяжелых металлов, количество реагента будет определяться по формуле
где С1, С2. Сn – концентрации металлов в сточных водах, кг/м; b1, b2. bn, – концентрации реагентов, требуемых для перевода металла из растворенного состояния в осадок (табл. 1.8), кг/кг.
Расход реагентов, требуемых для удаления металлов
| Металл | Реагент СаО | Реагент Са(ОН)2 | Реагент Na2CO3 | Реагент NaOH |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1 | 1,32 | 1,9 | 1,43 |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Например, при нейтрализации гашеной известью сточных вод, поступающих после травления черных металлов серной кислотой происходят следующие реакции:
На основании приведенных выше реакций или данных в табл. 1.7 и 1.8, а также по содержанию серной кислоты и железа в отработанных травильных растворах можно определить количество гашеной извести, необходимой для нейтрализации кислых сточных вод и осаждения железа
где А – содержание серной кислоты, кг/м3; С – содержание железа, кг/м3.
Количество сухого вещества, которое образуется при нейтрализации 1м3 сточной воды, содержащей свободную серную кислоту и соли тяжелых металлов, определяется по формуле
где М – масса сухого вещества, кг; В – содержание активного вещества в используемой извести, %; х1, х2 – количество активного вещества, необходимое соотвественно для осаждения металла и для нейтрализациии свободной серной кислоты, кг; х3 – количество образующихся гидроксидов металлов, кг; у1, у2 – количество сульфата кальция, образующиеся соответственно при осаждении металла и при нейтрализации свободной серной кислоты, кг.
Если значение третьего члена в приведенной формуле отрицательно, то он не учитывается.
Объем осадка, образующегося при нейтрализации сточной воды можно найти по уравнению
где Wвл – влажность осадка, %.
Для нейтрализации кислых вод могут быть использованы: NaOH, КОН, Na2CO3. NH4OH (аммиачная вода), СаСО3. доломит (СаСО3. MgСО3 ) цемент. Однако наиболее дешевым реагентом является гидроксид кальция (известковое молоко) с содержанием активной извести Са(ОН)2 5-10 %. Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (Н2СО3, СН3СООН); 2) воды, содержащие сильные кислоты (НСl, HNO3). Для их нейтрализации может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде; 3) воды, содержащие серную и сернистую кислоты. Кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок.
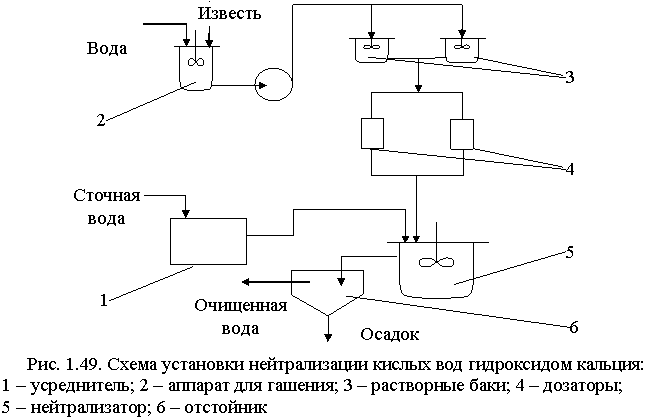
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция (известкового молока; «мокрое» дозирование) или в виде сухого порошка («сухое» дозирование). Схема установки для нейтрализации кислых вод известковым молоком показана на рис. 1.49.
Для гашения извести используют шаровые мельницы мокрого помола, в которых одновременно происходят тонкое измельчение и гашение. Для смешения сточных вод с известковым молоком применяют гидравлические смесители различных типов: дырчатые, перегородчатые, вихревые, с механическими мешалками или барботажные с расходом воздуха 5-10 м3/ч на 1 м2 свободной поверхности.
При нейтрализации сточных вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс CaSO4·2H:2O. Растворимость гипса мало меняется с температурой. При перемещении таких растворов происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Увеличение скорости движения нейтрализованных вод способствует уменьшению отложений гипса на стенках трубопровода.
Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы. Метод реагентной нейтрализации кислых и щелочных сточных вод широко используется на предприятиях химической промышленности.