Чем вылечить золотой стафилококк
Стафилококк золотистый. Микробиологические аспекты
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Автор: Трубачева Е.С., врач – клинический фармаколог
Прошло много лет после написания первой статьи, посвященной лечению инфекций, вызванных золотистым стафилококком. За это время автор, будем надеяться, немного помудрела и приобрела кое-какой опыт в более детальной диагностике вышеупомянутых состояний, чем и хотела бы поделиться с многоуважаемой аудиторией в надежде, что, возможно, поможет каждому из вас в рутинной ежедневной работе, так как с этой зверюшкой сталкивается буквально каждый, кто надел белый халат и уж тем более хирургический костюм.
Сначала повторим общеизвестные факты: S.aureus относится к грамположительным коккам и являются чуть ли не основной причиной большого количества инфекций кожи и мягких тканей, а так же ведущей причиной послеоперационных раневых инфекций.
Выделяют следующие разновидности золотистого стафилококка:
И сейчас обсудим первые три более подробно, так как именно они являются той причиной, ради которой повторно поднята данная тема, в том числе и по просьбам читателей (за что выражаем отдельную признательность).
Первое, что необходимо не просто запомнить, а буквально зазубрить наизусть — золотистый стафилококк, он же S.aureus, является нормальным жителем на неповрежденной коже и слизистых оболочках. Еще раз — нормальным, но только на неповрежденной коже и вне зависимости от антибиотикочувствительности пойманных экземпляров. Если кожа по тем или иным причинам поражается (например, сахарным диабетом) или повреждается, стафилококк тут же из милого соседа превращается в злейшего врага. Все как у людей — стоит дать слабину, и ближайшие соседи начнут добивать с ласковой улыбкой.
Таким образом, когда вы получаете результат микробиологического исследования образца, взятого с кожи (или из носоглотки), и видите там золотистого стафа, то должны понимать, кто перед вами, и насколько этот кто-то имеет отношение к текущему процессу.
Второе: если клиника отсутствует, а стафилококк посеялся, надо сделать что? Правильно, повторить посев еще раз. Золотистый стафилококк — это один из немногих микробов, чье наличие в отделяемом материале надо проверять дважды. Единственное исключение — это кровь, взятая непосредственно из сосудистого русла, чаще всего из вены. Наличие стафилококка в крови является поводом к немедленному назначению антибактериальной терапии, так как прямо указывает на наличие инфекции кровотока, а уж какого она генеза, спонтанного или ятрогенного, разбираться будете позже. Во всех остальных ситуациях проводится пересев с тщательным соблюдением техники забора материала (со стенок раны, а не гной, состоящий из дохлых нейтрофилов и нападавших сверху стафилококков) и правил асептики и антисептики, чтобы собственными стафилококками с кожи вновь забранный материал не контаминировать.
Чтобы понять, друг перед нами или враг, познакомимся со стафилококками более подробно.
И нет, автор не сошла с ума — резистентность к ванкомицину у природных диких золотистых стафилококков — совершенно нормальное явление. Более того, попытка лечить такого возбудителя ванкомицином считается грубейшей ошибкой и закончится полным провалом в силу природной устойчивости к данному препарату. Это третье, о чем помнить необходимо.
Где мы встречаем таких S.aureus чаще всего? В носоглотках грудных младенцев или в их же кале, если придумали посеять. Почему? Потому что это представитель нормальной микрофлоры кожи, и ребенок сглатывает то, что живет в его носоглотке или слизывает с кожи матери. Надо лечить? В данной ситуации — ни в коем случае, иначе побьете нормальную микрофлору кожи и слизистых, и если очень повезет, то для ребенка это пройдет без последствий, но, скорее всего, получим стафилококка, вооруженного пенициллиназами, или MSSA. Повторимся еще раз — только в случае отсутствия клинической картины можно принимать такого рода решения. Во всех иных случаях необходима антибактериальная терапия, причем на длительный (до 28 суток) период времени.
Обратите внимание на строку с бензилпенициллином, указывающую на наличие пенициллиназ. Мы обязаны упомянуть, что точно такая же картинка может наблюдаться и у пациентов, давно или никогда не применявших антибиотики, так как пенициллиназы еще в середине прошлого века «ушли» в дикую природу.
Почему MSSA? Обратите внимание на строку с оксациллином, который в данной панели поставлен вместо метициллина. Таким же ориентиром может быть цефазолин. Оба этих препарата до сих пор являются самыми эффективными в клиническом плане антибиотиками для эрадикации дикого и MSSA стафилококков, если к этому имеются показания
При каких состояниях мы можем увидеть подобных возбудителей?
Типичным для клинической картины будет довольно агрессивное течение заболевания с яркими клиническими проявлениями ввиду того, что именно такой вид стафилококка обладает определенным набором ферментов, очень быстро расплавляющим окружающие ткани с образованием полостей и большим количеством гнойного отделяемого.
на антибиотикограмме будет выглядеть приблизительно так, оксациллин-резистентный, но ванкомицин-чувствительный (хотя при таком значении МПК уже возможны варианты)
Когда встречается? Все многообразие ятрогенных ВБИ к вашим услугам — почти все раневые инфекции и послеоперационные гнойные осложнения вне зависимости от их локализации. Повторимся в очередной раз — руки надо мыть, и мыть правильно. А еще закрывать маской не только рот, но и нос всем, кто хоть как-то касается открытых ран вне зависимости от причин их образования, так как стоит ране появиться, как стафилококк мгновенно превращается в зверя, осложняющего течение любого послеоперационного периода, особенно после операций, связанных с установками импланта. Более подробно о лечении предлагаем почитать в первой статье.
А теперь, тихо-тихо прошепчем, что иногда так может выглядеть приболевший микробиологический анализатор, который все, что в него не поставят, может определять как подобную страшную зверюгу. Хотя у вашего анализатора может быть какая-то своя болячка, и эти болячки лучше все-таки знать. Именно такого рода антибиотикограммы, как ничто другое наглядно показывают необходимость развития клинического мышления для умения отличать истинного возбудителя от контаминанта или нормального жителя человеческого организма, а также необходимости понимания, как работают методы микробиологической диагностики и варианты их ограничения.
Подведем краткие итоги нынешнего разговора:
В заключение хотелось бы отметить следующее. Уважаемые коллеги, золотистый стафилококк, при отсутствии клинической картины и на неповрежденной коже и слизистых является нормой — не надо его там «лечить». И брызгать ничем туда не надо. А в случаях наличия клинической картины (исключение — инфекции кровотока), необходимо провести повторный посев, с тщательным соблюдением правил асептики и антисептики, чтобы быть уверенными, что именно этот микроб является возбудителем, а не кто-то прячется за его спиной.
Стафилококк золотистый
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины.
Автор: врач–клинический фармаколог Трубачева Е.С.
История применения антибактериальных препаратов переживает определенную цикличность. В доантибиотиковую эру среди возбудителей тяжелых инфекций преобладали Гр(+) возбудители, потом пришли антибиотики, и во время второй мировой основными возбудителями стали Гр(-) возбудители (по принципу «свято место пусто не бывает), но тут Гр(+) опять подняли голову, т.к. выяснилось, что свыше 80% штаммов стафилококков продуцируют пенициллиназу и разрушают бензилпенициллин и аминопенициллины. В ответ на это в 60-е годы в практику были введены пенициллиназоустойчивые антибиотики – оксациллин, мецитиллин и цефазолин. Проблему на какое-то время решили, но с конца 80-х годов она опять возникла с новой силой. Дело в том, что в 80-е годы в медицинскую практику вошли препараты, эффективные преимущественно против Гр(-) возбудителей (аминогликозиды, цефалоспорины, много позже – карбопенемы) и Гр(+) инфекции получили селективное преимущество, обладающие либо природной, либо приобретенной устойчивостью к уже имеющимся препаратам. Речь идет об основных патогенах – энтерококках и стафилококках. Энтерококки пока особых проблем не доставляют, так как у нас еще не встречаются ванкомицин-резистентные возбудители, а вот золотистый стафилококк (Staphylococcus aureus) стал очень большой проблемой, да такой, что происходящее несколько лет назад в некоторых источниках стали называть «стафилококковой чумой». Вот об этом самом возбудителе и как с ним можно справиться мы сегодня и поговорим. Еще точнее, поговорим о заболеваниях связанных со стафилококковой бактериемией и с тем, как с ними бороться.
Staphylococcus aureus делится на две группы – мецитиллинчувствительные (MSSA) и мецитиллинрезистентные (MRSA):
1. MSSA вырабатывают беталактамазы – пенициллиназы, которые разрушают незащищенные пенициллины, но сохраняют высокую чувствительность к оксациллину и цефазолину. Кроме того они обладают лейкоцидином Пантона-Валентайна, который вызывает распад тканей практически в любом очаге, что служит косвенным подтверждением стафилококковой инфекции еще до получения микробиологического анализа.
2. MRSA в свою очередь подразделяются на госпитальные, которые характеризуются тем, что:
и внебольничные MRSA, характеризующиеся:
Факторами риска MRSA инфекций являются
Для чего мы все это вспоминаем? Дело в том, что основные проблемы, связанные со стафилококковой инфекцией, это:
Проводить антистафилококковую терапию меньше 3-х, а то и 4-х недель нельзя, так как для этого возбудителя характерно развитие метастатических очагов и весь процесс пойдет по новому, только с учетом еще и того, что возбудитель окажется резистентным к ранее проводимой терапии.
Когда можно лечить 2 недели стафилококковую инфекцию?
Во всех остальных случаях лечим 21-28 дней. А что происходит у нас? Максимум 10-14 дней пролечили и отпустили.
Антистафилококковые препараты мы обязаны назначить сразу как только получили положительную гемокультуру на стафилококк однократно! И только потом проводим повторную проверку, так как максимально раннее начало антибактериальной терапии в 2-3 раза снижает летальность.
Итак, как уже стало понятно, основную проблему представляют устойчивые формы S.aureus. Для их эрадикации были синтезированы и предлагаются к использованию следующие препараты
1. Ванкомицин
Внедрен в практику в 1958 году, а первый устойчивый штамм стафилококка поймали только в 1996 году. Проблема с ванкомицинустойчивыми штамма стафилококка в том, что до сих пор нет отработанных схем преодоления этой самой устойчивости. Помимо прочего у возбудителей непрерывно нарастает МПК (минимальная подавляющая концентрация) к ванкомицину и сейчас при МПК 2 мы говорим о резистентном штамме.
Еще одна проблема – это плохо очищенные формы препарата. Если ванкомицин плохо очищен, то риск токсических нефропатий достигает 20%. К сожалению надо констатировать тот факт, что Ванкомицин отечественного разлива относится к плохо очищенным формам.
Основным и самым грозным осложнением является развитие острой почечной недостаточности, а она развивается у 40% пациентов, если дозировка препарата составляет более 4 гр/сут. А потому вводить данный препарат можно только под контролем клиренса креатинина (КК). То есть первый анализ мы проводим до введения препарата, второй через 2-3 дня и смотрим, если имеет место падение КК: если он падает на 25% – это говорит о нефротоксичном действии препарата, если на 50%, то препарат следует немедленно отменить.
Ванкомицин является бактериостатическим антибиотиком, эффективность действия мы оцениваем не ранее чем через 72 часа, а то и на 5-е сутки от начала терапии. Доза должна подбираться в соответствии с МПК возбудителя и под постоянным контролем клиренса креатинина. То есть для использования этого препарата нам необходимы хорошая клиническая и микробиологическая лаборатории.
Современные рекомендации по дозированию препарата выглядят следующим образом:
У Вас есть возможность это делать? У меня такой возможности не было и нет до сих пор, а потому мы до сих пор используем этот препарат как саперы на минном поле, где ошибиться можно только один раз.
Активность против MSSA у Ванкомицина сопоставима с плацебо, а значит применять его можно только при верифицированной MRSA, либо комбинировать с препаратами, активными против MSSA (цефазолином, например)
Следует так же помнить о том, что Ванкомицин, в виду строения его молекулы, а особенно ее размера, плохо проникает в ткани и проблемными его локализациями будут дыхательные пути, ЦНС, клапаны сердца и кости. А потому быстрого действия там не дождешься и терапия требуется очень и очень длительная.
Помимо прочего необходимо соблюдать скорость введения препарата – инфузия должна быть очень медленной – современные рекомендации говорят о 1,5-2 часовом введении препарата. В противном случае мы получим реакцию в виде «синдрома красного человека», перепугаемся сами, напугаем медсестер и пациента.
В заключении хотелось бы сказать, что препарат хорош, но будет лучше, если вы его не будете назначать в самостоятельном режиме, а вызовете врача – клинического фармаколога, ибо назначение и дозировка таких вот препаратов входит в его непосредственные обязанности.
Что делать если клин. фарма нет, а пациент есть. И что надо соблюсти, чтобы безопасно применять ванкомицин?
2. Линезолид
Является чистым бактериостатиком. Производителем неоднократно заявлялось, что препарат эффективнее Ванкомицина, однако проведенные независимые метаанализы клинических исследований хорошего качества рандомизированных и с двойным слепым контролем показали, что единственное, где Линезолид имеет преимущество – это вентилятор-ассоциированный пневмонии, вызванные MRSA. В других случаях, в т.ч. и стафилококковой пневмонии, преимуществ нет никаких. Зато стоимость лечения повышается в разы.
Еще один момент, о котором умалчивается – это безопасность применения Линезолида. Да, нефротоксичности нет, но по данным того же метаанализа частота возникновения тромбоцитопений при его использовании в 11,72 раза выше чем в группе плацебо.
Таким образом, Линезолид является препаратом выбора при нозокомиальной вентилятор-ассоциированной MRSA пневмонии, где при его использовании летальность ощутимо ниже, чем при использовании ванкомицина.
3. Тигециклин (или тайгециклин)
В данный момент активно выводится на рынок, зарегистрирован недавно не только в РФ, но и в мире. Разрабатывался как альтернатива карбопенемам, в условиях развития к ним устойчивости у ранее чувствительных микроорганизмов и основной точкой приложения должен был стать ацинетобактер (с которым в Штатах серьезная проблема). В спектре своего действия он имеет, в том числе, и S. aureus
Давайте разберемся и с ним, тем более к вам будут часто приходить и рассказывать про него как про самый препаратистый антибиотик в мире.
А теперь о том, куда его следует применять:
Повторюсь еще раз, место его применения это ЦЕЛЕНАПРАВЛЕННАЯ ЭТИОТРОПНАЯ ТЕРАПИЯ, т.е. когда микроб четко установлен в результате бактериологического исследования вместе с чувствительностью к антибиотикам.
Кроме того в сентябре 2010 г, буквально через несколько недель после вывода препарата на мировой рынок вышло вот такое предупреждение от FDA и наших надзорных органов: «о повышенном риске летального исхода при внутривенном применении антибиотика тайгециклина по сравнению с другими антибиотиками, применяемыми для лечения тяжелых инфекций. Повышенный риск летальности отмечен преимущественно при лечении тайгециклином внутрибольничной пневмонии (особенно вентилаторно-ассоциированной пневмонии), в редких случаях при лечении осложненных инфекций кожи и тканей и инфекций при синдроме диабетической стопы. FDA обновило информацию в инструкции к препарату. Следует отметить, что тайгециклин не одобрен для терапии инфекций диабетической стопы и для лечения внутрибольничной пневмонии (включая пневмонию при ИВЛ).»
Повторюсь еще раз – место этого препарата в лечении грам-отрицательной инфекции, но никак не стафилококков. Да и вообще это препарат крайне глубокого резерва, как по характеристикам, так и по цене, т.к. в ближайшие 10 лет не будет ни одного нового препарата с Гр(-) активностью, так как их просто нет даже в проекте (медицина традиционно не успевает за возбудителями, а только пытается их догонять, о чем мы в самом начале и говорили, прослеживая эволюцию возбудителей)
4. Даптомицин.
Препарат появился у нас недавно, хотя во всем мире применяется уже очень давно (в Штатах с 2003 года)
Препарат относится к классу липопептидов и от всех имеющихся на данный момент антиMRSA препаратов отличается тем, что является бактерицидным. И этот самый эффект развивается у него очень быстро и нам не надо ждать нескольких дней. То есть антибактериальный эффект мы можем оценивать как и у всех бактерицидных препаратов через 48 часов от начала применения, а это очень важно у больных в тяжелом состоянии. Еще одним несомненным плюсом является то, что не происходит лизиса клеток и не увеличивается интоксикация.
Основными показаниями к применению являются:
Также препарат может использоваться в эмпирической терапии (кстати, единственный из всех имеющихся на данный момент) Гр(+)инфекций, так как активность против MSSA и MRSA одинаковая.
Кроме того, препарат проявляет активность против MRSA в биопленках, а значит нет необходимости в удалении протезов и имплантов. А значит Даптомицин показан при ангиогенных инфекциях (бактериемиях), остеомиелите, бактериальном эндокардите.
Но всегда есть какое-то «но»… есть оно и здесь:
Итак, сводя все к общему знаменателю:
Ванкомицин мы используем тогда, когда у нас верифицирован MRSA стафилококк, имеется хорошая микробиологическая лаборатория, которая нам даст его МПК и это МПК не будет больше 2 (иначе он уже резистентен), в наличие есть клинический фармаколог, который посчитает дозу, будет ее контролировать и корригировать согласно изменениям клиренса креатинина. Но при этом мы помним о том, что препарат не работает на MSSA. И конечно же мы продолжаем помнить о его высокой нефротоксичности, если не имеем возможности пользоваться высокоочищенными формами.
Тигециклину нечего делать антистафилококковой терапии, этот препарат предназначен только для этиотропной терапии Гр(-)инфекции.
В связи с высокой активностью против MRSA и MSSA, быстрым бактерицидным эффектом является препаратом выбора при ангиогенных инфекциях, сепсисе и инфекционном эндокардите, а также препаратом выбора при эмпирической терапии MRSA+MSSA. Не использовать при лечении нозокомиальных пневмоний и инфекций ЦНС.
Staphylococcus aureus (стафилококк золотистый)
Staphylococcus aureus – патогенная разновидность стафилококков, вызывающий гнойно-воспалительные поражения органов и систем. Возбудитель диагностируется в подмышечной области, носовых ходах. Носителями патогенного микроорганизма считаются работники медицинских учреждений, больные некоторыми видами дерматита. У здоровых людей в норме золотистый стафилококк выявляется в носовых ходах, гортани, в промежности, на волосистой части головы, в ЖКТ.
Особенности носительства микроорганизма
Около 20% детей первых двух лет жизни являются носителями Staphylococcus aureus. Бактерия выявляется в носовой полости. С 4 лет патогенный микроорганизм выявляется у 50% детей.
Среди взрослых носителями является около 20% населения.
Среди медицинского персонала, число носителей достигает 30%.
После первой менструации, микроорганизм выявляется у 10% женщин. Во время менструального цикла, количество носителей среди женщин достигает 25%.
Штаммы золотистого стафилококка
Существует несколько видов штаммов золотистого стафилококка. Некоторые из них приобрели высокую устойчивость к некоторым группам антибактериальных препаратов. Такие штаммы получили название метициллин-резистентные. Они резистентны ко многим видам антибиотиков, в том числе к пенициллиновому ряду. В Америке ежегодно растет количество людей, зараженных этим видом микроорганизма.
Заразиться метициллин-резистентным штаммом можно в любом общественном месте. Смертность от него составляет порядка 30% — в США каждый год от инфекций, вызванных микроорганизмом, каждый год умирает до 20 тысяч человек.
Диагностика
Золотистый стафилококк выявляется при анализе биоматериала. Его могут обнаружить в кале при анализе на дисбактериоз. Метициллин-резистентный штамм обнаруживается в отделяемом носоглотки, околоносовых пазухах, в других видах отделяемого. Забор материала проводится при подозрении на носительство. В плановом порядке анализ на золотистый стафилококк делается при прохождении медицинского обследования медперсонала, работников сферы образования, общепита. В норме, микроорганизм должен отсутствовать.
Обнаружение бактерии возможно при проведении анализа на коагулазу.
Антибиотики против золотистого стафилококка
От золотистого стафилакокка применяют разные виды антибиотиков. Это могут быть:
Метициллин-резистентный вид бактерии показывается устойчивость к «Ципрофлоксацину», но они чувствительны к «Левофлаксацину» и «Рокситромицину».
Для борьбы с золотистым стафилококком применяют жирные кислоты, содержащие до16 атомов углерода. Противомикробная активность вещест обусловлена кислой средой, в которой микроорганизмы не выживают.
Staphylococcus aureus в МКБ включен в следующие разделы:
Staphylococcus aureus относится к роду стафилококков, класса бацил.
Антибиотики прямо под нашим носом
Антибиотики прямо под нашим носом
Структурная формула нового пептидного антибиотика.
Автор
Редакторы
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Доступные населению антибиотики теряют эффективность, а их частое и необоснованное применение приводит к отбору устойчивых форм бактерий внутри организмов людей и животных. MDRO в человеческом микробиоме трудно выявить, ведь обычно их носительство бессимптомно. Однако в стрессовых условиях (после хирургических операций, при травмах или иммуносупрессии) оно может перерасти в агрессивную инфекцию, побороть которую будет крайне сложно. А если еще учесть и частую устойчивость подобных бактерий к классическим дезинфектантам, становится понятным, почему MDRO считают настоящим бичом стационаров и роддомов. Они — куда более осязаемая угроза для населения всех континентов, чем тот же вирус Эбола, поэтому огромные усилия сейчас направляются на поиск и производство новых антибиотиков, способных «взломать» защитные системы MDRO.
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Может показаться странным, что человеческая микробиота производит антибиотики, ведь индустрия поиска противомикробных веществ всегда была сосредоточена на почвенных бактериях: считалось, что именно там бурлит жизнь и активно идет борьба за существование. Однако в микробиоме человека насчитывается более тысячи видов бактерий, конкурирующих за место и питательные вещества. Это способствует появлению настоящего «оружия массового поражения» — бактериоцинов, производимых с помощью ферментов двух типов — поликетидсинтаз и нерибосомных пептидсинтетаз [5].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Золотистый стафилококк
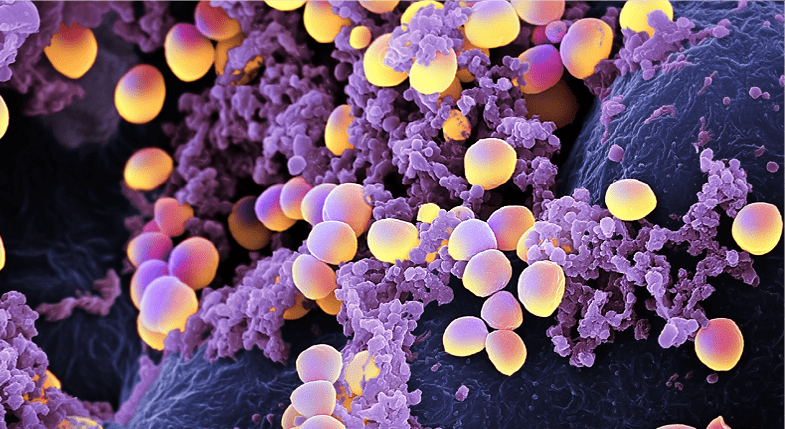
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
Рисунок 1. Staphylococcus aureus и лейкоциты.
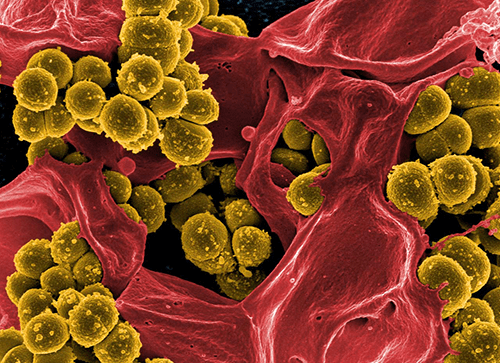
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.
Рисунок 3. Антибактериальная активность S. lugdunensis против метициллин-резистентного S. aureus. Слева — дикий штамм IVK28 образует зону лизиса на культуре S. aureus. В центре — штамм IVK28ΔlugD (с «выключенным» встраиванием транспозона геном lugD) не оказывает влияния на золотистого стафилококка. Справа — штамм с восстановленной активностью гена lugD снова лизирует клетки конкурента.
В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Разношерстные участники и пикантные подробности бактериального горизонтального генетического переноса описаны в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [11].
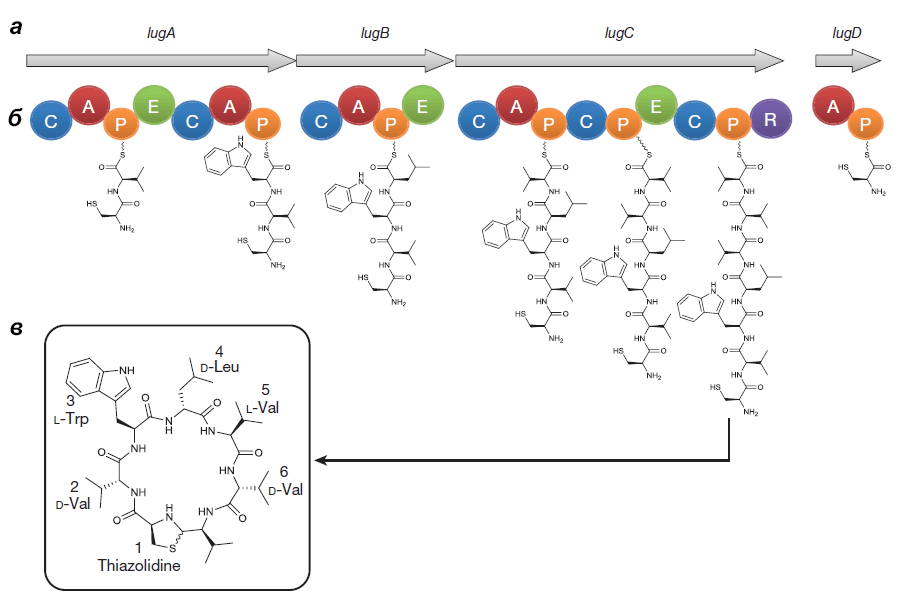
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Нерибосомные пептиды
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
Строение
Нерибосомные пептиды имеют длину от 2 до 50 аминокислот и часто циклическую или разветвленную структуру. Они содержат как «обычные», протеиногенные, так и непротеиногенные аминокислоты — D-формы или остатки, модифицированные присоединением N-метильных и N-формильных групп, гликозилированием, гидроксилированием, ацилированием или галогенированием. Циклизация происходит путем образования в пептидном остове оксазолинов и тиазолинов [12].
Синтез
НРП синтезируются нерибосомными пептидсинтетазами (НРПС), которые в своей работе не следуют «чужим» инструкциям, то есть обходятся без мРНК. НРПС — это гигантские мультимодульные ферменты, каждый из которых может синтезировать только один вид пептидов. Отдельный модуль фермента отвечает за включение одной аминокислоты в пептидную цепь, поэтому количество модулей соответствует длине пептида [14].
Каждый модуль состоит как минимум из трех доменов:
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
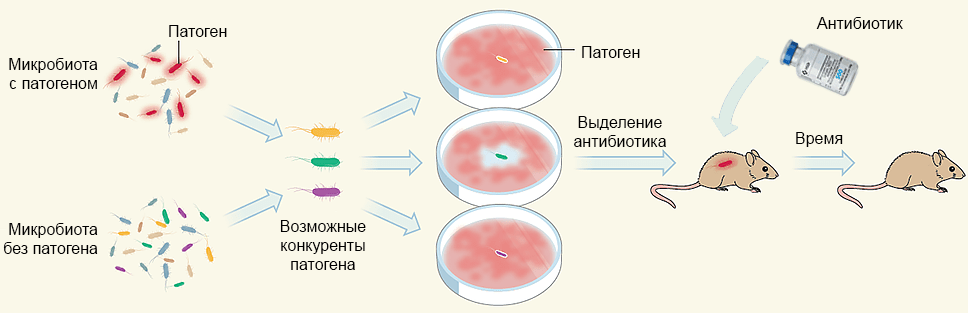
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Из-за высокой эффективности лугдунина авторы обсуждаемой работы предлагают использовать S. lugdunensis в борьбе с золотистым стафилококком, особенно у пациентов с высокими рисками развития инфекции — после операций, иммуносупрессии или гемодиализа. Ранее пробиотическими, как правило, называли бактерий, активно действующих на благо макроорганизма в желудочно-кишечном тракте. Группа Ципперера выступает за расширение понятия «пробиотики» — включение туда бактерий, борющихся с инфекциями и в других местах человеческого тела, таких как носовая полость или кожа.
В очень редких случаях и сам S. lugdunensis может вызывать заболевания, но если удастся создать мутантов, полностью утративших факторы вирулентности, или встроить lug-оперон в абсолютно «мирные» бактерии, можно разработать безопасный пробиотический препарат.
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)