Чем выше теплоемкость тем быстрее нагревается
Удельная теплоемкость вещества
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат
(в правом нижнем углу экрана).
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная теплоемкость: понятие и формула для расчета
Формулы количества теплоты для нагревания и охлаждения мы уже разбирали, но давайте еще раз:
Нагревание
Охлаждение
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
В этих формулах фигурирует такая величина, как удельная теплоемкость. По сути своей — это способность материала получать или отдавать тепло.
С точки зрения математики удельная теплоемкость вещества — это количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
Удельная теплоемкость вещества
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Также ее можно рассчитать через теплоемкость вещества:
Удельная теплоемкость вещества
c — удельная теплоемкость вещества [Дж/кг*˚C]
C — теплоемкость вещества [Дж/˚C]
Величины теплоемкость и удельная теплоемкость означают практически одно и то же. Отличие в том, что теплоемкость — это способность всего вещества к передаче тепла. То есть формулу количества теплоты для нагревания тела можно записать в таком виде:
Количество теплоты, необходимое для нагревания тела
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества [Дж/кг*˚C]
tконечная — конечная температура [˚C]
tначальная — начальная температура [˚C]
Таблица удельных теплоемкостей
Удельная теплоемкость — табличная величина. Часто ее указывают в условии задачи, но при отсутствии в условии — можно и нужно воспользоваться таблицей. Ниже приведена таблица удельных теплоемкостей для некоторых (многих) веществ.
Количество теплоты. Удельная теплоемкость вещества
Количеством теплоты называют количественную меру изменения внутренней энергии тела при теплообмене (или теплопередаче).
Количество теплоты — это энергия, которую тело отдает при теплообмене (без совершения работы). Количество теплоты, как и энергия, измеряется в джоулях (Дж).
Удельная теплоемкость вещества
Теплоемкость — это количество теплоты, поглощаемой телом при нагревании на 1 градус.
Теплоемкость тела обозначается заглавной латинской буквой С.
От чего зависит теплоемкость тела? Прежде всего, от его массы. Ясно, что для нагрева, например, 1 килограмма воды потребуется больше тепла, чем для нагрева 200 граммов.
А от рода вещества? Проделаем опыт. Возьмем два одинаковых сосуда и, налив в один из них воду массой 400 г, а в другой — растительное масло массой 400 г, начнем их нагревать с помощью одинаковых горелок. Наблюдая за показаниями термометров, мы увидим, что масло нагревается быстрее. Чтобы нагреть воду и масло до одной и той же температуры, воду следует нагревать дольше. Но чем дольше мы нагреваем воду, тем большее количество теплоты она получает от горелки.
Таким образом, для нагревания одной и той же массы разных веществ до одинаковой температуры требуется разное количество теплоты. Количество теплоты, необходимое для нагревания тела и, следовательно, его теплоемкость зависят от рода вещества, из которого состоит это тело.
Так, например, чтобы увеличить на 1 °С температуру воды массой 1 кг, требуется количество теплоты, равное 4200 Дж, а для нагревания на 1 °С такой же массы подсолнечного масла необходимо количество теплоты, равное 1700 Дж.
Физическая величина, показывающая, какое количество теплоты требуется для нагревания 1 кг вещества на 1 °С, называется удельной теплоемкостью этого вещества.
У каждого вещества своя удельная теплоемкость, которая обозначается латинской буквой с и измеряется в джоулях на килограмм-градус (ДжДкг • °С)).
Удельная теплоемкость одного и того же вещества в разных агрегатных состояниях (твердом, жидком и газообразном) различна. Например, удельная теплоемкость воды равна 4200 Дж/(кг • °С), а удельная теплоемкость льда 2100 Дж/(кг • °С); алюминий в твердом состоянии имеет удельную теплоемкость, равную 920 Дж/(кг • °С), а в жидком — 1080 Дж/(кг • °С).
Заметим, что вода имеет очень большую удельную теплоемкость. Поэтому вода в морях и океанах, нагреваясь летом, поглощает из воздуха большое количество тепла. Благодаря этому в тех местах, которые расположены вблизи больших водоемов, лето не бывает таким жарким, как в местах, удаленных от воды.
Количество теплоты. Удельная теплоёмкость
1. Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количеством теплоты.
Количеством теплоты называется изменение внутренней энергии тела в процессе теплопередачи без совершения работы.
Количество теплоты обозначают буквой \( Q \) . Так как количество теплоты является мерой изменения внутренней энергии, то его единицей является джоуль (1 Дж).
При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
2. Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. Таким образом, чем больше масса тела, тем большее количество теплоты требуется ему для нагревания. То же самое и с охлаждением: тело большей массы при охлаждении отдаёт большее количество теплоты. Эти тела сделаны из одного и того же вещества и нагреваются они или охлаждаются на одно и то же число градусов.
3. Если теперь нагревать 100 г воды от 30 до 60 °С, т.е. на 30 °С, а затем до 100 °С, т.е. на 70 °С, то в первом случае на нагревание уйдёт меньше времени, чем во втором, и, соответственно, на нагревание воды на 30 °С, будет затрачено меньшее количество теплоты, чем на нагревание воды на 70 °С. Таким образом, количество теплоты прямо пропорционально разности конечной \( (t_2\,^\circ C) \) и начальной \( (t_1\,^\circ C) \) температур: \( Q\sim(t_2-t_1) \) .
4. Если теперь в один сосуд налить 100 г воды, а в другой такой же сосуд налить немного воды и положить в неё такое металлическое тело, чтобы его масса и масса воды составляли 100 г, и нагревать сосуды на одинаковых плитках, то можно заметить, что в сосуде, в котором находится только вода, температура будет ниже, чем в том, в котором находятся вода и металлическое тело. Следовательно, чтобы температура содержимого в обоих сосудах была одинаковой нужно воде передать большее количество теплоты, чем воде и металлическому телу. Таким образом, количество теплоты, необходимое для нагревания тела зависит от рода вещества, из которого это тело сделано.
5. Зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
Физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К), называется удельной теплоёмкостью вещества.
Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой \( c \) . Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Удельная теплоёмкость свинца 140 Дж/кг °С. Это значит, что для нагревания 1 кг свинца на 1 °С необходимо затратить количество теплоты 140 Дж. Такое же количество теплоты выделится при остывании 1 кг воды на 1 °С.
Поскольку количество теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на 1 °С. В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.
По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.
6. Пример решения задачи. В стакан, содержащий 200 г воды при температуре 80 °С, налили 100 г воды при температуре 20 °С. После чего в сосуде установилась температура 60 °С. Какое количество теплоты получила холодная вода и отдала горячая вода?
При решении задачи необходимо выполнять следующую последовательность действий:
1. Условие задачи.
Дано:
\( m_1 \) = 200 г
\( m_2 \) = 100 г
\( t_1 \) = 80 °С
\( t_2 \) = 20 °С
\( t \) = 60 °С
______________
2. СИ: \( m_1 \) = 0,2 кг; \( m_2 \) = 0,1 кг.
3. Анализ задачи. В задаче описан процесс теплообмена между горячей и холодной водой. Горячая вода отдаёт количество теплоты \( Q_1 \) и охлаждается от температуры \( t_1 \) до температуры \( t \) . Холодная вода получает количество теплоты \( Q_2 \) и нагревается от температуры \( t_2 \) до температуры \( t \) .
4. Решение задачи в общем виде. Количество теплоты, отданное горячей водой, вычисляется по формуле: \( Q_1=c_1m_1(t_1-t) \) .
5. Вычисления.
\( Q_1 \) = 4200 Дж/кг · °С · 0,2 кг · 20 °С = 16800 Дж
\( Q_2 \) = 4200 Дж/кг · °С · 0,1 кг · 40 °С = 16800 Дж
6. В ответе получено, что количество теплоты, отданное горячей водой, равно количеству теплоты, полученному холодной водой. При этом рассматривалась идеализированная ситуация и не учитывалось, что некоторое количество теплоты пошло на нагревание стакана, в котором находилась вода, и окружающего воздуха. В действительности же количество теплоты, отданное горячей водой, больше, чем количество теплоты, полученное холодной водой.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. Удельная теплоёмкость серебра 250 Дж/(кг · °С). Что это означает?
1) при остывании 1 кг серебра на 250 °С выделяется количество теплоты 1 Дж
2) при остывании 250 кг серебра на 1 °С выделяется количество теплоты 1 Дж
3) при остывании 250 кг серебра на 1 °С поглощается количество теплоты 1 Дж
4) при остывании 1 кг серебра на 1 °С выделяется количество теплоты 250 Дж
2. Удельная теплоёмкость цинка 400 Дж/(кг · °С). Это означает, что
1) при нагревании 1 кг цинка на 400 °С его внутренняя энергия увеличивается на 1 Дж
2) при нагревании 400 кг цинка на 1 °С его внутренняя энергия увеличивается на 1 Дж
3) для нагревания 400 кг цинка на 1 °С его необходимо затратить 1 Дж энергии
4) при нагревании 1 кг цинка на 1 °С его внутренняя энергия увеличивается на 400 Дж
3. При передаче твёрдому телу массой \( m \) количества теплоты \( Q \) температура тела повысилась на \( \Delta t^\circ \) . Какое из приведённых ниже выражений определяет удельную теплоёмкость вещества этого тела?
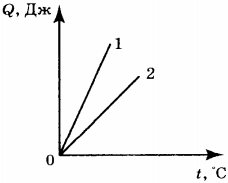
4. На рисунке приведён график зависимости количества теплоты, необходимого для нагревания двух тел (1 и 2) одинаковой массы, от температуры. Сравните значения удельной теплоёмкости ( \( c_1 \) и \( c_2 \) ) веществ, из которых сделаны эти тела.
1) \( c_1=c_2 \)
2) \( c_1>c_2 \)
3) \( c_1
4) ответ зависит от значения массы тел
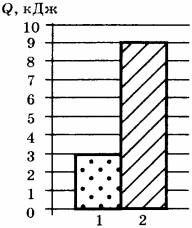
5. На диаграмме представлены значения количества теплоты, переданного двум телам равной массы при изменении их температуры на одно и то же число градусов. Какое соотношение для удельных теплоёмкостей веществ, из которых изготовлены тела, является верным?
1) \( c_1=c_2 \)
2) \( c_1=3c_2 \)
3) \( c_2=3c_1 \)
4) \( c_2=2c_1 \)
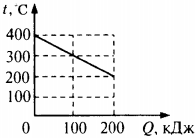
6. На рисунке представлен график зависимости температуры твёрдого тела от отданного им количества теплоты. Масса тела 4 кг. Чему равна удельная теплоёмкость вещества этого тела?
1) 500 Дж/(кг · °С)
2) 250 Дж/(кг · °С)
3) 125 Дж/(кг · °С)
4) 100 Дж/(кг · °С)
7. При нагревании кристаллического вещества массой 100 г измеряли температуру вещества и количество теплоты, сообщённое веществу. Данные измерений представили в виде таблицы. Считая, что потерями энергии можно пренебречь, определите удельную теплоёмкость вещества в твёрдом состоянии.
1) 192 Дж/(кг · °С)
2) 240 Дж/(кг · °С)
3) 576 Дж/(кг · °С)
4) 480 Дж/(кг · °С)
8. Чтобы нагреть 192 г молибдена на 1 К, нужно передать ему количество теплоты 48 Дж. Чему равна удельная теплоёмкость этого вещества?
9. Какое количество теплоты необходимо для нагревания 100 г свинца от 27 до 47 °С?
1) 390 Дж
2) 26 кДж
3) 260 Дж
4) 390 кДж
10. На нагревание кирпича от 20 до 85 °С затрачено такое же количество теплоты, как для нагревания воды такой же массы на 13 °С. Удельная теплоёмкость кирпича равна
1) 840 Дж/(кг · К)
2) 21000 Дж/(кг · К)
3) 2100 Дж/(кг · К)
4) 1680 Дж/(кг · К)
11. Из перечня приведённых ниже высказываний выберите два правильных и запишите их номера в таблицу.
1) Количество теплоты, которое тело получает при повышении его температуры на некоторое число градусов, равно количеству теплоты, которое это тело отдаёт при понижении его температуры на такое же число градусов.
2) При охлаждении вещества его внутренняя энергия увеличивается.
3) Количество теплоты, которое вещество получает при нагревании, идёт главным образом на увеличение кинетической энергии его молекул.
4) Количество теплоты, которое вещество получает при нагревании, идёт главным образом на увеличение потенциальной энергии взаимодействия его молекул
5) Внутреннюю энергию тела можно изменить, только сообщив ему некоторое количество теплоты
12. В таблице представлены результаты измерений массы \( m \) , изменения температуры \( \Delta t \) и количества теплоты \( Q \) , выделяющегося при охлаждении цилиндров, изготовленных из меди или алюминия.
Какие утверждения соответствуют результатам проведённого эксперимента? Из предложенного перечня выберите два правильных. Укажите их номера. На основании проведенных измерений можно утверждать, что количество теплоты, выделяющееся при охлаждении,
1) зависит от вещества, из которого изготовлен цилиндр.
2) не зависит от вещества, из которого изготовлен цилиндр.
3) увеличивается при увеличении массы цилиндра.
4) увеличивается при увеличении разности температур.
5) удельная теплоёмкость алюминия в 4 раза больше, чем удельная теплоёмкость олова.
Часть 2
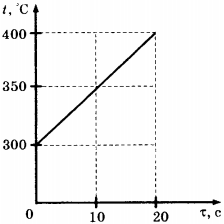
C1.Твёрдое тело массой 2 кг помещают в печь мощностью 2 кВт и начинают нагревать. На рисунке изображена зависимость температуры \( t \) этого тела от времени нагревания \( \tau \) . Чему равна удельная теплоёмкость вещества?
1) 400 Дж/(кг · °С)
2) 200 Дж/(кг · °С)
3) 40 Дж/(кг · °С)
4) 20 Дж/(кг · °С)
Физика
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Изменение внутренней энергии в расчетах
Работа и теплообмен (теплопередача) – два пути, изменяющих внутреннюю энергию. В преодолении этих путей внутренняя энергия изменяется или на величину совершенной работы А или на величину Q – количество переданной (может быть и отданной) теплоты.
(В седьмом классе было введена буква Δ для обозначения изменения какой-нибудь физической величины. Это использование прописной греческой буквы общепринято).
Пусть через ΔU обозначается изменение внутренней энергии. Тогда ΔU = U2 – U1. Здесь U2 – конечная, а U1 – начальная внутренняя энергия.
В зависимости от пути изменения ΔU можно определить следующими способами:
ΔU = А (если совершается работа) или ΔU = Q (если произошел теплообмен). Изменение ΔU может одновременно пройти двумя способами. И тогда для общего случая:
Согласно уравнению ΔU = Q + A,
Величина ΔU находится математическими расчетами. Результат вычислений бывает как отрицательной, так и положительной:
Слагаемые работа и количество теплоты в равенстве ΔU = Q + A так же могут обладать разными знаками:
На примере это выглядит так.
Внимательно изучив уравнение ΔU = Q + A, можно заметить следующее: если систему рассматриваемых тел изолировать, то есть не выполнять работу, и не дать возможности обмена теплом с внешней средой, то внутренняя энергия тела не сможет изменяться. Это утверждение определяет закон сохранения внутренней энергии и означает, что тепловое движение постоянно.
Еще один важный вывод следует для двух тел, находящихся в изолированном состоянии. При плотном контакте этих тел, начинается процесс теплообмена, что будет продолжаться до той поры, пока температура не выровняется у обоих тел.
Почему в нем присутствует знак модуля? Дело в том, что получение тепла имеет положительное значение, а отдача тепла – отрицательное. Но модули этих чисел равны (модуль – это абсолютное числовое значение величины).
Что означает удельная теплоемкость?
Удельное княжество, удельные земли, удел, как судьба или участь, конечно же, не имеют никакого отношения к физике. Но все же они обозначают что-то отдельное, часть, долю. Вот и в случае с теплотой используется понятие удельной теплоемкости вещества, как величины, связанной с частью, а вернее, с единицей объема этого вещества.
Такой простой опыт можно провести в домашних условиях. В равные емкости налить молока и воды одной массы. Нагревать на одинаковых горелках. Термометром для жидкостей следить за температурой обоих веществ. Не пройдет и минуты, станет заметно, что молоко нагревается быстрее.
Это значит, что для нагрева воды до той же температуры, что и молоко, нужно тепла больше.
Теперь объяснима разница в нагревании молока и воды. Удельные теплоемкости этих веществ различны: вода – 4200 Дж/кг∙ о С, молоко – 4020 (нежирное) и 3875 Дж/кг∙ о С (жирное). Это значит, что нагреть молоко легче, чем воду. Из веществ, приведенных в таблице, вода – самое теплоемкое вещество.
Стоит обратить внимание, что в разных агрегатных состояниях, удельная теплоемкость одного и того же вещества различна. Это зависит от того, что структура вещества в разных состояниях различна.
Какое количество тепла выделяется или поглощается?
Чтобы ответить на этот вопрос, надо выяснить от чего зависит количество теплоты. Зависимость от рода вещества показана на примере нагревания молока и воды. Но этого недостаточно.
Нетрудно догадаться, что тепла понадобится больше, если нужно нагреть воду до горячего состояния, а не сделать ее только теплой. В процессе охлаждения тепла выделится больше от горячей воды, чем от теплой. А характеризует степень нагретости тела температура. Значит, чем больше разница в начальной и конечной температуре, тем большее количество тепла выделяется или поглощается телом.
Теперь еще одна зависимость. Даже младший школьник мог наблюдать у себя на кухне, что целая кастрюля воды нагреваться будет намного дольше, чем половина кастрюли, если ее греть.
Это значит, количество тепла, потребляемого телом или выделяемого им, зависит от массы тела.
Получается прямая зависимость тепла от трех величин:
Следует обратить внимание на Δt. Если tкон ˃ tнач, разность температур положительна, значит тело нагревается, идет процесс потребления тепла. Если tкон ˂ tнач, разность температур отрицательна, тело охлаждается, происходит выделение тепла.
Термос. Сосуд Дьюара. Калориметр
Достаточно часто требуется остановить или задержать процесс остывания. В бытовых целях для этого используются термосы. Устройство их несложно. Главную роль здесь играет прослойка с низкой теплопроводностью между стенками двойного стеклянного (бывает и из другого вещества) сосуда.
Для сохранения повышенных или пониженных температур веществ в промышленности, медицине, ветеринарии, косметологии, лабораториях используют теплонепроницаемый сосуд, который носит название своего изобретателя – сосуд Дьюара.
Состоит сосуд из двух основных резервуаров, изготовленных из термостойкого алюминия. Меньший резервуар находится внутри большего и скреплен с ним небольшими прочными перемычками. Внешний резервуар покрыт защитным веществом, а внутренний очень хорошо отполирован. Сосуд закрыт непроводящей тепло пенопластиковой крышкой. Устройство сосуда Дьюара аналогично строению обычного бытового термоса, но термос – это упрощенный вариант дьюаровского изобретения.
Изначально сосуды Дьюара применялись для легко испаряющихся жидкостей. Теперь же эти сосуды используют для поддержания и сохранения свойств веществ при необходимых температурах. Чаще других в таких сосудах хранят жидкий азот, применение которого очень разнообразно:
приготовление мороженого, заморозка сметаны или фруктов в кулинарии
Шоу Источник Заморозка фруктов Источник
При исследованиях в школе и проведении опытов вместо сосудов Дьюара и термосов используют более простой прибор, который называют калориметром
Такое приспособление не может исключить полную связь содержимого внутреннего сосуда с внешней средой. Чтобы потеря тепла во внешнюю среду была минимальной, нужно опыты проводить достаточно быстро.
Используя калориметр, в условиях учебного класса можно проверить справедливость уравнения теплового баланса. Для этого понадобится одинаковое количество (например, 50 г) холодной и горячей воды, калориметр и термометр.
Нужно аккуратно холодную воду перелить в калориметр с горячей водой. Полученную смесь осторожно перемешать термометром (трубочку или ложку для смешивания брать не стоит, чтобы лишний раз не нарушать выбранную изолированную систему тел).
Начальные температуры воды и температуру смеси записать и использовать в дальнейших расчетах. Учитывая табличное значение удельной теплоемкости воды (4200 Дэ/кг о С), взятую массу (50 г = 0, 05 кг), вычисления будут следующими:
Конечно, такой результат может получиться лишь теоретически. В опыте с калориметром есть недостаток в том, что существует недостаточная изоляция системы рассматриваемых тел. Тепло горячей воды попадает во внешнюю среду, так как калориметр с горячей водой не закрыт. Нельзя забывать, что измерения проводятся с определенной долей погрешности.
Но суть проделанных набольших исследований понятна и подтверждает уравнение теплового баланса.
Где взять тепло?
Ответ прост. При сгорании топлива, виды которого разнообразны.
Отопительная ценность, например, каменного угля определяется количеством тепла, выделяющегося в процессе сгорания одного его килограмма.
Откуда в угле берется тепло? По одной из теорий топливные материалы, такие как уголь и торф, образовались из растений.
Некогда почти вся земля была покрыта растительностью, главным образом гигантскими лесными чащами. На месте сваленных бурей деревьев вырастали новые. С течением времени образовался толстый слой гниющего дерева. Некоторые пространства земного шара были опустошены буйными ураганами или сползающими ледниками. Пространства эти со временем покрыл ил, нанесенный волнами рек и морей. Или же землю засыпал песок пустынь. В таких условиях бревна, находящиеся под большим давлением и без доступа воздуха, образовали слой вещества, которое теперь называют каменным углем.
Долгое время тепло от сгорания топлива измерялось в калориях (1 кал) – это количество тепла, необходимое для нагревания 1 г воды на 1 о С. Большая калория – килокалория (1 ккал) – количество тепла, необходимое для повышения температуры 1 килограмма воды на 1 о С.
Сейчас вместо калорий и килокалорий используются Джоули и единицы, производные от 1 Джоуля.
Эта величина тепла называется удельной теплотой сгорания топлива и обозначается буквой q.
Например, табличное значение для природного газа, который сейчас очень широко применяется, q = 4,4 ∙ 10 7 Дж/кг означает: при сгорании 1 кг природного газа выделяется 4,4 ∙ 10 7 Джоулей тепла.
Если сгорает не один килограмм топлива, то полученное количество выделившегося тепла определяется формулой Q = qm.
Само тепло получается, как результат изменения опять же внутренней энергии сгорающего топлива. Горение происходит всегда с участием кислорода. При этом атомы кислорода, соединившись с атомами углерода (содержится и в древесном угле, и в каменном, и в нефти, и бензине), образуют продукт горения – это углекислый газ. Его молекулы обладают кинетической энергией большей, чем молекулы кислорода и углерода, отдельно взятые. Следовательно, внутренняя энергия становится больше и проявляется в виде выделения тепла.
Процесс увеличения энергии во время горения называют выделением энергии, то есть выделением тепла.
Чтобы можно было использовать тепло от сгоревшего топлива, человеком с давних пор применяются и простые, и сложные приспособления. Это костер, свеча, печь, газовая горелка, спиртовка, тепловые машины, двигатели.
На службе человека находятся и такие мощные преобразователи тепла, как тепловые электростанции.