Чем вызван рост лекарственной резистентности
Как бактерии развивают устойчивость к антибиотикам и почему это так важно
Врачи предупреждают, что если не принимать меры, к 2050 году 10 000 000 человек в мире будут умирать от бактерий, которые стали устойчивыми к антибиотикам.
Именно по этой причине ВОЗ призывает все страны участвовать в борьбе с ростом резистентности к антибиотикам. Что касается России, то у нас уже разработан план мероприятий на 2019–2024 годы, в котором предусмотрены соответствующие шаги.
Но что еще важно знать о проблеме? «Аргументы и Факты» пригласили известных врачей, экспертов и ученых для обсуждения — и вот к каким выводам они пришли.
Как бактерии становятся устойчивыми
Заведующий кафедрой фармакологии Института клинической медицины Первого МГМУ им. И. М. Сеченова, доктор медицинских наук Владимир Фисенко рассказал, что бактерии, как и любые микроорганизмы, стремятся избежать гибели, используя разные механизмы для этого.
Создание новых антибиотиков направлено во многом на преодоление этих механизмов защиты бактерий.
С чего все началось
Генеральный секретарь Российского научного медицинского общества терапевтов, заместитель начальника управления науки ГБОУ ВПО «МГМСУ им. А. И. Евдокимова» Минздрава России, главный внештатный специалист-пульмонолог Министерства здравоохранения РФ по ЦФО Андрей Малявин заострил внимание на двух проблемах, которые привели к существенному росту антибиотикорезистентности.
Например, во Франции из-за этого синтетические антибактериальные средства – фторхинолоны — стали неэффективны при лечении пневмонии (воспаление легких). В России при этой инфекции активно использовали антибиотики из группы макролидов, и к ним пневмококки стали устойчивы. В новых рекомендациях для врачей по лечению пневмонии, снова советуем начинать лечение с пенициллинов, они сохранили свою эффективность.
Какие меры будут предпринимать
«Проблема устойчивости к антибиотикам имеет глобальное значение, — подчеркнула представитель ВОЗ в РФ, доктор Мелита Вуйнович. — Это очень важные и полезные лекарства, но только тогда, когда применяются рационально и по назначению. Сегодня в мире каждый год из-за инфекций, вызванных микроорганизмами, резистентными к антибиотикам, погибает 700 тысяч человек.
Важно, что стратегия «Единого здоровья» — единственно возможная мера для сохранения эффективности антибиотиков. Она охватывает сферы защиты здоровья людей, животных и окружающей среды, и разработана ВОЗ, FAO (Продовольственная организация ООН) и OIE (Всемирная организация по охране здоровья животных).
Один из эффективных способов защиты человека от резкого роста устойчивых бактерий, запрет на использование антибиотиков в качестве стимуляторов роста в животноводстве и применение их для лечения в сельском хозяйстве только в исключительных случаях. Конечно, необходимо правильное и рациональное использование антибиотиков в лечении человека».
Резистентность
Это явление встречается довольно часто. Существует масса причин, приводящих к этому феномену. Один из наиболее частых случаев: ряд лекарств вызывает усиление выработки в печени особых ферментов, под воздействием которых интенсифицируется превращение химически активных веществ в неактивные. В качестве таких веществ могут выступать и другие лекарства. Тогда их эффект окажется в значительной мере ослаблен или полностью пропадет. Таким образом вырабатывается резистентность к этим лекарствам.
Лекарственное вещество, таким образом, перестает вызывать ожидаемый эффект (такое явление характерно для альфа-адреномиметиков местного действия, используемых при насморке в качестве средств, прочищающих нос).
Синоним этого явления: привыкание, тахифилаксия
Устойчивость микроорганизма к воздействию антимикробного препарата:
Это явление составляет едва ли не самую главную проблему современной фармакологии в части антимикробной терапии.
Для всех микроорганизмов в высшей степени свойственны мутации их генов. В результате этих изменений в составе генетического материала происходят и изменения в работе ферментов микробов, в их строении. Поскольку мутации передаются из поколения в поколения, те из них, которые оказываются полезными для микробов, наследуются. В том числе передается способность избегать пагубного влияния антибиотиков.
Факторами, способствующими появлению устойчивых штаммов бактерий, являются следующие: использование антибиотиков «не по адресу», недостаточная доза препарата или слишком короткий курс, длительное использование антибиотика в обшей медицинской практике (так, например, давно и активно применяемые препараты типа Биссептола, Септрина и др. не способны вылечить пневмонию, отит и др. ОРЗ, так как возбудители этих заболеваний утратили чувствительность к воздействию действующего вещества этих лекарственных средств).
Антибиотикорезистентность: аргументы и факты
Устойчивость к антимикробным препаратам создает угрозу для проведения эффективной профилактики и лечения постоянно возрастающего числа инфекций. Все более необходимым становится рациональное использование имеющихся антимикробных препаратов с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов антимикробных препаратов при лечении инфекций различной локализации.
За последние 100 лет врачам удалось справиться со многими болезнями и значительно увеличить среднюю продолжительность жизни людей. Ряд открытий и изобретений в области медицины по праву можно отнести к числу наиболее значимых в прошлом столетии. Примерами могут служить появление первых кровезаменителей и расшифровка ДНК. Но, по мнению многих экспертов, именно изобретение пенициллина, внедрение его в клиническую практику и последующее бурное развитие антимикробной терапии (АМТ) сыграли наиболее существенную роль в увеличении продолжительности жизни людей в XX веке. Сегодня невозможно представить нашу жизнь без антимикробных препаратов (АМП), помогающих бороться с большинством инфекционных заболеваний [1].
Вместе с тем, в настоящее время во всем мире наблюдается совершенно объективный процесс глобальный рост антибиотикорезистентности микроорганизмов к АМП. Проблема резистентности во многом обусловлена широким и часто нерациональным использованием данных препаратов. Инфекции, вызванные резистентными штаммами микроорганизмов, характеризуются более тяжелым течением, чаще требуют госпитализации больного, увеличивают продолжительность пребывания его в стационаре, предполагают применение комбинированной АМТ с использованием резервных препаратов. Все это приводит к увеличению затрат на лечение, ухудшает прогноз для здоровья и жизни пациентов, а также создает условия для возникновения эпидемий. По данным Центра по контролю и профилактике заболеваний, в США ежегодно не менее 2 миллонов человек инфицируются бактериями, устойчивыми к антибиотикам, из которых примерно 23 тысячи умирают вследствие этих инфекций [2,3].
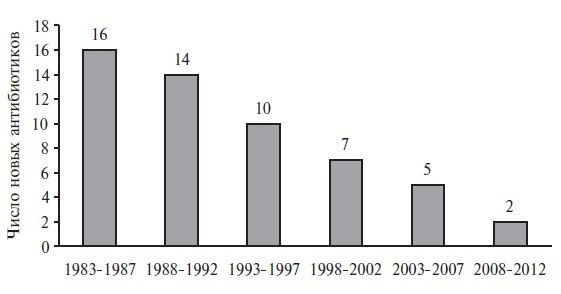
Несмотря на значительный прогресс в медицине, интенсивность разработки новых АМП за последние 30 лет значительно снизилась. Американское общество по борьбе с инфекционными болезнями в 2004 году сообщило, что за период 1998–2002 гг. количество одобренных Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) новых антибиотиков уменьшилось на 56% по сравнению с периодом 1983–1987 г.
Во втором квартале 2014 года Всемирная организация здравоохранения опубликовала отчет об антибиотикорезистентности в мире. Это один из первых детальных докладов за последние 30 лет, касающийся столь актуальной глобальной проблемы. В нем проанализированы данные из 114 стран, в том числе России, на основании которых сделан вывод о том, что резистентность к антибиотикам на сегодняшний день отмечается уже во всех странах независимо от уровня их благосостояния и экономического развития. Российская Федерация в 2014 году со своей стороны стала инициатором подписания документа, в котором закреплено, что оценка ситуации с антибиотикорезистентностью в стране является национальным приоритетом. Сложившаяся ситуация имеет большое социально-экономическое значениеи рассматривается как угроза национальной безопасности. При неэффективности стартовой терапии клиницисты вынуждены использовать альтернативные АМП, которые часто характеризуются более высокой стоимостью и худшим профилем безопасности.
Все более необходимым становится рациональное использование имеющихся АМП с учетом спектра их активности и профиля антибиотикорезистентности основных возбудителей. В связи с этим чрезвычайно актуально проведение научных и общественных мероприятий, направленных на обсуждение целого ряда вопросов, касающихся распространенности бактериальных инфекций, трудностей микробиологической диагностики, текущей ситуации с антибиотикорезистентностью и перспектив использования разных классов АМП при лечении инфекций различной локализации [3,4].
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России [5].
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ. Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) [7,8].
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa [9].
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) [10].
Еще одним знаменательным событием 2016 года стало подписание ведущими международными фармацевтическими, диагностическими и биотехнологическими компаниями совместной декларации о принятии всеобъемлющих мер против инфекций, устойчивых к лекарственной терапии. Декларация была оглашена на Всемирном экономическом форуме в г. Давосе и подписана на сегодняшний день почти 100 фармацевтическими компаниями. Представители индустрии призывают правительства всех стран мира выйти за рамки заявлений о намерениях и в сотрудничестве с компаниями принять конкретные меры для поддержки инвестиций в разработку антибиотиков, средств диагностики, вакцин и других продуктов, имеющих жизненно важное значение для предотвращения и лечения лекарственно устойчивых инфекций. Одновременно с этим в Декларации устанавливаются обязательства подписавших сторон по дальнейшим действиям в области проблем лекарственной устойчивости. Компании обязуются уменьшить воздействие производства АМП на окружающую среду; содействовать надлежащему применению новых и существующих АМП, в том числе за счет поддержки рекомендаций по применению АМП; продолжать и расширять научноисследовательские разработки по созданию новых АМП; поддерживать инициативы, направленные на обеспечение доступа к АМП во всех частях света при любых уровнях доходов.
Заключение
Современная медицина немыслима без АМТ. Антибиотики во много раз сократили смертность от инфекционных заболеваний, смягчили тяжесть их течения, уменьшили количество постинфекционных осложнений. Однако, несмотря на появление в арсенале врачей значительного перечня лекарственных препаратов, активных в отношении практически всех патогенных микроорганизмов, существует значительное количество проблем и нерешенных вопросов в области АМТ [1].
В течение последних десятилетий АМТ инфекционных заболеваний существенно осложняется резистентностью возбудителей к АМП. Постоянный рост резистентности к АМП отмечен среди возбудителей как нозокомиальных, так и внебольничных инфекций. Возникновение резистентности и распространение ее среди микроорганизмов является естественным процессом, возникшим в ответ на широкое использование АМП в клинической практике, однако имеет большое социально-экономическое значение и в развитых странах рассматривается как угроза национальной безопасности. Инфекции, вызванные резистентными штаммами микроорганизмов, отличаются более тяжелым течением, чаще требуют госпитализации и увеличивают продолжительность пребывания в стационаре, ухудшают прогноз для пациентов.
Специалисты в области АМТ выделяют несколько уровней резистентности к АМП глобальный, региональный и локальный. Прежде всего, необходимо учитывать глобальные тенденции в развитии резистентности. Примерами микроорганизмов, у которых во всем мире стремительно распространяется резистентность к АМП, являются Staphylococcus spp., Enterococcus spp, Streptococcus pneumoniae, Neisseria gonorrhoeae, Pseudomonas aeruginosa, Acinetobacter spp., бактерии семейства Enterobacteriaceae и другие. При этом следует помнить, что резистентность не является тотальной. Так, например, Streptococcus pyogenes сохраняет чувствительность к пенициллину.
При планировании политики АМТ внебольничных инфекций следует более рационально опираться на локальные (региональные) данные, полученные в конкретной стране или регионе страны. В Российской Федерации существуют значительные территориальные вариации частоты резистентности возбудителей вне больничных инфекций к АМП. Вот почему необходимы постоянный мониторинг резистентности и информирование врачей различных специальностей. Наряду с региональными данными по резистентности к АМП внебольничных возбудителей в каждом ЛПУ необходимо иметь данные по резистентности нозокомиальных возбудителей, особенно в отделениях с интенсивным использованием АМП: ОРИТ, отделения хирургической инфекции, травматологии и ортопедии [4].
Хотя от адекватных назначений врачей и отказа пациентов от самолечения во многом зависит успех борьбы с проблемой антибиотикорезистентности, этих шагов, к сожалению, недостаточно. Очень многие решения должны быть приняты на национальном уровне, например, запрет на безрецептурный отпуск антибиотиков, усиление законодательства в отношении предотвращения производства и продажи фальсифицированных АМП, снижение применения антибактериальных средств в продовольственном животноводстве. Следует также отметить, что современные тенденции развития фармацевтической промышленности таковы, что гарантий появления новых групп АМП нет [11,12].
Без сомнения, эра АМП сыграла существенную роль в жизни современного общества. Однако только трезвый подход как к проблеме лечения АМП и ее принципам, так и к роли антибиотикотерапии в современном обществе способен обеспечить правильное планирование выпуска АМП и прогнозирование их эффективности в будущем.
Газета «Новости медицины и фармации» Антимикробная терапия (355) 2011 (тематический номер)
Вернуться к номеру
Резистентность к лекарственным средствам — проблема XXI века
Авторы: О.А. Голубовская, д.м.н., заведующая кафедрой инфекционных болезней Национального медицинского университета имени А.А. Богомольца
Версия для печати
Ежегодно Всемирная организация здравоохранения в день своего создания, 7 апреля, отмечает День здоровья. В этом году темой Всемирного дня здоровья в Европейском регионе ВОЗ была выбрана растущая резистентность к антибактериальным препаратам. В настоящее время в результате тяжелых резистентных бактериальных инфекций в странах Европейского союза (ЕС) ежегодно умирает около 25 тысяч человек. Однако не только резистентность к антибиотикам вызывает опасение международных организаций, и прежде всего ВОЗ. Резистентность к терапии проявляют также вирусные и паразитарные заболевания.
После изобретения пенициллина и в последующем — многочисленного арсенала других антибиотиков человечество праздновало победу над инфекциями. Дело дошло до того, что главный хирург США Вильям Стеворд в 1969 году на слушаниях по вопросам медицины в Конгрессе заявил, что «пора зарыть книгу инфекционных болезней», имея в виду появление все новых и новых антибиотиков и успехи в лечении инфекционных болезней, обусловленные их применением. Однако реальность оказалась куда более серьезной: различные микроорганизмы стали проявлять устойчивость к лекарственным средствам, меняется спектр возбудителей, грамположительная флора сменилась на грамотрицательную и наоборот, патогенная — на условно-патогенную, а инфекционные заболевания по-прежнему являются основной причиной смертности в мире в странах с различным уровнем дохода (табл. 1) [2, 5, 7].
Quidquid agis, prudenter agas et respice finem.
Смотри, что делаешь, и предвидь результат.
Почему же устойчивость к противомикробным препаратам является такой глобальной проблемой? По мнению экспертов ВОЗ, причин несколько:
1. Инфекции, вызываемые устойчивыми микроорганизмами, чаще приводят к смерти и затрудняют борьбу с инфекционными заболеваниями, так как пациенты остаются заразными на протяжении длительного времени, что потенциально способствует передаче устойчивых штаммов другим людям.
2. Создается угроза возвращения к «доантибиотиковой» эре: многие инфекционные болезни могут стать неконтролируемыми и свести на нет прогресс на пути достижения к 2015 году связанных со здоровьем целей тысячелетия в области развития Организации Объединенных Наций.
3. Устойчивость к противомикробным препаратам приводит к повышению затрат на медицинскую помощь в связи с необходимостью использования более дорогостоящих методов лечения.
4. Устойчивость возбудителей ставит под угрозу завоевания здравоохранения для общества: без эффективных противомикробных препаратов для лечения и профилактики инфекций успех таких видов лечения, как трансплантация органов, химиотерапия при онкологических заболеваниях и основные хирургические операции, окажется под угрозой.
5. Устойчивость к противомикробным препаратам угрожает безопасности в области здравоохранения и наносит ущерб торговле и экономике: возрастающие объемы глобальной торговли и поездок способствуют быстрому распространению устойчивых микроорганизмов в отдаленные страны и континенты [7–10].
Резистентность — устойчивость микроорганизмов, их невосприимчивость к каким-либо факторам внешнего воздействия. В частности, такими неблагоприятными и опасными факторами внешнего воздействия для микроорганизмов являются химиотерапевтические средства. Для преодоления такого воздействия микроорганизмы включают ряд приспособительных процессов, приводящих их к устойчивости. Механизмы формирования резистентности у бактерий, вирусов и паразитов разные.
У бактерий резистентность бывает природной, когда у микроорганизма отсутствует (либо недоступна) мишень для действия антибактериального средства, и приобретенной, которая развивается вследствие мутаций либо при передаче генов, кодирующих антибиотикорезистеность. Примером природной резистентности к антибиотикам может служить непроницаемость клеточной стенки для макролидов, вследствие чего эти микроорганизмы не чувствительны к данным антибиотикам. Другой пример: микоплазмы лишены рецепторов, связывающих пенициллин, поэтому обладают природной устойчивостью к b-лактамам [4, 5].
Природная устойчивость лежит в основе современных рекомендаций по применению того или иного антибактериального средства. Выявить же приобретенную резистентность, тем более выяснить, почему у одних возбудителей она возникает, а у других — нет, — задача весьма сложная. В процессе применения того или иного антибактериального средства идет селекция устойчивых штаммов — это одно из условий глобальной выживаемости возбудителя [4, 5].
В основе формирования и передачи антибиотикорезистентности лежат сложные механизмы. Антибиотикорезистентность может передаваться плазмидами (дополнительные молекулы ДНК микроорганизма), бактериофагами тремя путями:
1. Трансформация: свободная ДНК погибшей антибиотикорезистентной бактерии захватывается из окружающей среды антибиотикочувствительной клеткой.
2. Трансдукция: случайный захват бактериальной ДНК частичкой бактериофага, при этом ДНК может быть как хромосомной, так и плазмидной. Далее частичка фага переносит бактериальную ДНК в следующую клетку, которую она инфицирует.
3. Конъюгация, представляющая собой физический контакт двух бактерий, во время которого происходит передача ДНК от клетки-донора к клетке-реципиенту [4, 5, 7].
Резистентными к антибиотикам могут стать также непатогенные микроорганизмы, контактирующие с ними, которые далее, попадая из организма человека в окружающую среду, могут становиться переносчиками генов резистентности. Так, грамотрицательные неферментирующие бактерии Acinetobacter spp., Stenotrophomonas maltophilia, Burkholderia cepacia (ранее благодаря ряду общих свойств входящие в род Pseudomonas spp.) долгое время являлись комменсалами или патогенами растений (Burkholderia cepacia) и могли существовать в любой экологической нише — в почве, воде, организме животных и растений. Однако в настоящее время они являются одними из ведущих возбудителей нозокомиальных инфекций, оказывающих влияние на летальность и потребление ресурсов [4, 7].
По определению ВОЗ, нозокомиальная инфекция — это любое клинически распознаваемое инфекционное заболевание, которое развивается у пациента в результате его обращения в больницу за лечебной помощью или пребывания в ней, а также любое инфекционное заболевание сотрудника больницы, развившееся вследствие его работы в данном учреждении, вне зависимости от времени появления симптомов (после или во время нахождения в больнице).
Важным признаком нозокомиальных инфекций является природная устойчивость ко многим антибиотикам. Это связано как с тем, что среди почвенных микроорганизмов известно большое количество штаммов — продуцентов антибиотиков, так и с тем, что эти микроорганизмы в большинстве своем имеют плазмиды, способные передавать ген устойчивости к антибактериальным перепаратам и детергентам, например мылу, в связи с чем часто выделяются с рук медицинского персонала. Контаминируя медицинские приборы, эти микроорганизмы образуют микропленки, устойчивые к дезинфектантам [4, 5, 7, 12].
Для изучения частоты и структуры возбудителей нозокомиальной бактериемии в США существует база данных по «Надзору и контролю за микроорганизмами, имеющими эпидемиологическое значение», или сокращенно SCOPE. Данный проект является крупнейшей неправительственной программой по мониторингу нозокомиальной бактериемии. Внимания заслуживают следующие факты, полученные по результатам мониторирования:
— фактором риска развития нозокомиальной бактериемии считается наличие центрального венозного катетера (72 %), периферического венозного катетера (35 %), артериального катетера (16 %) и мочевого катетера (46 %);
— летальность от нозокомиальной бактериемии составляет 27 %;
— распространенность нозокомиальной бактериемии составляет 60 случаев на 100 000 госпитализаций;
— анаэробы выделяются с частотой 1,3 %;
— частота выделения метициллинорезистентных штаммов S.aureus (MRSA) составила 41 и 75 % среди коагулазонегативных стафилококков;
— резистентными к ванкомицину оказались 60 % штаммов Enterococcus faecium и 2 % штаммов Enterococcus faecalis;
— среднее время от госпитализации до развития бактериемии составляло 2 недели для Escherichia coli, 2–3 недели для S.aureus, коагулазонегативных стафилококков, Pseudomonas aeruginosa и Serratia и 3–4 недели для таких возбудителей, как Enterobacter, Candida, Klebsiella, Enterococcus и Acinetobacter;
— было выявлено значительное увеличение резистентности, которое носило драматический характер для ванкомицинорезистентных энтерококков (с 48 до 70 %), резистентности к цефтазидиму у штаммов P.aeruginosa (c 12 до 29 %) и резистентности к метициллину у штаммов S.aureus (с 22 до 57 %) [9, 10].
Наиболее эффективными препаратами в лечении MRSA долгое время оставались гликопептидные антибиотики — ванкомицин и тейкопланин. О возможности появления ванкомицинорезистентных S.aureus стали задумываться около пятнадцати лет назад после сообщений о резистентности к ванкомицину у энтерококков и коагулазонегативных стафилококков. Особенно опасной считалась возможность передачи плазмидной резистентности к ванкомицину от энтерококков, доказанной экспериментально, тем более что довольно часто (по некоторым данным, до 20 %) эти микроорганизмы выделяются в ассоциации. Первое тревожное сообщение было получено от доктора К. Хираматсу (Япония) — о выделении в мае 1996 г. MRSA со сниженной чувствительностью к ванкомицину из послеоперационной раны у 4-месячного ребенка в отделении сердечно-сосудистой хирургии. Терапия этого пациента ванкомицином в течение 29 дней была безрезультатной. Клинический эффект был достигнут при применении комбинации ампициллин/сульбактам (в высоких дозах) и аминогликозида арбекацина. Данный штамм был зарегистрирован как VRSA (ванкомицинорезистентный S.aureus). Далее в США было выделено два S.aureus со сниженной чувствительностью к ванкомицину. Эти штаммы были получены от пациентов, получавших длительную терапию ванкомицином по поводу бактериемии и перитонита на фоне хронического перитонеального диализа. В Европе в 1997 г. доктором В. Кречмери (V. Krcmery) из Словакии было сообщено о выделении VRSA у ребенка со стафилококковым целлюлитом и множественными абсцессами на фоне иммунодефицитного состояния. В результате углубленного исследования ванкомицинорезистентности у MRSA, при скрининге более чем 2000 штаммов из различных стационаров, было выявлено от 1 до 25 % (!) штаммов с резистентностью к ванкомицину [9, 10].
Ежегодно 24 марта ВОЗ проводит Всемирный день борьбы с туберкулезом в ознаменование того, что в этот день в 1882 году доктор Роберт Кох открыл возбудителя — Mycobacterium tuberculosis. В настоящее время одна треть мирового населения инфицирована туберкулезом. Еще в 1997 году ВОЗ и Международный союз борьбы с туберкулезом и болезнями легких (IUATLD) впервые опубликовали стандартизированную информацию о выявлении туберкулеза со множественной лекарственной устойчивостью (МЛУ-ТБ) по данным обзоров и систем эпидемиологического надзора в 35 странах мира, проводимого с 1994 года. Эта информация подтвердила многие опасения, а именно — что лекарственная устойчивость достигла критического уровня в ряде регионов мира, особенно в некоторых странах бывшего Советского Союза [7, 8].
Основной причиной появления и распространения МЛУ-ТБ является чисто человеческий фактор: неадекватная или ошибочно выбранная схема химиотерапии приводит как к появлению бактерий-мутантов, так и к их доминированию у пациента, что сопровождается высокой летальностью. Распространение МЛУ-ТБ среди ВИЧ-инфицированных значительно выше (риск первичного заболевания именно мультирезистентной формой среди этих пациентов на 50 % выше) [7, 8].
Бактерии приобретают все более угрожающие формы резистентности. Так, в начале этого года ВОЗ сообщила о вспышках устойчивых штаммов E.сoli к карбапенемам и другим b-лактамам. Эта устойчивость обусловлена наличием энзима NDM1 (New Delhi metallo-b-lactamase), который может вызывать панрезистентность ко всем имеющимся на сегодняшний день антибактериальным средствам (!). Появление этого штамма бактерии вызвало серьезную настороженность экспертов. Так, Джон Конли1 предполагает, что в случае распространения этого штамма мы можем оказаться «отброшенными в эпоху, когда антибиотики не существовали». По мнению этого специалиста, наибольшую обеспокоенность в плане развития и распространения устойчивости к антибиотикам вызывают страны, где антибиотики находятся в свободной продаже: Китай, Индия, многие страны Африки, Центральной и Южной Америки. Постсоветское пространство также может быть причислено к этому списку. Однако употребление антибиотиков людьми не идет ни в какое сравнение с использованием их в агропищевой промышленности для стимуляции роста. Согласно некоторым оценкам, по весу в организм животных и рыб вводится по крайней мере в 1000 раз больше антибиотиков, чем используется людьми. Без решения такого серьезного вопроса на правительственном уровне невозможна успешная борьба с появлением и распространением антибиотикорезистентных штаммов. ЕС сейчас объединяет усилия в борьбе с антибиотикорезистентностью на правительственном уровне. Так, запрещено стимулирование роста скота при помощи антимикробных препаратов, а существующая во Франции программа информирования населения «Антибиотики не применяются автоматически» за пять лет сократила прием этих препаратов при гриппоподобных заболеваниях на 26,5 % [7, 12].
В настоящее время в патологии человека все большую роль играют вирусные заболевания, приобретающие пандемическое распространение (вирусные гепатиты, особенно С, ВИЧ-инфекция), возникают новые опасные возбудители, например пандемический штамм вируса гриппа А (Н1N1 Калифорния 04/2009), вызвавший настоящую панику у медицинской общественности, повышается роль в патологии человека герпесвирусных заболеваний.
Несмотря на то что в последние десятилетия достигнут значительный прогресс в лечении этих заболеваний, в целом противовирусная терапия по своей эффективности значительно уступает антибактериальной. В основном это связано с трудностями в разработке специфических препаратов из-за крайне тесной интеграции вирусного генома и генома хозяина (человека). Кроме того, оказалось, что вирусы достаточно быстро приобретают устойчивость к терапии, основными механизмами которой являются формирование и селекция мутаций в генах, кодирующих ферменты, участвующие в метаболизме препаратов или являющиеся непосредственными мишенями действия препаратов. Так, ацикловир — основной противогерпетический препарат — является аномальным аналогом нуклеозида гуанозина. Внутри инфицированной вирусом клетки ацикловир подвергается фосфорилированию под действием вирусной тимидинкиназы и клеточных фосфорилаз. Ацикловира трифосфат включается в растущие молекулы ДНК и блокирует их синтез, кроме того, он является ингибитором вирусной ДНК-полимеразы.
Устойчивость к ацикловиру формируется в результате мутаций в вирусной тимидинкиназе. Штаммы вирусов герпеса, дефицитные по тимидинкиназе, проявляют значительно сниженную вирулентность и вызывают инфекции в основном у людей с иммунодефицитом. Мутации в вирусной ДНК-полимеразе приводят лишь к умеренному снижению чувствительности вирусов герпеса к ацикловиру, клиническое значение такого снижения чувствительности окончательно не установлено. Кроме ацикловира, в клинической практике используют валацикловир, а также фамцикловир и ганцикловир. Механизмы резистентности у них такие же, как и у ацикловира.
Среди антиретровирусных препаратов, применяемых для лечения ВИЧ, выделяют ингибиторы обратной транскриптазы и ингибиторы протеазы. Обратная транскриптаза катализирует синтез ДНК с матрицы вирусной РНК. Вирусная протеаза осуществляет расщепление функционально неактивных полипротеинов и получение отдельных протеинов, необходимых для сборки вирионов.
К настоящему времени описано большое количество мутаций в генах обратной транскриптазы (около 10), приводящих к формированию устойчивости. Некоторые из этих мутаций опосредуют избирательную резистентность, другие вызывают перекрестную устойчивость ко всем известным препаратам. Для преодоления резистентности к антиретровирусной терапии важной стратегией лечения ВИЧ-инфекции является комбинированная терапия, что позволяет предотвратить селекцию резистентных штаммов [7].
При лечении вирусных гепатитов, особенно В, проблема резистентности является основной при лечении аналогами нуклеоз(т)- идов. Образование резистентных мутантов связывают с исходным уровнем сывороточной ДНК/РНК, скоростью подавления вируса, длительностью лечения и проводимой ранее терапией аналогами нуклеозидов. Среди применяемых лекарственных препаратов ламивудин обладает максимальной, а энтекавир — минимальной способностью индуцировать формирование резистентных штаммов при ХГВ [3].
Однако если хронические вирусные гепатиты не представляют сиюминутной смертельной опасности для здоровья людей, то острые инфекционные болезни способны вызвать повальные эпидемии. Например, с периодичностью в 15–30 лет в популяции человека возникает новый, ранее не встречавшийся штамм вируса гриппа, который способен вызвать пандемию вследствие отсутствия того самого коллективного иммунитета, причем пандемия, вызванная одним и тем же серотипом вируса, возникает с периодичностью около 70 лет, т.е. когда подавляющая часть популяции людей утрачивает иммунитет к вирусу, который циркулировал 70 лет назад. Таким новым штаммом оказался вирус гриппа А/California/04/2009 (A/H1N1). Однако новый штамм вируса гриппа, несмотря на вызываемые им, как правило, нетяжелые формы заболевания, на тот период времени показал высокую скорость распространения: только в июне месяце было подтверждено 30 000 случаев в 74 странах мира. Учитывая данное обстоятельство, а также отсутствие иммунитета населения к новому штамму вируса, после консультаций с ведущими экспертами мира по гриппу ВОЗ объявила пандемию, т.е. 6-й (последний) уровень готовности [2].
Как показали последующие события, новый вирус преподнес много сюрпризов и продемонстрировал некоторое сходство с «испанкой»: поражение молодых людей (чаще до 25 лет), высокой процент возникновения геморрагической пневмонии, «избирательные» группы риска (больные с сахарным диабетом, беременные женщины и лица с избыточной массой тела).
Для лечения гриппа, особенно его тяжелых форм, применяется ингибитор вирусной нейраминидазы озельтамивир. Этот препарат не только обладает доказанной способностью смягчать симптомы и сокращать сроки заболевания, но и предотвращает при своевременном приеме летальность. Однако его бесконтрольный прием в последнюю пандемию 2009–2010 годов показал появление резистентности, связанной с мутацией H275Y. В настоящее время систематический эпидемиологический надзор, который проводится Глобальной сетью по надзору за гриппом при поддержке центров ВОЗ и других лабораторий, продолжает выявлять отдельные случаи появления вирусов H1N1, которые демонстрируют резистентность к озельтамивиру (табл. 2).
Результатом выявления и распространения резистентных штаммов вируса гриппа А (H1N1) явилось изменение рекомендаций ВОЗ, запрещающих профилактический прием озельтамивира, исключая постконтактную профилактику.
Некоторые актуальные паразитозы также демонстрируют развитие резистентности. Малярия на сегодняшний день остается одним из самых смертоносных заболеваний — ежегодно от нее погибает около 1 млн жителей планеты. В основном смертность обусловлена P.falciparum и связана прежде всего с формированием резистентности к имеющимся лекарственным средствам. В Европейском регионе ВОЗ большинство случаев малярии являются завозными. С начала 1970-х гг. произошло десятикратное увеличение числа таких случаев: в странах ЕС ежегодно регистрируется от 10 000 до 12 000 случаев завозной малярии, хотя предполагается, что эти цифры существенно занижены. Согласно оценкам, за последние 35 лет в регионе зафиксировано почти 300 000 случаев завозной малярии [1, 6].
В настоящее время проблема лечения тропической малярии существенно осложняется широким распространением штаммов, резистентных к противомалярийным препаратам. Установлено, что мутации в паразитарных генах pfcrtT76 и pfmdr1 ответственны за развитие химиорезистентности. Для лечения малярии использовали различные препараты, к которым формировалась резистентность, — хлорохин, хинин. Вследствие их доступности они до сих пор используются для лечения малярии, хотя из разных частей света, особенно Африки и Азии, поступают сообщения о резистентности Pl.falciparum к этим препаратам. C 2005 г. в широкомасштабную клиническую практику внедрена так называемая артемизинин-комбинированная терапия (АКТ), предусматривающая комбинированное использование производных артемизинина и какого-либо другого противомалярийного препарата, кроме хлорохина, в связи с высокой устойчивостью к нему малярийных паразитов. Важно заметить, что эффективность АКТ зависит именно от второго используемого лекарства. На октябрь 2005 г. 53 страны (35 из которых расположены в Африке) официально приняли АКТ в качестве противомалярийного лечения первой линии. ВОЗ рекомендует странам, где паразит малярии стал устойчив к применяемым в качестве монотерапии лекарствам более чем в 10 % случаев, использовать такую комбинированную терапию.
Однако с 30 июля 2009 г. в Камбодже зарегистрирована быстро распространяющаяся заболеваемость малярией, не поддающейся лечению артемизинином, который до сих пор считался чудодейственным препаратом. Проведенный ВОЗ анализ этого явления выявил нарушения при назначении противомалярийной терапии, а именно: комбинированная терапия заменялась на монотерапию артемизинином, что является недопустимым. Так, при лечении монопрепаратами на основе артемизинина пациенты прерывают лечение на ранних стадиях в связи с быстрым исчезновением малярийных симптомов. При таком частичном лечении в крови пациентов остаются устойчивые паразиты. Без второго препарата в качестве компонента комбинированной терапии эти устойчивые паразиты выживают и могут быть переданы комару, а затем — другому человеку. Поэтому монотерапия является основной причиной распространения устойчивости к артемизинину. Считается, что если к артемизинину разовьется устойчивость, которая распространится на другие крупные географические районы, как это случилось ранее с хлорохином, последствия для здоровья людей могут быть катастрофическими, так как альтернативных противомалярийных лекарств в ближайшем будущем не появится [1, 6].
Таким образом, угрожающее распространение полирезистентных штаммов многих микроорганизмов ставит под угрозу все имеющиеся на сегодняшний день достижения в борьбе с инфекционной заболеваемостью. Одним из существенных признаков инфекционных заболеваний ХХI века ученые считают появление новых полирезистентных штаммов возбудителей, в результате чего невозможно будет найти эффективное средство лечения. Следует также помнить, что рост опасных инфекционных заболеваний, в том числе вызванных резистентными штаммами, резко возрастает при различных стихийных бедствиях, которые все чаще и чаще происходят в разных уголках мира, и системы здравоохранения разных стран должны быть к ним готовы.
— инфекции, вызываемые устойчивыми микроорганизмами, часто не поддаются лечению по стандартным схемам, что приводит к затягиванию болезни и повышенному риску смерти;
— ежегодно происходит около 440 000 новых случаев туберкулеза с множественной лекарственной устойчивостью, и по меньшей мере 150 000 из них заканчиваются смертельным исходом;
— устойчивость к противомалярийным препаратам предшествующего поколения, таким как хлорохин и сульфадоксин-пириметамин, широко распространена в большинстве стран, где распространена малярия;
— значительную долю внутрибольничных инфекций вызывает такая высокоустойчивая бактерия, как Staphylococcus aureus (MRSA), устойчивая к метициллину;
— появление штамма бактерии с наличием энзима NDM1 (New Delhi metallo-b-lactamase) в случае его распространения может вызывать панрезистентность ко всем имеющимся на сегодняшний день антибактериальным средствам;
— ненадлежащее и нерациональное использование противомикробных препаратов приводит к формированию благоприятных условий для появления, распространения и сохранения устойчивых микроорганизмов.
1 Профессор медицины, микробиологии и инфекционных заболеваний, а также лабораторной медицины в Центре резистентности к противомикробным препаратам при Университете Калгари, Канада. Содиректор Института по вопросам инфекции, иммунитета и воспалительного процесса им. Снайдера, Председатель правления Канадского комитета по резистентности к противомикробным препаратам.

/5/1.png)
/8/1.png)