Чем заменить гонадотропин хорионический на курсе
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
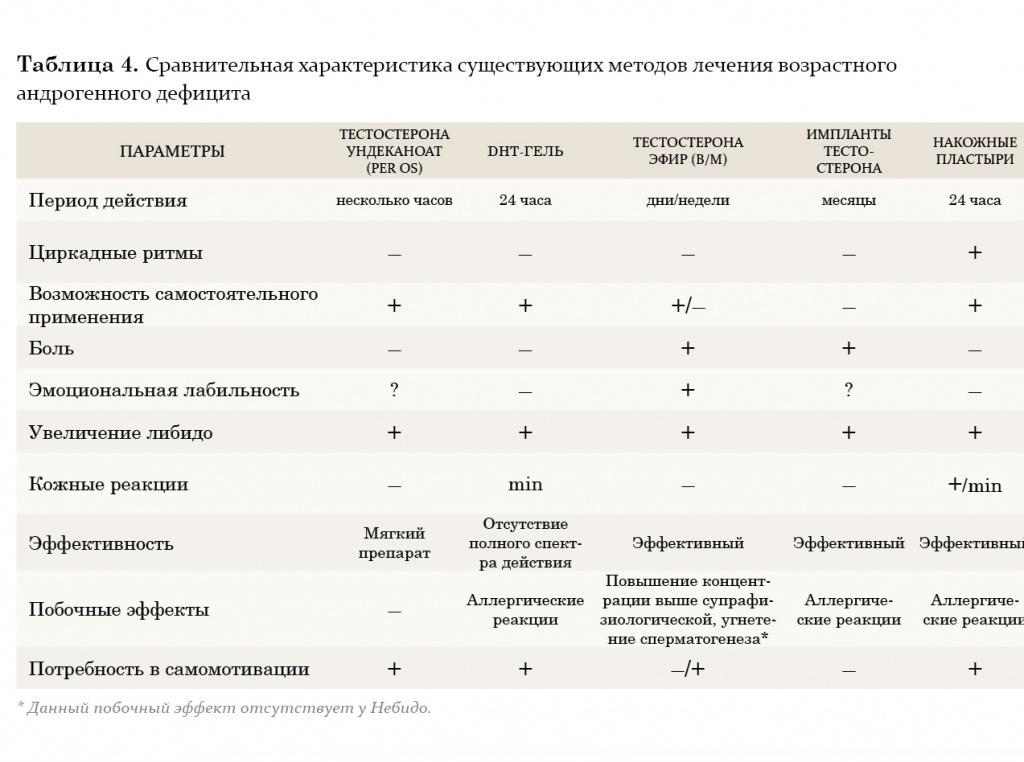
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
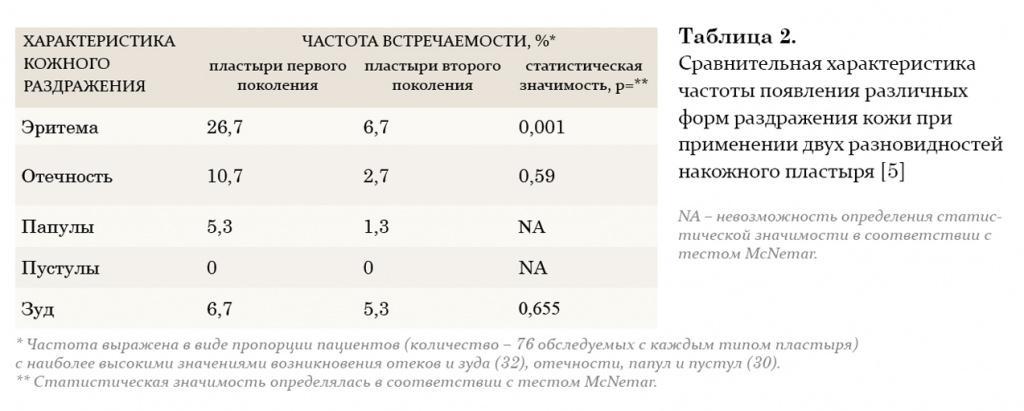
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Гонадотропины при гипогонадотропном гипогонадизме у юношей: перспективы лечения

Представлен аналитический обзор современных технологий терапии гипогонадотропного гипогонадизма у юношей с применением рекомбинантных гонадотропинов, признанных в настоящее время эффективным средством индукции пубертата и заместительной гормональной терап
Analytical review of modern technologies of hypogonadotropic hypogonadism therapy in adolescents was presented, using recombinant gonadotropins, currently recognized as an effective remedy of puberty induction and substitutive hormone therapy in the mentioned pathology.
При гипогонадотропном гипогонадизме (ГГ) отсутствие полового развития у мальчиков является следствием дефицита гонадотропных гормонов при неповрежденных тестикулах [1, 2]. Различают врожденные и приобретенные формы данного заболевания. К врожденным формам относят генетические варианты, приводящие к нарушению закладки нейронов, секретирующих гонадотропин-рилизинг-гормон; приобретенный ГГ развивается у детей с объемными образованиями хиазмально-селлярной области (ХСО) — краниофарингиомы, глиомы, аденомы гипофиза [2, 3].
В связи с внедрением новых методик вспомогательных репродуктивных технологий во всем мире встал вопрос о повышении репродуктивного потенциала у мужчин с врожденным и приобретенным ГГ [4–7].
Традиционно для лечения всех форм гипогонадизма у лиц мужского пола используют препараты тестостерона, которые позволяют добиться удовлетворительных конечного роста и стадии полового развития. Однако объем гонад остается допубертатным, и созревание сперматогенного эпителия в таких условиях невозможно [4–7]. Как следствие, пациенты остаются бесплодными, испытывают психосоциальную неудовлетворенность [8, 9].
По данным литературы, использование препаратов гонадотропинов — хорионического гонадотропина (ХГЧ) и рекомбинантного фолликулостимулирующего гормона (рФСГ) — у взрослых пациентов с ГГ позволяет не только увеличить объем гонад, но и, в ряде случаев, добиться сперматогенеза [4–7]. Однако терапия, начатая во взрослом состоянии, далеко не всегда позволяет получить удовлетворительные результаты спермограммы [4]. Полагают, что инициировать применение препаратов гонадотропинов у пациентов с ГГ необходимо в пубертатном возрасте [4, 7, 10]. Это приведет к созреванию сперматогенного эпителия (что повысит вероятность фертильности в будущем), улучшит качество жизни, а также поможет существенно снизить стоимость лечения бесплодия у взрослых [4–7, 9].
Тем не менее, при лечении ГГ у подростка, родители которого желают сохранить фертильность, врач сталкивается с рядом вопросов, касающихся сроков начала терапии, выбора препаратов и последовательности их введения, режима дозирования. Так, актуальный Приказ Министерства здравоохранения № 847н от 9 ноября 2012 г. «Об утверждении стандарта специализированной медицинской помощи детям при гипогонадизме» предусматривает применение препаратов тестостерона и лишь в четверти случаев — ХГЧ. При этом препараты рекомендуют использовать «в соответствии с инструкцией по применению [11], в индивидуальном режиме дозирования в зависимости от показаний и схемы лечения». [12]. Федеральные клинические рекомендации (протоколы) по диагностике и лечению гипогонадизма у детей (2014 г.) также рекомендуют терапию препаратами эфиров тестостерона в большинстве случаев. Указывая на возможность восстановления фертильности у пациентов с ГГ путем введения гонадотропинов, авторы подчеркивают, что «тактика лечения определяется актуальностью вопроса фертильности для пациента в настоящее время» и предлагают три схемы лечения [3].
В публикациях зарубежных авторов также можно найти результаты исследований различных вариантов терапии гонадотропинами. Например, Julia Rohayem и соавт. начинают с ХГЧ, в индивидуальных и постепенно возрастающих дозах, до достижения уровня тестостерона, соответствующего стадии полового развития пациента. При этом стартовая и полная терапевтическая дозы ХГЧ, а также целевой уровень тестостерона зависят от наличия/отсутствия предшествующей терапии препаратами половых гормонов. Далее к терапии добавляют препараты рФСГ (фоллитропин альфа) в дозе 75/150 МЕ [6]. Naoko Sato и соавт. предлагают одновременное введение препаратов ХГЧ и рФСГ в минимальных дозах с постепенным (раз в 6 месяцев) их увеличением до полных заместительных — 3000 ЕД и 150 ЕД соответственно, 1 раз в неделю [5].
Между тем накопленные литературные данные свидетельствуют о первоочередной роли ФСГ в создании условий для будущего сперматогенеза в пубертатном возрасте [4, 13]. У подростков так называемая «вторая волна» пролиферации клеток Сертоли («первой» называют пролиферацию незрелых клеток Сертоли в периоде «мини-пубертата» под действием гонадотропных гормонов) и увеличение объема тестикул связаны с повышением секреции ФСГ клетками гипофиза, стимулированными гонадолиберином [13, 14]. Далее лютенизирующий гормон (ЛГ) способствует повышению уровня тестостерона, что ведет, благодаря экспрессии соответствующих рецепторов на поверхности клеток Сертоли в пубертатном периоде [15], к их конечной дифференцировке [7, 13]. Количество клеток Сертоли находит отражение в качестве спермограммы [7, 16].
В результате многие исследователи полагают, что начинать следует с препаратов рФСГ, со временем переходя на комбинированную терапию гонадотропинами [4, 7]. Продолжительность периода монотерапии препаратами рФСГ, по данным литературы, варьирует от нескольких месяцев до 2 лет, находится в обратной зависимости от возраста пациентов и определяется уровнем ингибина В [4, 7]. Так, A. Dwyer и соавт. показали, что концентрация ингибина В претерпевает значимые изменения в первые 2–3 месяца введения препаратов рФСГ, после чего приобретает вид «плато» [4], подобно физиологическим изменениям в пубертатном возрасте [17].
Описание протокола лечения
Мы придерживаемся мнения, что проводить лечение гонадотропинами следует всем пациентам с диагностированным ГГ [2, 3], достигшим возраста 14 лет, когда синдром задержки пубертата является клинически значимым, снижает качество жизни подростка и, следовательно, требует лечения. От подобной терапии стоит воздержаться, если имеется хотя бы одно из нижеперечисленных состояний:
1) наличие опухоли гипофиза или гипоталамуса, лечение которой не проводилось, либо проводилась неадекватная терапия;
2) неконтролируемые нарушения со стороны щитовидной железы, надпочечников и гипофиза, с нестабильной заместительной терапией (дозы препаратов не были стабильными в течение по крайней мере 3 месяцев);
3) операция или лучевая терапия опухолей ХСО в течение 12 месяцев до начала лечения;
4) наличие в анамнезе химиотерапии по поводу онкологического заболевания;
5) клинически значимое заболевание печени, включая активный вирусный гепатит или цирроз;
6) аллергия/гиперчувствительность к гонадотропинам или их вспомогательным компонентам;
7) клинически значимое состояние или ситуация, при которой, по мнению лечащего врача, терапия может быть небезопасна.
Наиболее обоснованным представляется начало лечения с введения препаратов рФСГ. Режим дозирования (рФСГ 75 МЕ/150 МЕ в зависимости от веса и/или возраста, подкожно, 3 раза в неделю) согласуется с мнением большинства авторов [2, 3, 6]. В частности, результаты исследований по применению рФСГ в дозе 150 МЕ 3 раза свидетельствовали об увеличении объема яичек вдвое, индукции сперматогенеза у мужчин с ГГ и нормализации уровня иммунореактивного ФСГ [4, 6].
Переходить на комбинированную терапию целесообразно через 2–4 месяца от начала введения препаратов рФСГ. Возраст пациентов не позволяет длительно откладывать индукцию пубертата, а значимые изменения уровня ингибина В, как указывалось выше, происходят в первые 2–3 месяца лечения [4]. Так, через 2–4 месяца от начала введения препартов рФСГ пациент начинает получать дополнительно ХГЧ, внутримышечно (подкожно), в стандартном режиме дозирования — 1000/1500 МЕ в зависимости от веса и/или возраста, 2 раза в неделю с последующей титрацией дозы по уровню тестостерона, с целью поддержания его в пределах нормальных значений для стадии пубертата. При появлении признаков гинекомастии и/или повышении концентрации эстрадиола дозу ХГЧ можно снизить [18].
Продолжать этап комбинированной терапии, вслед за T. S. Han и P. M. G. Bouloux, мы рекомендуем в течение 1,5–2 лет [19].
Судить об эффективности терапии в подростковом возрасте можно на основании оценки полового развития по шкале Таннер (с измерением объема яичек с помощью орхидометра Prader), антропометрии (с определением костного возраста по рентгенограмме левой кисти с помощью атласа Greulich) [2, 3]. Важнейшими лабораторно-инструментальными методами контроля являются: измерение объема яичек методом ультрасонографии, определение в крови уровня тестостерона, который отражает функциональную активность клеток Лейдига, концентраций ингибина В и антимюллерова гормона (АМГ), которые отражают функцию клеток Сертоли. Увеличение объема яичек, достижение пубертатных уровней тестостерона и ингибина В, повышение и затем снижение уровня АМГ свидетельствуют об эффективности терапии гонадотропинами [2–7]. Заметим, что данные о ценности сывороточного АМГ и/или его отношения к тестостерону в плане фертильности противоречивы [20, 21]. С одной стороны, Massimo Alfano и соавт. называют уровень АМГ менее 4,62 нг/мл и/или соотношение АМГ к общему тестостерону менее 1,02 высокочувствительным маркером фертильности, доказанной методом тестикулярной микродиссекции [20], а с другой, L. Aksglaede и соавт. не обнаруживают взаимосвязи между концентрацией АМГ и качеством спермограммы [21]. О приверженности пациента к терапии, а таrже адекватности дозы препарата рФСГ можно судить по уровню иммунореактивного ФСГ 1–7 ЕД/л [6].
Учитывая вероятность задержки полового развития у пациента с ГГ, мы считаем важным проводить измерение уровня ЛГ на протяжении всего лечения. Предполагается, что у пациентов с ГГ эндогенный уровень ЛГ будет по-прежнему низкий. У юношей с задержкой полового созревания во время терапии препаратами с ФСГ-активностью и ХГЧ возможно созревание гипофиза, что приведет к повышению уровня ЛГ [22].
Схема терапии гонадотропинами, а также параметры ее эффективности представлены в таблице.
В качестве заключения, или Что после протокола
Главным способом оценки фертильности мужчины является спермограмма [23], однако провести подобное исследование у пациентов в возрасте младше 18 лет не всегда возможно по физиологическим и этическим соображениям. Тем не менее, многие авторы указывают на целесообразность данного исследования после двух-трех лет от начала лечения, так как это может позволить составить план дальнейшего наблюдения [19].
Терапия гонадотропинами на сегодняшний день является дорогостоящей, а лечение пациентам с ГГ требуется длительное. В связи с этим возникает вопрос о том, что делать после достижения половой зрелости и становления сперматогенеза.
Некоторые авторы предлагают переводить пациентов с ГГ на традиционную заместительную терапию препаратами тестостерона, с возобновлением лечения гонадотропинами при появлении желания восстановить фертильность [4]. Такой подход, по их мнению, должен существенно снизить стоимость и продолжительность лечения бесплодия у взрослых пациентов с ГГ. T. S. Han и P. M. G. Bouloux указывают на возможность поддержания сперматогенеза, достигнутого при помощи комбинированной терапии гонадотропинами, одним лишь ХГЧ [19], что поможет избежать возможных негативных последствий терапии препаратами тестостерона [8, 23]. Наконец, при получении удовлетворительных результатов спермограммы, можно рассмотреть вопрос криоконсервации, для обращения в центры вспомогательных репродуктивных технологий в будущем.?
Литература
* ФГБОУ ВО СПбГПМУ МЗ РФ, Санкт-Петербург
** ФГБУ НМИЦ им. В. А. Алмазова МЗ РФ, Санкт-Петербург
Гонадотропины при гипогонадотропном гипогонадизме у юношей: перспективы лечения/ Ю. Л. Скородок, И. Ю. Иоффе, И. Л. Никитина, Л. А. Желенина
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 44-46
Теги: половое развитие, нарушение, индукция пубертата, фертильность
Чем заменить гонадотропин хорионический на курсе
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Центр лечения бесплодия ‘Лера’, Москва
Гормональная стимуляция функции яичек при гипогонадотропном гипогонадизме, обусловленном приемом андрогенных анаболических стероидов (клинический случай)
Журнал: Проблемы репродукции. 2016;22(4): 102-105
Назаренко Р. В., Здановский В. М. Гормональная стимуляция функции яичек при гипогонадотропном гипогонадизме, обусловленном приемом андрогенных анаболических стероидов (клинический случай). Проблемы репродукции. 2016;22(4):102-105.
Nazarenko R V, Zdanovskiĭ V M. Hormonal stimulation of testicular function in patient with hypogonadotrophic hypogonadism due to androgenic anabolic steroids abuse (a case report). Russian Journal of Human Reproduction. 2016;22(4):102-105.
https://doi.org/10.17116/repro2016224102-105
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН В.И. Краснопольский), Москва, Россия, 101000
Центр лечения бесплодия ‘Лера’, Москва
Андрогенные анаболические стероиды (ААС) используются профессиональными атлетами и бодибилдерами для повышения силы и увеличения мышечной массы вот уже более 50 лет [2]. Вместе с тем распространившееся в последнее время повальное увлечение фитнесом привело к неконтролируемому и, подчас, безрассудному применению ААС даже среди людей, далеких от профессионального спорта. Согласно официальным данным, только в США насчитывается порядка 3 млн человек, употребляющих ААС для увеличения мышечной массы [3, 4]. В России такой статистики нет. Удручающе низкий уровень медицинской грамотности населения вкупе с многочисленными интернет форумами и чатами привел к распространению недостоверной, непроверенной информации об их использовании. Как итог, все больше молодых мужчин репродуктивного возраста стали использовать ААС в дозировках, превышающих таковые даже у профессиональных спортсменов. При этом анаболические стероиды имеют ряд негативных побочных эффектов: гепатотоксичность, кардиотоксичность, полицитемия, дислипидемия, гипертензия, гинекомастия, атрофия яичек и бесплодие [5,6]. Зачастую многие из этих мужчин становятся пациентами клиник репродуктивного здоровья. Кроме того, следует отметить, что, помимо ААС, в мире фитнеса и спорта сейчас распространено употребление различных пищевых добавок. При этом, по данным M. Parr и соавт. [7], более 20% официально зарегистрированных спортивных пищевых добавок содержат ААС, не указанные в их составе. Все более возрастающее употребление ААС позволило выделить такое его последствие, как гипогонадизм, в особое состояние, с присущей только ему клинической картиной и подходами к лечению.
Принято считать, что ААС приводят к угнетению высвобождения гонадотропин-рилизинг-гормона из гипоталамуса по механизму отрицательной обратной связи и, как следствие, к прекращению выработки ЛГ и ФСГ. В результате снижается, а затем и полностью прекращается секреция эндогенного тестостерона клетками Лейдига и андрогенсвязывающего протеина клетками Сертоли, что приводит к остановке сперматогенеза. Более того, согласно данным S. Shokri и соавт. [8], полученным в экспериментах на мышах, экзогенные производные тестостерона вкупе с физическими нагрузками индуцируют апоптоз в клетках сперматогенеза и разрушают герминогенный эпителий в яичках. Некоторые исследователи полагают, что и сами по себе чрезмерные физические нагрузки могут приводить к нарушению сперматогенеза [9]. Отмечено, что при больших нагрузках уровень потребления кислорода возрастает в 10-20 раз, что увеличивает продукцию активных радикалов кислорода. Избыточная продукция таких радикалов является основой оксидативного стресса, повреждающего клетки и ткани.
В литературе существует совсем немного работ, посвященных лечению мужского бесплодия, вызванного приемом ААС. Так, M. Gazvani и соавт. [11] описали 4 клинических случая спонтанного восстановления фертильности у пациентов, употреблявших ААС в течение 18, 8, 13 и 5 мес соответственно, после отмены препаратов. Во всех случаях беременность у партнерш наступила самостоятельно в течение года после нормализации показателей спермограммы.
D. Turek и соавт. [12] сообщили об успешном лечении азооспермии у пациента, употреблявшего ААС, с помощью инъекций Х.Г. Беременность в паре наступила после 3 мес лечения.
D. Menon [13] описал случай успешного лечения гипогонадизма и азооспермии, обусловленных приемом ААС, с помощью инъекций ХГ и человеческого менопаузального гонадотропина (чМГ). ХГ вводили 2 раза в неделю по 10 000 МЕ вместе с ежедневными инъекциями чМГ в дозе 75 МЕ. В течение 3 мес показатели спермограммы пришли в норму, уровень тестостерона также нормализовался. Спустя 10 мес после начала лечения у партнерши наступила беременность, закончившаяся рождением здорового ребенка.
L. Lipshultz и соавт. [14] рекомендуют введение ХГ по 3000 МЕ через день в течение 3 мес и более. Так как большие дозы ХГ подавляют секрецию ФСГ, авторы советуют одновременное назначение кломифена цитрата для усиления секреции ЛГ и ФСГ в передней доле гипофиза. Сперматогенез, по мнению авторов, восстанавливается через 4-6 мес.
Итак, анализируя данные немногочисленных источников литературы, можно сказать, что единого подхода к лечению такой группы пациентов нет до сих пор. Препараты и дозировки подбираются, как правило, эмпирически на основании индивидуального опыта и предпочтений лечащего врача. Отсутствует также единое мнение о времени начала стимуляции функции яичек. Большинство авторов отводят на самостоятельное восстановление сперматогенеза от 4 до 12 мес, однако некоторые специалисты советуют придерживаться выжидательной тактики вплоть до 2 лет.

_575.gif)
