Чем заменить гормональные таблетки при эндометриозе после 40
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников
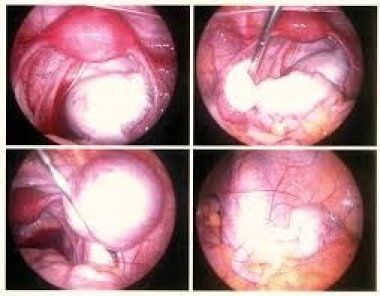
Изучены эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обоснованы условия и показания к минимально инвазивному вмешательству.
Efficiency and long-term results of sclerotherapy of ovary endometriosis were studied; conditions and indications for minimal invasive intervention were grounded.
Эндометриоз по праву считается одной из главных причин женского бесплодия и в силу особенностей морфогенеза тяжело поддается медикаментозной терапии. Онкологическая настороженность при эндометриозе остается малоизученной, вызывая много споров и дискуссий. Каждая локализация эндометриоза имеет не только свои клинические, но и патофизиологические и гистологические отличия. Эндометриозу яичников отводится особая роль, для подтверждения которой существует ряд фактов:
1) в структуре всех локализаций эндометриоидных гетеротопий эндометриоз яичников занимает первое место;
2) эндометриоз яичников неблагоприятно воздействует на фолликулогенез в целом и функцию желтого тела в частности;
3) эндометриоз яичников угнетает овариальный резерв, разрушая функциональную ткань яичников;
4) считается, что изначально именно эндометриоз яичников приводит к развитию тяжелого осложнения — глубоко инфильтративного эндометриоза, вовлекая в патологический процесс экстрагенитальные органы и структуры — мочевыводящие пути, кишечник, окружающую брюшину;
5) эндометриоз яичников, в отличие от других локализаций нозологии, представляет наибольшую потенциальную угрозу для озлокачествления.
Эндометриомы (эндометриоидные кисты) яичников занимают лидирующие позиции не только в структуре всех поражений эндометриозом, но и среди причин женского бесплодия, ассоциированного с эндометриозом. Более того, особенности гистогенеза эндометриом (способность к инфильтрации в окружающие ткани) обуславливают снижение объема функционирующей ткани яичника независимо от размеров новообразования [2]. В отношении тактики лечения пациенток с эндометриомами в репродуктивном периоде существуют две точки зрения: одни авторы считают, что при средних размерах эндометриоидных кист до 30 мм целесообразно проведение медикаментозной терапии, другие — придерживаются мнения о необходимости цистэктомии при таких новообразованиях.
Недопустимо медикаментозное лечение эндометриоидных кист яичников без верификации диагноза, так как предполагаемая «эндометриоидная киста» на самом деле может быть опухолью яичника или «переродиться» в нее в процессе лечения». Действительно, с одной стороны, пассивное наблюдение или медикаментозная терапия эндометриом связаны с высоким риском различных осложнений (снижение функции яичников, экспансивный рост новообразования, угроза его озлокачествления), с другой — хорошо известно, что классическая цистэктомия при эндометриоидных кистах яичников сопряжена с потенциальной потерей фолликулярного запаса. Следовательно, для решения данной проблемы необходим некий компромисс, который позволил бы не только избежать повреждения функциональной ткани яичников, но и снизить риски, обусловленные онкологической настороженностью. Сегодня роль «золотой середины» лечения пациенток с эндометриоидными кистами яичников играет аспирационная (склерозирующая) терапия. В литературе последних лет появилось сравнительно большое количество публикаций на эту тему. В частности, García-Tejedor et al. из университетского госпиталя Барселоны (Bellvitge University Hospital-IDIBELL, Испания) опубликовали результаты предварительного анализа 27 случаев склеротерапии эндометриом яичников, выполненных в период 2010–2014 гг. При этом указали частоту рецидивов новообразования всего лишь 12% в течение 17 мес наблюдения [5]. Профессор А. И. Давыдов и соавт. первое подобное вмешательство осуществили в 1999 г. у пациентки 32 лет с единственным яичником, в котором диагностирован рецидив эндометриоидной кисты после предшествующих цистэктомий [6]. Первый опыт оказался удачным: после 2 лет бесплодия у женщины наступила беременность, закончившаяся срочными родами. С того периода были произведены 124 подобные манипуляции, ретроспективный анализ которых позволил обосновать четкую позицию по данному вопросу.
Целью данной работы было изучить эффективность и отдаленные результаты склерозирующей терапии эндометриом яичников и обосновать условия и показания к минимально инвазивному вмешательству.
Пациенты и методы исследования
За период 1999–2017 гг. выполнены 124 вмешательства по методике аспирационной (склерозирующей) терапии эндометриоидных кист яичников. Возраст пациенток варьировал от 18 до 42 лет, составив в среднем 26,4 ± 4,2 года. Средний возраст менархе составил 13,3 ± 1,2 года. Продолжительность менструального цикла у большинства больных (68%) находилась в пределах 25–29 дней. У 92% пациенток длительность менструального кровотечения была 4 и более дней, жалобы на обильные менструации предъявляли 26% больных, а у 36 менструации сопровождались болями различной интенсивности. Одну и более беременностей имели 24 (19%) пациентки; соответственно, не было беременностей у 100 (81%) женщин. Первичное бесплодие диагностировано у 42 (34%) пациенток, вторичное бесплодие — у 9 (7%). Роды в анамнезе имели 26 (20%) больных, у 16% — беременность закончилась самопроизвольным прерыванием в сроки 3–11 нед гестации, причем у 10% женщин — после экстракорпорального оплодотворения. При анализе перенесенных заболеваний обращает на себя внимание высокий инфекционный индекс в детстве. Оперативные вмешательства на придатках матки в связи с новообразованиями яичников различного генеза в прошлом выполнены у 38 (31%) пациенток, в том числе по поводу эндометриоидных кист — у 26 (21%). Следует уточнить, что у 22 из 38 (18%) больных в ходе предшествующих хирургических вмешательств были удалены придатки матки.
Длительность основного заболевания колебалась от нескольких месяцев до 4 лет (в среднем — 1,6 ± 0,6 года). Его ведущими симптомами были: тазовые боли различной интенсивности — 74%, дисменорея — 22%, диспареуния — 14%, меноррагии — 5% (перечисленные симптомы сочетались в различных отношениях). Лишь 15 (12%) пациенток не предъявляли жалоб, у них образования яичников были выявлены гинекологом и/или врачом ультразвуковой диагностики при профилактическом осмотре. При гинекологическом исследовании патологические образования в проекции придатков матки обнаружены у 38% женщин, у 12% — высказано предположение об их наличии. Соответственно в 50% наблюдений новообразования яичников диагностированы только с помощью эхографии.
Методика аспирационной (склерозирующей) терапии эндометриом яичников хорошо известна и описана ранее [6]. Следует акцентировать внимание на необходимости полной санации полости кисты и экспозиции 70% раствора этанола не менее чем на 40 с (в зависимости от исходного объема эндометриомы).
Результаты исследования и их обсуждение
Средний диаметр эндометриом яичников в наших исследованиях варьировал от 25 до 65 мм. В 84 (67,7%) наблюдениях патологический процесс был односторонним, в 72,3% — двусторонним. У 43 (34,6%) женщин имел место рецидив заболевания после предшествующей цистэктомии, у 28 (22,6%) — эндометриоидные кисты локализовались в единственном яичнике и еще у 7 (5,6%) пациенток при ультрасонографии яичник, контрлатеральный от эндометриодного образования, был резко уменьшен в размерах, а в его срезах отсутствовали признаки антральных фолликулов (после предшествующей цистэктомии по поводу эндометриоидных кист). То есть фактически у 35 (28,2%) пациенток эндометриома диагностирована в единственном яичнике. Ультразвуковая характеристика эндометриоидных кист хорошо изучена и не требует обсуждения. Следует уточнить, что их главным акустическим критерием считается констатация внутри патологического образования мелкоточечной эхо-позитивной взвеси на фоне повышенного уровня звукопроводимости. Обнаружение подобной картины позволяет почти в 100% наблюдений установить точный диагноз до хирургического вмешательства.
Для выявления локусов неоангиогенеза — одного из основных маркеров злокачественной опухоли — использовали цветное допплеровское картирование в режиме энергетического допплера. В этом режиме у больных с эндометриомами кровоток регистрировали в области ворот яичника, а также по периферии новообразования в сохранной ткани яичника. Объем содержимого эндометриоидной кисты, эвакуированного в ходе аспирационной терапии, варьировал от 2 до 12 мл. Однако истинный объем содержимого этих кист было сложно оценить вследствие высокой плотности «шоколадной» жидкости, что практически всегда требовало предварительного лизиса с помощью 0,9% раствора NaCl. Важным этапом склерозирующей терапии эндометриом является экспозиция 70% раствора этанола на завершающем этапе вмешательства. Ее длительность зависит от объема полости новообразования и составляет 60–90 с. Суть данного этапа аспирационной терапии — вызвать легкий ожог (химическая деструкция) и в последующем — склероз эндометриоидной выстилки кисты. Склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением. Вопрос о роли послеоперационной гормональной терапии больных эндометриозом яичников до настоящего времени остается поводом для дискуссий. Существует точка зрения, что после полного удаления капсулы эндометриоидных кист, других очагов эндометриоза нет необходимости в применении гормональных средств. В то же время никто не отрицает сравнительно высокую частоту рецидивов эндометриом после цистэктомии, что можно объяснить наличием микроскопических и/или непигментированных гетеротопий, рост которых в последующем обуславливает рецидивы патологических образований. В любом случае, аспирационная терапия предусматривает обязательное назначение гормональных препаратов.
Применение в послеоперационном периоде экзогенных гормонов (антигормонов) преследует следующие цели:
1) дополнить склерозирующий эффект этанола;
2) подавить пиковые выбросы гормонов аденогипофиза, способствующие рецидиву заболевания.
Традиционно препаратами первой линии лечения пациенток с эндометриозом после хирургического вмешательства считаются комбинированные оральные контрацептивы (КОК) — эстроген-гестагенные средства [4]. При выборе последних особое внимание уделяют типу прогестагена, так как именно эти соединения оказывают антипролиферативное действие на очаги эндометриоза.
Эффективность результатов комплексной (склерозирующей + медикаментозной) терапии эндометриом оценивали по следующим параметрам:
1) частота рецидивов новообразования;
2) длительность периода, в течение которого произошел рецидив эндометриомы;
3) частота наступления беременности.
Ретроспективный анализ полученных результатов показал, что частота рецидивов заболевания в течение первых 12 мес наблюдения составила 38,7% (48 из 124 наблюдений). В то же время в течение первых 3 мес наблюдения этот показатель не превысил 9,7% (12 из 124 наблюдений). В период 7–12 мес после вмешательства самопроизвольная беременность наступила у 36,3% (46) женщин, которая во всех наблюдениях закончилась родами. Причем часть пациенток (20,1%) по разным причинам не планировали беременности.
Сегодня главная дилемма в отношении эндометриом яичников — оперировать или не оперировать. Справедливо отметить, что по данному вопросу мнения ученых всего мира разделились. Действительно, некоторые авторы ратуют в пользу нехирургического подхода при эндометриомах яичников диаметром до 3 см, аргументируя свою позицию резким снижением, а иногда потерей фолликулярного запаса после хирургических вмешательств на яичниках по поводу эндометриоидных образований. Нельзя не признать, что данный факт имеет высокий уровень достоверности. Механизмы снижения/утраты фолликулярного запаса после хирургического лечения больных эндометриомами яичников различны. Однако главная причина тесным образом связана непосредственно с морфогенезом эндометриом. Хорошо известно, что эндометриоидные кисты в отличие от других доброкачественных новообразований яичников характеризуются наличием плотных подэпителиальных сращений между капсулой кисты и воротами яичников — места прохождения основных кровеносных и лимфатических сосудов, питающих яичник. Поэтому цистэктомия при эндометриоидных кистах — это уже большая травма для яичника, а необходимость лигирования (коагуляции) яичника в области его ворот вызывает дополнительные нарушения в системе кровоснабжения яичника. «Агрессивность» цистэктомии при эндометриомах — это одна сторона медали. Другая — напрямую связана с онкологической настороженностью. Сегодня не является поводом для дискуссий риск озлокачествления эндометриоза. Однако в обсуждении данной проблемы «ускользает» важное уточнение: способностью к малигнизации обладает, как правило, эндометриоз яичников. Именно для этой локализации эндометриоза характерны атипические формы, которые принято рассматривать как фазу перехода доброкачественного процесса в злокачественный [8]. Проведенные по данной проблеме клинико-статистические исследования установили, что в отдаленном периоде наблюдения (11,4 года) риск развития рака яичников у пациенток с эндометриомами яичников в 2 раза выше, чем в популяции [9].
Анализ данных литературы и опыт собственных наблюдений по данной проблеме позволяют обосновать ряд положений:
1) эндометриоз — гистологический диагноз, характеризующийся специфическими морфоструктурными особенностями; до хирургического вмешательства «эндометриодная киста яичника» — лишь предположительное заключение методов инструментальной диагностики (УЗИ, КТ, МРТ);
2) нецелесообразно проводить медикаментозное лечение при эндометриоидных кистах яичников без их гистологической верификации вследствие погрешности диагностики даже при использовании ультрасовременных методов нехирургической визуализации;
3) учитывая высокие риски повреждения фолликулярного запаса после хирургического лечения эндометриом, особенно при их рецидивах, необходимо ставить вопрос о применении аспирационной (склерозирующей) терапии;
4) склерозирующую терапию пациенток с эндометриоидными кистами яичников необходимо рассматривать только в комплексе с послеоперационным гормональным лечением.
Важно подчеркнуть, что от комплаентности экзогенных гормонов зависит исход микроинвазивного (максимально щадящего для функции яичников) хирургического вмешательства, коим является склеротерапия. Сегодня КОК вполне справедливо причисляют к препаратам первой линии выбора, которые используют для купирования тазовой боли у пациенток с эндометриозом. Их потенциальными преимуществами являются сравнительно низкая цена, небольшая частота побочных эффектов, возможность длительного лечения. Последний аспект имеет особое значение у женщин, не планирующих беременность. При выборе КОК для послеоперационного лечения пациенток с эндометриоидными кистами яичников необходимо учитывать фармакодинамику прогестагена, входящего в состав КОК. Данные литературы свидетельствуют, что эффективность диеногеста при эндометриозе сопоставима с таковой агонистов гонадотропин-рилизинг-гормона [10]. Однако в отличие от последних прогестагены не модулируют развитие эстроген-дефицитных состояний, тяжело переносимых пациентами. В литературе последних лет сведения об эффективности склерозирующей терапии эндометриом имеют разноречивый характер. В метаанализе Cohen et al., основанном на изучении мировых источников (Pubmed, Embase, Ovid Medline, Google Scholar, Clinicaltrials. gov, Cochrane Central Register of Controlled Trials), частота рецидивов эндометриом после склерозирующей терапии варьирует от 0% до 62,5% (соответственно эффективность — от 37,5% до 100%) [11]. В наших исследованиях частота рецидивов составила 38,7%, что коррелирует с «нижней границей» эффективности данного метода. В то же время мы считаем это достаточно высоким результатом, основанным на многолетнем опыте. Различия в эффективности склерозирующей терапии, представленные в литературе, по-видимому, объясняются длительностью периода наблюдения за этими пациентками. В частности, в наших исследованиях в течение первых 3 мес наблюдения этот показатель не превысил 9,7%, что в итоге способствовало наступлению беременности у 46 из 124 женщин. С учетом того, что 25 (20,1%) женщин, вошедших в настоящее исследование, не планировали беременность и использовали гормональную контрацепцию (диеногест + этинилэстрадиол), частота наступления беременности в данной группе достигла 46,4%.
Необходимо подчеркнуть, что склеротерапия эндометриом яичников не должна рассматриваться в качестве панацеи в лечении таких пациенток. Ее популяризация не означает отказ от применения других методов хирургического вмешательства. Безусловно, данный метод обеспечивает максимально бережное отношение к фолликулярному запасу. Однако он имеет и свои ограничения, такие как невозможность выполнения овариолизиса, отсутствие визуального контроля над деструкцией капсулы кисты, отсутствие информации о распространенности эндометриоза. Более того, благоприятный исход аспирационной терапии эндометриоидных кист яичников во многом зависит от соблюдения условий и показаний к подобному вмешательству:
Заключение
Склеротерапия эндометриом яичников с ультразвуковым мониторингом вмешательства — минимально инвазивный метод лечения пациенток репродуктивного возраста, обеспечивающий сохранность фолликулярного запаса. Также данный метод можно рассматривать в качестве выбора в сложных клинических ситуациях: рецидив эндометриоидной кисты единственного яичника; предшествующие многократные оперативные вмешательства на единственном яичнике; высокий риск осложнений абдоминального хирургического вмешательства и др. Аспирационная терапия эндометриом не должна рассматриваться в качестве основного метода лечения таких пациенток, для ее применения разработаны определенные условия и показания. Склерозирование капсулы эндометриом яичников не является монотерапией, ее исход во многом определяется адекватностью послеоперационного гормонального лечения.
Литература
М. Б. Таирова 1
А. И. Давыдов, доктор медицинских наук, профессор
ФГАОУ ВО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Дифференциальный подход к выбору метода лечения больных эндометриозом яичников/ М. Б. Таирова, А. И. Давыдов
Для цитирования: Лечащий врач № 12/2018; Номера страниц в выпуске: 20-23
Теги: тазовая боль, эндометриома, склерозирующая терапия
Комплексное лечение больных аденомиозом
За последнюю четверть века наблюдается неуклонный рост частоты генитального эндометриоза. В настоящее время эндометриоз постепенно выходит на 3-е место в структуре гинекологической заболеваемости в России, поскольку около 8–15% женщин
За последнюю четверть века наблюдается неуклонный рост частоты генитального эндометриоза. В настоящее время эндометриоз постепенно выходит на 3-е место в структуре гинекологической заболеваемости в России, поскольку около 8–15% женщин репродуктивного возраста имеют эту патологию [1,3,10,11]. Генитальный эндометриоз является вторым по частоте заболеванием у женщин репродуктивного возраста, вызывающим бесплодие, боль и различные нарушения менструального цикла [13].
Проблема генитального эндометриоза особенно актуальна для молодых женщин, так как заболевание сопровождается значительными нарушениями репродуктивной и менструальной функций, стойким болевым синдромом, нарушением функции смежных органов, а также ухудшением общего состояния больных, снижением их трудоспособности [2, 3]. Наиболее распространенной локализацией генитального эндометриоза является поражение матки — аденомиоз, доля которого в структуре этой патологии составляет от 70 до 80% [6, 9, 14].
Целью проведенного нами исследования стало совершенствование лечебной тактики у больных аденомиозом с начальными проявлениями заболевания на основе коррекции результатов морфо-биохимического исследования.
Комплексное клинико-морфо-биохимическое исследование проводилось у 90 больных аденомиозом, в том числе у 50 пациенток (средний возраст 42,6 ± 3,35 лет) с гистологически верифицированным диагнозом. Проанализированы результаты консервативного лечения 40 больных аденомиозом (средний возраст 38,7 ± 2,71 лет).
Для уточнения диагноза проводилось инструментальное обследование: трансабдоминальное и трансвагинальное ультразвуковое сканирование на аппаратах «Aloka-630» (Япония), «Megas» (Италия) и гистероскопия с помощью эндоскопической техники фирмы Karl Storz (Германия). В качестве контрастной среды использовались стерильные растворы хлористого натрия (0,9%), глюкозы (5,0%). После первичного осмотра, раздельного диагностического выскабливания цервикального канала и слизистой полости матки, с последующим их гистологическим исследованием, выполнялась контрольная гистероскопия.
Гистологический материал обрабатывали по общепринятой методике. Гистохимическими методами выявляли основное вещество соединительной ткани миометрия с помощью альцианового синего по методу А. Кригер-Стояловской [8]; определение нейтральных полисахаридов проведено с помощью ШИК-реакции, ДНК клеточных ядер — по методу Фельгена, макромолекулярную устойчивость тканевых структур соединительной ткани — по методу К. Великан [5].
Выделение фосфоинозитидов (ФИН) осуществлялось с помощью усовершенствованного метода проточной тонкослойной хроматографии, позволявшего определять содержание различных ФИН [12]. Исследовалось содержание ФИН в цельной крови, моноцитах, лимфоцитах. Группу сравнения для определения показателей содержания ФИН в крови составили 50 здоровых женщин-доноров (средний возраст 39,3 ± 2,45 лет).
Проведен анализ анамнестических и клинических данных, результатов комплексного обследования (гистероскопии, ультразвукового сканирования) 40 больных аденомиозом (средний возраст 38,7 ± 2,71 лет), получавших консервативную терапию.
Установлены наиболее характерные жалобы больных: дисменорея, которую отмечали 34 (86,1%) женщины, меноррагия — 17 (42,5%), пред- и постменструальные кровяные выделения из половых путей — 14 (35,0%). Кроме того, жалобы на боли в нижних отделах живота предъявляли 18 (45,0%) пациенток; на боли в области таза, не связанные с менструацией или половым актом, — 10 (25,0%) женщин; диспареунию отмечали 13 (32,5%) больных. У каждой пятой женщины дисменорея сопровождалась головной болью и головокружением. Повышенную раздражительность, угнетенное настроение, снижение работоспособности и невротические расстройства отмечали 23 (57,5%) женщин. У большинства болевой синдром сопровождался общей слабостью, чувством тревоги, страха, возбудимостью, эмоциональной лабильностью, рассеянным вниманием, снижением памяти, нарушением сна и другими психоастеническими проявлениями, которые беспокоили каждую вторую пациентку.
При гинекологическом исследовании было выявлено увеличение размеров матки, соответствующее 6–7 нед беременности, — у 31 больной, у остальных женщин матка была увеличена до 8–9 нед беременности. Патологических образований в области придатков матки не обнаружено ни у одной больной как при двуручном, так и при эхографическом исследованиях.
В целях уточнения клинического диагноза проводили обследование с помощью наиболее информативных инструментальных методов: УЗИ и гистероскопии. Информативность ультразвукового исследования в выявлении аденомиоза составила 77,5 ± 6,69%, гистероскопии — 87,5 ± 5,29%.
Морфо-биохимическое исследование проведено у 50 оперированных больных (средний возраст 42,6 ± 3,35 лет) с верифицированным при морфологическом исследовании аденомиозом. Установлено, что рост гетеротопических очагов сопровождался выраженным полнокровием микроциркуляторного русла миометрия, лимфостазом, отеком периваскулярной ткани миометрия, увеличением вокруг очагов эндометриоза числа тканевых базофилов, высоким содержанием в межклеточном веществе альцианпозитивных гликозаминогликанов. Эти изменения были наиболее выражены при II–III степенях поражения. Обнаружено неравномерное уплотнение и разжижение аргирофильного вещества с утратой волокнистой структуры вокруг желез, расположенных в миометрии. Нарушения строения основного вещества и волокнистых структур соединительно-тканного каркаса миометрия в виде развития базо- и пикринофилии, прогрессирующей утраты межмолекулярных связей, накопления кислых несульфатированных гликозаминогликанов, увеличения числа тканевых базофилов являются следствием возникающей тканевой гипоксии. Морфологическим проявлением последней можно считать присутствующее в образцах полнокровие микроциркуляторного русла миометрия и сопутствующие ему отек перивазальных пространств и выраженный лимфостаз. Патологический процесс, глубоко инфильтрирующий ткани, приводит к ишемизации нервов и их демиелинизации. Результатом этих процессов является изменение афферентного входа на уровне сегмента спинного мозга, стойко меняется импульсация, поступающая в ЦНС, что приводит к изменению сенсорного качества боли и появлению наиболее тягостных ощущений [4]. Рефлекторный спазм сосудов, развивающийся в ответ на болевой раздражитель, усугубляя ишемические расстройства, еще больше усиливает афферентную импульсацию в головной мозг, способствуя формированию «порочных кругов» в симпатических рефлексах. Кроме того, функционирующие очаги эндометриоза сами по себе превращаются в мощный раздражитель высших центров регуляции половой функции, что приводит к дальнейшей стимуляции пролиферативной активности клеток. В результате создаются условия для прогрессирования патологического процесса, в котором основная роль принадлежит нарушению внутрикоммуникативных взаимоотношений в системе кровь–ткань матки. Все это приводит к образованию порочного круга, характеризующегося взаимосвязанными гормональными, иммунными, клеточными нарушениями, полностью устранить которые только гормональными препаратами крайне сложно. Об этом свидетельствует невысокая эффективность терапии, применяемой у больных c данной патологией.
В настоящее время большое внимание уделяется исследованию арахидоновой кислоты и ее метаболитов (простагландинов и тромбоксана А2) в процессах пролиферации клеток. Показано, что простагландины могут оказывать влияние на регуляцию клеточной пролиферации и/или дифференциацию, особенно в эндометрии [1]. Возникновение боли у пациентов с аденомиозом может быть обусловлено гиперпродукцией производных арахидоновой кислоты — простагландинов. С простагландинами связывают явление сенситизации к алгогенным продуктам, вырабатывающимся при воспалении, ишемии, при иммунопатологических процессах [4]. Простагландин F2α (ПГF2α) и простагландин Е2 (ПГЕ2) во время менструации накапливаются в эндометрии и вызывают симптомы дисменореи. ПГF2α и ПГЕ2 синтезируются из арахидоновой кислоты через так называемый циклооксигеназный путь. Основным источником гиперпродукции простагландинов являются активированные мононуклеары. Мы провели исследование содержания ФИН в фагоцитирующих мононуклеарах у больных аденомиозом, оценивая их содержание по присутствию в моноцитах. Содержание в крови ФИН отражает специфику изменений обменных процессов, происходящих в организме, поскольку доказано участие инозитсодержащих липидов в переходе клеток к неконтролируемому росту и трансформации. Выявлено, что в моноцитах у больных аденомиозом количество основного ФИН — фосфатидилинозита (ФИ) было достоверно снижено в 1,3 раза по сравнению со значениями у женщин группы контроля. Полученные данные свидетельствуют о том, что у больных аденомиозом дефицит ФИ играет весьма важную роль в процессах пролиферации, а значит эти нарушения следует корригировать при лечении этого заболевания.
В настоящее время наиболее эффективными препаратами для лечения аденомиоза являются препараты агонисты гонадотропинрилизинг-гормона (золадекс, декапептил, диферелин, бусерелина ацетат, бусерелин-депо и др.). Вместе с тем высокая стоимость препаратов не позволяет широко применять их в клинической практике. В связи с этим больным с ограниченными финансовыми возможностями назначают прогестагены, у которых в качестве активного вещества фигурирует норэтистерона ацетат — норколут (Gedeon Richter, Венгрия), примолют-нор (Schering, Германия).
Проведено изучение результатов традиционной гормональной терапии и разработанного нами способа лечения аденомиоза. В 1-ю группу больных включены 20 женщин (средний возраст 38,2 ± 2,88 лет), которым проводилась только гормональная терапия (норколут — по 10 мг в сутки с 5-го по 25-й дни менструального цикла в течение 6 мес). Во 2-й группе больных, в которую вошли 20 пациенток (средний возраст 39,4 ± 2,97 лет), проводилось комплексное лечение с применением следующих препаратов: норколут (режим дозирования, как у больных 1-й группы) в сочетании с тренталом (по 1 драже 3 раза в день в течение 6 нед), хофитолом (Labor. Rosa-Phytopharma) (по 2–3 таблетки 3 раза в сутки перед едой в течение 20 дней) в сочетании с 10 сеансами низкоэнергетической лазерной терапией, осуществлявшейся аппаратом РИКТА (Россия) по разработанной нами методике (2004). Повторный курс лазерной терапии проводили через 2 мес. Терапевтическая эффективность лазерной терапии обусловлена как лазерным, инфракрасным и магнитным воздействием данного аппарата, так и спецификой сочетанного использования перечисленных видов энергии. Хофитол — препарат растительного происхождения с выраженным гепато-, нефропротекторным и диуретическим действием, обладает антиоксидантным эффектом. Лечение этим препаратом оказывает влияние на метаболизм липидов и увеличивает выработку коферментов гепатоцитами. В связи с тем, что в возникновении болевого синдрома у больных аденомиозом определенную роль играет гиперпродукция простагландинов, нами в состав комплексной терапии был включен нестероидный противовоспалительный препарат нурофен плюс (Boots Healthcare International).
Прием трентала и хофитола больные начинали в ходе первого цикла лечения гормональным препаратом. Нурофен плюс назначали за 3–4 дня до начала менструации и в течение первых 3–5 дней менструации (по 200–400 мг каждые 4 ч). Препарат принимали с учетом индивидуальной переносимости. Низкоэнергетическую лазерную терапию проводили сразу после окончания менструации, чтобы курс лечения не прерывался и уложился в рамки одного менструального цикла.
Через 6 мес при анализе эффективности терапии было установлено, что лечение лучше переносили пациентки из 2-й группы. Так, улучшение общего состояния, самочувствия, настроения отмечали 5 (25,0%) больных из 1-й группы и 17 (85,0%) женщин из 2-й группы. Такие изменения оказывали благоприятный психоэмоциональный эффект и способствовали повышению работоспособности пациенток. Улучшился сон у 2 (10,0%) женщин из 1-й группы и у 10 (50,0%) — из 2-й группы; менее раздражительными стали 1 пациентка из 1-й группы и 8 женщин из 2-й группы. При сравнении динамики изменения клинических симптомов заболевания лучший терапевтический эффект отмечался у больных из 2-й группы — по сравнению с женщинами, получавшими традиционное гормональное лечение. Так, дисменорея уменьшилась у 11 (64,7%) больных из 1-й группы и у 16 (94,1%) женщин из 2-й группы, причем полностью купировать ее удалось у 2 и 11 больных соответствующих групп. Боли в нижних отделах живота уменьшились у 4 из 8 больных в 1-й группе и у 9 из 10 женщин во 2-й группе. Следует отметить, что уменьшение выраженности болевого симптома и дисменореи больные из 2-й группы отмечали уже в очередную менструацию после проведения лазерной терапии, осуществлявшейся на фоне лекарственной терапии. Диспареуния сократилась у 2 больных из 1-й группы и у 6 женщин из 2-й группы. Уменьшение длительности и интенсивности менструальной кровопотери отмечали 7 из 1-й группы и 10 женщин из 2-й группы. Отсутствие эффекта от проведенной терапии, приведшее к оперативному вмешательству, констатировали у 4 (20,0%) женщин из 1-й группы и у 1 (5,0%) больной из 2-й группы, у которых диагностировали диффузно-узловую форму аденомиоза.
Таким образом, комплексная коррекция нарушений, возникающих у больных аденомиозом, способствует повышению эффективности лечения этой патологии. Включение в состав комплексной терапии у больных аденомиозом низкоэнергетической лазерной терапии, а также препаратов, улучшающих микроциркуляцию, нестероидного противовоспалительного препарата (нурофен плюс) способствует повышению эффективности лечения и снижению в 4 раза частоты оперативных вмешательств по сравнению с больными, получавшими традиционную гормональную терапию.
Литература
М. М. Дамиров, доктор медицинских наук, профессор
Т. Н. Полетова, кандидат медицинских наук
К. В. Бабков, кандидат медицинских наук
Т. И. Кузьмина, кандидат медицинских наук, доцент
Л. Г. Созаева, кандидат медицинских наук
З. З. Муртузалиева