Чем заменить кларитромицин при хеликобактер
Выбор схемы эрадикационной терапии при helicobacter pylori в случае необходимости повторного лечения
Опубликовано в журнале:
«Врач», 2008, №4, с. 64-67
Т. Лапина, кандидат медицинских наук,
ММА им. И. М. Сеченова
Лечение при инфекции Helicobacter pylori (Hp) можно считать детально разработанным: по комбинации лекарственных средств, их дозам и продолжительности курса оно стандартизировано. В России эта терапия утверждена в соответствующих стандартах медицинской помощи и Формулярной системе. Национальные рекомендации многих европейских стран и отечественные стандарты по диагностике и лечению при Нр основаны на алгоритмах, разработанных под эгидой Европейской группы по изучению этой инфекции. Поскольку первые конференции по выработке данного консенсуса прошли в Маастрихте, рекомендации носят название Маастрихтских (конференции проходили в 1996, 2000 и 2005 гг.).
Схемы эрадикационной терапии строго регламентированы, кажется, что такое лечение не должно вызывать вопросов. Однако выполнение любого стандарта на практике не всегда сопровождается стопроцентной эффективностью. Большинство наиболее острых вопросов касаются выбора схемы лечения после неудачи первой (а иногда второй и третьей) попытки.
Почему же при Нр иногда требуется проведение повторного курса эрадикационной терапии (в англоязычной литературе для его обозначения используют термин «терапия второй, третьей линии»)? В качестве показателя, свидетельствующего об оптимальности схемы лечения, все Маастрихтские рекомендации [9, 16, 17] называют 80% эрадикацию Нр. Это означает, что процент эрадикации микроорганизма по критерию intention-to-treat должен быть равен или превышать 80%. Этот «целевой» процент успешной эрадикации предложен на основании анализа данных множества клинических исследований различных схем лечения, их доступности и переносимости; он учитывает и характеристики Нр (чувствительность микроорганизма к лекарственным средствам, особенности среды обитания). Стабильно высокий процент уничтожения микроорганизма должен быть легко воспроизводим при лечении в разных популяциях и разных регионах и странах.
Решающее значение имеет, безусловно, терапия первой линии, которая должна быть нацелена на достижение эрадикации Hр у максимального числа больных. В качестве терапии первой линии Маастрихтские рекомендации III предлагают следующие трехкомпонентные схемы лечения (табл. 1): ингибитор протонной помпы в стандартной дозировке 2 раза в день+кларитромицин – 500 мг 2 раза в день+амоксициллин – 1000 мг 2 раза в день или метронидазол – 400 или 500 мг 2 раза в день. Минимальная продолжительность тройной терапии – 7 дней, однако оказалось, что для данной схемы более эффективен 14-дневный курс лечения (на 12%; 95% доверительный интервал – ДИ: 7–17%) [12]. Тем не менее 7-дневная тройная терапия может быть признана приемлемой, если местные исследования показывают, что она высокоэффективна. Рекомендуется одинаковая терапия первой линии для всех стран, хотя в разных странах могут быть одобрены разные дозы лекарственных средств [17].
Таблица 1. Схемы стандартной тройной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Кларитромицин – 500 мг 2 раза в день | Амоксициллин – 1000 мг 2 раза в день или Метронидазол – 400 или 500 мг 2 раза в день |
Четырехкомпонентная схема лечения включает в себя ингибитор протонной помпы в стандартной дозе 2 раза в день+висмута субсалицилат/трикалия дицитрат – 120 мг 4 раза в день+метронидазол – 500 мг 3 раза в день+тетрациклин – 500 мг 4 раза в день (табл. 2). В Маастрихтских рекомендациях II за четырехкомпонентной схемой была закреплена позиция терапии второй линии [16]. Одно из новых положений Маастрихтских рекомендаций III – возможность применения такой схемы в определенных клинических ситуациях, как терапии первой линии (альтернативная терапия первой линии) [17].
Таблица 2. Схемы четырехкомпонентной эрадикационной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент | 4-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Висмута субсалицилат/ субцитрат – 120 мг 4 раза в день | Метронидазол – 500 мг 3 раза в день | Тетрациклин – 500 мг 4 раза в день |
Почему претерпели изменения представления об оптимальной терапии первой линии в Маастрихтских рекомендациях? Почему поиск лучших режимов лечения не прекращается? Появились результаты клинических исследований стандартной тройной терапии (ингибитор протонной помпы +амоксициллин+кларитромицин) в разных странах, согласно которым «целевая» эрадикация не достигается, т.е. она ниже 80% [14]. Наиболее значимая причина снижения эффективности стандартной эрадикационной терапии – резистентность микроорганизма к антимикробным агентам. В Маастрихтских рекомендациях III большое внимание уделено вопросам планирования лечения в зависимости от чувствительности Hp к антибактериальным средствам. Так, комбинация «ингибитор протонной помпы+кларитромицин+амоксициллин или метронидазол» остается рекомендуемой терапией первой линии для популяций с частотой резистентных штаммов к кларитромицину менее 15–20%. В популяциях с частотой резистентности к метронидазолу менее 40% предпочтительнее схема «ингибитор протонной помпы+кларитроми-цин+метронидазол» [17].
Остановимся подробнее на проблеме резистентности Hp к антибиотикам. Согласно международным данным, резистентность Нр к амоксициллину либо равна 0, либо она менее 1%. Имеются крайне редкие сообщения о формировании резистентности из-за мутации pbp-1A-гена. Таким образом, резистентность к амоксициллину – крайне редкое явление, не имеющее клинического значения. Такую же редкость представляет собой резистентность к тетрациклину, которая во многих странах вообще не описана. Она обусловлена мутацией 3 смежных нуклеотидов в гене 16S rRNA (AGA 926–928→TTC). По экспериментальным данным, если мутация возникает лишь в 1 или 2 из этих нуклеотидов, резистентность клинически незначима; лишь тройственная мутация приводит к стабильной резистентности, которая способна оказать влияние на исходы лечения [18].
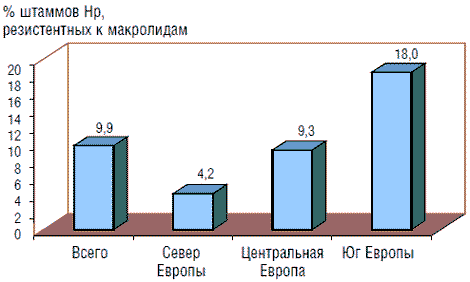
Принципиальное значение имеет чувствительность Hp к кларитромицину и метронидазолу. Количество резистентных штаммов Hp к кларитромицину, по данным мультицентрового европейского исследования, в среднем составляет 9,9% (95% ДИ: 8,3–11,7). Выявлены существенные различия этого показателя: в странах Северной Европы частота резистентности к кларитромицину низкая (4,2%; 95% ДИ: 0–10,8%); в Центральной и Восточной Европе она выше (9,3%; 95% ДИ: 0–22%) и самая высокая – на юге Европы (18%; 95% ДИ: 2,1–34,8%) (рис. 1) [13]. Риск возникновения резистентности к кларитромицину связан с частотой назначения макролидов в данной группе населения. В связи с тем что в ряде европейских стран в педиатрической практике широко назначали макролиды по поводу, например, респираторных заболеваний, частота резистентности штаммов Hp к кларитромицину у детей весьма высока, что делает проблемой выбор тактики эрадикационной терапии.
Рис. 1. Распространенность штаммов Hp, резистентных к макролидам, в европейских странах (по Glupczynski Y. и соавт., 2000)
Ответственна за резистентность к кларитромицину мутация гена 23S rDNA, которая ведет к нарушению пространственной конфигурации рибосомы. Признано, что она способствует развитию перекрестной резистентности к макролидным антибиотикам; вместе с тем не ясно, все ли макролиды, разными путями проникающие в слизистую оболочку желудка, могут приводить к селекции резистентных штаммов in vivo.
Различны и данные о влиянии резистентности к кларитромицину на исходы эрадикационной терапии. Максимальный из описанных эффектов следующий: 87,8% эрадикации Hp при наличии чувствительных штаммов, 18,3% – при наличии резистентных штаммов [18].
Количество штаммов Hp, резистентных к метронидазолу, в Европе и США колеблется от 20 до 40%. Известно, что в развивающихся странах число метронидазолрезистентных штаммов выше. Наибольшее значение для селекции резистентных штаммов имеет применение метронидазола в популяции. Механизм формирования резистентности к метронидазолу до конца не ясен: подозревают изменения гена rdxA, но точные мутации не известны [18].
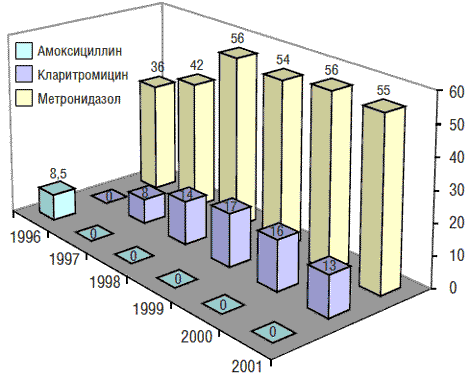
Наблюдение (1996–2001) за динамикой резистентности к производным нитроимидазола (метронидазол), макролидам (кларитромицин) и β-лактамам (амоксициллин) у штаммов Hp, выделенных в Москве, показало, что она отличается от таковой в Европе (рис. 2). Так, во взрослой популяции уровень первичной резистентности Hp к метронидазолу уже в 1996 г. превысил среднеевропейский показатель (25,5%) и составил 36,1%. На протяжении 1996–1999 гг. отмечалось увеличение числа первично резистентных штаммов Hp к метронидазолу, а затем оно не выявлялось [2].
Рис. 2. Динамика резистентности (в %) к метронидазолу, кларитромицину и амоксициллину у штаммов Hp, выделенных от взрослых в Москве в 1996–2001 гг. (Кудрявцева Л., 2004)
В отличие от данных, полученных в Европе в 1996 г., где во взрослой популяции уровень первичной резистентности Hp к макролидам (кларитромицин) составлял 7,6%, в Москве в то время штаммов Hp, резистентных к этому антибиотику, выявлено не было. Относительный прирост количества штаммов Hp, первично резистентных к кларитромицину, среди взрослой популяции за 1-й год наблюдения составил 8%, за 2-й – 6,4%, за 3-й – 2,7%. В 2000 г. уровень резистентности Hp к кларитромицину несколько снизился: если в 1999 г. он составлял 17,1%, то в 2000 г. – 16,6%. В 2001 г. наметилась явная тенденция к снижению этого показателя (13,8%).
В 1996 г. в Москве было выделено 3 штамма Hp, резистентных к амоксициллину; в дальнейшем такие находки не повторялись, и эти данные можно считать единственными в РФ и уникальными [2].
Последние доступные данные о чувствительности Hp к антибиотикам в Москве относятся к 2005 г. : у взрослых количество резистентных к метронидазолу штаммов составило 54,8%, к кларитромицину – 19,3%; у детей – соответственно 23,8 и 28,5% (Кудрявцева Л., 2006: персональное сообщение).
Таким образом, исходя из последних данных, в России сложились неблагоприятные условия для проведения стандартной тройной терапии вследствие высоких показателей резистентности Нр и к кларитромицину, и к метронидазолу. Тем не менее результаты отечественных клинических исследований свидетельствуют о большем значении для исходов терапии в нашей стране резистентности к метронидазолу, чем к кларитромицину. Чрезвычайное распространение штаммов, резистентных к метронидазолу, значительно ограничивает использование этого антибактериального агента. Так, по данным В. Ивашкина и соавт., в контролируемом исследовании схема «ингибитор протонной помпы+амоксициллин+метронидазол» (одобренная Маастрихтскими рекомендациями I и исключенная их вторым пересмотром) была успешной лишь в 30% случаев [1]. Что же касается резистентности к макролидам, то следует помнить, что контингент больных, из биопсийного материала которых были выделены штаммы для определения резистентности, был особый, в частности среди них было много стационарных пациентов. Кроме того, при анализе штаммов, полученных от лиц, проживающих в разных городах РФ, были выявлены существенные различия. Так, штаммов Hp, резистентных к кларитромицину, в Абакане зарегистрировано не было (табл. 3) [2]. Это заставляет предположить, что их распространенность за пределами Москвы и Санкт-Петербурга ниже среднеевропейского уровня.
Таблица 3. Частота антибиотикорезистентности Hp в разных городах России в 2001 г. (Кудрявцева Л. и соавт., 2004)
| Резистентность штаммов Hp | Города | ||
| Москва | Санкт-Петербург | Абакан | |
| К метронидазолу | 55,5 | 40 | 79,4 |
| К кларитромицину | 13,8 | 13,3 | 0 |
| К амоксициллину | 0 | 0 | 0 |
Не следует забывать, что обеспечивают высокий процент уничтожения Нр не только антибактериальные компоненты схемы лечения, но и ингибиторы протонной помпы. Было убедительно доказано, что без ингибитора протонной помпы при применении только 2 тех же антибиотиков в тех же дозировках эрадикация Нр снижается на 20–50%. Именно ингибиторы протонной помпы служат базисными препаратами схемы, обеспечивая путем мощного подавления желудочной секреции благоприятные условия для реализации действия антибиотиков. Если качество ингибитора протонной помпы низкое и он мало влияет на интрагастральный рН, то и процент эрадикации микроорганизма не будет достигать «целевого» рубежа. С другой стороны, высокий антихеликобактерный эффект свидетельствует об успешном контроле желудочной секреции ингибитором протонной помпы и о качестве этого лекарственного средства.
В большом числе отечественных клинических исследований продемонстрирована успешность стандартной тройной терапии даже при ее 7-дневной продолжительности. Так, в работе В. Пасечникова и соавт. (2004) больные с обострением язвенной болезни двенадцатиперстной кишки (92 человека) получали стандартную тройную терапию в течение 7 дней: Омез® (омепразол, «Д-р Редди`с Лабораторис Лтд.») в дозе 40 мг/сут в сочетании с амоксициллином (2000 мг/сут) и кларитромицином (1000 мг/сут). Затем была проведена рандомизация: пациенты 1-й группы продолжали получать омепразол (40 мг/сут) еще 2 нед; пациенты 2-й группы не получали никакого лечения. Эрадикация Hp была успешной у 82,6% больных (intention-to-treat; per protocol – 91,6%). В 1-й группе она составила 84,2% (intention-to-treat; per protocol – 92,8%), во 2-й – 82,2% (intention-to-treat; per protocol – 90,2%). Принципиальное значение имеет тот факт, что заживление язвы достигнуто у 91,5% больных, получавших монотерапию Омезом® после антихеликобактерного курса, и у 93,3% больных, получавших только недельный курс эрадикации Hp и никакого лечения в дальнейшем [4]. Таким образом, в данном исследовании 7-дневная стандартная тройная терапия способствовала достижению «целевого» процента эрадикации и более того – заживлению язвы даже без продолжения монотерапии омепразолом, что косвенно свидетельствует об эффективности антихеликобактерного курса.
Предпринимаются самые разные попытки повысить эффективность стандартной тройной терапии. Так, имеются данные о том, что сочетание антихеликобактерной схемы с пробиотиком приводит к повышению показателя эрадикации Hp и снижает частоту нежелательных явлений [10, 20]. Недавно в Москве было предпринято исследование с добавлением к стандартной тройной терапии пребиотика лактулозы (Нормазе). Омез® (40 мг/сут) в сочетании с амоксициллином (2000 мг/сут) и кларитромицином (1000 мг/сут) назначали на 12 дней и в одной группе больных сочетали с Нормазе. Эрадикация Hp в этой группе достигнута в 85% случаев, в другой – в 90% случаев (различие недостоверно). Несмотря на то что лактулоза не способствовала увеличению эрадикации Hp (процент все же превзошел «целевой» рубеж), она уменьшила частоту нарушений стула и метеоризм [3].
Терапия первой линии – стандартная тройная – не утратила актуальности для России. От точного соблюдения этого стандарта врачом и пациентом зависит успех эрадикации Нр. Чем выше ее показатель, тем меньше вероятность повторного лечения. Наиболее обоснованным способом повышения эффективности стандартной тройной терапии следует признать увеличение ее продолжительности до 14 дней [7, 11, 12].
Как надо планировать терапию второй линии при неудаче применения первой линии? Следует избегать назначения антибиотиков, которые пациент уже получал. Это – один из основополагающих (но не общепризнанных) постулатов, на которых строится такое планирование [7]. С точки зрения экспертов – авторов Маастрихтских рекомендаций III, наиболее правильным выбором в данной ситуации является квадротерапия с препаратом висмута [17]. К такому же выводу пришли и авторы Американских рекомендаций по диагностике и лечению Hp [7]. При анализе нескольких десятков клинических исследований с применением квадротерапии в качестве терапии второй линии средний показатель эрадикации микроорганизма составил 76% (60–100%) [15]. Данная схема доступна, относительно дешева и эффективна. К ее недостаткам относят большое число таблеток и капсул, которые приходится принимать ежедневно (до 18 штук в сутки), четырехкратный режим дозирования и сравнительно часто развивающиеся нежелательные явления [7].
В некоторых странах препараты висмута недоступны, и в качестве схем второй линии Маастрихтские рекомендации III предлагают варианты тройной терапии: ингибитор протонной помпы и амоксициллин, а в качестве антибактериального агента фигурируют тетрациклин или метронидазол [17]. В России нет систематизированного опыта использования таких схем, хотя имеются данные о весьма низкой эффективности 7-дневной тройной терапии: ингибитор протонной помпы+амоксициллин+метронидазол [1].
Как терапию третьей линии Маастрихтские рекомендации III позиционируют тройную терапию с представителем рифамицинов – рифабутином – и хинолонов – левофлоксацином.
В группе больных с неудавшимся курсом стандартной тройной терапии 12-дневное лечение ингибитором протонной помпы в сочетании с амоксициллином и рифабутином (150 мг) привело к эрадикации Hp в 91% случаев, причем доказанная резистентность к метронидазолу и кларитромицину не сказалась на результате [5]. Привлекательная сторона применения рифабутина – очень малая вероятность формирования резистентности к нему Hp (описана лишь в единичных случаях). Механизм формирования резистентности (перекрестной ко всем рифамицинам) – это точечная мутация rpoB-гена [18]. Маастрихтские рекомендации III настаивают на осторожном назначении этого антибиотика, так как его широкое применение может привести к селекции резистентных штаммов Mycobacteria.
Удобной в применении и достаточно эффективной кажется тройная терапия с левофлоксацином: ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут) и левофлоксацином (500 мг/сут). В качестве терапии второй линии после неудачной стандартной тройной терапии эта схема дает высокий результат [8]. Но с применением левофлоксацина связана проблема формирования резистентности к хинолонам вследствие целого ряда мутаций гена gyrA. В недавно опубликованном французском исследовании, в котором изучали большое число штаммов Hp, резистентность выявлена у 17,2% из них [6]. В работе итальянских авторов (с гораздо меньшим числом изученных штаммов) резистентность к левофлоксацину установлена в 30,3% случаев; показатель успешной эрадикации чувствительного к данному антибиотику микроорганизма – 75% против 33,3% при наличии резистентности [19].
В последних рекомендациях экспертов и обзорах по данной проблеме очень пристальное внимание уделяется новой схеме эрадикации Hp – последовательной терапии [7, 10, 11, 14]. Курс последовательной терапии занимает 10 дней: на первые 5 дней назначают ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут); затем в течение еще 5 дней – ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с кларитромицином (1000 мг/сут) и тинидазолом (1000 мг/сут). В итальянском исследовании [21] при последовательной терапии эрадикация Hp (intention-to-treat) составила 91 против 78% в группе сравнения (10-дневная стандартная тройная терапия). В группе пациентов, инфицированных штаммами, резистентными к кларитромицину, этот показатель достиг 89 против 29%.
Для исключения неудачи в эрадикации Hp стандартную тройную терапию следует назначать в полном объеме по дозам и при возможности – на 14 дней. Выбор схем лечения в случае неудачи терапии первой линии достаточно широк и позволяет учесть индивидуальные особенности пациента.
Какую схему эрадикации H. pylori выбрать при недавнем использовании макролидов?
Актуальность
Современные клинические рекомендации по лечению пациентов с инфекцией Helicobacter pylori (H. pylori) говорят, что следует избегать тройной терапии, содержащей кларитромицин у пациентов, которые ранее использовали макролиды. Доказательства этой рекомендации весьма скудные и влияние более раннего использования макролидов на эффективность квадротерапии остается не ясной.
Исследователи из США оценили влияние предыдущей терапии макролидами на эффективность эрадикационной терапии.
Методы
Исследователи проанализировали базу данных Clalit Health Services, включавшую пациентов в возрасте 25-60 лет, которые прошли впервые 13-С уреазный дыхательный тест между 2010 и 2015 годами.
Пациенты, которым ранее проводился поиск антигена хеликобактера в кале или гастроскопия были исключены из анализа.
Результаты
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Антихеликобактерные средства (ч. 2)
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты.
Преферанская Нина Германовна
Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Амоксициллин (табл./капс. 250 мг, 500 мг) — полусинтетический антибиотик пенициллинового ряда широкого спектра действия, с умеренной активностью в отношении H. pylori. Биодоступность составляет 70–80%, растворимая лекарственная форма — 90%. В тканях достигается терапевтическая концентрация. Амоксициллин характеризуется широким спектром антимикробного действия, низким уровнем резистентности, хорошей всасываемостью в желудочно–кишечном тракте, высокой биодоступностью и кислотостойкостью. Блокада амоксициллином пенициллиносвязывающих белков приводит к остановке роста и гибели микробной клетки.
Период полувыведения — 1–1,5 ч. Выводится на 50–70% почками в неизмененном виде путем канальцевой секреции (80%) и клубочковой фильтрации (20%), печенью — 10–20%. В небольшом количестве выделяется с грудным молоком.
Противопоказаниями служит повышенная чувствительность к амоксициллину, детский возраст до 3 лет.
Важно! Вызывает аллергические реакции, тошноту, нарушения со стороны крови и лимфатической системы очень редко, диарею, очень редко кристаллурию.
Кларитромицин (табл. 250 мг, 500 мг; капс. 250 мг) — относится к группе полусинтетических макролидов, оказывает дозозависимый бактериостатический эффект за счет блокирования белковых систем микробной клетки, взаимодействует с 50S рибосомальной субъединицей, подавляет синтез белка бактерий. Однако при достижении концентрации, которая в 2–3 раза превышает минимальную ингибирующую концентрацию, оказывает бактерицидное действие. Бактерицидное действие оказывает в отношении H. pylori, данная активность Кларитромицина выше при нейтральном pH, чем при кислом. Кларитромицин по эффективности в отношению к H. pylori превышает все другие активные субстанции этой группы. Обладает широким спектром действия и является одним из наиболее эффективных и распространенных макролидов. При приеме внутрь хорошо всасывается, концентрация его в тканях намного превышает сывороточную. Максимальное накопление также наблюдается в слизистой ЖКТ.
Препарат хорошо проникает внутрь клеток (моноцитов, макрофагов, фагоцитов), создавая высокие внутриклеточные концентрации. Высокие концентрации в очаге воспаления делают его средством выбора при H. pylori — ассоциированной патологии желудка и 12-перстной кишки. Благодаря лиофильности способен проникать в клетки и накапливаться в высоких концентрациях в слизистой оболочке желудка и двенадцатиперстной кишки, что имеет большое значение при эрадикации H. pylori.
Также нельзя не вспомнить позитивный эффект санации, присущий Кларитромицину. Широкий спектр активности данного антибиотика по отношению к грампозитивным и грамнегативным бактериям позволяет элиминировать патогенные и условно–патогенные возбудители из полости ЖКТ, колонизация которых наблюдается в условиях хеликобактер–ассоциированных заболеваний. Препарат обладает собственной противовоспалительной активностью, что обусловлено угнетением продукции провоспалительных цитокинов и стимуляцией синтеза противовоспалительных гуморальных факторов. Однако самым главным его качеством является способность разрушать матрикс биопленки. 99% микроорганизмов, к которым относится и H. pylori, существуют не в виде отдельных микроорганизмов, а в составе сложно организованных сообществ — биопленок, которые представляют собой совокупность бактериальных клеток, которые окружены внеклеточным матриксом, который имеет полисахаридную природу. Матрикс выполняет защитную функцию и часто является причиной устойчивости микроорганизмов к действию антибиотиков, резистентность бактерий в составе биопленки возрастает в 10–1000 раз.
Важно! При применении препарата могут возникать диарея, гиперчувствительность, аллергические реакции, часто сыпь, очень редко может вызвать анафилактоидную реакцию, дерматит, нарушение слуха, звон в ушах (частота неизвестна), а также снижение числа лейкоцитов и тромбоцитов.
Метронидазол (ТН «Трихопол», «Флагил», табл. 250 мг) — противопротозойный препарат, относится к производным 5-нитроимидазола, активен в отношении микроаэрофилов H. pylori. Механизм действия заключается в биохимическом восстановлении 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов и простейших. Препарат оказывает избирательный бактерицидный эффект в отношении тех микроорганизмов, ферментные системы которых способны восстанавливать нитрогруппу. Восстановленная 5-нитрогруппа взаимодействует с дезоксирибонуклеиновой кислотой (ДНК) клетки микроорганизмов. Возникает ингибирование тканевого дыхание, нарушается репликация ДНК, синтез нуклеиновых кислот и синтез белка, что ведет к гибели бактерий.
Метронидазол быстро проникает в ткани (легкие, почки, печень, кожу, желчь, спинномозговую жидкость, слюну, семенную жидкость, вагинальный секрет), в грудное молоко и проходит через плацентарный барьер. Около 30–60 % метронидазола метаболизируется путем гидроксилирования, окисления и глюкуронирования.
Препарат медленно выводится из организма, период полувыведения 8–10 час., при повторных введениях кумулирует. Проникает в ткани и жидкости организма, обеспечивая терапевтические концентрации.
Важно! Вызывает темное окрашивание мочи, металлический привкус во рту, тошноту, рвоту, диарею, могут возникать аллергические реакции: крапивница, кожная сыпь, нарушения со стороны иммунной системы: ангионевротический отек, анафилактический шок.
КОМПЛЕКСНОЕ ПРИМЕНЕНИЕ ЛС
Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной. В схемы терапии обязательно включают препараты висмута, химиотерапевтические препараты и ингибиторы протонной помпы (о последних препаратах мы писали в предыдущей статье).
Существуют стандартные схемы лечения двух-, трех- или четырехкомпонентной терапии в период лечения и обострения гастритов, язвенной болезни12-перстной кишки и желудка.
Используют:
√ БИТЕРАПИЮ: Ранитидин + Висмута цитрат (Пилорид);
Амоксициллин + Метронидазол (Хеликоцин);
√ ТРОЙНУЮ ТЕРАПИЮ:
Кларитромицин + Омепразол + Тинидазол (Пилобакт);
√ КВАДРОТЕРАПИЮ:
ЭРАДИКАЦИОННАЯ ТЕРАПИЯ H. pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы. Использование данных схем лечения значительно улучшает состояние больных и предупреждают развитие рецидивов.
Применение комбинированных лекарственных препаратов «Пилобакт», «Пилорид», «Хеликоцин» и др. значительно улучшает состояние больных и предупреждает развитие рецидивов. Как правило, терапия обязательно включает антисекреторные препараты, химиотерапевтические средства, гастропротекторы и препараты коллоидного висмута.
Интенсивную терапию проводят до достижения устойчивой ремиссии и отсутствия рецидивов у больных в течение 1,5–2 лет. При необходимости проводят профилактическую противорецидивную терапию. При применении комбинированной терапии необходимо убедиться в безопасном применении сочетанных препаратов, их переносимости и эффективности. При применении таких препаратов могут наблюдаться нежелательные побочные явления: тошнота, рвота (20%), диарея (10%), псевдомембранозный колит (1%), головокружение (2%), чувство жжения в ротовой полости, глотке, кандидоз (15%). Неэффективность лечения может быть обусловлена нарушением правил приема препаратов или развитием устойчивости бактерии к ним. Но несмотря на применение комбинированных схем лечения, у 10–20% пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя.
Повышают клиническую эффективность эрадикационной терапии комбинации ингибиторов протонной помпы (ИПП) с противомикробными препаратами.
Предполагается, что антисекреторные препараты из группы ИПП могут способствовать повышению концентрации антимикробных средств (Метронидазола и Кларитромицина) в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, а концентрация антибиотиков, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильную терапевтическую концентрацию антимикробных препаратов. При проведении эрадикационной антихеликобактерной терапии совместно с ИПП является одним из необходимых условий.
Успешность комбинированных схем терапии определяется во многом правильным выбором антибактериального средства и обеспечением постоянно высокого уровня эрадикации бактерии. Удлинение курса лечения до 10–14 дней также повышает эффективность эрадикации в среднем на 5%, а назначение высоких (двойных) доз ИПП позволяет дополнительно получить 8% показателей эффективности эрадикации H. pylori.
Именно два антибактериальных агента Амоксициллин и Кларитромицин определяют высокую эффективность в отношении микроорганизмов, которые находятся в фазе деления. Поддержка уровня рН в желудке выше чем 3,0 при помощи антисекреторных препаратов резко тормозит процесс деградации Кларитромицина (при рН 1,0 в желудочном соке Т½ составляет 1 час, а при рН 7,0 205 час.), что обеспечивает полноценную эрадикацию H. pylori. На протяжении последних 20 лет в основных схемах эрадикационной терапии сохраняется стойкая комбинация указанных антибиотиков, что связано с фармакокинетическими и фармакодинамическими особенностями данных препаратов.
Схема эрадикации бактерии H. pylori подбирается в индивидуальном порядке в зависимости от чувствительности бактерии и реакции организма на выбранные препараты. Продолжительность курса лечения определяется лечащим врачом. Самолечение такого опасного заболевания, как хеликобактериоз, категорически противопоказано.