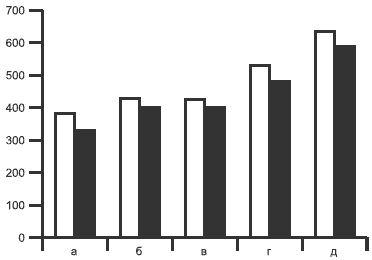Чем заменить мирапекс при паркинсоне
Мирапекс (прамипексол) в лечении недвигательных нарушений при болезни Паркинсона
Опубликовано в журнале:
«Журнал неврологии и психиатрии», № 5, 2008, с. 32-38
Кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова, Москва
Mirapex (pramipexole) in the treatment of non-motor disturbances in Parkinson’s disease
M.R. NODEL, N.N. YAKHNO
Изучали влияние агониста дофаминовых рецепторов — мирапекса на эмоциональные расстройства (тревогу, депрессию), когнитивные нарушения и расстройства сна у 66 пациентов с диагнозом болезни Паркинсона (БП). Мирапекс назначался дополнительно к препаратам леводопы и другим противопаркинсоническим средствам с дозой 3,5±1,1 мг в сутки в группе больных с эмоциональными и когнитивными нарушениями (36 пациентов) и 2,9±0,96 мг в сутки у пациентов с нарушениями сна (30 человек). Оценка состояния больных велась по роду клинических психометрических шкал и нейропсихологических жестов. Установили эффективность мирапекса в отношении всех изучавшихся расстройств.
Ключевые слова: болезнь Паркинсона, недвигательные нарушения, депрессия, тревога, расстройства сна, лечение, мирапекс.
The effect of the dopamine receptor antagonist mirapex on emotional disorders (anxiety, depression), cognitive disturbances and sleep disorders has been studied in 66 patients with Parkinson’s disease. Mirapex has been administered in addition to levodopa and other antiparkinsonian drugs in dosage 3,5±1,1 mg daily to 36 patients with emotional and cognitive disorders and in dosage 2,9±0,96 mg daily to 30 patients with sleep disorders. Patient’s state has been assessed using a number of psychometric scales and neuropsychological tests. The effectiveness of Mirapex in all disorders studied has been shown.
Key words: Parkinson’s disease, non-motor disturbances, depression, anxiety, sleep disorder, mirapex.
Основным методом лечения болезни Паркинсона (БП) в настоящее время продолжает оставаться фармакотерапия. Применение современных подходов лекарственной терапии позволяет значительным образом улучшить качество жизни пациентов с этим заболеванием.
Однако даже при использовании широкого арсенала дофаминергических препаратов нередко возникают проблемы разной степени сложности. Возможны затруднения при ведении пациентов с преимущественно дрожательной формой заболевания в связи с недостаточной эффективностью большинства дофаминергических средств в отношении тремора покоя. Одной из ведущих проблем терапии развернутых и поздних стадий заболевания является коррекция прогрессирующего сокращения периода действия препаратов леводопы (с возобновлением симптомов заболевания через 1,5—4 ч после приема очередной дозы), именуемого двигательными флюктуациями[1, 3].
Помимо основных двигательных симптомов, при БП отмечается широкий спектр недвигательных нарушений, которые нередко дезадаптируют пациентов в большей степени, чем основные двигательные расстройства. Недвигательными проявлениями БП, которые ухудшают качество жизни больных, являются эмоциональные, когнитивные расстройства, нарушения сна и бодрствования [35, 37]. Терапевтические подходы к их коррекции пока разработаны недостаточно. Назначение дополнительных препаратов для симптоматического контроля недвигательных нарушений в ряде случаев затруднительно, в частности, из-за нежелательности полифармакотерапии у пациентов старшей возрастной группы.
Решению многих сложных вопросов терапии БП способствует применение препарата прамипексола (мирапекс) —агониста дофаминовых рецепторов (АДР). Препарат отличается высокой интенсивностью и селективностью воздействия на D2 тип дофаминовых рецепторов, преимущественно на D3 подтип. Стимуляция D2 дофаминовых рецепторов базальных ганглиев обеспечивает эффективность препарата в отношении двигательных нарушений заболевания, а взаимодействие с D3-рецепторами лимбической системы, премоторных отделов коры мозга — положительное воздействие на нейропсихологические функции [9, 11]. Высокая селективность препарата в отношении дофаминовых рецепторов и низкий аффинитет к другим подтипам рецепторов лежат в основе хорошей переносимости лечения [12, 31].
Согласно данным контролируемых мультицентровых исследований, прамипексол значительно уменьшает тяжесть двигательных нарушений на любых стадиях БП [14, 18, 26, 28—32, 38]. По нашим данным и результатам работ зарубежных авторов [5, 8, 28, 32], одним из значимых достоинств препарата является высокая эффективность как в отношении брадикинезии и ригидности, так и тремора покоя. Выраженное положительное воздействие на тремор позволяет успешно применять препарат при ротации, устойчивом к другим дофаминергическим препаратам.
Применение мирапекса на ранних стадиях БП в качестве монотерапии достоверно снижает риск развития осложнений (флюктуаций и дискинезий) на более поздних этапах заболевания [30]. В связи с этим препарат рекомендуется назначать в качестве начальной терапии прежде всего пациентам молодого и среднего возраста, у которых эти осложнения развиваются раньше и протекают тяжелее [5, 21—22, 27]. Существенно, что эффективность монотерапии прамипексолом у пациентов на ранних стадиях БП сопоставима с препаратами леводопы [14]. Назначение препарата на развернутых стадиях заболевания позволяет эффективно корректировать флюктуации симптоматики. Наш опыт применения прамипексола, а также результаты, полученные другими исследователями, свидетельствуют о достоверном увеличении на фоне применения препарата продолжительности периода ограниченной двигательной активности — «включения» и сокращении ежедневного времени ограниченной двигательной активности — «выключения» (в среднем на 2,5 ч). При этом клинически значимо улучшаются двигательные функции и показатели повседневной активности пациентов [5, 8, 10, 31]. Наши наблюдения показали эффективность прамипексола в отношении так называемых «непредсказуемых» флюктуаций, когда эффект отдельных доз препаратов леводопы непредсказуем по времени начала и продолжительности [10]. Данный результат терапии прамипексолом обусловлен высокой биодоступностью и хорошими фармакокинетическими свойствами препарата. Иным важным показателем эффективности терапии препаратом является возможность коррекции дистонических спазмов, осложняющих течение развернутых стадий БП. На фоне приема прамипексола значительно снижается тяжесть ночных и утренних дистонических спазмов, дистонии дневных периодов «выключения» [5, 7, 8, 10]. Назначение прамипексола может способствовать уменьшению хореических дискинезий периодов «включения». Данный эффект достигается главным образом в результате снижения дозы препаратов леводопы. Умеренно выраженные дискинезии в отдельных случаях нивелируются без сопутствующего изменения дозы леводопы [7, 10].
Результаты многоцентрового российского исследования, основанного на длительном наблюдении за пациентами с БП на фоне терапии прамипексолом, показали долгосрочный эффект лечения. Так, было продемонстрировано, что у большей части пациентов, которым удалось подобрать адекватную дозу препарата, через год терапии состояние двигательных функций не ухудшилось. При этом большинству больных не потребовалось дополнительного назначения (либо повышения дозы) препаратов леводопы [10]. Данные результаты свидетельствуют о возможности поддержания хорошего эффекта лечения прамипексолом в течение продолжительного периода.
Несмотря на достаточный клинический опыт применения мирапекса при БП, эффективность препарата продолжает изучаться. В настоящее время в фокусе внимания исследователей находится такой аспект, как влияние терапии на недвигательные нарушения заболевания.
Целью настоящего исследования являлась оценка эффективности терапии прамипексолом (мирапексом) эмоциональных, когнитивных расстройств и нарушений сна у пациентов с БП.
Материал и методы
Динамика эмоциональных и когнитивных расстройств на фоне терапии оценивалась у 36 пациентов (группа 1), нарушений сна — у 30 больных (группа 2) с диагнозом БП. В исследование были включены пациенты БП без деменции. Основные демографические и анамнестические данные приведены в таблице.
Основные демографические и анамнестические данные пациентов, включенных в исследование
| Группа | Возраст, годы | Длительность БП, годы | Стадия (по Хен—Яр) | Длительность приема леводопы, годы | Суточная доза леводопы, мг |
| 1 | 58,4±8,2 | 6,8±3,2 | 2,5±0,4 | 2,7±3,0 | 347±30 |
| 2 | 56,2±6,02 | 4,9±2,16 | 2,6±06 | 2,5±0,5 | 352±14 |
Мирапекс назначался дополнительно к препаратам леводопы и другим противопаркинсоническим средствам в соответствии со стандартной схемой назначения препарата до достижения оптимальной по эффективности и переносимости дозы. Средняя суточная доза составила — 3,5±1,1 мг в группе 1 и 2,90±0,96 мг в группе 2.
Для оценки динамики двигательных нарушений применялись «Унифицированная шкала оценки БП» (УШОБП) и Шкала оценки тяжести моторных флюктуаций и дискинезий [17]. Для изучения влияния лечения на эмоциональные нарушения применялись опросник депрессии Бека и шкала оценки тревоги Спилбергера. Оценка динамики интегративных показателей когнитивных функций проводилась с помощью Шкалы комплексной оценки когнитивных функций Маттиса; нейродинамических показателей психической деятельности — методики оценки кратковременной слухоречевой памяти — запоминания пациентами 10 не связанных по смыслу слов с пяти предъявлений (метод А.Р. Лурия), ассоциативного теста (оценка количества грамматически и семантически опосредованных ассоциаций за 1 мин), пробы Шульте. Для изучения влияния терапии на регуляторные (лобные) функции применялись Висконсинский тест сортировки карточек (ВТСК), компьютерные тесты (разработка А. Курганского), позволяющие оценить селективное зрительное и слуховое внимание. Компьютерные тесты включали в себя измерение времени простой реакции, когда задача не содержала элемент выбора, а также измерение времени сложной реакции, оценивающее переключаемость внимания, т. е. реакцию выбора. Анализ динамики показателей когнитивной деятельности первоначально проводился в общей выборке, а затем в выделенных группах пациентов с различной степенью тяжести БП. Нарушения сна оценивались с помощью шкалы оценки сна при БП [16] и разработанного нами опросника для пациентов, направленного на уточнение степени тяжести нарушений засыпания и поддержания сна при БП, а также выявление основных (вторичных) причин их возникновения. Методики обследования пациентов с двигательными флюктуациями применялись в фазе «включения».
Достоверность динамики показателей шкал оценивалась путем статистического анализа отличий исходных показателей и показателей через 2 мес терапии с использованием Marginal Homogeneity Test. Для выявления взаимосвязи динамики двигательных и недвигательных нарушений применялся коэффициент корреляции Спирмена.
Результаты
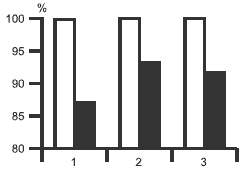
Терапия оказала статистически достоверное влияние на выраженность депрессии (pРис. 1. Показатели тревоги и депрессии до (светлые столбцы) и после (темные столбцы) терапии мирапексом.
Различия до и после лечения для всех показателей достоверны. 1 — депрессия, 2 — личностная тревога; 3 — реактивная тревога. По оси ординат — изменения показателей соответствующих шкал в % (за 100% приняты показатели до лечения).
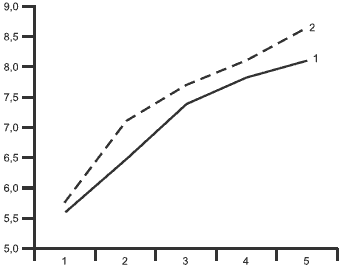
На фоне лечения мирапексом отмечена достоверная положительная динамика со стороны ряда показателей когнитивных функций, в результате чего выявлено небольшое, но достоверное (pРис. 2. Показатели заучивания слов до (кривая 1) и после (кривая 2) терапии мирапексом.
По оси абсцисс — число попыток; по оси ординат — среднее количество слов. Для второй попытки в общей группе 1 и подгруппе с флюктуация-ми p
Рис. 3. Количество ошибочных ответов в ВТСК (ось ординат) до и после лечения. Достоверность — p
Рис. 4. Количество персеверативных ошибок в ВТСК (ось ординат) до и после лечения. Достоверность — p
Рис. 5. Показатели психомоторной реакции до (светлые столбцы) и после (темные столбцы) лечения.
По оси ординат — среднее время реакции, мс. По оси абсцисс: а — показатели времени простой зрительной реакции; б и в — показатели времени сложной зрительной реакции; г и д — показатели времени сложной слуховой реакции. Достоверность — p
Таким образом, в результате терапии была выявлена достоверная положительная динамика со стороны когнитивных функций в виде улучшения показателей внимания и концептуализации; уменьшения аспонтанности. В ходе лечения выявлено повышение речевой активности, вероятно, вследствие увеличения скорости психических процессов, улучшения внимания, повышения инициативы, уменьшения истощаемости. Помимо этого, отмечено уменьшение персеверативных и ошибочных ответов в ВТСК, что демонстрирует улучшение процессов мышления (способностей к переключению с одной стратегии на другую, поддержке эффективной стратегии). Сокращение времени простой реакции является отражением, вероятно, повышения внимания, а изменение времени сложной реакции обусловлено положительной динамикой со стороны более сложных когнитивных процессов, связанных с усвоением двигательной программы, планированием и выбором стратегии моторного ответа.
Анализ динамики когнитивных показателей в подгруппах пациентов с различной степенью тяжести БП выявил существенные различия в эффективности терапии. Так, приведенная выше положительная динамика была характерна для пациентов, получающих препараты леводопы с развитием двигательных флюктуаций. При анализе эффективности лечения в отношении когнитивных функций в каждой из подгрупп с более ранними стадиями болезни статистически значимой динамики получено не было. Возможно это было обусловлено относительной малочисленностью подгрупп. В общей группе пациентов без двигательных флюктуаций была выявлена значимая положительная динамика в виде улучшения внимания и уменьшения трудностей вхождения в задание (сокращение времени выполнения первого теста Шульте и заучивания большего количества слов в исследовании слухоречевой памяти при первом предъявлении задания) (pТаким образом, приведенные данные о динамике состояния когнитивных функций свидетельствуют о положительном влиянии терапии мирапексом на нейродинамические нарушения психической деятельности у пациентов на разных этапах БП. Эффект заключался в улучшении внимания, умственной работоспособности, уменьшении трудностей вхождения в задание. Наиболее существенным оказалось влияние терапии на когнитивные функции у пациентов с двигательными флюктуациями. Помимо улучшения нейродинамических функций, была выявлена значимая динамика со стороны регуляторных нарушений психической деятельности в виде уменьшения трудностей планирования; улучшения выбора, поддержания и коррекции правильной стратегии мышления.
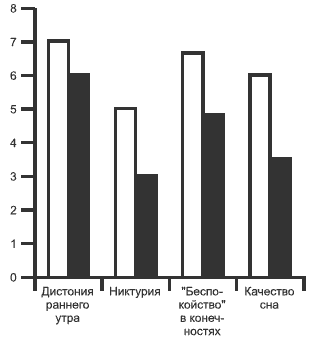
На фоне проводимой терапии значительно улучшилось качество сна пациентов с БП. В наибольшей мере терапия мирапексом повлияла на нарушения засыпания (64,7 и 44,1% соответственно) и поддержания сна (в виде сокращения числа ночных пробуждений — 73,5 и 55,9% соответственно), в меньшей степени — на частоту ранних пробуждений (67,6 и 61,8% соответственно). Анализ влияния терапии на показатели шкалы оценки сна выявил положительную динамику в виде общего улучшения качества сна, уменьшения тяжести утренних дистонических спазмов, ощущения «беспокойства» в конечностях; никтурии (pРис. 6. Динамика частоты нарушений сна.
Обсуждение
Полученные данные об эффективности терапии мирапексом депрессии у пациентов с БП подтверждается результатами наших более ранних наблюдений, а также данными ряда других открытых и контролируемых клинических исследований [5, 6, 8, 13, 25, 33]. Антидепрессивный эффект прамипексола связывают с воздействием препарата на D3-рецепторы мезолимбической системы [11]. Отсутствие столь заметного воздействия терапии на тревожные расстройства, вероятно, обусловлено большей значимостью недофаминергических систем мозга в генезе тревоги. Первоначально антидепрессивный эффект прамипексола был продемонстрирован в психиатрической практике, а затем отмечен при лечении пациентов с БП [17, 39]. В открытом исследовании M. Lemke и соавт. [25] на примере наблюдения 657 пациентов с БП, выявлена эффективность прамипексола не только в отношении депрессии, но и ангедонии — уменьшения способности испытывать удовольствие. Данный симптом обнаруживается у 79,7% пациентов БП с депрессией, являясь одним из ее ведущих проявлений. Следует заметить, что антидепрессивный эффект не является специфичным для всего класса агонистов дофаминовых рецепторов. Так, в результате сравнительного рандомизированного исследования прамипексола и перголида было продемонстрировано антидепрессивное действие только прамипексола [33]. Представляют интерес результаты клинических испытаний, свидетельствующие о сопоставимости антидепрессивного действия прамипексола с эффектом антидепрессантов — ингибиторов обратного захвата серотонина [13, 17]. В рандомизированном (с параллельными группами) исследовании P. Barone и соавт. [13] сравнивал антидепрессивный эффект прамипексола и сертралина у пациентов БП. Для исключения взаимосвязи антидепрессивного эффекта терапии с коррекцией двигательных осложнений заболевания, в исследование включались пациенты без проявлений двигательных флюктуаций. Антидепрессивный эффект в виде улучшения показателей (на 50% и более) по шкале депрессии Гамильтона был выявлен у 69,7% пациентов, получавших прамипексол, и лишь у 48,5%, принимавших сертралин. Отсутствие корреляции динамики двигательных симптомов и депрессии на фоне приема прамипексола свидетельствовало о самостоятельном антидепрессивном эффекте препарата, не связанном с его антипаркинсоническим действием. Таким образом, результаты этого исследования указывают на возможный приоритет прамипексола перед ингибиторами обратного захвата серотонина в отношении коррекции проявлений депрессии при БП. Следует отметить, что в настоящее время для подтверждения антидепрессивного эффекта препарата с позиций доказательной медицины проводится контролируемое (двойное слепое) международное мультицентровое исследование эффективности прамипексола у пациентов с БП и депрессией.
Депрессия выявляется более чем у половины пациентов с БП и в ряде случаев ухудшает качество жизни больных в большей мере, чем двигательные расстройства [37]. Поэтому своевременная диагностика и адекватная терапия данного синдрома очевидна. Однако разработка эффективной и безопасной тактики терапии депрессии при БП нередко затруднительна. Прием трициклических антидепрессантов нередко ограничен у пожилых пациентов в связи с соматическими противопоказаниями. Кроме того, антихолинергический эффект трициклических антидепрессантов может способствовать усугублению когнитивных нарушений у пациентов с БП. Ингибиторы обратного захвата серотонина в отдельных случаях могут усиливать тремор и другие симптомы паркинсонизма [33]. Поэтому возможность коррекции эмоциональных нарушений на фоне приема мирапекса без дополнительного назначения антидепрессантов можно считать важным достоинством препарата.
Когнитивные нарушения той или иной степени тяжести наблюдаются фактически у всех пациентов БП. По мере прогрессирования заболевания тяжесть когнитивных нарушений нарастает, достигая в ряде случаев степени деменции, становясь при этом одним из главных факторов дезадаптации пациентов [37]. При этом данные о влиянии дофаминергической терапии на когнитивные функции пациентов с БП довольно противоречивы. Во многом эти противоречия объясняются различными подходами к подбору пациентов и методик их обследования. В работе О.С. Левина и соавт. [6] оценивалось долговременное влияние прамипексола на когнитивные функции у пациентов с разными стадиями БП. В ходе исследования было выявлено улучшение показателей выполнения нейропсихологических тестов, оценивающих, главным образом регуляторные, зрительно-пространственные и нейродинамические функции. Улучшение внимания и других нейродинамических функций, увеличение речевой активности были выявлены лишь у пациентов с ранней стадией заболевания. Эти результаты во многом согласуются с данными других работ, оценивающих эффект дофаминергических препаратов у пациентов, ранее не получавших противопаркинсоническую терапию [2, 4, 24]. Наши данные свидетельствуют о возможности положительного влияния терапии прамипексолом на нейродинамические нарушения у пациентов на разных этапах БП. Дискуссионным является вопрос о влиянии дофаминергической терапии у пациентов на развернутых стадиях болезни, имеющих колебания двигательной активности (смены периодов «включения» и «выключения»). Так, имеются свидетельства негативного влияния короткодействующих препаратов леводопы на когнитивные функции у пациентов с двигательными флюктуациями в периоде «включения» [23]. Одним из объяснений данного факта является денервационная гиперчувствительность дофаминовых рецепторов, связанная с воздействием избыточного количества дофамина (образованного из леводопы [19]) на рецепторы префронтальной коры, лимбической системы в периоде «включения». Положительное влияние терапии на регуляторные нарушения психической деятельности, выявленные в нашей работе, свидетельствует о восстановлении «процедурной мобилизации» или избирательной активации лобных долей мозга у пациентов с двигательными флюктуациями в периоде «включения». Полученные результаты могут являться косвенным свидетельством того, что применение мирапекса — препарата с длительным периодом полувыведения из плазмы, приводит к более физиологичной продолжительной дофаминергической стимуляции рецепторов мозга, что в свою очередь и оказывает положительное влияние на показатели когнитивной деятельности у пациентов с флюктуациями.
Нарушения сна, как и депрессия, встречаются у большинства пациентов с БП и существенно влияют на их повседневную активность и качество жизни [35]. Нарушения сна при БП имеют мультифакториальную этиологию и комплексную патофизиологию. В патогенез инсомнии вовлечены дегенеративные изменения центральных регулирующих сон систем, а также двигательные, сенсорные, нервно-психические расстройства, связанные с БП [20]. Подходы к терапии инсомнии при БП нуждаются в дальнейшей разработке. Во многом дискуссионным является вопрос о влиянии противопаркинсонической терапии на показатели сна. Известно, что дофаминергические препараты могут нарушать цикл сон—бодрствование. Отмечено, что эффект этих лекарственных средств в отношении сна отчасти является дозозависимым. В отдельных случаях воздействие дофаминергической терапии проявляется инсомнией или, наоборот, повышенной сонливостью [20]. С другой стороны, показано, что применение дофаминергических препаратов длительного действия позволяет улучшить сон благодаря коррекции ночной акинезии, синдрома беспокойных ног и периодических движений во сне [15]. Терапия прамипексолом способствует улучшению качества сна у пациентов с синдромом «беспокойных ног» [34]. Выявлен умеренный эффект препарата в отношении нарушений поведения во сне с быстрыми движениями глаз (БДГ). При этом прамипексол увеличивает латенцию появления фазы сна с БДГ и сокращает ее длительность [36]. Наши данные об улучшении качества сна на фоне терапии могут служить дополнительным аргументом для назначения препарата пациентам БП с инсомнией.
Обобщая опыт применения препарата, можно заключить, что терапия мирапексом (прамипексолом) позволяет эффективно решать многие сложные вопросы лечения пациентов с БП путем коррекции широкого спектра не только двигательных, но и недвигательных симптомов заболевания.
Стандарты лечения болезни Паркинсона
Статья основана на положениях «Протокола ведения пациентов с болезнью Паркинсона», разработанного группой экспертов, в которую вошли ведущие отечественные специалисты по болезни Паркинсона (БП), и утвержденного Минздравсоцразвития РФ в 2005 г. Положения Протокола основаны на анализе в соответствии с принципами доказательной медицины контролируемых исследований, проведенных в нашей стране и за рубежом [1, 2, 4–7, 9–11, 13, 15], и в целом соответствуют недавно опубликованным рекомендациям по лечению БП Европейской федерации неврологических обществ [8] и Американской академии неврологии [12, 14, 16]. Текст Протокола опубликован в журнале «Проблемы стандартизации в здравоохранении» [3]. В Протоколе используется следующая шкала убедительности доказательств данных: А — доказательства убедительны (есть веские доказательства предлагаемому утверждению), B — относительная убедительность доказательств (есть достаточно доказательств в пользу того, чтобы рекомендовать данное предложение), C — достаточных доказательств нет (имеющиеся доказательства недостаточны для вынесения рекомендаций, но они могут быть даны с учетом иных обстоятельств).
Начальный этап лечения
Общие принципы. Поскольку на данный момент нейропротекторный потенциал ни одного средства при БП убедительно не доказан, лечение основывается главным образом на симптоматическом действии противопаркинсонических средств, которые принято назначать в том случае, когда хотя бы одно из проявлений заболевания приводит к ограничению жизнедеятельности пациента.
Лечение начинается с монотерапии. Если препарат оказался неэффективным (нет регресса симптоматики в течение месяца после достижения оптимальной дозы) или плохо переносится, его заменяют средством той же или другой фармакологической группы. При выборе препарата и его дозы следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющему поддерживать бытовую и профессиональную активность. При частичном эффекте (недостаточное улучшение функций) к принимаемому препарату последовательно добавляют лекарственные средства иной фармакологической группы.
Принципы выбора противопаркинсонического препарата. Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента. Помимо достижения оптимального симптоматического контроля, выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (табл.).
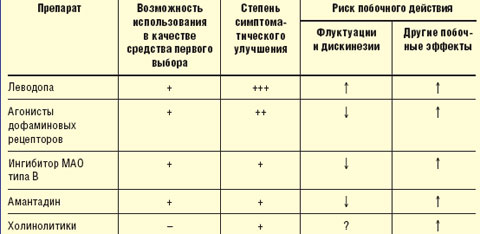 |
| Таблица Выбор препарата для начального лечения болезни Паркинсона |
У лиц моложе 50 лет при умеренной выраженности двигательных нарушений в отсутствие выраженных когнитивных нарушений назначают один из следующих препаратов: агонист дофаминовых рецепторов, ингибитор моноаминооксидазы (МАО) типа В (селегилин), амантадин, антихолинергические средства (тригексифенидил, бипериден).
Лечение предпочтительнее начинать с одного из агонистов дофаминовых рецепторов, которые хотя и не позволяют достичь того же уровня симптоматического контроля, как препараты леводопы, способны обеспечить поддержание уровня жизнедеятельности пациентов в течение длительного времени, отсрочить назначение леводопы и тем самым развитие осложнений долгосрочной терапии леводопой (уровень А). Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности, и избежать побочного действия (уровень С). Неэрголиновые агонисты (пирибедил, прамипексол) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин).
Лечение пирибедилом начинают с дозы 50 мг 1 раз в день (днем или вечером — после основного приема пищи), в дальнейшем суточную дозу увеличивают на 50 мг 1–2 раза в неделю — до достижения необходимого эффекта, но не выше 250 мг/сут (50 мг 5 раз в день). Лечение прамипексолом начинают с дозы 0,125 мг 3 раза в день (после еды), затем еженедельно дозу последовательно увеличивают до 0,25 мг 3 раза в день, 0,5 мг 3 раза в день, при недостаточном эффекте — до 1 мг 3 раза в день и 1,5 мг 3 раза в день (максимальная доза — 4,5 мг/сут). Лечение бромокриптином начинают с дозы 2,5 мг 3 раза в день, в дальнейшем ее еженедельно последовательно увеличивают до 5 мг 3 раза в день, 7,5 мг 3 раза в день, 10 мг 3 раза в день, 10 мг 4 раза в день (максимальная доза — 40 мг/сут). При появлении тошноты в период титрования назначают домперидон. При неэффективности или плохой переносимости одного из агонистов дофаминовых рецепторов может быть испробован другой агонист дофаминовых рецепторов или препарат другой фармакологической группы (уровень С).
Антихолинергические средства показаны при наличии выраженного тремора покоя и сохранности нейропсихологических функций (уровень С). Хотя у этой категории лиц они могут применяться в качестве средств первого выбора, более целесообразно их добавление к агонисту дофаминовых рецепторов, если последний не обеспечивает достаточного подавления тремора. Лечение тригексифенидилом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут). Лечение бипериденом начинают с дозы 1 мг 2 раза в день, в дальнейшем дозу не чаще чем 1 раз в неделю последовательно увеличивают до 2 мг 2 раза в день, 2 мг 3 раза в день, 2 мг 4 раза в день (максимальная доза — 10 мг/сут).
Лечение амантадином начинают с дозы 100 мг 2 раза в день, при недостаточном эффекте она может быть увеличена до 100 мг 3 раза в день, в дальнейшем — до 100 мг 4–5 раз в день (максимальная доза — 500 мг/сут). Лечение селегилином начинают с дозы 5 мг утром, через 1 нед ее увеличивают до 5 мг 2 раза в день.
Если указанные препараты и их комбинация в максимально переносимых дозах не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат, содержащий леводопу (стандартный препарат или препарат с замедленным высвобождением) в минимальной эффективной дозе (уровень А).
У лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности нейропсихологических функций лечение начинают с одного из агонистов дофаминовых рецепторов. Если максимальные переносимые дозы одного из этих препаратов не обеспечивают достаточного функционального улучшения, к нему последовательно добавляют по указанным выше схемам один из следующих препаратов: селегилин, амантадин или холинолитик (при наличии тремора покоя). Больным после 65 лет тригексифенидил и другие антихолинергические средства не следует назначать из-за риска ухудшения познавательных функций и других побочных эффектов (уровень В). При недостаточной эффективности к комбинации из двух-трех указанных выше препаратов добавляют средство, содержащее леводопу, в минимальной эффективной дозе (200–400 мг/сут).
У лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и/или возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта, лечение начинают с препаратов, содержащих леводопу. Для лечения могут быть использованы как стандартные препараты, так и препараты с замедленным высвобождением. Если небольшие дозы леводопы (200–400 мг/сут) не обеспечивают необходимого улучшения, к ним последовательно добавляют по указанным выше схемам следующие препараты: агонист дофаминовых рецепторов, амантадин, селегилин.
У лиц старше 70 лет лечение следует начинать со средств, содержащих леводопу. Для лечения могут применяться как стандартные препараты, содержащие леводопу, так и препараты с замедленным высвобождением (уровень В).
Другие меры. Поскольку дофаминергические препараты у больных с глаукомой могут повысить внутриглазное давление, перед их назначением у всех пациентов старше 40 лет следует измерить внутриглазное давление. В дальнейшем его измерение проводят после подбора противопаркинсонической терапии (обычно на втором месяце лечения) либо при появлении жалоб на ухудшение зрения. Больным с запорами и другими проявлениями нарушения моторики желудочно-кишечного тракта показана диета с высоким содержанием пищевых волокон (уровень С); при снижении массы тела показана диета с повышенным содержанием белковых продуктов, а также продуктов, богатых витаминами и микроэлементами (уровень С); для подбора диеты назначается консультация врача-диетолога.
При ограничении подвижности и наличии скелетно-мышечных болей показано проведение лечебной физкультуры, включающей упражнение на растяжение мышц, поддержание гибкости и тренировку координации движений (уровень С), физиотерапии (уровень С), рефлексотерапии (уровень С); в связи с этим назначаются консультации врача лечебной физкультуры, физиотерапевта, рефлексотерапевта. Больному рекомендуется посильная двигательная активность с ежедневными занятиями лечебной гимнастикой, по показаниям — занятия с логопедом. В зависимости от тяжести двигательных расстройств больной может продолжать прежнюю работу, перейти на более легкую, изменить условия работы (неполный рабочий день). При стойкой утрате трудоспособности больному определяется группа инвалидности (вопросы трудоспособности определяются МСЭК).
Алгоритм лечения БП представлен на рисунке.
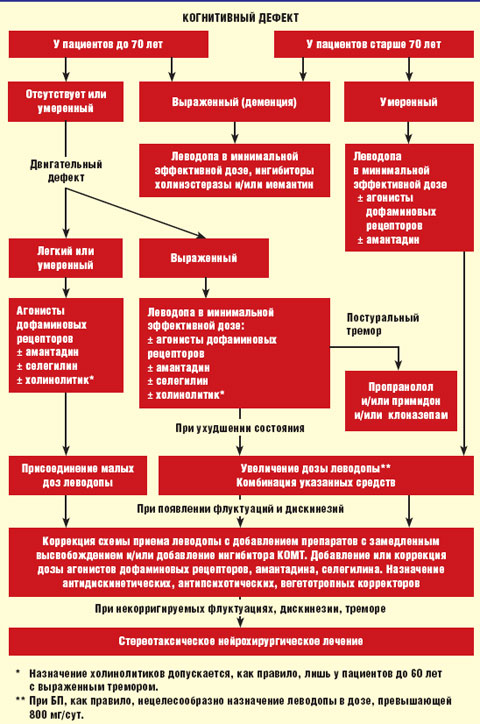 |
| Рисунок. Алгоритм лечения болезни Паркинсона |
Дальнейшая терапия при стабильной реакции на противопаркинсонические средства
Общие принципы лечения. Индивидуальную эффективную дозу препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности или поддержания повседневной активности, и избежать побочного действия. При необходимости для усиления эффекта противопаркинсонической терапии проводятся следующие мероприятия.
Особенности лечения больных с тремором. При выраженном дрожательном гиперкинезе, нарушающем функции конечностей, особенно если он имеет постурально-кинетический компонент, к противопаркинсоническим средствам при отсутствии противопоказаний добавляют пропранолол (уровень В). Лечение пропранололом начинают с дозы 10 мг 3 раза в день. В дальнейшем дозу последовательно увеличивают не чаще чем 1 раз в неделю до 20 мг 3 раза в день, 40 мг 3 раза в день, 40 мг 4 раза в день (максимально до 320 мг/сут в 3–4 приема). При наличии противопоказаний к применению пропранолола (брадиаритмия, сахарный диабет, заболевания периферических сосудов), непереносимости или неэффективности препарата назначают примидон (уровень С). Первоначально препарат назначают в дозе 31,25 мг на ночь, затем дозу последовательно увеличивают 1 раз в 7–10 дней до 62,5 мг на ночь, 125 мг на ночь, 250 мг на ночь (максимально до 750 мг/сут в 2–4 приема или однократно на ночь).
Если пропранолол вызвал недостаточное улучшение, то к нему добавляют примидон в указанных дозах (уровень С). Клоназепам может быть добавлен к пропранололу или примидону при наличии выраженного кинетического компонента тремора (уровень С). Клоназепам первоначально назначают в дозе 0,5 мг на ночь, затем 1 раз в 7–10 дней дозу последовательно увеличивают до 0,5 мг 2 раза в день, 1 мг 2 раза в день, 2 мг 2 раза в день, пока не будет достигнуто существенное ослабление дрожания. При выраженном треморе может быть также использован клозапин в дозе 12,5–50 мг/сут (уровень В).
Особенности лечения больных с аффективными нарушениями. При наличии аффективных нарушений назначается консультация врача-психотерапевта для решения вопроса о целесообразности проведения аутогенной тренировки или других методов психотерапии. При наличии депрессии у больных без выраженных нарушений познавательных функций лечение следует начинать с одного из агонистов дофаминовых рецепторов (прамипексол, пирибедил), способных корригировать легкую депрессивную симптоматику, или их сочетания с малыми дозами леводопы (уровень В). При выраженной депрессивной симптоматике после консультации с психиатром показано назначение одного из следующих антидепрессантов: амитриптилин (25–150 мг на ночь), имипрамин (50–150 мг/сут), циталопрам (20–40 мг/сут), флуоксетин (20–40 мг/сут), сертралин (50–100 мг/сут), пароксетин (10–20 мг/сут), миртазапин (7,5–30 мг/сут), венлафаксин (75–225 мг/сут). После получения лечебного эффекта продолжительность назначения антидепрессанта в эффективной дозе должна быть не менее 6 мес (уровень С).
Продолжение читайте в следующем номере.
О. С. Левин, доктор медицинских наук, профессор
РМАПО, Центр экстрапирамидных заболеваний, Москва