Формирование белковых молекул и их транспортировка осуществляется чем
Формирования белков молекул и их транспортировка осуществляется?
Формирования белков молекул и их транспортировка осуществляется.
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями.
Легко представить, что количество аминокислот может быть различно : от минимум двух до любых разумных величин.
Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называетсяпептид ; если от 10 до 40 аминокислот –полипептид, если более 40 аминокислот –белок.
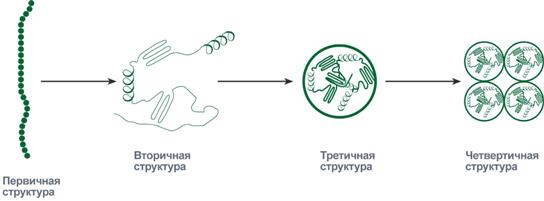
Линейная молекула белка, образующаяся при соединении аминокислот в цепь, являетсяпервичной структурой.
Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот).
Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы : ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя.
Формы молекулы, создаваемые при свертывании, последовательно могут приниматьвторичный, третичныйичетвертичный уровеньорганизации.
Вспомните строение молекул белка?
Вспомните строение молекул белка.
Какие химические вещества участвуют в создании молекул белка?
Почему этот процесс называют биосинтезом?
Где осуществляется транскрипция?
Где осуществляется транскрипция?
Где осуществляется трансляция?
Какие молекулы участвуют в процессе синтеза белка?
Где происходит синтез белка и как осуществляется биосинтез белка?
Где происходит синтез белка и как осуществляется биосинтез белка?
Чем обусловлена многофункциональность молекул белка?
Чем обусловлена многофункциональность молекул белка?
В митохондриях происходит 1)формирование первичной структуры белка 2)формирование третичной структуры белка 3)клеточное дыхание и запасание энергии 4)накопление синтезированных клеткой веществ?
В митохондриях происходит 1)формирование первичной структуры белка 2)формирование третичной структуры белка 3)клеточное дыхание и запасание энергии 4)накопление синтезированных клеткой веществ.
Как осуществляется одомашнивания диких животных на первых этапах формирования человеческого общества?
Как осуществляется одомашнивания диких животных на первых этапах формирования человеческого общества.
1. В митохондриях происходит : а) формирование молекул белка б) формирование жирок в) клеточное дыхание с запасанием энергии г) накопление синтезированных клеток веществ 2?
1. В митохондриях происходит : а) формирование молекул белка б) формирование жирок в) клеточное дыхание с запасанием энергии г) накопление синтезированных клеток веществ 2.
Мономерами белка являются : а) нуклеотиды б)моносахариды в)аминокислоты г) глицерин.
В процессе пищеварения молекулы белков распадаются на молекулы?
В процессе пищеварения молекулы белков распадаются на молекулы?
Как из аминокислот образуются молекулы белка?
Как из аминокислот образуются молекулы белка?
Что называют пластическим обменом в клетке?
Что называют пластическим обменом в клетке?
Как осуществляется биосинтез белка?
К многолетним травам относится Д) пырей ползучий.
Чтобы смотреть не только прямо и все время двигать шеей, которая в скором времени по любому устанет.
Размножение млекопитающих давольно важно для природы и окружающей среды. Млекопитающие есть полезные и те которые приносят вред другим.
12) а 13)бы 14)б 15) б 17) б 18)в 19)б.
Формирование молекулы белка



Защитная
Сократительная
Резервная
Транспортная
Рецепторная
Гормональная
Ферментативная
Структурная
Функции белков
БЕЛКИ.
Определение Ф.Энгельса «Жизнь есть способ существования белковых тел» до сих пор, по прошествии почти полутора веков, не потеряло своей правильности и актуальности.
В основе структуры любого организма и всех протекающих в нем жизненных реакций лежат белки. Любые нарушения в этих белках приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин(поверхностный, основной белок цитоскелета эритроцитов), гликофорин(интегральный, фиксирует спектрин на поверхности),
К данной функции можно отнести участие в создании органелл – рибосомы.
Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулини глюкагон.
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканейи печени.
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями.
Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Линейная молекула белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот).
Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровеньорганизации.
Схематичное представление последовательности
укладки белков в четвертичную структуру
На уровне вторичной структуры белковые «бусы» способны укладываться в виде спирали(подобно дверной пружине) и в виде складчатого слоя, когда «бусы» уложены змейкой и удаленные части бус оказываются рядом.
Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка.
Некоторые белковые глобулы существуют и выполняют свою функцию не поодиночке, а группами по две, три и более штук. Такие группы образуют четвертичную структуру белка.
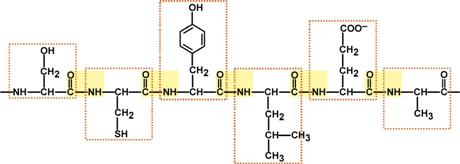
Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка.
Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизмбелков.
Например, при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (HbS) – такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и при прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу.
Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичнойи четвертичнойструктур.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала.
Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
Формирование молекулы белка



Защитная
Сократительная
Резервная
Транспортная
Рецепторная
Гормональная
Ферментативная
Структурная
Функции белков
БЕЛКИ.
Определение Ф.Энгельса «Жизнь есть способ существования белковых тел» до сих пор, по прошествии почти полутора веков, не потеряло своей правильности и актуальности.
В основе структуры любого организма и всех протекающих в нем жизненных реакций лежат белки. Любые нарушения в этих белках приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Белки формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин(поверхностный, основной белок цитоскелета эритроцитов), гликофорин(интегральный, фиксирует спектрин на поверхности),
К данной функции можно отнести участие в создании органелл – рибосомы.
Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулини глюкагон.
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканейи печени.
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями.
Легко представить, что количество аминокислот может быть различно: от минимум двух до любых разумных величин. Биохимики условились считать, что если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Линейная молекула белка, образующаяся при соединении аминокислот в цепь, является первичной структурой. Образно ее можно сравнить с обычной нитью на которую навешено до нескольких сотен бусинок двадцати различных цветов (по числу аминокислот).
Последовательность и соотношение аминокислот в первичной структуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формировать те или иные связи внутри себя. Формы молекулы, создаваемые при свертывании, последовательно могут принимать вторичный, третичный и четвертичный уровеньорганизации.
Схематичное представление последовательности
укладки белков в четвертичную структуру
На уровне вторичной структуры белковые «бусы» способны укладываться в виде спирали(подобно дверной пружине) и в виде складчатого слоя, когда «бусы» уложены змейкой и удаленные части бус оказываются рядом.
Укладка белка во вторичную структуру плавно переходит к формированию третичной структуры. Это отдельные глобулы, в которых белок уложен компактно, в виде трехмерного клубка.
Некоторые белковые глобулы существуют и выполняют свою функцию не поодиночке, а группами по две, три и более штук. Такие группы образуют четвертичную структуру белка.
Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется первичной структурой белка.
Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка.
Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то новый белок может передаться по наследству и остаться в популяции. В результате возникают новые белки с похожими функциями. Такое явление называется полиморфизмбелков.
Например, при серповидноклеточной анемии в шестом положении β-цепи гемоглобина происходит замена глутаминовой кислоты на валин. Это приводит к синтезу гемоглобина S (HbS) – такого гемоглобина, который в дезоксиформе полимеризуется и образует кристаллы. В результате эритроциты деформируются, приобретают форму серпа (банана), теряют эластичность и при прохождении через капилляры разрушаются. Это в итоге приводит к снижению оксигенации тканей и их некрозу.
Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичнойи четвертичнойструктур.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей. Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала.
Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: α-спираль (α-структура) и β-складчатый слой (β-структура). В одном белке, как правило, присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
Общая информация о биосинтезе белка: значение, код ДНК, процесс считывания и передачи информации
Общая информация о биосинтезе белка
Значение биосинтеза белка в клетке
Процесс биосинтез белка — наиболее значимая реакция пластического обмена. Способность синтезировать белок есть у всех клеток живых организмов: сложных и простых, грибов, растений и животных. Клетка содержит несколько тысяч различных белков. При этом, для каждого вида клеток характерны специфические белки.
Способность к синтезу собственных уникальных белков является наследственной и сохраняется на протяжении всей жизни организма. Биосинтез белков происходит наиболее интенсивно, когда клетки активно растут и развиваются.
Что такое биосинтез белка?
Процессом синтеза белка называется — процесс, состоящий из множества стадий, на которых происходит синтез белковой макромолекулы и последующее созревание (формирование) белка, и происходящий в живых организмах.
Фотосинтез связан с большими энергетическими затратами. Благодаря ему происходит обеспечение клеток так называемым строительным материалом, биологическими катализаторами (ферментами), регуляторами и средствами защиты организма.
Каково значение белков в клетке? Значение белков неоценимо. Для этого рассмотрим, что такое биосинтез подробнее.
Код ДНК
Определение места синтеза белковых макромолекул — наивысшее достижение молекулярной биологии. ДНК играет ключевую роль в определении структуры синтезируемого белка. Молекула ДНК содержит информацию о первичной структуре молекулы белка.
Геном — часть молекулы ДНК, содержащая информацию о первичной структуре одного белка.
Генетический код — единая для всех живых организмов система сохранения полной наследственной информации.
Если говорить о структуре, то она представляет собой определенную последовательность нуклеотидов в молекулах нуклеиновых кислот. Эта последовательность задает последовательность введения аминокислотных остатков в полипептидную цепь в ходе ее синтеза.
Согласно исследованиям ученых, каждая аминокислота в полипептидной цепи кодируется последовательностью, которая состоит из 3 нуклеотидов (это триплет нуклеотидов).
Всего выделяют 20 основных аминокислот. Каждая аминокислота имеет способность кодироваться несколькими разными триплетами.
Матрица — молекула ДНК, которая содержит информацию.
Процесс считывания и передачи информации
Расположение молекул ДНК — ядро клетки. Также они могут находиться в пластидах и митохондриях. В определенный момент происходит деспирализация молекулы ДНК и расхождение ее параллельных цепей.
В соответствии с принципом комплементарности, на этих цепях происходит синтез небольших молекул и-РНК (информационной РНК). Это транскрипция или считывание.
Молекула и-РНК, синтезированная таким образом, направляется к месту синтеза белка.
Трансляция — процесс переноса и-РНК из ядра к месту синтеза белка.
Механизм биосинтеза белка
Синтез белковых молекул осуществляется на мембранах ЭПС (эндоплазматическая сеть). Рибосома является органеллой, которая отвечает за синтез белка. Рибосомы, нанизываясь на молекулу и-РНК, формируют полисому. Молекула т-РНК (транспортная РНК), которая несет кислотный остаток, подходит к каждой рибосоме.
т-РНК отличается формой трилистика: верхушка — это триплет нуклеотидов или антикодон. Он формирует комплементарную пару с соответствующим триплетом и-РНК (кодоном).
Рибосома в процессе синтеза белка надвигается на нитевидную молекулу и-РНК, которая оказывается двумя ее субъединицами. Присоединение т-РНК к и-РНК происходит в определенном месте — в месте совпадения кодона и антикодона. Присоединение аминокислотных остатков к синтезируемой цепи происходит при помощи полипептидных связей. Происходит отсоединение т-РНК, после чего она покидает рибосому.
Это продолжается до завершения синтеза нити аминокислотных остатков (белковой молекулы).
Заключительный этап — приобретение синтезированным белком пространственной структуры. Благодаря соответствующим ферментам от него отщепляются лишние аминокислотные остатки, происходит введение небелковых фосфатных, карбоксильных и других групп, присоединение углеводов, липидов и т. д. Белок «созревает». Как только все эти процессы заканчиваются, молекула белка становится полностью функционально активной.