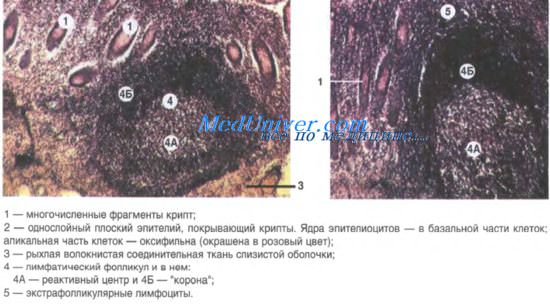
Формирование лимфоидных фолликулов в желудке что это
Формирование лимфоидных фолликулов в желудке что это
Имеется вариабельность в строении лимфатических узлов из различных анатомических областей. Для лимфатических узлов шеи характерна типичная структура фолликулов, паракортикальной зоны, мозгового вещества и синусов. Подмышечные лимфатические узлы в состоянии покоя имеют вид ободка лимфоидной ткани вокруг жировой ткани в центре.
При злокачественных лимфомах и других лимфопролиферативных состояниях эта жировая ткань заселяется опухолевыми клетками и может полностью исчезнуть. Брыжеечные лимфатические узлы имеют более широкие синусы и обычно менее заметные фолликулы и паракортикальную зону.
Лимфоидные фолликулы отвечают за Т-зависимое образование антител. Они являются местом образования различных антител и переключения изотипов. Первичные фолликулы построены из малых В-клеток, несущих на поверхности IgM и IgD, и фолликулярных дендритных клеток. Если рассечь вторичный фолликул в области полюса, не затрагивая центр размножения, он будет выглядеть как первичный фолликул.
Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность, выражающуюся в формировании темной зоны из бластных клеток (из-за выраженной базофилии цитоплазмы при окрашивании по Гимза) и светлой зоны из центроцитов. В клетках темной зоны выявляются многочисленные митозы и высокая степень пролиферации; во многих клетках могут определяться признаки апоптоза.
Обычно полярность фолликулов лучше видна в лимфоидных фолликулах слизистых оболочек (таких как слизистая миндалины) и лимфатических узлах.
В-клетки центра размножения не экспрессируют BCL-2 и, таким образом, подвержены апоптозу. Допускается, что только В-клетки, обеспечивающие хорошую аффинность антител, реэкспрессируют BCL-2 и выживают. Апоптозу подвергается значительная доля В-клеток фолликулярных центров, которые захватываются макрофагами центра (макрофаги «окрашенных телец»).
Центр размножения окружен мантийной зоной, состоящей из малых В-лимфоцитов с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных фолликулах. В-клетки маргинальной зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Часто такие клетки обнаруживаются в брыжеечных узлах, но обычно не заметны в других местах. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК).
ФДК захватывают и удерживают иммунные комплексы на своей поверхности для презентации В- и Т-клеткам. ФДК имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются в срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Эти отростки также выявляются окрашиванием на CD21 и CD23.
Центры размножения с обратным развитием часто содержат интерстициальное эозино-фильное протеиногеннос вещество. Иногда в центрах роста реактивных лимфатических узлов обнаруживаются плазматические клетки. Лимфоидные фолликулы содержат различное число малых Т-клеток, многие из которых экспрессируют CD3, CD4 и CD57.
Лимфофолликулярная гиперплазия
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гиперплазия представляет собой процесс патологического разрастания клеток. Лимфофолликулярная гиперплазия – увеличение фолликулярной ткани слизистого/подслизистого слоя. Болезнь встречается у пациентов всех возрастных категорий без привязки к половой принадлежности, пищевым пристрастиям и вне зависимости от места жительства.
Диагностируется лимфофолликулярная гиперплазия в эндокринной сфере, но наиболее часто поражает систему пищеварения. Чем обусловлено преобладание патологии в желудочно-кишечном тракте? Конечно, количеством предрасполагающих факторов – болезни пищеварительной системы в хронической стадии, потребление большого числа канцерогенов, уровнем застресованности. Гиперпластические изменения в эндокринных органах выявляются на фоне эндокринных либо системных нарушений. Например, лимфофолликулярное поражение вилочковой железы наблюдается при уже имеющейся патологии гипофиза.

Код по МКБ-10
Причины лимфофолликулярной гиперплазии
Появление гиперплазии связывают с разнообразными негативными воздействиями на ткань, приводящими к увеличению численности клеток. Запустить болезнетворный механизм могут сопутствующие проблемы – ожирение, нарушение функции печени, гипергликемия и т.п. Наследственный фактор специалисты также относят к фактору риска.
Выделяют следующие причины лимфофолликулярной гиперплазии:

Симптомы лимфофолликулярной гиперплазии
Проявления болезнетворной симптоматики во многом зависят от локализации патологического очага. Обобщенными признаками считаются – рост температуры, ощущение слабости, количественное увеличение лимфоцитов и понижение альбуминового уровня. Следует отметить, что зачастую при доброкачественном характере поражения симптомы лимфофолликулярной гиперплазии отсутствуют. Негативная симптоматика распространена в запущенных и особо трудных случаях гиперпластического поражения желудочно-кишечного тракта, которым свойственны боли области живота (нередко в эпигастрии) в присутствии диспептических расстройств.
Стадии гиперплазии классифицируются согласно размеру и распространению фолликулов:
Исходя из приведенных особенностей формирования и течения патологии, можно заключить:
Лимфофолликулярная гиперплазия слизистой желудка
Сложное строение слизистой оболочки желудка обусловлено выполнением множеством функций, включая секреторную активность, защиту и участие в процессе перистальтики. Здоровая слизистая – это залог правильной работы всей системы пищеварения.
Чрезмерное разрастание клеток эпителия с одновременным утолщением стенок слизистой называется лимфофолликулярная гиперплазия слизистой желудка. Патология нередко сопровождается формированием наростов или полипов. Причиной заболевания считаются неврологические и гормональные изменения. Лимфофолликулярная гиперплазия редко трансформируется в онкологию. Появлению раковых клеток в большинстве случаев способствует дисплазия эпителия, при которой здоровые клетки слизистого слоя перерастают в клетки с выраженным атипичным строением. Наиболее опасным является метаплазия слизистой, характеризующаяся пищеварительной дисфункцией и большой вероятностью развития опухолей злокачественного типа.
Постановка диагноза и проведение соответствующего лечения – это основные задачи врача-гастроэнтеролога. Причем терапевтические методы подбираются индивидуально для каждой патологии.
Лимфофолликулярная гиперплазия антрального отдела желудка
Согласно статистическим данным причина поражения антральной области желудка при наличии хронического гастрита обусловлена не только реакцией на воспаление (микроорганизмом-возбудителем в данном случае выступает Helicobacter pylori), но является следствием ослабления иммунитета. Иммунные изменения в совокупности с гастритом, как показывает практика, выявляются при условии пониженной кислотности, которая в свою очередь является предпосылкой для появления аутоиммунных заболеваний.
Изучение патологии в детском возрасте позволило сделать вывод, что лимфофолликулярная гиперплазия антрального отдела желудка является следствием аутоиммунной ревматической болезни, а не действия бактерий. Конечно, наличие патогенной флоры и аутоиммунных отклонений в разы увеличивает риск гиперплазии.
Изменения слизистой нередко влекут за собой возникновение полипов, локализация которых в антральном отделе занимает около 60% всех случаев поражения желудка. Полипы воспалительной природы, иными словами гиперпластические встречаются с частотой от 70 до 90 %, развиваясь из подслизистого либо слизистого слоя. Представляют собой округлые, цилиндрической формы, плотные образования с широким основанием и плоской верхушкой.
Лимфофолликулярная гиперплазия подвздошной кишки
Нижняя часть тонкого кишечника называется подвздошной кишкой, выстланной изнутри слизистой с обилием ворсинок. Поверхность снабжена лимфатическими сосудами и капиллярами, участвующим в усвоении питательных и полезных веществ. Так жиры поглощаются лимфатическим синусом, а сахара с аминокислотами впитываются кровеносным руслом. Слизистый и подслизистый слои подвздошной кишки представлены циркулярными складками. Помимо всасывания необходимых веществ, орган вырабатывает специальные ферменты и переваривает пищу.
Лимфофолликулярная гиперплазия подвздошной кишки формируется, как следствие иммунодефицита и пролиферативных процессов кишечной стенки. Нарушения обнаруживаются при специфической реакции на внешнее раздражение лимфоидной ткани отделов кишечника. Клинические проявления патологического состояния:
Дифференцировать заболевание позволяют анализы крови, мочи, кала, а также обследование посредствам фиброволоконной эндоскопии. Как правило, лимфофолликулярная гиперплазия диагностируется сугубо в терминальной зоне подвздошной кишки, что свидетельствует о вторичности патологического процесса и не нуждается в терапевтическом воздействии. В качестве лечебно-профилактических мероприятий может быть рекомендована строжайшая диета с ограничением ряда продуктов питания. Если же речь идет о серьезном воспалении, подозрении на рак или болезнь Крона, то применяется лечение медикаментами либо хирургическое вмешательство.
Диагностика лимфофолликулярной гиперплазии
Сложность раннего выявления патологического состояния слизистой оболочки заключается в бессимптомном течении заболевания на первых этапах формирования. Нередко обнаружение лимфоидных фолликулов происходит случайным образом при проведении колоноилеоскопии по другим показаниям. К сожалению, обращения пациентов начинаются с появления кишечного кровотечения либо нестерпимых болей в животе, что соответствует последним стадиям болезни.
Увеличение слизистого слоя в желудке и кишечнике можно исследовать посредством эндоскопических технологий, к которым относят – колоноскопию, ФГДС и ректороманоскопию. Диагностика лимфофолликулярной гиперплазии проводится также методом рентгенографии с применением контрастных веществ. Рентген исследование помогает оценить степень распространения новообразованных клеток, а эндоскопическое изучение позволяет получить биологический материал для гистологии.
Подтверждение диагноза лимфофолликулярная гиперплазия говорит о необходимости постоянного контроля состояния в виду возможного перерастания аномальных участков в злокачественные опухоли.

К кому обратиться?
Лечение лимфофолликулярной гиперплазии
Лимфофолликулярная гиперплазия слизистой оболочки, протекающая с явными признаками патологического процесса, лечится путем понижения кислотности желудка и подавления активности хеликобактерий. Терапевтическая схема подавления хеликобактерной флоры с обязательным устранением гастрита занимает две недели, включает прием медикаментозных средств (в том числе и антибиотиков) и соблюдение диеты.
Наличие злокачественных тканей делает необходимым оперативное вмешательство. Гиперплазия отделов пищеварительной системы может потребовать резекцию желудка или иссечения участка кишечника. Период реабилитации зависит от тяжести заболевания, успеха операции и общего состояния пациента. Важным моментом после хирургической манипуляции остается постоянное наблюдение для исключения рецидивов и осложнений.
Выявление патологического очага в эндокринной либо кроветворной системе с признаками злокачественного процесса требует длительного комбинированного лечения, объединяющего хирургические методики и химиотерапевтическое воздействие.
Лечение лимфофолликулярной гиперплазии доброкачественного характера, как правило, не проводится.
Профилактика лимфофолликулярной гиперплазии
Учитывая тот факт, что лимфофолликулярная гиперплазия в большинстве случаев протекает бессимптомно, выявить патологию на этапе зарождения можно только путем регулярных обследований. Поэтому регулярное посещение медицинского учреждения с целью прохождения профилактического осмотра является обязательным.
Профилактика лимфофолликулярной гиперплазии включает рекомендации общего характера: здоровое и полноценное питание, соблюдение режима дня, умеренная физическая активность, наличие времени на отдых и расслабление, минимизирование стрессовых ситуаций, отказ от пристрастий к табаку/алкоголю/наркотическим веществам.
Следует отметить, что любители заниматься самолечением лекарственными препаратами либо народными средствами входят в группу риска, так как выраженная симптоматика гиперплазии имеет место только на поздних стадиях формирования патологии. Запущенные процессы тяжело поддаются лечению, перерастают в хронические формы болезней, требуют сложных хирургических вмешательств, способны трансформироваться в злокачественные новообразования.
Прогноз лимфофолликулярной гиперплазии
Число пациентов с хроническими заболеваниями системы пищеварения неуклонно растет. Подобные патологии все чаще выявляются в детском возрасте, приводя к тяжелым последствиям и даже инвалидности. Присутствии в желудочно-кишечном тракте хеликобактерий связывают с развитием аутоиммунного гастрита, который в свою очередь провоцируется вирусом герпеса. Как, например, при мононуклеозе, вызываемом инфекцией Эпштейна-Барра, наблюдается поражение эпителия органов пищеварения с явными признаками лимфофолликулярной гиперплазии.
Для качественного лечения аутоиммунного гастрита хронического течения определяющим фактором остается раннее диагностирование. Гастрит аутоиммунного типа имеет доатрофическую форму, соответствующую иммунному отклику, провоцирующему лимфофолликулярную гиперплазию.
Прогноз лимфофолликулярной гиперплазии тем лучше, чем раньше обнаружено заболевание. Путем комплексной терапии, включающей схему лечения хронического гастрита (сочетание интерферона с иммунокоррекцией и валацикловиром), купируют патологический очаг слизистой желудка, нормализуют защитные силы организма и добиваются стойкой ремиссии.
Диагноз лимфофолликулярная гиперплазия должен быть подтвержден клиническими, морфологическими, эндоскопическими, вирусологическими и иммунологическими данными. Только после перечисленных исследований можно назначить качественное и эффективное лечение.
Формирование лимфоидных фолликулов в желудке что это
Мы, однако, наблюдали и выраженные эрозивные изменения лимфоидных фолликулов, что следует отнести к стадии IV, поэтому считаем необходимым дополнить эту классификацию.
Для IV стадии характерно наличие гиперемии слизистой оболочки, эрозий, покрытых фибрином, с конгломератами воспаленных лимфоидных фолликулов, что расценивалось как проявление илеита. Складки слизистой оболочки были сглажены или несколько утолщены, исчезала поверхностная зернистость, слизистая оболочка имела матовый оттенок, сосудистый рисунок чаще был усилен. Подобные изменения слизистой оболочки никогда не локализовались только в терминальном отделе тонкой кишки, а распространялись на значительно более протяженные ее сегменты и не имели тенденции к стиханию в оральном направлении.
Таким образом, IV стадию можно расценивать как илеит на фоне лимфофолликулярной гиперплазии, но что здесь первично, что вторично, сказать трудно. Вероятно, лимфофолликулярная гиперплазия развивается первично, но по мере развития лимфоидной гиперплазии, нарастания воспаления лимфоидные фолликулы эрозируются (что соответствует нашим клиническим находкам и данным морфометрии).
В стадиях 0, I, II выраженные клинические проявления не наблюдались и лимфофолликулярная гиперплазия была случайной находкой, а в III и особенно в IV стадии в большинстве случаев отмечались боли в животе и кишечные кровотечения.
Эти данные совпадают с литературными сообщениями о том, что лимфофолликулярная гиперплазия терминального отдела подвздошной кишки у детей может быть причиной кишечного кровотечения, рецидивирующих болей в животе.
У большинства больных не отмечена взаимосвязь возникновения подобных изменений с поражениями толстой кишки. Каких-либо специфических для этой патологии симптомов выявить не удалось. У этих больных лимфофолликулярная гиперплазия была случайной находкой, хотя у большинства колоноилеоскопии проводились по поводу кишечного кровотечения. У 8 больных лимфофолликулярная гиперплазия отмечалась при терминальном илеите.
При исследовании морфометрических показателей слизистой оболочки подвздошной кишки при лимфофолликулярной гиперплазии I—II стадии не отмечалось изменений в архитектонике по сравнению с таковой в биоптатах с нормальной слизистой оболочкой. Увеличивалось число эпителиоцитов, находящихся в состоянии митоза (1,58±0,11 %; Р<0,01), число межэпителиальных лимфоцитов (МЭЛ) (до 28,9±6,1 %; Р<0,05) и клеточная плотность инфильтрата собственной пластинки. Среди клеток инфильтрата возрастало количество лимфоцитов, плазматических клеток (Р<0,05).
Вопрос о первичности или вторичности поражения лимфатического аппарата остается открытым. По-видимому, имеется взаимообусловленность и взаимосвязь между степенью воспаления слизистой оболочки и подслизистого лимфатического аппарата.
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии

Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желе
Abstract. Gastritis is a reaction of the mucous membrane (MM) of the stomach to damage and is characterized by the formation of inflammatory, dystrophic and dysregenerative changes in the MM of the stomach, as well as atrophy of epithelial cells with replacement of normal glands with fibrous tissue. The progression of chronic gastritis (CG) is accompanied by the development of MM atrophy, dysplasia and becomes a significant factor in the formation of gastric malignant neoplasms. The article presents the modern etiological classification of CG, approaches to the diagnosis of CG, assessing the stage of gastritis on a scale of progressive increase in the likelihood of developing stomach cancer, presents the histological characteristics, and also substantiates etiopathogenetic approaches to the treatment of various forms of CG, including methods for optimizing the eradication therapy of H. pylori infection. which can be used to increase the effectiveness of not only standard triple therapy, but also other anti-Helicobacter treatment regimens. The use of proton pump inhibitors in the treatment of gastritis is considered. For citation: Dolgalev I. V., Kareva E. N., Lyalyukova E. A. Chronic gastritis: from histological protocol to substantiation of etiopathogenetic therapy // Lechaschy Vrach. 2021; 2 (24): 30-34. DOI: 10.26295/OS.2021.76.84.006
Резюме. Гастрит представляет собой реакцию слизистой оболочки (СО) желудка на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Прогрессирование хронического гастрита (ХГ) сопровождается развитием атрофии, дисплазии СО и становится значимым фактором формирования злокачественных новообразований желудка. В статье приводятся современная этиологическая классификация ХГ, подходы к диагностике ХГ, оценке стадии гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка, представлены гистологические характеристики, а также обоснованы этиопатогенетические подходы к терапии различных форм ХГ, включая методы оптимизации эрадикационной терапии инфекции H. pylori, которые могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения. Рассмотрено примение ингибиторов протонной помпы в терапии гастрита.
Хронический гастрит (ХГ) – широко распространенное заболевание пищеварительной системы, регистрируемое у 15-30% населения в различных популяциях и составляющее 80-85% всех заболеваний желудка 3. Медико-социальная значимость проблемы заключается в том, что прогрессирование ХГ сопровождается развитием атрофии, дисплазии слизистой оболочки (СО) и становится значимым фактором формирования злокачественных новообразований желудка [4, 5].
Целью данного обзора было представить гистологическую характеристику и обосновать этиопатогенетические подходы к терапии различных форм ХГ.
Дефиниции
Гастрит представляет собой реакцию СО на повреждение и характеризуется формированием воспалительных, дистрофических и дисрегенераторных изменений в СО желудка, а также атрофией эпителиальных клеток с замещением нормальных желез фиброзной тканью. Развитие этого заболевания сопровождается нарушением секреторной и моторной функций желудка.
К настоящему времени сложилось устойчивое мнение о том, что диагноз гастрита должен быть верифицирован морфологически. Основным гистологическим признаком заболевания являются инфильтрация собственной пластинки воспалительными клетками и структурные изменения железистого аппарата слизистой желудка [5]. При гистологическом исследовании гастрит подтверждается наличием нейтрофилов или мононуклеарных клеток 2-й степени по крайней мере в одном участке биопсии желудка либо нейтрофилов или мононуклеарных клеток 1-й степени по меньшей мере в двух участках [6]. Воспалительный инфильтрат представлен лимфоцитами, плазматическими клетками, гистиоцитами и гранулоцитами, расположенными диффузно или в виде скоплений в собственной пластинке СО, иногда – внутри желез. Активность воспалительного процесса определяется степенью инфильтрации полиморфноядерными лейкоцитами (нейтрофилами и ацидофильными гранулоцитами) собственной оболочки (lamina propria) слизистой желудка [7].
Международная группа патологов Оперативного звена для оценки гастрита (Operative Link for Gastritis Assessment – OLGA) предложила интегральный метод оценки выраженности морфологических изменений СО желудка и стандартизировала гистологические фенотипы по степени и стадии развития (OLGA Staging System) 10. Локализация нейтрофилов определяет степень: нейтрофилы в собственной пластинке оболочки – легкая (+-) активность; нейтрофилы в эпителии – умеренная (++-) активность и нейтрофилы в просвете железы – выраженная (+++) активность.
Прогрессирование заболевания сопровождается замещением собственных железистых структур lamina propria фиброзной тканью (неметапластическая атрофия) или заменой желез метапластическими железами. Метапластическая атрофия может иметь два фенотипа: кишечная метаплазия (КМ), поражающая слизистые железы, и псевдопилорическая метаплазия, которая также известна как метаплазия псевдопилорических желез. Система позволяет оценить стадию гастрита по шкале прогрессирующего увеличения вероятности развития рака желудка – риск от самого низкого (стадия 0) до самого высокого (стадия IV). Таким образом, под степенью гастрита подразумевается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией – выраженность атрофии. Такая система дает достаточно полную характеристику гастрита и отражает его динамику.
Альтернативная система определения стадии заболевания (Operative Link on Gastric Intestinal Metaplasia Assessment – OLGIM) предлагает рассматривать только КМ для оценки атрофии [9]. Различение неатрофического и атрофического гастрита необходимо, чтобы получить информацию о том, за какими пациентами требуется клиническое/эндоскопическое наблюдение.
Этиология ХГ
Современная этиологическая классификация ХГ была предложена в 2015 г. на Международном консенсусе в Киото (Япония) [12].
С учетом этиологического фактора различают следующие формы гастрита:
I. Аутоиммунный ХГ (АИГ) (этиология неизвестна; аутоиммунный патогенез).
II. Инфекционный ХГ.
III. Экзогенный ХГ (лекарственный, алкогольный, радиационный, вызванный химическими веществами).
IV. ХГ, вызванный воздействием специфических причин (лимфоцитарный, гигантский гипертрофический (болезнь Менетрие), аллергический, эозинофильный).
V. Вторичный ХГ, вызванный другими заболеваниями (при саркоидозе, васкулитах, болезни Крона).
Аутоиммунный хронический гастрит
В общей популяции встречается нечасто – менее чем в 1% случаев, а среди больных ХГ – до 5% [13]. Заболевание вызывает поражение фундального отдела и тела желудка. АИГ является наследственно обусловленным и передается как аутосомно-доминантный признак, часто сочетаясь с другими аутоиммунными заболеваниями (сахарным диабетом 1 типа, тиреоидитом Хашимото, синдромом Шегрена) [14]. Патогенетически это аутоиммунная патология, связанная с наличием антител, направленных против париетальных клеток желудка и их компонентов (внутренний фактор и протонная помпа) с формированием атрофии СО желудка. Прогрессивное снижение количества париетальных клеток приводит к гипохлоргидрии вплоть до анацидного состояния. Снижение синтеза соляной кислоты стимулирует G-клеточную гиперплазию и таким образом способствует повышению уровня гастрина в сыворотке крови. В свою очередь гипергастринемия создает условия для гиперплазии энтерохромаффиноподобных клеток, которые иногда трансформируются в злокачественную опухоль желудка [15]. Относительный риск развития аденокарциномы желудка у этих больных возрастает в 3 раза [16]. Снижение образования внутреннего фактора приводит к мальабсорбции витамина В12 и его дефициту в организме, что может стать причиной пернициозной (мегалобластной) анемии, а также множественных неврологических расстройств (фуникулярный миелоз) [15].
Типичные гистологические паттерны аутоиммунного гастрита 18
Другие гистологические паттерны
ХГ, ассоциированный с инфекцией H. pylori
Инфекция H. pylori – наиболее частая причина развития ХГ. Заболевание первоначально развивается как хронический активный гастрит, при котором H. pylori обнаруживается как в антральном отделе, так и в теле желудка (обычно в большем количестве в антральном отделе). Длительно сохраняющийся активный гастрит, ассоциированный с H. pylori, создает условия для развития вторичной атрофии СО желудка. Так, по результатам 10-летнего проспективного наблюдения больных хеликобактерным активным гастритом, атрофия выявлена у 6% пациентов через 2 года, у 22% – через 4 года, у 34% – через 6 лет и у 43% – через 10 лет наблюдения, при этом в группе контроля (Нр-негативные) атрофия не развивалась [19].
Гистология процесса представлена следующим образом: полиморфноядерные лейкоциты инфильтрируют собственную пластину, железы и фовеолярный эпителий, образуя небольшие микроабсцессы. Наблюдаются лимфоидные агрегаты и лимфоидные фолликулы, расширяющие собственную пластинку СО, иногда лимфоциты проникают в эпителий. Инфекция H. pylori – основная причина вторичной атрофии СО желудка. Атрофические изменения (как метапластические, так и неметапластические) в образце биопсии из угла и антрального отдела в первую очередь следует рассматривать как доказательства хеликобактерного гастрита. На поздних стадиях атрофии, связанной с хронической инфекцией H. pylori, как в теле, так и в антральном отделе наблюдается обширное замещение КМ, связанной с развитием гипохлоргидрии. По мере распространения КМ количество бактерий H. pylori, обнаруживаемых в желудке, уменьшается, так как H. pylori исчезает из участков метапластического эпителия. Особое значение этой проблеме придает то, что атрофический гастрит является начальной ступенью каскада изменений СО, приводящего к злокачественному новообразованию желудка (каскад Корреа) [20]. Вероятность развития рака желудка возрастает по мере нарастания тяжести атрофии слизистой, и этот риск находится в прямой зависимости от степени атрофических изменений, выявляемых в антральном отделе и в теле желудка, в особенности при наличии метаплазии [21]. Длительное течение гастрита, ассоциированного с H. pylori, повышает вероятность развития злокачественной опухоли желудка в 6 раз [21].
Типичные гистологические паттерны
Варианты гистологических паттернов
Последствия
Цитомегаловирусный (ЦМВ) гастрит
Единственная вирусная инфекция желудка с отчетливой патологической картиной. Преимущественно поражает детей и пациентов с ослабленным иммунитетом. Обычно поражаются разные участки желудочно-кишечного тракта. Эндоскопически СО желудка может выглядеть полностью нормальной или иметь эрозии и язвы. В редких случаях это может быть образование, называемое псевдоопухолью. Гистологически многочисленные включения ЦМВ в эпителиальных клетках можно увидеть реже, чем в эндотелиальных, а также в макрофагах с незначительным воспалением или его отсутствием. В этом случае иммунологический статус пациентов обычно сильно подавлен. В других случаях может наблюдаться обильная грануляционная ткань с серьезной воспалительной реакцией, в то время как включения ЦМВ трудно увидеть без методов иммуногистохимии или гибридизации in situ. Эозинофильные инфильтраты также могут быть важным компонентом воспаления при ЦМВ-гастрите [7].
Гастрит, вызванный лекарственными средствами; алкогольный гастрит; лучевой гастрит, рефлюкс-гастрит
Химические агенты увеличивают обновление эпителия желудка, что приводит к фовеолярной гиперплазии. Эти состояния часто протекают бессимптомно, но они могут привести к множественным эрозиям или язвам, даже с кровотечением. Атрофические изменения встречаются редко [7].
Диагноз основан на микроскопическом исследовании СО желудка, и, согласно существующему определению, основным его признаком является наличие не менее 25 интра-эпителиальных лимфоцитов на 100 эпителиальных клеток желудка. Большинство этих лимфоцитов имеют фенотип CD3+ и CD8+. Известно, что инфекция H. pylori связана с ЛГ, достигая от 0% до 27% случаев. Связь между ЛГ и глютеновой болезнью установлена и колеблется от 10% до 38% [7].
Эозинофильный гастрит (ЭГ)
Является частью семейства эозинофильных желудочно-кишечных расстройств, которое включает эозинофильный эзофагит, эозинофильный гастроэнтерит и эозинофильный энтерит/колит, связанные с триггерами пищевых аллергенов. У многих пациентов в анамнезе были атопические состояния, включая астму, аллергический ринит или атопический дерматит, а также аллергию на лекарственные продукты или пыльцу. Рекомендованы два основных критерия диагностики ЭГ: 1) в биоптате желудка средняя плотность эозинофилов > 127/мм 2 (или > 30 эозинофилов/поле высокого увеличения (HPF) на микроскопах, оснащенных широкоугольными окулярами (FN 22), по крайней мере в пяти отдельных HPFs); 2) отсутствие известных ассоциированных причин эозинофилии (например, инфекция H. pylori, болезнь Крона, паразитарные инфекции, а также гематологические или лимфоидные нарушения) [7].
Диагностика ХГ
Диагностика ХГ включает клиническое обследование, cерологическое исследование (пепсиногены и антитела против инфекционных агентов и/или аутоантигены), эндоскопию верхних отделов желудочно-кишечного тракта (с применением стандартизированных протоколов биопсии) и последующее гистологическое исследование. Гистологическое изучение биоптата является «золотым стандартом» в диагностике заболевания. Прицельная биопсия из пяти мест: антральный отдел, большая (А1) и малая кривизна (А2), угол (А3) и тело желудка, большая (С1) и малая кривизна (С2).
Стандартизация морфологических признаков ХГ нашла отражение в полуколичественных системах гистологической классификации гастритов, которые были заложены Сиднейской системой (Sydney Systems, 1990) и получили дальнейшее развитие в Хьюстонской модифицированной классификации (1994) и системах OLGA и OLGIM (2008) 22.
Подходы к терапии отдельных форм ХГ
Своевременная диагностика и верное определение классификационной группы ХГ имеют основополагающее значение для успешного лечения этого заболевания.
Особенности АИГ зависят от стадии, наличия инфекции H. pylori, текущего дефицита питательных веществ, сопутствующих аутоиммунных состояний и риска злокачественной трансформации. Так как инфекция H. pylori может играть решающую роль в патогенезе АИГ, необходим скрининг на H. рylori пациентов с диагностированным АИГ, атрофией желудка, КМ/дисплазией и гипо- или ахлоргидрией. При положительном результате на H. pylori пациенты нуждаются в последующем лечении. Исследования подтверждают, что эрадикация H. pylori была связана со снижением уровней антител к париетальным клеткам и антител против внутреннего фактора на ранних стадиях AИГ.
Пероральный прием витамина B12, железа и фолиевой кислоты рекомендуется на ранних стадиях АИГ. При появлении неврологических симптомов следует назначать витамин B12 парентерально.
Поскольку различные аутоиммунные заболевания признаются сопутствующими AИГ, необходимо уделять внимание их скринингу и последующему лечению.
Тактика лечения AИГ с предотвращением осложнений требует надлежащего длительного наблюдения в соответствии с текущими симптомами, серологическими результатами и данными визуализации. Для этого необходим правильный мониторинг показателей – один раз в год (общий анализ крови, уровень гастрина, железа и витамина B12) [25, 26].
ХГ, вызванный Н. pylori, в том числе у «бессимптомных» лиц, является показанием к проведению эрадикационной терапии инфекции Н. pylori. Эрадикация способствует излечению хронического неатрофического гастрита, может привести к регрессии атрофического гастрита и снижает риск развития рака желудка у пациентов с неатрофическим и атрофическим гастритом. Эрадикация H. pylori у пациентов с КМ тяжелой степени, судя по всему, не приводит к существенному снижению риска развития рака желудка, как минимум в краткосрочной перспективе, однако обеспечивает снижение выраженности воспаления и атрофии, и у таких пациентов следует рассмотреть возможность ее проведения [27].
В России терапией первой линии эрадикации служит стандартная тройная терапия, включающая ИПП, кларитромицин и амоксициллин. Стандартную тройную терапию следует проводить, применяя различные меры, повышающие ее эффективность. Среди методов оптимизации, позволяющих повысить эффективность эрадикационной терапии инфекции H. pylori, следует отметить увеличение продолжительности лечения до 14 дней, выбор надежного ИПП или увеличение дозы ИПП, добавление висмута трикалия дицитрата или пробиотика. В качестве альтернативного варианта эрадикационной терапии первой линии может быть использована классическая четырехкомпонентная схема на основе висмута трикалия дицитрата или без препаратов висмута, которая включает ИПП, амоксициллин, кларитромицин и метронидазол. Квадротерапию с висмута трикалия дицитратом применяют также как основную схему терапии второй линии при неэффективности стандартной тройной терапии. Другая схема второй линии включает ИПП, левофлоксацин и амоксициллин. Тройная терапия с левофлоксацином может быть назначена только гастроэнтерологом по строгим показаниям. Терапию третьей линии подбирают индивидуально в зависимости от предшествующих схем лечения.
Методы оптимизации эрадикационной терапии инфекции H. pylori могут быть применены для повышения эффективности не только стандартной тройной терапии, но и других режимов антихеликобактерного лечения, а комбинирование этих методов позволяет добиться наилучшего результата у конкретного пациента [28].
Эрадикация H. pylori позволяет купировать симптомы диспепсии и активность гастрита.
Если все варианты терапии исчерпаны, обычное лечение будет направлено на снижение секреции кислоты СО желудка и защиту слизистого барьера.
В клинической практике кислая среда в желудке играет решающую роль в развитии гастрита, вызванного H. рylori, и ассоциированных с ним симптомов диспепсии, поэтому ИПП являются важной стратегией лечения пациентов с симптоматическим гастритом [29].
Кислотообразующая АТФаза, известная как АТФаза вакуо-лярного типа, помимо париетальных клеток имеется также в лизосомах лейкоцитов, и на ее активность тоже влияют ИПП [31]. Противовоспалительный эффект ИПП включает торможение хемотаксиса и дегрануляции нейтрофилов, взаимодействие нейтрофилов с эндотелиоцитами, выработку нейтрофилами свободных радикалов [32]. Противовоспалительная активность ИПП подтверждена результатами клинических и экспериментальных исследований. В частности, в экспериментальном исследовании было оценено влияние омепразола на адгезивную активность нейтрофилов, стимулированную H. pylori. Адгезия нейтрофилов увеличивалась за счет присутствия H. рylori, тогда как введение ИПП (омепразола), напротив, значительно снижало адгезию дозозависимым образом [31].
Использование авторадиографии позволило выявить накопление 3H-лансопразола в цитоплазматических гранулах нейтрофилов, инфильтрирующих СО желудка. За счет повышения внутривакуолярного уровня pH в лизосомах нейтрофилов, ИПП ослабляют активацию нейтрофилов и высвобождение ими токсичных метаболитов [33].
В исследованиях in vivo было показано, что омепразол (1-100 мкМ) дозозависимо увеличивал рН в лизосомах, ингибировал подвижность активированных нейтрофилов, подавлял выработку ими токсичных продуктов и снижал работу лизосомальных ферментов. У здоровых добровольцев, которым вводили омепразол в дозе 40 мг/сут в течение 7 дней, выявлено значительное снижение хемилюминисценции (отражающей активности) периферических нейтрофилов [34].
Учитывая, что длительное воспаление в СО желудка сопряжено с повреждением ДНК и риском канцерогенеза, своевременное и эффективное лечение гастрита, особенно на ранних его стадиях, является важным аспектом канцеропревенции в гастроэнтерологии.
Таким образом, не вызывает сомнений тот факт, что класс ИПП является наиболее востребованным при лечении кислотозависимых заболеваний с позиции доказательной медицины. Согласно реестру Сomcon (2020) [35], омепразол занимал и продолжает занимать лидирующие позиции в назначениях докторов и полностью отвечает критериям эффективности и безопасности при лечении кислотозависимых заболеваний [36].
Среди препаратов омепразола, представленных на российском фармацевтическом рынке, одним из самых изученных и надежных, а также известных [37] является Омез®. Полный цикл производства лекарственного препарата Омез® соответствует международным стандартам GMP [сертификат, подтверждающий производство Омеза по стандартам GMP], что обеспечивает высокое качество препарата и достижение должного уровня рН в желудке у пациентов, необходимого для кислотосупрессии. Омез® включен в Оранжевую Книгу FDA с терапевтической эквивалентностью категории «А», что подтверждает его качество на мировом уровне и идентичность оригинальному омепразолу [38].
Сравнительное исследование по оценке эффективности генериков омепразола, назначаемых в течение 7 дней в параллельных группах (в одной из которых использовали ИПП Омез®, в других – небрендированные омепразолы разного производства), показало, что уровень кислотосупрессии желудка достоверно выше на фоне применения Омез® в дозе 20 мг 2 раза в сутки. Использование других генериков омепразола в приведенном исследовании не приводило к целевому снижению уровня кислоты в желудке, что очевидно отражает их потенциальную клиническую неэффективность. Полученные различия могут быть связаны как с качеством субстанции, так и различиями лекарственных форм. Все молекулы ИПП являются кислотонеустойчивыми, и потому для сохранения действующего вещества в нативном виде для всасывания в кровь в кишечнике абсолютно необходимо защитить молекулу от кислоты. Для этого в лекарственной форме имеется кишечнорастворимая оболочка. Из капсулы Омез®, которая растворяется в желудке, высвобождаются гранулы (пеллеты), покрытые кишечнорастворимой оболочкой (MUPS – multi-unit pellet system). Пеллеты правильной формы и одинакового размера, который позволяет им смешаться с химусом и без задержек отправиться в тонкую кишку. Здесь происходит растворение оболочки, выход омепразола в жидкую среду и абсорбция его энтероцитами. Этот процесс должен происходить дружно, и пик концентрации омепразола должен совпасть с пиком активации протонных насосов (для этого обязательно принять пищу через 30 мин после приема препарата ИПП), только в активированном состоянии они доступны для связывания и блокады. Очевидно, что оптимизация лекарственных форм отражается на клинической эффективности препаратов. Но это статья расходов, на которой дженериковые компании зачастую экономят. Поэтому при выборе медикаментозной кислотосупрессивной терапии следует учитывать потенциальные возможности лекарственных препаратов, ориентируясь на должный уровень эффективности [39].
Омез® – один из немногих препаратов омепразола, имеющих форму выпуска – капсулы 40 мг. Пациентам с низкой приверженностью к терапии можно рекомендовать Омез® 40 мг 1 раз в сутки за 30 минут до завтрака [40]. Эта доза является оптимальной и для быстрых метаболизаторов. Еще одним несомненным достоинством препарата является его доступная цена при высоком качестве субстанции и уникальной лекарственной форме, что дает возможность в сложившихся социально-экономических условиях поддерживать на высоком уровне качество жизни большого числа больных кислотозависимыми заболеваниями.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
* ФГБОУ ВО Сибирский ГМУ Минздрава России, Томск, Россия
** ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, Москва, Россия
*** ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России, Москва, Россия
**** ФГБОУ ВО ОмГМУ Минздрава России, Омск, Россия
***** ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва, Россия
Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии/ И. В. Долгалёв, Е. Н. Карева, Е. А. Лялюкова, Н. В. Павлова
Для цитирования: Долгалёв И. В., Карева Е. Н., Лялюкова Е. А., Павлова Н. В. Хронический гастрит: от гистологического протокола до обоснования этиопатогенетической терапии // Лечащий Врач. 2021; 2 (24): 30-34.
Теги: хеликобактерная инфекция, слизистая оболочка, дисплазия, факторы риска