Формула h2so4 что это
Серная кислота. Свойства серной кислоты.
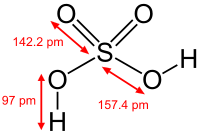
Серная кислота H2SO4 – нелетучая тяжелая жидкость, хорошо растворима в воде (при нагревании). tпл. = 10,3°C, tкип. = 296°С,
Отлично впитывает влагу, поэтому часто выступает в качестве осушителя.
Производство серной кислоты представляет собой контактный процесс. Его можно разделить на 3 этапа:
1. Получение SO2 путем сжигания серы или обжигом сульфидов.
3. Поглощение SO3 серной кислотой, в результате чего образуется 100% серная кислота (олеум):
Воду использовать нельзя из-за образования тумана.
Химические свойства серной кислоты.
Серная кислота H2SO4 – двухосновная кислота, которая обладает большой силой. В воде она диссоциирует ступенчато:
Разбавленная серная кислота реагирует только с металлами, стоящими в ряду напряжения до водорода:
В реакциях с щелочами или основными оксидами образует сульфаты или гидрофильфаты:
Необходимо отметить, что сульфат бария является нерастворимым сульфатом, поэтому его используют в качестве индикатора на присутствие сульфат-ионов.
Концентрированная H2SO4 окисляет медь, серебро, углерод и фосфор:
Концентрированная H2SO4 при обычных условиях не взаимодействует с Al, Cr, Fe, но при нагревании вступает в реакцию.
Концентрированная H2SO4 быстро вступает в реакцию с водой, выделяя пр этом огромное количество тепла.
Серная кислота
| Серная кислота | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общие | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Систематическое наименование | серная кислота | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
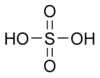
| Химическая формула | H2SO4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Состояние (ст. усл.) | жидкость | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Отн. молек. масса | 98,082 а. е. м. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса | 98,082 г/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность | 1,8356 г/см³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Термические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | -10,38 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 279,6 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура воспламенения | не воспламеняется °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплота плавления | 10,73 Дж/кг | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Растворимость в воде | смешивается г/100 мл | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оптические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Показатель преломления | 1.397 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дипольный момент | 2.72 Д | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рег. номер CAS | 7664-93-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер EC | 231-639-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| RTECS | WS5600000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Безопасность | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛД50 | 510 мг/кг | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Токсичность | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | — | 1,0661 | −5,5 | 102,0 |
| 20 | — | 1,1394 | −19,0 | 104,4 |
| 40 | — | 1,3028 | −65,2 | 113,9 |
| 60 | — | 1,4983 | −25,8 | 141,8 |
| 80 | — | 1,7272 | −3,0 | 210,2 |
| 98 | — | 1,8365 | 0,1 | 332,4 |
| 100 | — | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме, общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Химические свойства
Серная кислота — сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, S — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Применение
Серную кислоту применяют:
Мировое производство серной кислоты ок. 160 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озер вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянной лабораторной посуды перешли к большим промышленным свинцовым камерам.
Дополнительные сведения
Получение серной кислоты
Стандарты
Примечания
Литература
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Серная кислота» в других словарях:
Серная кислота — – сильная двухосновная кислота, в стандартных условиях представляет собой маслянистую жидкость без цвета и запаха. Неочищенная серная кислота имеет желтоватый или буро желтый цвет. В технике серной кислотой называют ее смеси как с водой,… … Энциклопедия ньюсмейкеров
СЕРНАЯ КИСЛОТА — СЕРНАЯ КИСЛОТА, H2S04, Acidum sulfuri cum. Химически чистая безводная С. к. представляет собой хим. соединение серного ангидрида S03 (81,63%) и воды Н20 (18,37%). Это бесцветная, прозрачная, маслянистая, нелетучая жидкость, сильно… … Большая медицинская энциклопедия
Серная кислота — СЕРНАЯ КИСЛОТА, H2SO4, тяжелая маслянистая жидкость, tкип 296,2°C. Применяется в производстве минеральных удобрений, для получения различных химических веществ, химических волокон, дымообразующих и взрывчатых веществ, красителей, в органическом… … Иллюстрированный энциклопедический словарь
Серная кислота — обладает очень сильными коррозионными свойствами. Она представляет собой плотную маслянистую жидкость, бесцветную (если не содержит примесей), желтую или коричневую (в других случаях). Бурно реагирует с водой, сжигает кожу и большинство… … Официальная терминология
серная кислота — сущ., кол во синонимов: 1 • кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
СЕРНАЯ КИСЛОТА — (H2SO4) сильная двухосновная кислота; бесцветная маслянистая жидкость; с водой смешивается во всех отношениях. Концентрированная С. к. реагирует почти со всеми металлами, образуя соли сульфаты. С. к. получают растворением в воде серного ангидрида … Российская энциклопедия по охране труда
СЕРНАЯ КИСЛОТА — (старое название купоросное масло) (H2SО4), токсичная жидкость без цвета и запаха, одна из самых едких известных кислот. Получается путем окисления сернистого газа (SO2) контактным способом. Является одним из основных химических соединений в… … Научно-технический энциклопедический словарь
серная кислота — Регулятор кислотности пищевого продукта, получаемый обжигом серного колчедана с последующим окислением выделяемой двуокиси серы в SO3, содержащий нитратов не более 10 мг/кг, хлоридов не более 50 мг/кг, железа не более 20 мг/кг, свинца не более… … Справочник технического переводчика
серная кислота — H2SO4, сильная двухосновная кислота. Безводная серная кислота бесцветная маслянистая жидкость, плотность 1,8305 г/см3, tпл 10,3°C, tкип 279,6°C. С водой смешивается во всех отношениях. Концентрированная серная кислота реагирует почти со всеми… … Энциклопедический словарь
Серная кислота
Содержание
Физические и физико-химические свойства [ ]
Олеум [ ]
Температура кипения водных растворов cерной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов cерной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3, в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
С повышением температуры усиливается диссоциация H₂SO₄ ↔ H₂O + SO₃ — Q, уравнение температурной зависимости константы равновесия lnKp = 14,74965 − 6,71464ln(298/T) — 8,10161·10⁴T² — 9643,04/T — 9,4577·10⁻³T + 2,19062·10⁻⁶T². При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К). Плотность 100%-ной cерной кислоты можно определить по уравнению: d = 1,8517 − 1,1·10⁻³t + 2·10⁻⁶t² г/см³. С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается: λ = 0,518 + 0,0016t — (0,25 + t/1293)·С/100, где С-концентрация серной кислоты, в %. Максимальнаую вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации 30 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H₂SO₄. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T 3/2 см²/с.
Химические свойства [ ]
Применение [ ]
Серную кислоту применяют:
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие [ ]
Дополнительные сведения [ ]
Получение серной кислоты [ ]
Стандарты [ ]
Примечания [ ]
Литература [ ]
ar:حمض الكبريتيك bg:Сярна киселина br:Trenkenn sulfurek bs:Sumporna kiselina ca:Àcid sulfúric cs:Kyselina sírová cy:Asid swlffwrig da:Svovlsyre de:Schwefelsäure el:Θειικό οξύ en:Sulfuric acid eo:Sulfata acido es:Ácido sulfúrico et:Väävelhape fa:اسید سولفوریک fi:Rikkihappo fr:Acide sulfurique gl:Ácido sulfúrico he:חומצה גופרתית hu:Kénsav id:Asam sulfat is:Brennisteinssýra it:Acido solforico ja:硫酸 ko:황산 la:Acidum sulphuricum lmo:Acid sulforich lt:Sieros rūgštis lv:Sērskābe ms:Asid sulfurik nds:Swevelsüür nl:Zwavelzuur nn:Svovelsyre no:Svovelsyre pl:Kwas siarkowy(VI) pt:Ácido sulfúrico ro:Acid sulfuric sh:Sumporna kiselina simple:Sulfuric acid sk:Kyselina sírová sl:Žveplova kislina sr:Сумпорна киселина sv:Svavelsyra th:กรดกำมะถัน tr:Sülfürik asit uk:Сульфатна кислота ur:ترشۂ گندھک vec:Àsido solfòrico vi:Axít sulfuric zh:硫酸















