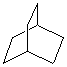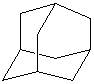Формулы с2н6 и с4н10 показывают что это
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
АЛКАНЫ И ЦИКЛОАЛКАНЫ
АЛКАНЫ И ЦИКЛОАЛКАНЫ – углеводороды, в которых все атомы углерода соединены друг с другом и с атомами водорода простыми (одинарными) связями. Алканы (синонимы – предельные углеводороды, насыщенные углеводороды, парафины) – углеводороды с общей формулой CnH2n+2, где n – число атомов углерода. Такую же формулу имеет и всем знакомый полиэтилен, только величина n у него очень велика и может достигать десятков тысяч. Кроме того, полиэтилен содержит молекулы разной длины. В циклоалканах атомы углерода образуют замкнутую цепь; если цикл один, формула циклоалкана CnH2n.
В зависимости от порядка соединения атомов углерода в цепь алканы делятся на линейные и разветвленные. Соответственно для алканов с n і 4 возможно существование более одного вещества с одинаковой формулой. Такие вещества называются изомерами (от греч. isis – равный, одинаковый и meros – доля, часть.
Названия алканов.
Слово «алкан» того же происхождения, что и «алкоголь» (см. ниже). Устаревший термин «парафин» произошел от латинских parum – мало, незначительно и affinis – родственный; парафины обладают малой реакционной способностью по отношению к большинству химических реагентов. Многие парафины являются гомологами; в гомологическом ряду алканов каждый последующий член отличается от предыдущего на одну метиленовую группу СН2. Термин происходит от греческого homologos – соответственный, подобный.
Номенклатурные (от лат. nomenclatura – роспись имен) названия алканов строятся по определенным правилам, которые не всегда однозначны. Так, если в молекуле алкана ecть различные заместители, то в названии алкана они перечисляются в алфавитном порядке. Однако в разных языках этот порядок может различаться. Например, углеводород СН3–СН(СН3)–СН(С2Н5)–СН2–СН2–СН3 в соответствии с этим правилом по-русски будет называться 2-метил-3-этилгексан, а по-английски 3-ethyl-2-methylhexane…
В соответствии с названием углеводорода называются и алкильные радикалы: метил (СН3-), этил (С2Н5-), изопропил (СН3)2СН-, втор-бутил С2Н5–СН(СН3)-, трет-бутил (СН3)3С- и т.д. Алкильные радикалы входят как целое в состав многих органических соединений; в свободном состоянии эти частицы с неспаренным электроном исключительно активны.
Некоторые изомеры алканов имеют и тривиальные названия (см. ТРИВИАЛЬНЫЕ НАЗВАНИЯ ВЕЩЕСТВ), например, изобутан (2-метилпропан), изооктан (2,2,4-триметилпентан), неопентан (2,3-диметилпропан), сквалан (2,6,10,15,19,23-гексаметилтетракозан), название которого происходит от лат squalus – акула (непредельное производное сквалана – сквален, важное для обмена веществ соединение, было впервые обнаружено в печени акулы). Часто используется и тривиальное название радикала пентила (С5Н11) – амил. Оно происходит от греч. amylon – крахмал: когда-то изоамиловый спирт С5Н11ОН (3-метилбутанол-1) называли «амильным алкоголем брожения», так как он составляет основу сивушного масла, а оно образуется в результате брожения сахаристых веществ – продуктов гидролиза крахмала.
Простейший член ряда циклоалканов CnH2n – циклопропан (n = 3). Его гомологи называются так же, как алканы с добавлением приставки «цикло» (циклобутан, циклопентан и т.д.). У циклоалканов возможна изомерия, связанная с наличием боковых алкильных групп и их расположением в кольце. Например, изомерны циклогексан, метилциклопентан, 1,1-, 1,2- и 1,3-диметилциклобутаны, 1,1,2- и 1,2,3-триметилциклопропаны.
Число изомеров алканов резко возрастает с увеличением числа атомов углерода. Названия некоторых алканов, а также теоретическое число их возможных изомеров приведены в таблице.
| Формула | Название | Число изомеров | Формула | Название | Число изомеров |
| СН4 | Метан | 1 | С11Н24 | Ундекан | 159 |
| С2Н6 | Этан | 1 | С12Н26 | Додекан | 355 |
| С3Н8 | Пропан | 1 | С13Н28 | Тридекан | 802 |
| С4Н10 | Бутан | 2 | С14Н30 | Тетрадекан | 1858 |
| С5Н12 | Пентан | 3 | С15Н32 | Пентадекан | 4347 |
| С6Н14 | Гексан | 5 | С20Н42 | Эйкозан | 366319 |
| С7Н16 | Гептан | 9 | С25Н52 | Пентакозан | 36797588 |
| С8Н18 | Октан | 18 | С30Н62 | Триаконтан | 4111846763 |
| С9Н20 | Нонан | 35 | С40Н82 | Тетраконтан | 62481801147341 |
| С10Н22 | Декан | 75 | С100Н202 | Гектан | около 5,921·10 39 |
Этан (а также эфир, этанол, алкоголь, алкан) имеют общее происхождение. Древнегреческие философы словом aither называли некую субстанцию, которая пронизывает космос. Когда алхимики в 8 в. получили легко испаряющуюся жидкость из винного спирта и серной кислоты, ее назвали серным эфиром. В 19 в. выяснили, что серный эфир (по-английски ether) относится к так называемым простым эфирам и содержит группировку из двух атомов углерода – такую же, как и этиловый спирт (этанол); эту группировку назвали этилом (ethyl). Таким образом, название вещества «этиловый эфир» (С2Н5–О–С2Н5) – по сути дела «масло масляное».
От «этила» произошло и название этана. Одно из названий этанола, алкоголь, того же происхождение, что и слово алкан (а также алкен, алкин, алкил). По-арабски al-kohl – порошок, пудра, пыль. От малейшего дуновения они поднимаются в воздух, как и винные пары – «алкоголь вина», который со временем превратился просто в алкоголь.
Почему же в «этане» и «этаноле» – буква «т», а в «эфире» – «ф»? Ведь английском языке, в отличие от русского, слова «эфир» (ether) и «этил» (ethyl) имеют сходное написание и звучание. Сочетание th восходит к греческой букве q (тета); в русском языке до 1918 такое же начертание имела буква «фита», которую, однако, произносили как «ф» и использовали с единственной целью отличить слова, в которых эта буква происходит от греческих q и 247 («фи»). В западноевропейских языках греч. j перешла в ph, а q – в th. В русском языке во многих словах «фита» еще в 18 в. была заменена буквой «ф»: театр вместо «qеафтр», математика вместо «маqематика», теория вместо «qеория»… В связи с этим интересно, что в словаре Даля, изданном в 1882, написано эqиръ, а в энциклопедическом словаре Брокгауза и Ефрона (1904) – «эфиръ».
Кстати, сложные эфиры в западных языках – ester, а не ether. Но слова «эстер» в русском языке нет, поэтому любому химику режет глаз неграмотный перевод на этикетках текстильных изделий английского polyester как «полиэстер» вместо «полиэфир», «полиэфирное волокно» (к полиэфирам относятся, например, лавсан, терилен, дакрон).
Названия «пропан» и «бутан» происходят от названий соответствующих кислот – пропионовой и бутановой (масляной). Пропионовая кислота – «первая» (т.е. с самой короткой цепью), которая встречается в жирах (см. ЖИРЫ И МАСЛА), и ее название произведено от греч. protos – первый и pion – жир. Бутан и бутановая кислота (англ. butyric acid) – от греч. butyron – масло; в русском языке бутиратами называются соли и эфиры масляной кислоты. Эта кислота выделяется при прогоркании масла.
Далее, начиная с пентана, названия производятся от греческих числительных. Редкое исключение – цетан, одно из названий гексадекана С16. Это слово происходит от названия цетилового спирта, который в 1823 получил французский химик Мишель Эжен Шеврёль. Шеврёль выделил это вещество из спермацета – воскоподобного вещества из головы кашалота. Слово спермацет происходит от греческих sperma – семя и ketos – крупное морское животное (кит, дельфин). От латинского написания второго слова (cetus) происходят цетиловый спирт С16Н33ОН (гексадеканол) и цетан.
В русском языке немало слов с теми же корнями, что и у алканов: Пентагон, гептахорд (звукоряд из 7 ступеней), додекафония (метод музыкальной композиции), октава, децима и ундецима (музыкальные интервалы), октет и нонет (ансамбли из 8 и 9 музыкантов), пентод, гексод и гептод (радиолампы); гекзаметр (стихотворный размер), октаэдр, декада, декан, гектар, октябрь, декабрь и т.д. и т.п.
Алкан с самыми длинными молекулами был синтезирован английскими химиками в 1985. Это нонаконтатриктан С390Н782, содержащее цепочку из 390 углеродных атомов. Исследователей интересовало, как будут упаковываться такие длинные цепи при кристаллизации (гибкие углеводородные цепочки могут легко складываться).
Число изомеров алканов.
С точки зрения химика число структурных изомеров предельных углеводородов представляет практический интерес только для первых членов ряда. Даже для сравнительно простого алкана, содержащего всего полтора десятка атомов углерода, подавляющее число изомеров не получено и вряд ли будет когда-либо синтезировано. Например, последние из теоретически возможных 75 изомеров декана были синтезированы лишь к 1968. И сделано это было для практических целей – чтобы иметь более полный набор стандартных соединений, по которым можно идентифицировать различные углеводороды, например, те, что встречаются в нефти. Кстати, в различных видах нефти были обнаружены все 18 возможных изомеров октана.
Но самое интересное, что, начиная с гептадекана С17Н36, сначала лишь некоторые из теоретически возможного числа изомеров, затем – многие, и, наконец, почти все являются ярким примером «бумажной химии», т.е. не могут существовать в действительности. Дело в том, что по мере роста числа атомов углерода в молекулах разветвленных изомеров возникают серьезные проблемы пространственной упаковки. Ведь математики рассматривали атомы углерода и водорода как точки, тогда как на самом деле они имеют конечный радиус. Так, метановый «шарик» имеет на «поверхности» 4 атома водорода, которые свободно на ней размещаются. В неопентане C(CH3)4 на «поверхности» уже 12 атомов водорода, расположенные значительно ближе друг к другу; но для них еще есть место для размещения. А вот у алкана [C(CH3)3]4 (С17Н36) на поверхности становится мало места для размещения всех 36 атомов водорода в 12 метильных группах; это легко проверить, если нарисовать плоское изображение (а еще лучше – слепить объемную модель из пластилина и спичек) для подобных изомеров, соблюдая постоянство длин связей С–С и С–Н и всех углов между ними). С ростом n проблемы размещения возникают и для атомов углерода. В результате, несмотря на то, что число возможных изомеров с ростом n увеличивается очень быстро, доля «бумажных» изомеров растет значительно быстрее. Проведенная с помощью компьютеров оценка показала, что с ростом n отношение числа действительно возможных изомеров к числу «бумажных» быстро стремится к нулю. Именно поэтому расчет точного числа изомеров предельных углеводородов для больших n, которое когда-то вызывало значительный интерес, сейчас имеет для химиков лишь теоретическое значение.
Строение и физические свойства алканов.
В алканах различают первичные атомы углерода (они связаны только с одним соседним атомом С), вторичные (связаны с двумя атомами С), третичные (связаны с тремя атомами С) и четвертичные (связаны с четырьмя атомами С). Так, в 2,2-диметил-3-метилпентане СН3–С(СН3)2–СН(СН3)–СН2–СН3 есть один четвертичный, один третичный, один вторичный и пять первичных атомов углерода. Разное окружение атомов углерода очень сильно отражается на реакционной способности связанных с ними атомов водорода.
| Таблица. ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И КИПЕНИЯ АЛКАНОВ | ||
| Алкан | Тпл | Ткип |
| Метан | –182,5 | –161,5 |
| Этан | –183,3 | –88,6 |
| Пропан | –187,7 | –42,1 |
| Бутан | –138,4 | –0,5 |
| Пентан | –129,7 | 36,1 |
| Гексан | –95,3 | 68,7 |
| Гептан | –90,6 | 98,4 |
| Октан | –56,8 | 125,7 |
| Нонан | –51,0 | 150,8 |
| Декан | –29,7 | 174,1 |
| Ундекан | –25,6 | 195,9 |
| Додекан | –9,6 | 216,3 |
| Тридекан | –5,5 | 235,4 |
| Тетрадекан | +5,9 | 253,7 |
| Пентадекан | +9,9 | 270,6 |
| Гексадекан | 18,2 | 286,8 |
| Гептадекан | 22,0 | 301,9 |
| Октадекан | 28,2 | 316,1 |
| Нонадекан | 32,1 | 329,7 |
| Эйкозан | 36,8 | 342,7 |
| Генэйкозан | 40,5 | 356,5 |
| Докозан | 44,4 | 368,6 |
| Трикозан | 47,6 | 378,3 |
| Тетракозан | 50,9 | 389,2 |
| Пентакозан | 53,7 | 399,7 |
Наличие разветвления в цепи резко изменяет физические свойства, особенно температуру плавления. Так, если гексан нормального строения (н-гексан) плавится при –95,3° С, то изомерный ему 2-метилпентан – при –153,7° С. Связано это с трудностью упаковки разветвленных молекул при их кристаллизации. В результате алканы с разветвлениями цепи при быстром охлаждении не кристаллизуются, а переходят в стеклообразное состояние переохлажденной жидкости (см. СТЕКЛО). Например, если тонкую ампулу с пентаном погрузить в жидкий азот (температура –196° С), вещество превратится в белую снегообразную массу, тогда как изопентан (2-метилбутан) застывает в прозрачное «стекло».
На различии геометрической формы линейных и разветвленных алканов основан оригинальный способ их разделения: в кристаллах мочевины имеются каналы, в которых могут поместиться алканы с прямой цепью и не помещаются разветвленные.
Циклоалканы с n = 2, 3 – газы, высшие – жидкости или твердые вещества. Самый большой цикл, который удалось синтезировать химикам, – это циклооктаоктаконтадиктан С288Н576. Разная форма молекул циклоалканов с четным и нечетным числом атомов углерода в молекуле приводит к сильному четно-нечетному эффекту относительно температуры плавления, что видно из таблицы. Объясняется этот эффект различием в «удобстве» упаковки молекул разной формы в кристалле: чем упаковка компактнее, тем прочнее кристалл и тем выше его температура плавления. Например, циклододекан плавится почти на 70° выше его ближайшего гомолога – циклоундекана. Имеет значение, конечно, и масса молекулы: легкие молекулы плавятся при более низкой температуре.
| С3Н6 | –127,5 |
| С4Н8 | –50 |
| С5Н10 | –93,9 |
| С6Н12 | +6,5 |
| С7Н14 | –12 |
| С8Н16 | 14,3 |
| С9Н18 | 9,7 |
| С10Н20 | 10,8 |
| С11Н22 | –7,2 |
| С12Н24 | 61,6 |
| С13Н26 | 23,5 |
| С14Н28 | 54 |
| С15Н30 | 62,1 |
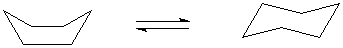
Легкость поворота вокруг связи С–С приводит к тому, что молекулы циклоалканов не плоские (за исключением циклопропана), таким способом они избегают сильного искажения валентных углов. Так, в циклогексане и его высших гомологах валентные углы ненапряженные и близки к тетраэдрическому (109°), тогда как в шестиугольнике углы равны 120°, в восьмиугольнике – 135° и т.д. Отдельные атомы углерода в таких циклоалканах не занимают жестко закрепленного положения: кольцо как бы находится в постоянном волнообразном движении. Так, молекула циклогексана может находиться в виде разных геометрических структур (конформеров), способных переходить друг в друга (инверсия цикла). За внешнее сходство их назвали «ванной» и «креслом» (в англоязычной литературе «ванну» называют «лодкой» – boat):
Форма кресла более устойчива; при обычной температуре циклогексан на 99,9% существует в более устойчивой форме кресла. Переход между двумя формами осуществляется через промежуточную «твист-конформацию» (от англ. twist – скручивать).
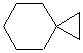
Циклоалканы с двумя циклами и одним общим атомом углерода называются спироалканами. Если же общих углеродных атомов больше двух, то образуются бициклоалканы, трициклоалканы и т.д.. В результате такой «сшивки» сразу нескольких циклов химикам удалось получить углеводороды, пространственное строение которых соответствует различным многогранникам: тетраэдру, кубу, призме и др. Бициклические производные циклогексана содержатся в эфирных маслах, живице хвойных деревьев, скипидаре. Бицикл из шести и пяти атомов углерода содержится в камфоре, холестерине, сахарине, пиперине (он придает жгучий вкус черному перцу), азотистых основаниях – нуклеотидах, других соединениях (при этом некоторые атомы углерода в циклах могут быть соединены двойными связями, а часть – замещена другими атомами как, например, в сахарине). Цикл из 17 атомов углерода (два из них соединены двойной связью) содержится в циветоне – пахучем веществе, составной части мускуса, который применяется в парфюмерии. Красивая молекула адамантана содержит три шестичленных цикла и по структуре соответствует кристаллической решетке алмаза. Адамантановая структура содержится в противовирусном лекарстве ремантадине, в гексаметилентетрамине (в последнем соединении 4 атома углерода заменены атомами азота, которые соединены друг с другом метиленовыми мостиками –СН2–). Ниже представлены структуры некоторых циклоалканов, в молекулах которых более одного по-разному соединенных цикла.
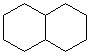
Бициклодекан (тетрагидронафталин, декалин)
Химические свойства алканов.
Алканы – химически наименее активные органические соединения. Все связи С–С и С–Н в алканах одинарные, поэтому алканы неспособны к реакциям присоединения. Для алканов характерны реакции замещения атомов водорода на другие атомы и группы атомов. Так, при хлорировании метана образуются метилхлорид CH3Cl, метиленхлорид CH2Cl2, трихлорметан (хлороформ) CHCl3 и тетрахлорид углерода (четыреххлористый углерод) CCl4. Эти реакции идут по цепному механизму с промежуточным образованием свободных радикалов.
При хлорировании алканов, начиная с пропана, первый же атом хлора может заместить разные атомы водорода. Направление замещения зависит от прочности связи С–Н: чем она слабее, тем быстрее замещение именно этого атома. Первичные связи С–Н, как правило, прочнее вторичных, а вторичные прочнее третичных. В результате хлорирование при 25° С по вторичной связи (СН3)2СН–Н происходит в 4,5 раза быстрее, чем по первичной связи С2Н5–Н, а третичной связи (СН3)3С–Н – в 6,7 раза быстрее. Разная реакционная способность первичных, вторичных и третичных атомов водорода может приводить к тому, что из нескольких возможных продуктов хлорирования будет преобладать только один. Например, при хлорировании 2,3-диметилбутана в растворе сероуглерода (CS2) образуется 95% 2-хлорпроизводного и только 5% 1-хлорпроизводного, т.е. в 19 раз меньше. Если же учесть, что в исходном алкане первичных атомов водорода в 6 раз больше, чем третичных, то отношение их реакционных способностей окажется еще больше (19 ґ 6 = 114). Сероуглерод как растворитель понижает реакционную способность атомов хлора и соответственно повышает его селективность. Аналогично действует понижение температуры.
Атомы брома менее активны; заметная энергия активации этой реакции приводит к тому, что бромирование алканов хотя и идет по цепному механизму, но значительно медленнее, чем хлорирование, и только при повышенной температуре или на свету. Меньшая активность атомов брома приводит и к усилению селективности бромирования. Так, если относительную скорость фотохимического бромирования этана при 40° С принять равной 1, то скорость бромирования пропана (по вторичному атому Н) составит в тех же условиях уже 220, а скорость бромирования изобутана (по третичному атому Н) – 19000
Атомы иода наименее активны, поэтому реакция иодирования алканов RH + I2 ® RI + HI – эндотермическая, возможна только при высоких температурах и идет с очень короткими цепями. Более того, очень легко идет обратная экзотермическая реакция RI + HI ® RH + I2. При иодировании алканов образуются и непредельные соединения. Например, при 685° С этан, реагируя с иодом, образует 72% этилена и 10% ацетилена. Такие же результаты получены с пропаном, бутаном и пентаном.
Реакция фторирования алканов идет с очень высокой, часто взрывной, скоростью с образованием всех возможных полифторпроизводных исходного алкана. Энергия, выделяющаяся при фторировании алканов, настолько велика, что может привести к распаду молекул продуктов на радикалы, которые начинают новые цепи. В результате скорость реакции лавинообразно нарастает и это приводит к взрыву даже при низких температурах. Особенность фторирования алканов – в возможности разрушения углеродного скелета атомами фтора с образованием в качестве конечного продукта CF4 с другими галогенами такая реакция не идет.
Нитрование алканов (реакция Коновалова) также идет по радикальному механизму: RH + NO2 ® R· + HNO2, R· + NO2 ® RNO2. Источником NO2 служит азотная кислота, которая при нагревании распадается. Реакцию проводят в растворе при температуре выше 150° С или в парах под давлением до 10 атм и температуре 400 – 500° С. В последнем случае происходит также разрыв С–С-связей в алканах и образуется смесь нитроалканов.
Значительные усилия химиков были направлены на подробное изучение реакции низкотемпературного окисления алканов с целью остановить ее на стадии образования ценных промежуточных продуктов – альдегидов, кетонов, спиртов, карбоновых кислот. Так, в присутствии солей Co(II), Mn(II) можно окислить бутан до уксусной кислоты, парафин – до жирных кислот С12 – С18. Окислением циклогексана получают капролактам – мономер для производства капрона и адипиновую кислоту.
Важная промышленная реакция – фотохимическое сульфохлорирование алканов: совместная радикально-цепная реакция с Cl2 и SO2 с образованием хлорангидридов алкансульфоновых кислот RSO2Cl. Эта реакция широко используется в производстве моющих веществ. При замене хлора на кислород происходит цепная радикальная реакция сульфоокисления алканов с образованием алкансульфоновых кислот R–SO2–OH. Натриевые соли этих кислот –применяют как моющие и эмульгирующие средства.
При высоких температурах происходит разложение (пиролиз) алканов, например: CH4 ® C + 2H2 (1000° C), 2CH4 ® C2H2 + 3H2 (1500° C), C2H6 ® C2H4 + H2. Последняя реакция идет при 500° С в присутствии катализатора (Ni). Аналогично из бутана можно получить 2-бутен СН3СН=СНСН3, одновременно образуется смесь этилена и этана. В отличие от этой радикальной реакции, каталитический крекинг алканов протекает по ионному механизму и служит для получения бензина из более тяжелых нефтяных фракций. При нагревании в присутствии кислот Льюиса, например, AlCl3 происходит изомеризация: неразветвленные (нормальные) алканы превращаются в разветвленные с тем же числом атомов углерода. Эта реакция имеет большое практическое значение для получения высококачественного моторного топлива (см. ОКТАНОВОЕ ЧИСЛО). Дегидрирование алканов может сопровождаться замыканием цикла (дегидроциклизация). В случае дегидроциклизации гексана основным продуктом является бензол.
Метан при высокой температуре в присутствии катализатора реагирует с водяным паром и оксидом углерода(IV) с образованием синтез-газа: CH4 + H2O ® CO + 3H2, CH4 + CO2 ® 2CO + 2H2. Синтез-газ используют для получения моторных топлив и метилового спирта.
В последние годы усилия химиков направлены на создание катализаторов, активирующих связи С–Н в молекулах алканов в мягких условиях. Подобные реакции «умеют» осуществлять некоторые микроорганизмы, ферменты которых способны «переваривать» даже парафин с образованием белковых соединений. Задача химиков – понять, как действуют природные катализаторы и смоделировать ферментативные реакции, которые могут идти при обычной температуре. При этом в качестве катализаторов используются различные металлоорганические соединения. Например, в присутствии некоторых платиновых соединений можно получать метанол СН3ОН непосредственно из метана, а в присутствии трифенилфосфинового комплекса родия Rh[(C6H5)3P], связанного с молекулами СО; в ходе реакции молекулы СО внедряются по связи С–Н алканов с образованием альдегидов.
Циклоалканы по химическим свойствам напоминают алканы. Так, они горючи, могут галогенироваться по радикальному механизму, при повышенной температуре в присутствии катализаторов дегидрируются – отщепляют водород и превращаются в непредельные углеводороды. Особыми свойствами, как говорилось, обладает циклопропан. В отличие от алканов, циклоалканы гидрируются, при этом цикл раскрывается и образуются алканы, например: цикло-C3H6 + H2 ® C3H8 (реакция идет при нагревании в присутствии платинового катализатора). С увеличением размера цикла реакция затрудняется – так, уже циклопентан гидрируется (до пентана) с большим трудом и при высокой температуре (300° С).
Нахождение в природе и получение.
Алканы получают и пиролизом (коксованием) каменного угля и его гидрирования (получение синтетического жидкого топлива). Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев, цветов и семян растений, входят в состав пчелиного воска.
Применение алканов.
Алканы в составе бензина, керосина, солярового масла, мазута используются в качестве топлива. Высшие алканы входят в состав смазочных масел, вазелина и парафина. Смесь изомерных пентанов и гексанов называется петролейным эфиром и применяется в качестве растворителя. Циклогексан также широко применяется в качестве растворителя и для синтеза полимеров (капрон, найлон). Циклопропан используется для наркоза. Сквалан – высококачественное смазочное масло, компонент фармацевтических и косметических препаратов, адсорбент в газожидкостной хроматографии.
Алканы служат сырьем для получения многих органических соединений, в том числе спиртов, альдегидов, кислот. Хлорпроизводные алканов используют как растворители, например, трихлорметан (хлороформ) CHCl3, тетрахлорметан CCl4. Смесь высших алканов – парафин нетоксичен и широко применяется в пищевой промышленности для пропитки тары и упаковочных материалов (например, пакетов для молока), при производстве жевательных резинок. Парафином пропитывают карандаши, верхнюю (вблизи головки) часть спичек для их лучшего горения. Разогретый парафин используют в лечебных целях (парафинолечение). Окисление парафина в контролируемых условиях в присутствии катализаторов (органические соли переходных металлов) приводит к получению кислородсодержащих продуктов, главным образом, органических кислот.
Петров А.А. Химия алканов. М., Наука, 1974
Азербаев И.Н. и др. Синтезы на основе нефтяных углеводородов. Алма-Ата, Наука, 1974
Рудаков Е.С. Реакции алканов с окислителями, металлокомплексами и радикалами в растворах. Киев, Наукова думка, 1985
Пэрэушану В. Производство и использование углеводородов. М., Химия, 1987