Фосфатидилхолин и фосфатидилсерин в чем разница
Лецитин и другие фосфолипиды
Что такое лецитин? Слово «лецитин»имеет два значения. Это постоянно порождает путаницу и в понятиях, и в расчётах содержания фосфолипидов (сложных липидов, которые содержат остаток фосфорной кислоты).
В узком смысле лецитин – это фосфатидилхолин –один из наиболее распространённых фосфолипидов. А в широком смысле «лецитином» называют смесь разных фосфолипидов, где фосфатидилхолин является доминирующей фракцией.
Наиболее распространёнными фосфолипидами являются:
Какую роль играют разные фосфолипиды? Большинство врачей и даже диетологов не видят различия в составе фосфолипидов. Для них важно, чтобы фосфолипиды были. А какие они – не имеет значения. Между тем, разные фосфолипиды играют далеко не одинаковую роль. Дело в том, что разные органы и ткани (мембраны клеток) содержат в своём составе разные типы фосфолипидов.
Значение ФОСФАТИДИЛХОЛИНА:
Значение ФОСФАТИДИЛСЕРИНА:
Значение ФОСФАТИДНОЙ КИСЛОТЫ:
Разные источники различаются составом фосфолипидов:
Источник «лецитина»
Рекомендации по приему фосфолипидов:
Фосфолипиды широко представлены в составе животных и растительных продуктов. В суточной дозе обычной смешанной пищи человека содержится около 5,0 г фосфолипидов, и, примерно, столько же (5,25 г) фосфолипидов содержится в 3-х желтках куриных яиц. Подчеркнём, что это количество – ниже уровня адекватной потребности.
Диетологи рекомендуют дополнительно принимать фосфолипиды в количестве 1-3 г/сутки, допускают употребление 4-6 г/сутки. При этом подчёркивают, что положительное действие фосфолипидов проявляется, начиная с дозы 800 мг.
Одна капсула «Лецитин НСП» содержит 206,6 мг чистых фосфолипидов. Официальная рекомендация по приёму продукта – 2 капсулы х 2 раза в день, что обеспечивает поступление 826,4 мг фосфолипидов.
Мы провели сравнительный фармакоэкономический анализ нашего продукта «Лецитин НСП» с другими продуктами – источниками фосфолипидов, которые зарегистрированы в РФ.
На рис.1 показано содержание фосфолипидов в составе одной капсулы. Как видно из графика, в большинстве продуктов содержание фосфолипидов примерно одинаковое и составляет около 200 мг на одну стандартную капсулу.
Мы рассчитали среднюю стоимость месячного курса приёма этих продуктов. Как следует из расчётов наш «Лецитин НСП» является наиболее выгодным источником незаменимых фосфолипидов среди аналогов, имеющихся на нашем рынке, при условии ежедневного приёма 826 мг фосфолипидов (доза, соответствующая 4 капсулам «Лецитина НСП»).
«Наш лецитин»
Подсолнечный лецитин от производителя
0 товаров в корзине
Свежие записи
Рубрики
Статьи
Экстракт семян расторопши (силимарин, флаволигнаны)
Лецитин — «бронежилет для печени»
Лецитин против «синдрома менеджера»
Лецитин – здоровый и умный ребенок
«Лецитиновый» человек
Важней всего — фундамент дома, а остальное…
Наш лецитин
Новая болезнь цивилизации (дефицит фосфолипидов)
Анализ и рекомендации в применении комплекса «Наш лецитин для мужчин» для развития силовых способностей.
Янтарная кислота (сукцинат)
Экстракт эхинацеи пурпурной (оксикоричневые кислоты)
Эссенциальные фосфолипиды (масло подсолнечника)
Фосфолипиды в кардиологии
Супер-защита для печени
С чем и как «едят» лецитин?
Правильное питание
Сравнительный анализ лецитинов, полученных из разных видов сырья
Лецитин – коммерческое название комплекса липидов с преобладанием фосфолипидов, соответствующего установленным требованиям.
Фосфолипиды – вещества, содержащиеся в клетках всех живых организмов, выполняющие жизненно важные функции, связанные с регулированием обменных процессов и защитой клеточных мембран. Входя в состав клеточных мембран, фосфолипиды обеспечивают их регенерацию, влияя на биологическую активность мембранных белков и рецепторов, играют решающую роль в активации ферментов, регулируют многочисленные метаболические процессы, в том числе превращения веществ жировой природы, обеспечивая липидный обмен.
Основные физиологически функциональные свойства лецитинов определяются групповым составом (видом полярной группы) и жирнокислотным составом (видом ацилов жирных кислот) фосфолипидных молекул. Эти показатели также определяют основные отличия лецитинов, полученных из разных видов сырья.
Главными сырьевыми источниками лецитинов являются желток яйца и семена масличных растений.
В яйцах фосфолипиды находятся главным образом в желтке, где в основном связаны в комплексы с белками (преимущественно с вителлином), углеводами и холестерином.
В семенах масличных растений фосфолипиды входят в состав липидного комплекса и извлекаются совместно с нейтральными липидами (маслом).
Усредненные данные, характеризующие групповой состав фосфолипидов, находящихся в лецитинах, полученных из различных видов сырья, представлены в таблице 1.
| Наименование групп фосфолипидов | Содержание групп фосфолипидов, % к сумме | ||
| Яичный лецитин | Соевый лецитин | Подсолнечный лецитин | |
| Фосфатидилхолины (ФХ) | Нет данных | 24 | 36 |
| Фосфатидилэтаноламины (ФЭА) | Нет данных | 26 | 17 |
| Фосфатидилинозитолы (ФИ) | Нет данных | 19 | 24 |
| Фосфатидилсерины (ФС) и лизофосфатидилэтаноламины (ЛФЭА) | Нет данных | следы | следы |
| Фосфатидные кислоты (ФК) | Нет данных | 4 | 4 |
| Фосфатидилглицерины (ФГ) и дифосфатидилглицерины (ДФГ) | Нет данных | 9 | 14 |
| Полифосфатидные кислоты (ПФК) | Нет данных | 8 | 5 |
| Сфингомиелины (СГ) | Нет данных | отсутствие | отсутствие |
| Соотношение ФХ/ФЭА | Нет данных | 1,4:1,0 | 2,1:1,0 |
Из представленных данных видно, что подсолнечный лецитин характеризуется наибольшим содержанием фосфатидилхолинов — группы фосфолипидов, обладающей наиболее широким спектром физиологического действия, в том числе проявляющей выраженные гипохолестеринемические, гиполипидемические и гепатопротекторные свойства.
Наряду с фосфатидилхолинами, содержание которых несколько выше у подсолнечного лецитина по сравнению с соевым, важным показателем биологической активности фосфолипидов является соотношение между фосфатидилхолинами и фосфатидилэтаноламинами, которое влияет на структурные особенности и взаимодействие фосфолипидных молекул. Большее значение данного соотношения у подсолнечного лецитина свидетельствует о его большей биологической активности.
Данный вывод подтверждают результаты исследований Института Биомедицинской химии РАМН, показавшие, что фосфолипиды семян подсолнечника, по сравнению с фосфолипидами семян сои, обладают существенно большей степенью гепатопротекторного действия, которое заключается в более активном регенеративном действии на биологические мембраны, в частности, на мембраны гепатоцитов.
Следует отметить высокое содержание в подсолнечном лецитине фосфатидилинозитолов – группы фосфолипидов, проявляющей важные физиологически функциональные свойства, специфика которых является предметом изучения современной медицины.
Состав ацилов жирных кислот, присутствующих в лецитинах, полученных из разных видов сырья, представлен в таблице 2.
| Наименование жирных кислот | Содержание жирных кислот, % от суммы | ||
| Яичный лецитин | Соевый лецитин | Подсолнечный лецитин | |
| Миристиновая С14:0 | Отсутствует | 0,1 | 0,1 |
| Пальмитиновая С16:0 | 26,0 | 22,0 | 19,6 |
| Стеариновая С18:0 | 14,0 | 4,6 | 3,6 |
| Арахиновая С20:0 | Отсутствует | 0,2 | 0,3 |
| Бегеновая С22:0 | Отсутствует | 0,4 | 1,1 |
| Лигноцериновая С24:0 | Отсутствует | 0,4 | 0,4 |
| [Символ] S | 40,0 | 27,7 | 24,5 |
| Пальмитолеиновая C16:1 | Отсутствует | 0,1 | 0,1 |
| Олеиновая С18:1 (ω9) | 36,0 | 10,7 | 14,6 |
| Линолевая С18:2 (ω6) | 15,0 | 55,4 | 60,4 |
| Линоленовая С18:3 (ω3) | 1,0 | 6,0 | 0,2 |
| Эйкозеновая С20:1 | Отсутствует | 0,1 | 0,2 |
| Арахидоновая кислота С20:4 (ω6) | 5,0 | Отсутствует | Отсутствует |
| Докозагексаеновая кислота С22:6 (ω3) | 3,0 | Отсутствует | Отсутствует |
| Другие | — | — | — |
| [Символ] US | 60,0 | 72,3 | 75,5 |
Как видно из представленных данных, яичный лецитин отличается от подсолнечного и соевого большим содержанием насыщенных жирных кислот, относящихся к атерогенным факторам питания. Положительным отличием яичного лецитина является присутствие в жирнокислотном составе физиологически активных арахидоновой и докозагексаеновой жирных кислот, дефицит которых обусловливает возникновение и развитие различных патологий, что особенно существенно для детей раннего возраста.
Следует отметить, что арахидоновая кислота относится к заменимым и синтезируется в организме из незаменимой линолевой кислоты, тогда как докозагексаеновая кислота является незаменимой и в организм поступает только с продуктами питания. Несмотря на отмеченный факт, основными источниками докозагексаеновой кислоты являются не яичные лецитины, а жиры морских рыб. Тем не менее, это является одним из факторов, обусловливающих использование именно яичного лецитина в производстве препаратов для детей раннего возраста.
Следует отметить, что наряду с высокой стоимостью яичного лецитина, обусловленной как стоимостью исходного сырья, так и высоко затратной технологией его производства, широкое использование яичного лецитина сдерживается риском потенциальной микробиологической загрязненности. Необходимо помнить о том, что низкая стоимость яичного лецитина всегда сопряжена с высоким риском микробиологической обсемененности.
Соевый лецитин отличается большим количеством линоленовой кислоты, относящейся к классу ω3 антиатерогенных жирных кислот. Этот благоприятный с физиологической точки зрения факт в тоже время определяет более низкую стабильность соевого лецитина к окислительной порче и определяет особые требования к технологии его производства и условиям хранения.
Подсолнечный лецитин отличается от соевого большим количеством олеиновой и линолевой кислот. Это характеризует физиологическую ценность данного вида лецитина, так как моноеновые ω9 кислоты способствуют снижению риска сердечно-сосудистых заболеваний, а линолевая кислота является эссенциальной.
Важным аспектом физиологической ценности лецитинов является так называемое позиционное распределение ацилов жирных кислот в молекуле фосфолипидов.
Так, присутствие в молекуле фосфатидилхолина двух ацилов линолевой кислоты является ключевым фактором, обусловливающим активность таких фосфатидилхолинов в нормализации мембранных расстройств и нивелировании связанных с ними заболеваний при введении в организм.
Кроме того, в научной литературе имеются данные, свидетельствующие о том, что фосфатидилхолины с двумя ацилами линолевой кислоты проявляют выраженные антиоксидантные, противовоспалительные, антифиброгенные и другие физиологически функциональные свойства.
Согласно данным (K.-J. Gundermann Is 1.2-Dilinoleoylphosphatidylcholine (DLPC) the Key Ingredient in Polyenylphosphatidylcholine (PPC) from soybean to Treat Membrane Damages? // 15-th International Conference «Phospholipids: New Opportunities in Technology, Analytical, Chemistry and Applicatinons», Оctober 12-13, 2016) в соевом лецитине содержание фосфатидилхолинов с двумя ацилами линолевой кислоты составляет в среднем 40,6 %, а в подсолнечном – 64,2 %, что свидетельствует о большей физиологической ценности последнего.
Результаты исследований состава сопутствующих веществ и минорных компонентов лецитинов представлены в таблице 3.
Данные, представленные в таблице 3, демонстрируют одно из основных различий между лецитинами растительного происхождения и яичным лецитином, которое состоит в составе стеролов, присутствующих в них наряду с фосфолипидами: яичный лецитин содержит холестерин, а растительные – фитостерины.
Присутствие холестерина в сочетании с высоким содержанием насыщенных жирных кислот снижает гипохолестеринемические и антиатерогенные свойства яичного лецитина и может являться противопоказанием для использования лицами с повышенным холестерином.
Фитостерины, напротив, обладают антиатерогенными свойствами и их повышенное (по сравнению с соевым) присутствие в подсолнечном лецитине объясняет присущие ему выраженные гипохолестеринемические и антиатерогенные свойства.
Наличие в составе неомыляемых липидов соевого лецитина, повышенного содержания пигментов (каротиноидов и хлорофиллов) часто обусловливает необходимость проведения процесса отбелки с использованием перекиси водорода при получении товарной продукции, что отрицательно сказывается на его физиологической ценности. Кроме того, присутствие хлорофиллов, обладающих прооксидантной активностью, является нежелательным с точки зрения пищевой ценности и обеспечения стабильности готовой продукции при хранении.
Представленные в таблице 3 данные, характеризующие состав минеральных элементов растительных лецитинов, свидетельствуют о значимом преобладании в составе подсолнечного лецитина биоусвояемого калия и магния, что является благоприятным для лиц, страдающих сердечно-сосудистыми заболеваниями.
Проводя сравнительный анализ физиологической ценности растительных лецитинов нельзя не остановиться на оценке рисков, связанных с использованием сырья, подвергшегося генетической модификации.
В мировой практике традиционным сырьем для получения растительных лецитинов является соя, в связи с чем подавляющее большинство лецитинов зарубежного производства, представленных на потребительском рынке РФ и стран Таможенного союза, получены из семян сои.
В последнее время, более 95 % сои получают с применением методов генной инженерии. Это заставляет основных производителей фосфолипидосодержащих продуктов (лецитинов и БАД на их основе) искать новые сырьевые ресурсы, о чем свидетельствует возрастающий спрос европейских производителей на подсолнечный лецитин, основным производителем которого является Россия.
Результаты клинических испытаний порошкового подсолнечного лецитина, проведенные в клинике Института Питания РАМН (г. Москва), а также в медицинских учреждениях Москвы, Тюмени, Краснодара показали, что он обладает выраженным гиполипидемическим, гипохолестеринемическим, мембранопротекторным и антиоксидантным действием.
Механизм гиполипемического действия подсолнечного лецитина в первую очередь связан с участием составляющих его фосфолипидных молекул в модификации клеточных мембран, в частности, в процессах, повышающих степень их «ненасыщенности» и, таким образом, изменяющих их физико-химические характеристики и биологические свойства.
Отсюда вытекает и другой возможный механизм гиполипемического действия подсолнечного лецитина, опосредованный через эффект простагландинов, простациклинов, лейкотриенов, в качестве предшественников синтеза которых выступают ПНЖК омега-6 как один из структурных компонентов фосфолипидных молекул.
Учитывая полученные при проведении медико-биологических и клинических исследований данные о способности фосфолипидов подсолнечника ингибировать процессы перекисного окисления липидов (ПОЛ) в тромбоцитах, подсолнечный лецитин можно рассматривать как эффективное средство в комплексной терапии сахарного диабета.
Принимая во внимание, что одним из серьезных осложнений сахарного диабета являются нарушения липидного обмена, выраженная гиполипидемическая активность подсолнечного лецитина делает его перспективным средством для использования в профилактике и лечении осложнений, сопутствующих различным формам диабета.
Гепатопротекторные свойства подсолнечного лецитина обусловлены тем, что при патологии печени его молекулы предотвращают дистрофические изменения гепатоцитов и образование некрозов, а также усиливают репарационные процессы даже в большей степени, чем соевые.
Обследование больных хроническим панкреатитом, проведенное в условиях Республиканского центра функциональной хирургической гастроэнтерологии (г. Краснодар), показало, что в результате приема порошкового подсолнечного лецитина в количестве 6 граммов в два приема в течение 16 дней у большинства пациентов отмечалась положительная динамика клинической картины заболевания, снижение содержания холестерина в крови на 22,1 %, триглицеридов — на 19,7 %, диеновых конъюгатов — на 13,8 %.
Вместе с тем отмечено снижение содержания гексахлорциклогексана в крови на 52,3 %, что связано с положительным влиянием на функциональное состояние печени и желчевыводящих путей и усилением элиминации пестицидов с желчью. В группе сравнения, получавшей только симптоматическое лечение без приема подсолнечного лецитина, указанный эффект был выражен в значительно меньшей степени.
Имеется опыт использования порошкового подсолнечного лецитина в санаторно-курортных учреждениях гг. Сочи, Геленджика, Анапы. Положительные результаты были отмечены при использовании подсолнечного лецитина в комплексном лечении при заболеваниях желудочно-кишечного тракта (сан. «Металлург», г. Сочи), в комплексных общеоздоровительных программах (сан. им. Ф. Дзержинского, сан. «Русь» г. Сочи).
Быстро проявляющееся благоприятное воздействие подсолнечного лецитина на липидный обмен, процессы перекисного окисления липидов позволяет рассматривать этот вид лецитина как перспективное средство в профилактике и комплексной терапии целого ряда заболеваний, в патогенезе которых лежат нарушения вышеуказанных процессов.
Фосфатидилхолин и фосфатидилсерин в чем разница
В настоящее время активно разрабатываются новые способы доставки ЛС с целью увеличения их биодоступности [6, 8]. Одной из таких систем являются фитосомы. В этих структурах водорастворимые растительные компоненты вступают в реакцию с фосфолипидами, при достижении равновесия между гидрофильными и гидрофобными радикалами, увеличивается способность преодоления липидного слоя клеточных мембран и растворения в желудочно-кишечных жидкостях [5].
Особый интерес представляют фитосомы с флавоноидами из-за широкого спектра фармакологической активности этих соединений. Однако гидрофильность данного класса существенно снижает их проницаемость через кожный барьер и всасывание в ЖКТ, следовательно, снижается биодоступность флавоноидов и оказываемый эффект [1].
Целью настоящего исследования стало информационно-аналитическое исследование свойств, способов получения и применения новой лекарственной формы – фитосомы.
Результаты исследования и их обсуждение
Строение и назначение фитосомы. Название «фитосома» недаром созвучно с «липосома». В состав обеих лекарственных форм входят липиды, однако строение фитосом существенно отличается от липосомальных лекарственных форм. В структуре липосомы активное вещество либо растворено внутри фосфолипидного «шарика», либо находится в слое мембраны, а также может быть конъюгировано на поверхности мембраны [16, 21]. Фитосома отличается от липосомы тем, что фитокомпонент ковалентно связан с полярной головкой фосфолипидов, являясь неотъемлемой частью мембраны. Некоторые липосомальные препараты действуют в водной среде или буферном растворе, тогда как фитосомы активны с растворителями, имеющими низкую диэлектрическую проницаемость [17, 18, 20].
Обобщая литературные данные, можно дать следующее определение понятию фитосома – это флавоноидная молекула, связанную по крайней мере с одной молекулой фосфатидилхолина. Она является молекулой-гибридом, обладающей высокой растворимостью в липидной и в водной средах. В водных средах фитосомы группируются в мицеллу [8, 10, 22].
Несмотря на разницу в строении, сходство фитосомы и липосомы проявляется в их предназначении. Как и липосома, фитосома используется для увеличения биодоступности лекарственного компонента, более направленной доставки, повышения эффективности действия и снижения терапевтической дозы лекарства [5, 16].
В фитосоме активное вещество хорошо преодолевает кожный барьер и предотвращает разрушение фитокомпонентов под действием пищеварительных ферментов и кишечных бактерий. Это приводит к улучшению терапевтической эффективности. Следовательно, дозы, требуемые для достижения желаемого эффекта, также снижаются [20].
На сегодняшний день известны фитосомы с экстрактами гинкго билоба, расторопши, виноградных косточек, боярышника, зеленого чая и женьшеня. Флавоноидные и терпеноидные соединения этих экстрактов хорошо связываются с фосфатидилхолином [5, 18, 19].
Эффективность фитосомальных лекарственных форм доказана клинически. Так, например, гепатопротекторные свойства плодов расторопши пятнистой связаны с присутствием в них силибина [9], который, однако, имеет ограниченную биодоступность. Были проведены клинические испытания силибина в виде фитосомы дозировкой от 240 до 360 мг в течение 150 дней [12]. В качестве контроля использовали «плацебо» (n = 117) или силибин вне комплекса (n = 49). Для оценки клинического действия были изучены энзимные уровни аспартат-аминотрансферазы (AST), аланин-аминотрансферазы (ALT) и гамма-глутамилтранспептидазы (GGT). Исследователи пришли к выводу, что фитосомальная форма силибина оказывает значительно более выраженный клинический эффект [16].
Способ получения фитосомы. Технология получения фитосом предполагает включение фосфолипидов (таких как фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин) в стандартизованные растительные экстракты [5, 16].
Фитосомы получают реакцией взаимодействия между 1–2 молями фосфолипида с 1 молем активного растительного компонента (флавоноиды или терпеноиды) в апротонном растворителе (диоксан, ацетон, метиленхлорид, этилацетат). Затем комплекс выделяют путем выпаривания растворителя в вакууме или осаждением с реагентом, таким как алифатические углеводороды, путем лиофилизации или методом распылительной сушки. Наиболее оптимальное соотношение компонентов в фитосоме 1:1 [5, 10, 19].
В литературе встречается ряд методик получения фитосом. Например, для образования комплекса силимарина с соевым фосфатидилхолином 1:1 поступают следующим образом: к раствору 5 г силимарина в 100 мл ацетона добавляют 8 г реактива «Липоид S 100 (R) », при перемешивании при комнатной температуре. После полной солюбилизации реакционную смесь концентрируют в вакууме до объема 30 мл и приливают к 300 мл лигроина, при перемешивании. Осадок отстаивают в течение ночи, затем его отделяют фильтрованием, промывают лигроином и сушат в вакууме при 40 °С. Выход составляет 11,2 г комплекса. При изучении спектральных характеристик полученного фитосомального комплекса было установлено, что удельный показатель поглощения составляет 170,2 при 288 нм (растворитель – метанол) [7].
Вторым примером может служить методика получения фитосомы силибина с соевым фосфатидилхолином в соотношении 1:2. К суспензии, содержащей 4,82 г (0,010 моль) силибина в 75 мл диоксана, добавляют при перемешивании 15,4 г (0,020 моль) «Липоид S 100 (R) ». Через 4 часа реакционную смесь лиофилизируют. Выход составил 20 г комплекса светло-желтого цвета с удельным показателем поглощения, равным 106 при 288 нм в растворе метанола [7].
Для получения комплекса силибина с соевым фосфатидилхолином 1:0,3 раствор силибина в диоксане (2,41 г (0,005 моль) силибина на 100 мл диоксана) обрабатывают при 60 °С реактивом «Липоид S 100 (R) » массой 0,770 г (0,001 моль) в течение 1 часа. Реакционную смесь упаривают досуха в вакууме и остаток переносят в 100 мл хлороформа. Избыток силибина, присутствующий в виде осадка, удаляют фильтрованием, а маточный раствор, содержащий комплекс, выпаривают досуха в вакууме. Полученный остаток сушат при 30 °С под вакуумом. Выход составляет 2,3 г комплекса в виде белого желтоватого порошка. Удельный показатель поглощения метанольного раствора полученного комплекса равен 300 при 288 нм (CH3OH) [7].
Методика получения фитосомы экстракта гинкго билоба с соевым фосфатидилсерином заключается в следующем: 1,87 кг 20 % фосфатидилсерина суспендируют в 17,5 л этилацетата при комнатной температуре. Добавляют сухой экстракт гинкго билоба (0,65 кг) и перемешивают. Суспензию выдерживают в течение 1 часа при перемешивании при кипячении с обратным холодильником, затем фильтруют при 70–75 °C и концентрируют при давлении окружающей среды до получения мягкого осадка. Осадок сушат при 40 °C в течение 48 часов. Выход продукта: 2,23 кг комплекса экстракт гинкго билоба – фосфатидилсерин [3].
Интерес представляют фитосомы с индивидуальными флавоноидами, поскольку из-за разнообразия фармакологических эффектов этих соединений можно существенно расширить ассортимент лекарственных средств, обладающих хорошей биодоступностью.
Фитосомы кверцетина с фосфатидилхолином и холестерином получают с использованием метода тонкослойной гидратации с различным молярным отношением кверцетина, фосфатидилхолина и холестерина. Кверцетин и фосфатидилхолин растворяют в метаноле, а холестерин – в дихлорметане. Смесь помещают в круглодонную колбу и упаривают на роторном испарителе при 45 °С до образования пленки. Затем с помощью вакуумной сушки полностью удаляют органические растворители. Дополнительно готовый липидный тонкий слой подвергают воздействию потока газообразного азота и выдерживают в течение ночи при комнатной температуре, чтобы обеспечить полное удаление органических растворителей. Пленку увлажняют дистиллированной водой в роторном аппарате при 45 °С. Для уменьшения размера фитосомы применяют: диспергирование в ультразвуковой ванне при 45 °С, гомогенизацию в центрифуге с 20000 оборотов в минуту и метод ультразвуковой обработки [11, 12].
Физико-химическая оценка фитосом. Фитосомы можно охарактеризовать по форме, размеру, плотности распределения, % связанного вещества в объеме, количеству высвобождаемого вещества, стабильности [2, 6, 15].
В литературе встречается пример оценки свойств кверцетин-фосфатидилхолин-холестеринового фитосомального комплекса. Средний размер частиц фитосом, полученных при молярных соотношениях 1: 2: 0 и 1: 2: 0,2 кверцетина : фосфатидилхолина : холестерина, составил 79 нм и 82 нм соответственно. Анализ частиц, проведенный на приборе Malvern, Nano series, S90 Zetasizer, Великобритания, показал узкое распределение. При увеличении концентрации холестерина увеличивалась и толщина липидного бислоя. По результатам исследования эффективность инкапсуляции кверцетина в фитосоме была в пределах 96–98 % и не менялась в зависимости от изменений молярных соотношений компонентов системы. Анализ показал, что при добавлении холестерина стабильность фитосом возрастает за счет ограничения ацильных цепей фосфатидилхолина [9, 15].
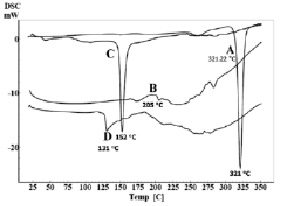
ДСК-термограмма чистого кверцетина (A), фосфатидилхолина (В), холестерина (С) и фитосомального комплекса (D)
Удельную теплоту плавления определяли с помощью дифференциального сканирующего калориметра (DSC 60, Shimadzu, Япония) [15]. Дифференциальные сканирующие (ДСК) термограммы чистого кверцетина, холестерина, фосфатидилхолина и фитосомального комплекса показаны на рисунке. Эндотермический пик кверцетина наблюдался в 321.22 °C (рисунок, А), соответствующий его точке плавления. ДСК-термограмма фосфатидилхолина и холестерина также показали эндотермические пики при 205 °С и 152.45 °С соответственно (рисунок, B, C). Термограмма фитосомального комплекса (рисунок, D) показала исчезновение эндотермического пика плавления кверцетина и значительное смещение эндотермического пика плавления холестерина в нижних точках плавления. Эти наблюдения показали, что кверцетин был молекулярно распределен на поверхности и внутри матрицы фитосомы и утратил свою кристаллическую структуру. Кверцетин и фосфатидилхолин образуют водородные связи между гидроксильными группами кверцетина и полярной части фосфатидилхолина [2, 15].
В литературе встречаются примеры определения удельной температуры плавления рутин-фосфатидилхолинового комплекса с помощью прибора Perkin Elmer JADE DSC, США. Также данный комплекс исследовали с помощью ИК-спектроскопии на Alpha FT-IR спектрофотометре (Bruker, Германия), образец исследовали на просвечивающем электронном микроскопе JEOL (JEM 2100), Япония [4, 13].
Выводы
1. По сравнению с традиционными лекарственными растительными формами фитосомы наиболее перспективны в доставке растительных экстрактов, т.к. абсорбция и биодоступность водорастворимых компонентов возрастает благодаря их взаимодействию с фосфолипидами.
2. В литературе присутствуют данные о фитосомах, содержащих преимущественно растительные экстракты, богатые флавоноидами, или индивидуальные флавоноиды. Однако данные о возможности включения других растительных гидрофильных, мало растворимых в воде соединений в липидные комплексы, отсутствуют. Это открывает широкие перспективы для исследователей в разработке методов получения новых фитосомальных комплексов.
3. Фитосомы – как лекарственная форма – новое, только развивающееся направление. Для его правильного становления необходима разработка единых подходов к оценке качества фитосом. В существующих литературных примерах методы физико-химической оценки этой лекарственной формы представлены крайне скудно или вовсе отсутствуют.