Фосфор для чего используется
Производство и получение фосфора
Одним из наиболее важных биогенных элементов признан именно фосфор. Его отсутствие делает невозможным жизнедеятельность многих живых организмов, в том числе и человеческого, поскольку он содержится в белках, фосфолипидах, и многих других органических соединениях, среди которых АТФ и ДНК. Одновременно с этим неорганика фосфора является богатой разнообразными молекулами. Участвует в образовании свыше 200 минералов, из которых наиболее приоритетными являются фосфорит и апатит.
Фосфором называется химический элемент, название которого с древнегреческого означает «светоносный». В периодической системе Менделеева фосфор занял место в 15-й группе третьего периода. Он относится к группе химических элементов под названием пниктогены.
Существует несколько версий открытия данного элемента. Наиболее раннее упоминание о существовании фосфора можно найти в алхимических записях, которые датируются 12 веком. Само название элемента в подобных работах отсутствует, однако, можно встретить сведения о получении неизвестного «светящегося» вещества.
По официально версии фосфор был открыт в 1669 году обанкротившимся торговым купцом, пытающимся найти философский камень. Произошло это случайно во время многократного прокаливания мочи человека, в результате чего было образовано вещество, от которого исходил яркий свет.
Получение фосфора
Современные ученые владеют многими методами, посредством которых можно синтезировать фосфор. Наиболее популярным считается его восстановление из минералов, в составе которых он содержится. Как правило, таковыми являются апатиты или фосфориты, взаимодействующие с коксом и кремнеземом в достаточно высоких температурных условиях (порядка 1600 0 С). Производство фосфора, в данном случае, осуществляется в специальных печах.
В природе данный химический элемент широко распространен. Фосфор обладает очень сильной химической активностью, в связи с чем не встречается в свободном состоянии. Он содержится в земной коре и воде, однако к наиболее крупным его запасам во всем мире относятся морские фосфориты наряду с продуктами их выветривания. Ученые считают, что последние имеют океаническое происхождение.
Так, фосфаты формировались путем разных органических и неорганических процессов на протяжении очень продолжительного времени в прибрежных регионах пояса пассатов. Фосфаты аккумулировались из внешней среды, что привело к многократному увеличению концентрации фосфоритов в месторождении.
Сегодня наиболее крупные такие месторождения находятся на территории Марокко, а также Западной Сахары, Америки, Китая, Туниса, Казахстана. Пальма первенства в этом принадлежит именно Марокко – на долю этой страны приходится 70% от всех запасов фосфатов в мире. Но, не смотря на это, среди стран-производителей фосфора Марокко расположилась на втором месте, пропустив вперед США. По данным на 2002 г. в мире из года в год добывается порядка 135 млн. тонн данного вещества.
Стоит отметить, что не все месторождения данного вещества могут называться промышленными. Таковыми принято считать только те, из 1 га которых можно получить фосфатную породу в количестве минимум 6000 тонн и более. Добыча фосфата осуществляется в открытых карьерах с применением скребковых экскаваторов. Первым делом происходит очистка от песчаных наносов и пустых пород, после чего и начинается извлечение фосфатной руды, путь которой к обогатительным фабрикам пролегает по стальным трубам. Стоит сказать, что таким образом руда может преодолевать расстояния в несколько километров.
В морской воде вид данного вещества несколько отличается от других мест его нахождения. Так в водной среде фосфор представлен ортофосфат-анионом, концентрация которого, в среднем, насчитывает около 0,07 мг 3 /л. Общий океанический объем фосфора составляет 9,8*1010 тонн.
Применение фосфора
| Вещества | Область применения |
|---|---|
| Белый фосфор | Получение красного фосфора, зажигательных и дымообразующих веществ, в металлургии. |
| Красный фосфор | В производстве спичек: P+KCLO3+S+MnO2+Fe2O3 |
| P2O5 | Получение фосфорной кислоты |
| H3PO4 | Получение фосфорных солей и удобрений |
| Используются в качестве фосфорных удобрений в сельском хозяйстве |
Сфер человеческой деятельности, в которых применяется фосфор и его соединения, колоссальное множество. Это связано, прежде всего, с тем, что как само вещество, так и его соединения, принимают очень важное, неотъемлемое, участие в биологических процессах живых организмов.
Кроме этого, с участием данного химического элемента осуществляется производство такого очень известного предмета, которым пользуется каждый человек, как спички. С его участием изготавливаются взрывчатые соединения, зажигательные бомбы, некоторые виды топлива, смазочные материалы. Использование фосфора уместно для производства антикоррозионных материалов, при производстве ламп накаливания, в качестве средства для снижения жесткости воды, а также для поглощения газов. Кроме этого, фосфор является распространенным веществом, применяемым в сельском хозяйстве в качестве материала для удобрения почвы. Также он является активным участником химических синтезов во время производства различных веществ.
Ну и ко всему стоит добавить, что фосфор – это жизненно необходимый элемент, на котором основывается синтез ДНК, РНК и фосфолипидов
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
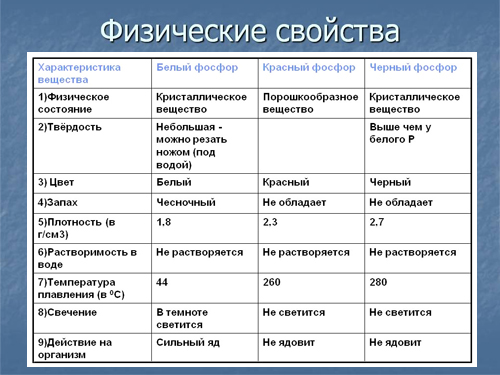
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
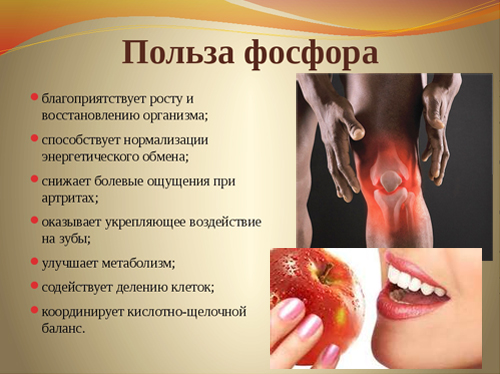
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Фосфор (Р) – роль в организме, применение, суточная потребность, источники
Фосфор (Phosphorus, Р) – химический элемент, который играет важную роль макроэлемента в организме человека и берет непосредственное участие в формировании, развитии и поддержании здоровья сердечно-сосудистой системы, головного мозга и опорно-двигательного аппарата.
Основными функциями фосфора также являются – превращение жиров, углеводов, передача нервных импульсов, синергичная работа с кальцием в формировании костного скелета и зубов. Данный элемент входит в состав фосфолипидов, белков, ДНК и АТФ, в связи с чем по праву имеет титул – «элемент жизни».
В чистом виде Р из-за высокой химической активности практически не встречается, тем не менее, он участвует в образовании около 190 минералов, наиболее популярными из которых являются – апатит и фосфорит. По расчётам ученых, масса земной коры на 0,08-0,09% состоит из фосфора.
История – краткая справка
Свое название фосфор получил от двух древнегреческих слов «φῶς» (свет), и «φέρω» (несу), объеденив которые получаем – светоносный.
Впервые о существовании фосфора заявил в 1669 году немецкий алхимик из г. Гамбург – Хеннинг Бранд (Hennig Brandt). Получил же Бранд совершенно случайно – когда пытался добыть золото из человеческой мочи. Конечно, логика у людей тех времен была уникальна – раз моча золотистая, значит в ней может присутствовать золото. В результате многодневного отстаивания, а после длительного выпаривания мочи, вместо жидкости в емкости остались белые воскоподобные частички непонятного вещества, которые могли ярко гореть и мерцать в темноте. Нововыявленное вещество Х.Бранд назвал «чудотворным носителем света» (phosphorus mirabilis).
Далее, Р смогли добыть — немецкий химик Иоганн Кункель (Johannes Kunckel), в 1680 г. англо-ирландский химик и физик Роберт Бойль (англ. Robert Boyle), в 1743 г. немецкий химик Андреас Маргграф (Andreas Marggraf) и другие.
Получить красный фосфор сумел в середине XIX в — А.Шрёттер, что произошло при нагревании белого фосфора без контакта с кислородом.
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, V группа, в новой версии таблицы – 15 группа, 3 период.
Физико-химические свойства. Фосфор известен во многих модификациях – белый, красный, желтый, черный, металлический и др., которые еще называются аллотропными. Физические и химические свойства напрямую зависят от его формы, особенно его химическая активность.
Белый фосфор – химически активное вещество белого цвета с легкой желтизной или зеленоватостью, схожее на парафин, легко поддается деформации при небольших физических усилиях. Плохо растворим в воде, при контакте с кислородом и светом начинает светиться бледно-зеленым цветом. Небольшое воздействие температуры способно привести к самовозгоранию вещества. Очень ядовит – попадание внутрь всего 0,05-0,15 г вещества может привести к летальному исходу. При контакте с кожей также способен самовоспламеняться, после чего оставляет сильные ожоги.
Красный фосфор – более устойчивая форма элемента к термическому воздействию, которую получают из его белой формы. Окрашен в красные, фиолетовые цвета с металлическим отблеском. Не растворяется в воде, не светится в темноте, способен самопроизвольно загореться при ударе или трении. Ядовитость в тысячи раз меньше по сравнению с белым. Применяется при изготовлении спичечных коробков – входит в состав терочной поверхности.
Биологическая роль фосфора в организме
В организме фосфор присутствует в виде ортофосфорной и пирофосфорной кислот. Этот элемент входит в состав фосфолипидов, АТФ (аденозинтрифосфорная кислота), нуклеиновых кислот (ДНК, РНК), фосфопротеидов, нуклеотидов, различных ферментов и коферментов. В костях человека Р находится в форме гидроксилапатита, в зубной эмали – в виде фторапатита.
В целом, 1% массы тела человека припадает на фосфор в тех или иных формах, из которых около 85% элемента содержится в составе костей из зубов.
Регулирование метаболизма фосфорных соединений производят витамин D и гормоны.
Фосфор выполняет множество важных и полезных функций, среди которых:
Применение фосфора в других сферах человеческой жизни
Суточная потребность
Рекомендуемые суточные дозы фосфора в зависимости от пола и возраста:
| Дети | до 1 года | 100-275 мг |
| От 1 до 3 лет | 460-3000 мг | |
| От 3 до 9 лет | 500-3000 мг | |
| Подростки | от 9 до 18 лет | 1250—4000 мг |
| Взрослые | от 18 до 70 лет | 700-4000 мг |
| Лица преклонного возраста | старше 70 лет | 700-3000 мг |
| Во время беременности | до 3000—3500 мг |
Для максимальной эффективности усваивания организмом фосфора его необходимо одновременно употреблять с кальцием, в соотношении – 1,5 (Р) : 1 (Са).
Суточная доза фосфора повышается при обильных физических нагрузках, занятиях спортом.
Нехватка фосфора — симптомы
Дефицит фосфора в организме (гипофосфатемия) дает о себе знать, когда его количество в сыворотке крови составляет 0,81-0,32 ммоль/л и меньше. Это может вызвать ряд осложнений со здоровьем, среди которых:
Причины нехватки фосфора
Применение фосфора в медицине
Применение Р с лечебной целью целесообразно в следующих случаях:
В качестве препаратов фосфора чаще всего применяют биофосфонаты («Этидронат»), «Кальция глицерофосфат».
Избыток фосфора
Избыток фосфора в организме (гиперфосфатемия) также, как и нехватка может вызвать ряд осложнений со здоровьем, среди которых:
Причины переизбытка фосфора
Источники фосфора
В каких продуктах содержится фосфор больше всего?
Химические источники (Р): «Этидронат», «Кальция глицерофосфат», «Фосален», витаминно-минеральные комплексы «Витрум», пищевые добавки Е338, Е339, Е340, Е341, Е342, Е343.
Взаимодействие фосфора с другими веществами
Избыточное количество в организме алюминия, кальция, магния, железа, эстрогенов, андрогенов и тироксина понижают усвояемость фосфора, а также его полную активность;
Прием Р в сочетании с кальцием (пропорция 1,5 Р к 1 Са) взаимодополняют друг друга, тем самым повышая свою активность.
Повышенное количество витамина D способствует переизбытку фосфора, однако, недостаток D приводит к недостатку Р.
При воздействии кислорода — Р легко окисляется.
Видео
Фосфор как химический элемент таблицы Менделеева
Как был открыт Фосфор
История открытия фосфора является очень интересной. Вообще, кандидатов на открытие фосфора было очень много, так как несколько ученых объявили об открытии приблизительно одновременно. Само открытие было сделано 1669 году немецким алхимиком Хеннигом Брандом. Его желание создать легендарный «филосовский камень» и позволило свершиться этому открытию. Он ставил опыты над мочой в надежде из нее получить золото. Его предположение основывалось на том, что и то и другое одного цвета. Бранд держал мочу несколько дней пока та не начала издавать ужасный запах. После этого он сварил ее в пасту и нагрел до высокой температуры. Образовавшиеся пары он проводил через воду в надежде, что они сконденсируют в золото. Вместо этого он получил белое воскообразное вещество, которое светилось в темноте. Вот таким способом был открыт новый химический элемент.
Кстате, фосфор действительно является первым химическим элементом, который был по настоящему открыт. То есть об этом элементе не было известно вообще ничего и ни о каких его формах.
Где и как добывают Фосфор
Фосфор как отдельный химический элемент получают из фосфатных минералов, таких как фосфорит или апатит. Распространенность этих минералов довольно широкая. Ими в достаточных количествах обладают Россия, Китай, Индия, Канада, Бразилия и многие другие страны.
Получают элементарный фосфор нагревом фосфорита или апатита с кварцевым гравием при температуре около 1500°C. Необходимым условием является то, чтобы печь была выполнена в виде закрытой шахтной печи. Тепло должно передаваться через электроды Содерберга. Углеродная масса, содержащаяся в электроде действует как восстановитель, а диоксид кремния в этом случае служит в качестве генератора шлака. Газообразный фосфор конденсируется и собирается под водой в результате химичнских реакций.
Распространенность Фосфора
Распространенность фосфора является не полностью определенной. О распространенности фосфора во вселенной известно довольно немного. В 2013 году ученые выдвинули предположение, что фосфор в больших количествах вырабатывается при появлении сверхновых звезд. Не понятно из каких соображений сделаны такие выводы, но факт такого открытия присутствует.
Что касается Земли, то тут можно заметить, что ученые оценивают отношение содержания фосфора в земной коре как один грамм на один килограмм массы. В свободном виде из-за его высокой реакционной способности фосфор не встречается. Основные формы фосфора на Земле в виде соединений в минералах. К самым коммерчески важным относят апатит, вавеллит, вивианит и бирюзовый. На сегодняшний день дефицита фосфора не предвещается, но предположительно запасов хватит только на 400 лет.
Так же фосфор содержится в помете некоторых животных и птиц. В основном это касается морских животных и птиц. В пример можно привести гуано, которое является пометом птиц. Они могут содержать от 7 до 60% фосфатных соединений. Эти птицы были завиксированны на небольших островах принадлежащих современным Перу и Чили. Это свидетельствует о том, что океан является безграничным неизведанным запасом фосфора. Ежегодная добыча фосфоросодержащих минералов оценивается приблизительно в 180 миллионов.
Применение Фосфора
Что касается применения фосфора, то тут можно явно отметить, что на сегодняшний день оно является не очень широким. Сегодня 80% из 180 млн тонн добываемых фосфоросодержащих минералов перерабатывается до оксида фосфора(V), который является важнейшим сырьем для производства удобрений и различного рода средств защиты для растений. Таким образом большая часть переходит в пользование химической прлмышленности. Оставшаяся часиь фосфора тратится на металлургию, пищевую промышленность, медицину, изготовление фарфора и военное дело.
Интересные факты
Интересных фактов связанных с фосфором достаточно много. Стоит начать с того, что потенциал фосфора в полной мере еще не реализован. Это предположение выдвигается потому что он играет огромную роль в организме человека. В частности уже известно, что фосфор является составной частью цепей РНК и ДНК. На сегодняшний день ведуться исследования по воздействию на эти цепи. Вы только представьте, что в один прекрасный день можно будет избавиться от всех страшных болезней путем воздействия на цепь ДНК человека. Среднестатистический взрослый человек имеет около 700 грамм фосфора в составе своего организма. Большая его часть содержится в костях и зубах в виде аппатита. Недостаток фосфора в организме может пагубно влиять на здоровье человека.
Стоит отметить еще высокую токсичность этого элемента. Вернее не его самого, а именно его аллотропов. В пример можно привести белый фосфор. Раньше использование белого фосфора было очень широко. Чтобы было понятней его использовали даже в спичках, вместо привычной нам сегодня серы. От него пришлось отказаться из-за его высокой токсичности. Так же он имеет возможность самовоспламеняться. Температура самовоспламенения его пыли составляет 34°C, что очень приближено к комнатной. Поэтому он представляет опасность со всевозможных сторон безопасности.
Фосфор
Фосфор/ Phosphorus (P), 15
2,19 [1] (шкала Полинга)
(белый фосфор)1,82 г/см³
21,6 [3] (ромбич.) Дж/(K·моль)
Содержание
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος ) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярное строение; формула P4. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.
Легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией).
Белый фосфор не только активен химически, но и весьма ядовит (вызывает поражение костей, костного мозга, некроз челюстей). Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.
Жёлтый фосфор
для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·10 5 Па.
Металлический фосфор
При 8,3·10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·10 11 Па — ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность резко снижается. Белый фосфор на воздухе светится в темноте, свечение обусловлено окислением паров фосфора до низших оксидов.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:


Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
фосфиды разлагаются водой и кислотами с образованием фосфина

Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водой, при этом протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В растворах щелочей также протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:

Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Токсикология элементарного фосфора
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³. [6]
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества зарин, зоман, табун, V-газы являются соединениями фосфора.