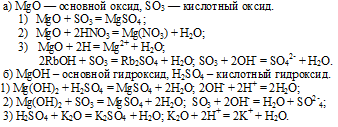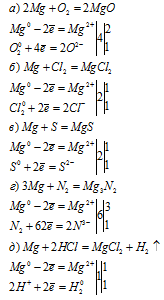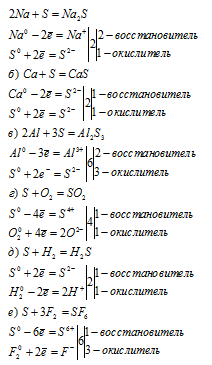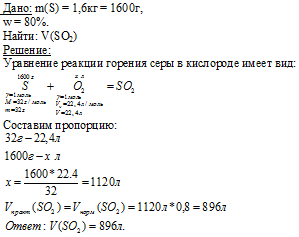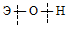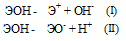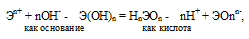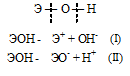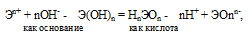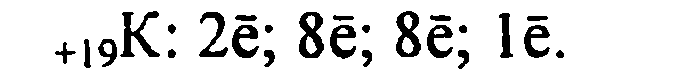Фосфор обладает более выраженными неметаллическими свойствами чем мышьяк
Характеристика химических элементов на примере фосфора, калия и магния
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами:
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
Аллотропия химических элементов
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S):
Физические свойства ромбической серы (S2):
вещество лимонно-желтого цвета, устойчивое до t = 95,6 °С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, так как в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.
Вопрос 8.
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов:
Правильное составление формул веществ хрома, селена, мышьяка, ванадия, серы, азота, углерода, сурьмы
Ванадий d-элемент VВ- группы, а мышьяк – р-элемент VА- группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять эти электроны. Эти атомы обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия сильнее выражены, чем у мышьяка.
Задание 48.
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Решение:
Марганец в своих соединениях проявляет степень окисления +2, +3, +4, +6, +7.
Формулы оксидов, отвечающих этим степеням окисления:
Формулы гидроксидов марганца:
Mn(OH)2 – гидроксид марганца(II);
Mn(OH)3 – гидроксид марганца(III);
Mn(OH)4 – гидроксид марганца(IV);
H2MnO4 – марганцовистая кислота;
HMnO4 – марганцовая кислота.
Mn(OH)4 – гидроксид марганца(IV) – амфотерное основание, которое реагирует как с кислотами, так и со щелочами:
Хром d-элемент VIВ- группы, а селен – р-элемент VIА – группы. На внешнем энергетическом уровне у атома хрома один электрон, а у атома селена – шесть. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, и, следовательно, тенденцией терять их. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трёх электронов, обладают определённым сродством к электрону, и, следовательно, приобретают определённую отрицательную степень окисления и даже образуют элементарные отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома сильнее выражены, чем у селена. К тому же селен, присоединив два электрона к наружному р-подуровню, проявляет отрицательную степень окисления и образует с водородом газообразное соединение H2Se, которое называют селеноводород.
Формулы соединений алюминия с данными элементами в этой степени окисления:
AlCl3 – хлорид алюминия;
Al2S3 – сульфид алюминия;
AlN – нитрид алюминия;
Al4C3 – карбид алюминия.
+15Р 1s 2 2s 2 2p 6 3s 2 3p 3 ; +51Sb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 3
На внешнем энергетическом уровне оба элемента содержат по пять валентных электронов, из которых два s-и три р-электрона.
Так как фосфор – элемент третьего периода, а сурьма – пятого, то из этого следует, что радиус атома фосфора значительно меньше, чем у атома сурьмы. В группах с увеличением порядкового номера элементов закономерно увеличиваются радиусы их атомов, что приводит к уменьшению связи внешних электронов; поэтому атом фосфора обладает определённым сродством к электрону, и, следовательно, приобретает отрицательную степень окисления и имеет больше шансов образовывать отрицательные ионы. Таким образом, фосфор, как все неметаллы, обладает только очень слабыми восстановительными свойствами и более сильными окислительными функциями. Сурьма, имея большие размеры атома, будет легче отдавать электроны внешнего энергетического уровня, чем принимать и поэтому будет проявлять восстановительные функции, т. е. обладать характерными металлическими свойствами.
Задание 52.
Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ва(ОН)2 или Мg(OH)2; Ca(OH)2 или Fе(ОН)2; Сd(ОН)2 или Sr(OH)2.
Решение:
Гидроксиды можно изобразить общей формулой ЭОН, где Э – металл. Гидроксиды могут диссоциировать по схеме:
Диссоциация зависит от прочности и полярности связей Э — О и О — Н и может протекать по двум направлениям:
Задание 53.
Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: СuОН Или Сu(OH)2; Fе(ОН)2 или Fе(ОН)3; Sn(ОН)2 или Sn(ОН)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Решение:
Если данный элемент проявляет переменную степень окисления (валентность) и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства послед-них меняются от основных к амфотерным и кислотным. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э — О и О — Н может протекать по двум направлениям:
Полярность связей, в свою очередь, определяется разностью электроотрицательностей компонентов, размерами и эффективными зарядами ионов. Диссоциация по кислотному типу (II) протекает, если
ЕО—Н > ЕЭ—О (низкая степень окисления).
Если прочности связей Э — О и О — Н близки или равны, то диссоциация гидроксида может одновременно протекать и по основному (I), и по кислотному типу (II). В этом случае речь идёт об амфотерных электролитах (амфолитах):
Отсюда вытекает, что гидроксид меди (I) CuOH более сильное основание, чем гидроксид меди (II) Cu(OH)2; а Fe(OH)2 более сильное основание, чем Fe(OH)3; Sn(OH)2 более сильное основание, чем Sn(OH)4.
Фосфор мышьяк
Горящий фосфор не только причиняет очень сильные ожоги, но и вызывает отравление тканей, прилежащих к месту ожога, вследствие чего заживление идет крайне медленно. При ожогах фосфором противоядием служит мокрая повязка, пропитанная 5% раствором медного купороса.
В связи с тем что белый фосфор легко окисляется и воспламеняется, его хранят под водой. Нужно следить за тем, чтобы в банке постоянно была вода и чтобы тем-пература в помещении, где находится белый фосфор, не спускалась ниже нуля. В противном случае вода может замерзнуть и разорвать сосуд, а потом при оттаивании вытечь и фосфор, оставшись без воды, может воспламениться.
Окисление белого фосфора на воздухе сопровождается выделением световой энергии, благодаря чему белый фосфор светится в темноте. Это свечение, в конце концов, может привести к самовоспламенению и вызвать пожар, Если в процессе реакции кусочек белого фосфора упадет на пол, его нужно найти и сжечь или поместить в банку с водой.
Красный фосфор — порошок с слабо выраженной кристаллической структурой и потому названный аморфным, темно-красного цвета, весьма гигроскопичен (легко погло-щает воду), но в воде нерастворим; нерастворим он и в сероуглероде. Плотность его 2,20. Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450°. При нагревании красный фосфор возгоняется, и пары его при охлаждении превращаются в белый фосфор. Красный фосфор в отличие от белого не ядовит, запаха не имеет. Воспламеняется он при температуре 250—300°.
Фиолетовый и черный фосфор также получают из белого фосфора при высоком давлении и температуре. Черный фосфор обладает металлическим блеском, проводит тепло и электричество. Следовательно, у фосфора в весьма незначительной степени, появляются металлические свойства.
Химическая активность у разных аллотропных видоиз-менений фосфора неодинакова. Например, они имеют разную температуру воспламенения, белый фосфор светится в темноте, красный не светится.
Наличие на внешнем электронном слое фосфора 3 неспаренных р-электронов позволяет предположить, что для фосфора должно быть возможно образование трех валентных связей с другими элементами. Таковы ионные соединения с металлами — фосфиды, например фосфид магния Мg3Р2, летучее водородное соединение фосфин РН3 с полярными молекулами. Вследствие того что у фосфора сравнительно небольшая электроотрицательность, эти соединения при непосредственном синтезе образуются с большим трудом, и потому их предпочитают получать косвенным путем.
■ 50. Составьте и заполните таблицу: (См. Ответ)
| Свойства | Белый фосфор | Красный фосфор |
| Плотность Цвет Температура плавления Температура воспламенения Растворимость в воде Растворимость в сероуглероде Запах Физиологическое действие Самопроизвольное свечение |
Фосфористый водород РН3, или фосфин, неустойчив, может самовоспламеняться на воздухе, сильный восстановитель. Фосфин — газ, обладающий неприятным запахом гнилой рыбы. В отличие от аммиака почти не дает реакций соединения, с водой не взаимодействует. Практического значения фосфин не имеет. С элементами, обладающими большей, чем у фосфора, электроотрицательностью, фосфор реагирует очень энергично.
Если в сосуд с хлором внести красный фосфор, то через несколько секунд он самовоспламеняется в хлоре. При этом обычно получаются соединения трехвалентного фосфора. Это соединение образуется легче, чем РСl5, так как ковалентная связь в РСl3 возникает за счет не-спаренных р-электронов фосфора, а в образовании РСl5 участвуют все валентные электроны.
Взаимодействие фосфора с кислородом протекает также весьма энергично. Фосфор, предварительно подожженный на воздухе, сгорает в кислороде ослепительно ярким пламенем с образованием фосфорного ангидрида Р2О5:
4Р + 5О2 = 2Р2О5
При медленном окислении получается фосфористый ангидрид Р2О3.
■ 51. Выпишите из текста все уравнения, характеризующие свойства фосфора.
52. Какого типа химическая связь образуется в молекулах соединений фосфора с водородом, магнием, хлором, кислородом? (См. Ответ)
Свободный фосфор получают из фосфорита сплавлением с песком и углем в электропечи. Реакция протекает в две стадии:
а) Са3(РО4)2 + 3SiO2 = Р2О5 + 3CaSiО3
б) P2O5 + 5С = 2Р + 5СО
Са3(РО4)2 + 3SiО2 + 5С = 3CaSiО3 + 5СО + 2Р
На первой стадии двуокись кремния вытесняет из фосфата кальция фосфорный ангидрид. На второй стадии фосфорный ангидрид восстанавливается углем до свободного фосфора. Выделяющиеся пары фосфора охлаждают водой. В результате выделяется белый фосфор.
■ 53. Сколько фосфора можно получить промышленным путем, если в процессе реакции образуется 20 м3 окиси углерода? Сколько фосфорита будет израсходовано, если известно, что последний содержит 65% фосфата кальция?
54. Сколько фосфора можно получить из 5 m фосфата кальция, если выход фосфора равен 90% от теоретического? (Задачу решите, не применяя уравнение реакции). (См. Ответ)
В промышленности при изготовлении спичек находит применение главным образом красный фосфор. Белый фосфор начал применяться в спичечной промышленности раньше красного, в 1830 г. Такие спички легко зажигались при трении о любую поверхность, но были весьма ядовиты и вредны для здоровья, а также огнеопасны, поэтому от них вскоре отказались, заменив белый фосфор красным.
Фосфор применяется для изготовления некоторых его соединений, например фосфорного ангидрида Р2О5, фосфорной кислоты Н3РО4 и т. д.
■ 55. Что такое аллотропия и аллотропные видоизменения того или иного элемента?
66. Какие вам известны элементы, способные образовывать аллотропные видоизменения?
67. Чем объясняется различие в свойствах у разных аллотропных видоизменений одного и того же элемента? (См. Ответ)
Кислородные соединения фосфора
Наиболее устойчивой и распространенной кислотой является ортофосфорная, или просто фосфорная, кислота. Это кислота устойчивая, средней силы, нелетучая. В лаборатории фосфорная кислота хранится в виде концентрированных растворов, а в чистом виде это твердое кристаллическое вещество. Фосфорная кислота — кислота средней силы. Она значительно слабее таких сильных кислородных кислот, как серная или азотная.
Фосфорная кислота диссоциирует ступенчато:
Н3РО4 ⇄ Н + + Н2РO4 — ⇄ 2Н + + HPO 2 4 — ⇄ 3Н + + PO 3 4 —
С водой фосфорная кислота смешивается в любых отношениях. Это кислота трехосновная, поэтому она образует три ряда солей. Соли фосфорной кислоты называются фосфатами, или ортофосфатами. Если в кислоте замещены все три атома водорода, например Ca3(PО4)2, Na3PО4, то такие соли называются средними, или трехзамещенны-ми, фосфатами. Если в кислоте замещены только два атома водорода, например Na2HPО4, CaHPО4, Fe2(HPО4)3, то такие кислые соли называются двухзамещенными фосфатами, или гидрофосфатами. Если в кислоте замещен только один атом водорода, например NaH2P04, Са(Н2РО4)2, Fe(H2PО4)3, то такие кислые соли называются однозамещенными, или дигидрофосфатами.
Образуется осадок фосфата серебра желтого цвета, который растворяется в азотной кислоте в отличие от иодида серебра.
■ 58. Составьте рассказ о кислородных соединениях фосфора по следующему плану: (См. Ответ)
1) формула высшего окисла фосфора;
2) тип химической связи между атомами в молекуле высшего окисла фосфора;
3) к какой группе окислов относится фосфорный ангидрид? Докажите это, приведя уравнения соответствующих реакций;
4) фосфорные кислоты, их формулы эмпирические и графические;
5) фосфаты, их состав и применение.
59. Напишите уравнение следующих реакций в молекулярной, полной и сокращенной ионной формах:
а) дигидрофосфат кальция + гидроксид кальция;
6) фосфат кальция + фосфорная кислота;
в) фосфат кальция + серная кислота;
г) фосфат калия + нитрат бария. (См. Ответ)
Мышьяк
а затем полученный окисел восстанавливают углеродом:
As2O3 + 3С = ЗСО + 2As
В природе в свободном виде мышьяк не встречается.
Мышьяк может быть получен в виде трех аллотропных видоизменений, из которых наиболее распространен серый мышьяк.
Серый мышьяк темно-серого цвета с металлическим блеском, нерастворим ни в воде, ни в органических растворителях, легко образует сплавы с металлами, обладает тепло- и электропроводностью. Его плотность 5,73. Все это указывает на то, что у мышьяка уже проявляются металлические свойства. Как металл он менее активен чем водород, и не вытесняет его из кислот.
Желтый мышьяк — желтое кристаллическое, легко окисляющееся вещество, довольно легко переходящее в серый мышьяк.
Черный мышьяк — аморфное вещество, переходящее при слабом нагревании в серый мышьяк — наиболее устойчивую форму.
Химические свойства мышьяка подчеркивают его амфотерность. Например, мышьяк реагирует с хлором, образуя хлорид мышьяка:
2As + 3Сl2 = 2AsCl3.
Это соль, в которой мышьяк играет роль трехвалентного металла.
При сгорании мышьяка на воздухе или в кислороде образуется мышьяковистый ангидрид:
4As + 3О2 = 2As2O3
в котором мышьяк ведет себя как кислотообразующий элемент. Мышьяковистый ангидрид имеет белый цвет и потому получил название «белого мышьяка», которое, как ясно из формулы, не соответствует составу соединения. Этот ангидрид плохо растворим в воде.
■ 60. Изобразите распределение электронов по энергетическим уровням атома мышьяка и размещение электронов на орбиталях внешнего слоя.
61. Какие аллотропные видоизменения имеет мышьяк?
62. Что такое «белый мышьяк»? (См. Ответ)
Соединения мышьяка
При растворении в воде мышьяковистого ангидрида образуется ортомышьяковистая, или мышьяковистая кислота:
As2O3 + 3Н2O = 2H3AsO3
Это слабая кислота, известная лишь в водных растворах. Мышьяковистая кислота амфотерна. Она может диссоциировать двояко:
3Н + + AsO 3 3 — ⇄ H3AsO3 ⇄ As3 + + 3ОН —
в щелочной среде в кислой среде
Ортомышьяковистая кислота очень легко разлагается с образованием более устойчивой метамышьяковистой кислоты:
H3AsO3 = HAsO2 + Н2O
Ортомышьяковистая кислота является хорошим восстановителем. Соли мышьяковистых кислот называются арсенитами.
Соединения мышьяка применяются при выделке кож, мехов. Особенно широко их используют в сельском хозяйстве для борьбы с вредителями. В медицине мышьяк применяется в виде арсената натрия Na2HAsО4 и арсенита калия KAsО2. Мышьяк входит в состав лечебного препарата новарсенола. В качестве микроэлемента мышьяк стимулирует жизнедеятельность животных и человека и всегда содержится в незначительном количестве в моче и тканях животных и растений.
Мышьяк в свободном состоянии добавляют в некоторые сплавы для придания им твердости, устойчивости к окислению и других свойств.
■ 63. Напишите в молекулярной и ионных формах уравнения реакций мышьяковистой кислоты: а) с соляной кислотой; б) с едким натром.
64. Каково физиологическое действие соединений мышьяка?
65. Где применяются соединения мышьяка? (См. Ответ)
У какого элемента фосфора или мышьяка свойства неметалла выражены ярче
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Вариант 1
1. У какого элемента сильнее выражены неметаллические свойства: а) у кислорода или углерода; б) у фосфора или мышьяка? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у кислорода (неметалличность усиливается слева направо по периоду)
б) у фосфора (неметалличность усиливается снизу вверх по группе)
2. Дайте характеристику элемента №11 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как и почему изменяются свойства химических элементов в периодах? Покажите это на примере элементов 3-го периода.
4. Рассчитайте относительную атомную массу бора, если известно, что доля изотопа 10B составляет 19,6%, а изотопа 11В – 80,4 %. (Ответ: 10,8.)
Вариант 2
1. У какого элемента сильнее выражены металлические свойства:
а) у лития или рубидия; б) у калия или скандия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у рубидия (металличность усиливается сверху вниз по группе)
б) у калия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №7 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Как изменяются свойства химических элементов в А-группах? Покажите это на примере элементов IIA-группы.
4. Сколько различных видов молекул оксида углерода (IV) можно получить из изотопа углерода 12C и трех изотопов кислорода: 16О, 17О, 18О? Напишите формулы всех оксидов и рассчитайте их молярные массы.
Вариант 3
1. У какого элемента сильнее выражены неметаллические свойства: а) у хлора или йода; б) у серы или кремния? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у хлора (неметалличность усиливается снизу вверх по группе)
б) у серы (неметалличность усиливается слева направо по периоду)
2. Дайте характеристику элемента №12 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Какие общие свойства проявляют элементы одних и тех же групп? Покажите это на примере элементов VIIA-группы.
4. Медь имеет два изотопа: 63Cu и 65Cu. Их доли в природной меди составляют 73 и 27? Соответственно. Рассчитайте среднюю относительную массу меди. (Ответ: 63,5.)
Вариант 4
1. У какого элемента сильнее выражены металлические свойства: а) у бериллия или стронция; б) у натрия или алюминия? Дайте обоснованный ответ на основании положения элементов в периодической таблице.
а) у стронция (металличность усиливается сверху вниз по группе)
б) у натрия (металличность усиливается справа налево по периоду)
2. Дайте характеристику элемента №16 по плану:
Положение в периодической таблице
Металл или неметалл
Строение атома
Электронная формула
Число электронов на наружном энергетическом уровне, является ли он завершенным
Формула высшего оксида
Образует ли элемент летучее соединение с водородом, если образует, какова его химическая формула
3. Что общего и каковы различия в строении малых и больших периодов? Покажите это на примере 3-го и 4-го периодов.
Малые периоды состоят из одного ряда (3-й период), большие и двух рядов (4-й период). Свойства элементов меняются строго от металлов к неметаллам в любом периоде. 4-й период содержит на 10 элементов больше, чем 3-й. Эти элементы являются переходными металлами, у них заполняется d-подоболочка предыдущего энергетического уровня.
4. Оксид элемента имеет состав ЭО3. Массовая доля кислорода в этом оксиде составляет 60%. Какой элемент образуется оксид?