Фосген с чем реагирует
Фосген
| Фосген | |
 | |
 | |
| Общие | |
|---|---|
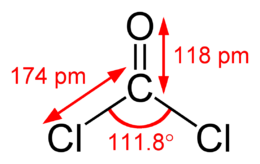
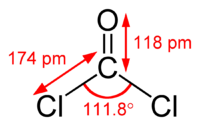
| Химическая формула | CCl2O |
| Физические свойства | |
| Молярная масса | 98,92 г/моль |
| Термические свойства | |
| Температура плавления | −118 °C |
| Температура кипения | 8,3 °C |
| Структура | |
| Дипольный момент | 1,17 Д |
| Классификация | |
| Рег. номер CAS | 75-44-5 |
| SMILES | O=C(Cl)Cl |
| Безопасность | |
| Токсичность | удушающее действие |
Фосге́н (дихлорангидрид угольной кислоты) — химическое вещество с формулой CCl2O, при нормальных условиях — бесцветный газ с запахом прелого сена. Синонимы: оксид-дихлорид углерода, карбонилхлорид, хлорокись углерода.
Обладает удушающим действием. Использовался в Первую мировую войну как боевое отравляющее вещество.
Содержание
Свойства
tкип= 8,2 °C, tпл= −118 °C, плотность в жидкой фазе 1,403 г/см³ (при температуре кипения), в газовой фазе 4,248 кг/м³ (15 °C, 1 бар) [1] ; плохо растворим в воде, хорошо — в органических растворителях. Фосген представляет собой бесцветный газ, который ниже 8,2 °C конденсируется в бесцветную жидкость. Его запах напоминает прелые фрукты или сено. Технический продукт имеет слегка желтоватую или красновато-жёлтую окраску. Фосген примерно в 3,5 раза тяжелее воздуха. Из-за высокого давления пара он даже при низких температурах обладает большой летучестью. Фосген можно легко конденсировать сжатием, его критическая температура составляет 183 °C, критическое давление 56 кгс/см². В холодной воде фосген растворим мало −0,9 %. Он легко растворим в органических растворителях, например в бензине, толуоле, ксилоле, уксусной кислоте, хлороформе. В маслах и жирах фосген не растворим.
При обычной температуре фосген — стабильное соединение. При сильном нагревании он частично разлагается на хлор и окись углерода. Выше 800 °C он полностью диссоциирует. Количество ядовитых продуктов разложения при взрыве ничтожно, поэтому возможно применение фосгена во взрывных боеприпасах.
При хранении фосгена в стальных ёмкостях, например при длительном нахождении в минах, образуется пентакарбонил железа Fe(CO)5. Это — красновато-жёлтая жидкость, тяжелее фосгена, и разлагаемая на свету фотокаталитически с образованием ядовитой окиси углерода. Фосген почти не гидролизуется парами воды, поэтому концентрация фосгена, созданная в воздухе, заметно изменяется лишь через долгое время. При высокой влажности воздуха облако фосгена за счёт частичного гидролиза может приобрести беловатый отсвет.
Энергично реагирует с аммиаком с образованием карбамида и хлорида аммония:
Данная реакция используется для экспресс-обнаружения утечек фосгена — смоченный раствором аммиака тампон в присутствии фосгена начинает заметно выделять белый дым из кристалликов хлорида аммония. Обнаружению фосгена этим способом мешает хлор, который с аммиаком также образует дым хлорида аммония.
Получение
Впервые фосген получил Дэви в 1812 г.
Фосген образуется при окислении хлороформа кислородом воздуха под действием света.
В промышленности получают нагреванием СО с Cl2 в присутствии угля.
В лаборатории может быть легко получен несильным нагреванием смеси CCl4 и SO3 (или олеума):
Токсичность
Токсические свойства
Фосген очень ядовит, но только при вдыхании паров. Первые отчетливые признаки отравления появляются после скрытого периода от 4 до 8 ч; наблюдались даже периоды в 15 ч.
По различным данным вдыхание фосгена в концентрации 0,004 мг/л в течение 60-90 мин не приводит к отравлению.
Пребывание в атмосфере, содержащей до 0,01 мг/л фосгена, возможно максимально в течение 1 ч. При этом восприимчивые люди уже могут получить легкое отравление. Концентрации в 0,022 мг/л являются смертельными уже через 30 мин экспозиции. В 50 % случаев отравление при вдыхании 0,1 мг/л в течение 30-60 мин приводит к смерти. Остальные 50 % оставшихся в живых длительно небоеспособны в результате тяжелейших отравлений. Даже при малом времени воздействия таких концентраций могут произойти сильные отравления, при известных обстоятельствах заканчивающиеся смертью.
Концентрация 1 мг/л при времени экспозиции 5 мин в 50—75 % случаев отравления ведет к смерти; меньшие концентрации (0,5—0,8 мг/л) приводят к тяжелым отравлениям.
Концентрация 5 мг/л смертельна уже через 2—3 сек.
Малые концентрации фосгена влияют на вкусовые ощущения, так, например, курить сигарету в содержащем фосген воздухе неприятно или вовсе невозможно.
Запах фосгена ощутим в концентрации 0,004 мг/л, однако на обонятельный нерв фосген влияет так, что в дальнейшем обоняние притупляется и перестают ощущаться даже более высокие концентрации.
Физиологическое действие
Токсический отёк лёгких, возникающий после вдыхания паров фосгена, дифосгена, трифосгена, проявляется лишь после скрытого периода в несколько часов. В этот период отравленный чувствует себя хорошо, и как правило вполне дееспособен. У восприимчивых людей в это время появляется сладкий, часто противный привкус во рту, иногда тошнота и рвота. В большинстве случаев возникают незначительные позывы к кашлю, першение и жжение в носоглотке, небольшие нарушения ритма дыхания и пульса.
После латентного периода наступает сильный кашель, одышка, синюшность лица и губ.
Прогрессирующий отёк лёгких ведёт к сильному удушью, мучительному давлению в грудной клетке, ритм дыхания увеличивается от 18-20 в мин (норма) до 30-50 в мин, в кризисе — до 60-70 в мин. Дыхание судорожное. Содержащая белок отёчная пенистая и вязкая жидкость выбрызгивается из альвеол и бронхиол в более широкие дыхательные пути, ведёт к затруднению и невозможности дыхания. Отравленный отхаркивает большие количества этой жидкости, часто смешанной с кровью. При токсическом отёке лёгких примерно до половины общего количества крови организма переходит в лёгкие, которые в результате этого опухают и увеличиваются в массе. В то время как нормальное лёгкое весит около 500—600 г, можно было наблюдать «фосгеновые» лёгкие весом до 2,5 кг.
Встречаются также случаи, когда отравленный избегает любого лишнего движения и для облегчения дыхания выбирает какое-то наиболее удобное положение. Губы у таких отравленных серые, пот холодный и липкий. Несмотря на удушье, мокрота у них не отделяется. Через несколько дней отравленный умирает.
Редко через 2-3 суток может наступить улучшение состояния, которое через 2-3 недели может закончится выздоровлением, но часты осложнения в результате вторичных инфекционных заболеваний, что приводит к смертельному исходу.
Хеглер на примере одного поражения так описывает коварный характер отравления фосгеном:
Один из известных токсикологов Мунтш так описывал состояние поражённого фосгеном человека:
Использование в качестве боевого отравляющего вещества
Использовался в Первую мировую войну как боевое отравляющее вещество.
340 ppm (крыса, 30 мин)
438 ppm (мышь, 30 мин)
243 ppm (кролик, 30 мин)
316 ppm (морская свинка, 30 мин)
1022 ppm (собака, 20 мин)
145 промилле (обезьяна, 1 мин)
30 ppm (человек, 17 мин)
50 ppm (млекопитающее, 5 мин)
88 ppm (человек, 30 мин)
46 ppm (кошка, 15 мин)
50 ppm (человек, 5 мин)
2,7 ppm (млекопитающее, 30 мин)
СОДЕРЖАНИЕ
Структура и основные свойства
Производство
Эта реакция является экзотермической и обычно проводится при температуре от 50 до 150 ° C. При температуре выше 200 ° C фосген превращается в оксид углерода и хлор, K экв (300 K) = 0,05. Мировое производство этого соединения оценивалось в 2,74 миллиона тонн в 1989 году.
Непреднамеренное поколение
История
Реакции и использование
Синтез карбонатов
Диолы реагируют с фосгеном с образованием линейных или циклических карбонатов (R = H, алкил, арил):
Синтез изоцианатов
Синтез изоцианатов из аминов иллюстрирует электрофильный характер этого реагента и его использование для введения эквивалентного синтона «CO 2+ »:
В промышленных масштабах фосген используется в избытке, чтобы увеличить выход и избежать побочных реакций. Избыток фосгена отделяется во время обработки конечных продуктов и возвращается в процесс, а оставшийся фосген разлагается в воде с использованием активированного угля в качестве катализатора.
Лаборатория использует
RCO 2 H + COCl 2 → RC (O) Cl + HCl + CO 2
Такие хлорангидриды реагируют с аминами и спиртами с образованием соответственно амидов и сложных эфиров, которые обычно являются промежуточными продуктами. Тионилхлорид более часто и более безопасно использовать для этого приложения. Особым применением фосгена является производство сложных эфиров хлормуравьиной кислоты, таких как бензилхлорформиат :
ROH + COCl 2 → ROC (O) Cl + HCl
Фосген хранится в баллонах и металлических баллонах. Выход цилиндров всегда стандартный, с конической резьбой, известной как CGA 160.
Промышленное использование
Другие реакции
Аналогично при контакте с аммиаком он превращается в мочевину :
Химическая война
После широкого использования фосгена во время Первой мировой войны его запасы складывались в различных странах.
Токсикология и безопасность
Если случайный выброс фосгена происходит в промышленных или лабораторных условиях, его можно уменьшить с помощью газообразного аммиака ; в случае разливов жидкости ( например, растворов дифосгена или фосгена) можно использовать абсорбент и карбонат натрия.
Фосген
Фосген – это бесцветный газ с запахом прелого сена. Обладает удушающим действием. Симптомы поражения, кашель, головокружение, сладковатый привкус во рту.
Аварийная карточка (АХОВ)
ФОСГЕН КЛАСС ТОКСИЧЕСКОЙ ОПАСНОСТИ – 2
| CAS № 75-44-5 | COCl2 формула |  | Классификация ООН |
| ООН № 1076 | Молекулярная масса: 98.9 | Класс опасности ООН: 2.3 | |
| ЕС № 006-002-00-8 | Вторичная опасность по ООН: 8 |
ПРЕДУПРЕЖДЕНИЕ
ТРАНСПОРТИРОВКА/ХРАНЕНИЕ
Фосген перевозят в железнодорожных и автомобильных цистернах, контейнерах и баллонах, которые являются временным его хранилищем. Обычно фосген хранят в сжиженном состоянии при температуре окружающей среды под давлением собственных паров 6-18 кгс/см 2 в наземных цилиндрических горизонтальных резервуарах. Максимальные объемы хранения составляют 52 тонны.
ЛИКВИДАЦИЯ
НЕЙТРАЛИЗАЦИЯ
В случае возгорания в окрестностях: разрешены все средства пожаротушения. В случае пожара: охлаждать баллоны, обливая их водой, но НЕ допускать прямого контакта вещества с водой. Вести борьбу с огнем из укрытия.
Провести эвакуацию из опасной зоны! Проконсультироваться со специалистом! Вентиляция. Удалить газ, используя мелкие брызги воды.
При ликвидации аварий, связанных с утечкой (выбросом) фосгена изолировать опасную зону в радиусе не менее 200 м, удалить из нее людей, держаться наветренной стороны, избегать низких мест, в зону аварии входить только в полной защитной одежде, не курить. Непосредственно на месте аварии и на удалении до 50 метров от источника заражения работы проводят в изолирующих противогазах или дыхательных аппаратах (ИП-4M, КИП-8, АСВ-2) и средствах защиты кожи (Л-1, КИХ-4, КИХ-5 и др.). На расстоянии 400-500 метров от очага при аварийно-спасательных работах, а также для выхода из зоны химического заражения защиту органов дыхания обеспечивают фильтрующие промышленные противогазы с коробками марок В и БКФ, гражданские и детские противогазы.
Нейтрализуют сжиженный фосген 10%-ным водным раствором щелочи (например, 100 кг едкого натра и 900 литров воды). Расход раствора для нейтрализации 1 тонны фосгена составляет 16-20 тонн. При необходимости понижения температуры замерзания к полученному раствору добавляют моноэтаноламин.
Для рассеивания паров используют распыленную воду. Для распыления воды или растворов применяют авторазливочные станции (АРС-14, АРС-15), тепловые специальные машины (ТМС-65), пожарные машины, а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
В случае разлива сжиженного фосгена место разлива обваловывают и не допускают попадания вещества в поверхностные воды, промывают большим количеством воды, покрывают воздушно-механической пеной. Для утилизации загрязненного грунта на месте разлива при нейтрализации фосгена срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают водой в контрольных целях.
В зараженной зоне: надевание противогаза на пострадавшего, срочный вывод (вывоз) из зоны заражения.
После эвакуации из зараженной зоны: тепло, покой, кислородные ингаляции, при раздражении глаз обильное промывание 2%-ным раствором питьевой соды или водой, для профилактики отека легких – внутримышечно 2 мл 4%-ного раствора метилпреднизолона. Полусидячее положение. Удалить загрязненную одежду. ПРИ ОБМОРОЖЕНИИ: промыть большим количеством воды, НЕ удалять одежду. Промыть кожу большим количеством воды или под душем.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
БЕСЦВЕТНЫЙ СЖАТЫЙ СЖИЖЕННЫЙ ГАЗ, С ХАРАКТЕРНЫМ ЗАПАХОМ.
ФИЗИЧЕСКАЯ ОПАСНОСТЬ:
Пар тяжелее воздуха, стелиться над землёй.
ХИМИЧЕСКАЯ ОПАСНОСТЬ:
Вещество разлагается при разогреве до температуре выше 300°C при контакте с водой и влажности, образует токсичные и едкие газы (монооксид углерода и хлористый водород). Реагирует с алюминием, изопропиловым спиртом.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании.
РИСК ПРИ ВДЫХАНИИ:
При утечке содержимого очень быстро достигается опасная концентрация этого газа в воздухе.
НАЛИЧИЕ ФОСГЕНА ОПРЕДЕЛЯЮТ:
– войсковым прибором химической разведки ВПХР с индикаторной трубкой на фосген;
– фотокалометрический стационарный автоматический газоанализатор «Сирена-4» с диапазоном измерения 0-1 мг/м 3 ;
– химический газоопределитель промышленных выбросов ГХПВ-2 с индикаторной трубкой на фосген с диапазоном измерений 0,5-50 мг/м 3 ;
ФИЗИЧЕСКИЕ СВОЙСТВА
ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК)
Температура кипения: 8°C
Относительная плотность (вода = 1): 1.4
Растворимость в воде: реагирует
Давление паров, кПа при 20°C: 161.6
Относительная плотность пара (воздух = 1): 3.4
Фосген
340 ppm (крыса, 30 мин)
438 ppm (мышь, 30 мин)
243 ppm (кролик, 30 мин)
316 ppm (морская свинка, 30 мин)
1022 ppm (собака, 20 мин)
145 промилле (обезьяна, 1 мин) [5]
30 ppm (человек, 17 мин)
50 ppm (млекопитающее, 5 мин)
88 ppm (человек, 30 мин)
46 ppm (кошка, 15 мин)
50 ppm (человек, 5 мин)
2,7 ppm (млекопитающее, 30 мин) [5]
Формальдегид
Угольная кислота
Мочевина
Окись углерода
Хлормуравьиная кислота
Содержание
Структура и основные свойства [ править ]
Производство [ править ]
Реакция экзотермическая. Обычно реакцию проводят при температуре от 50 до 150 ° C. При температуре выше 200 ° C фосген превращается в оксид углерода и хлор, K экв (300 K) = 0,05. Мировое производство этого соединения оценивалось в 2,74 миллиона тонн в 1989 г. [7]
Случайное создание [ править ]
История [ править ]
Реакции и использование [ править ]
Синтез карбонатов. [ редактировать ]
Диолы реагируют с фосгеном с образованием линейных или циклических карбонатов (R = H, алкил, арил):
Синтез изоцианатов [ править ]
Синтез изоцианатов из аминов иллюстрирует электрофильный характер этого реагента и его использование при введении эквивалента «CO 2+ »: [10]
Лаборатория использует [ править ]
RCO 2 H + COCl 2 → RC (O) Cl + HCl + CO 2
Такие хлорангидриды реагируют с аминами и спиртами с образованием соответственно амидов и сложных эфиров, которые обычно являются промежуточными продуктами. Тионилхлорид более часто и более безопасно использовать для этого приложения. Особым применением фосгена является производство сложных эфиров хлормуравьиной кислоты:
ROH + COCl 2 → ROC (O) Cl + HCl
Фосген хранится в баллонах и металлических баллонах. Выход цилиндров всегда стандартный, с конической резьбой, известной как CGA 160.
Промышленное использование [ править ]
Другая химия [ править ]
Фосген реагирует с водой с выделением хлористого водорода и диоксида углерода :
Аналогично при контакте с аммиаком он превращается в мочевину :
Галогенидный обмен с трифторидом азота и трибромидом алюминия дает COF 2 и COBr 2 соответственно. [7]
Химическая война [ править ]
После широкого использования фосгена во время Первой мировой войны его запасы складывались в различных странах. [17] [18] [19]