Фотосенсибилизирующие препараты для чего
Повышенная фоточувствительность: когда виноваты лекарства
Что такое фоточувствительность кожи и о чем должен предупредить фармацевт, когда посетитель покупает препараты, вызывающие побочное действие под влиянием солнечных лучей.
Фоточувствительность, – реакция, возникающая на коже после приема определенных лекарств – достаточно распространенная реакция, которая встречается гораздо чаще, чем могли бы подумать даже опытные медицинские специалисты. Поэтому если посетитель приобретает препараты, вызывающие побочное действие под влиянием солнечных лучей, предупредите его насчет рисков «лекарственная терапия+инсоляция».
Фоточувствительность и препараты: опасные сочетания
Краснота, раздражение, сыпь и зуд. подобные кожные симптомы не всегда являются следствием аллергии или дерматологического заболевания – нередко их провоцируют соединения, повышающие чувствительность к ультрафиолетовому излучению. И попадают эти вещества в организм при приеме внутрь некоторых лекарств (а в некоторых случаях – даже продуктов питания, о чем мы тоже упомянем, но ниже).
Даже непродолжительное нахождение на солнце может вызвать ожог или дерматит у человека, который проходит курс лечения фотосенсибилизирующими препаратами. При этом перечень таких лекарственных средств достаточно велик: это и традиционные противовоспалительные средства, и препараты с мочегонным действием, и ЛС, снижающие уровень холестерина, и даже гормональные пероральные контрацептивы. Известны десятки препаратов, в том числе безрецептурных, которые могут спровоцировать повышенную чувствительность к солнцу. В таблице приведены наиболее распространенные фотосенсибилизирующие лекарства как при наружном, так и при местном применении, которые способны повысить фоточувствительность.
Таблица: Препараты, повышающие фоточувствительность
| Класс лекарственных средств | Представители класса, провоцирующие фоточувствительность (INN) |
| Антибиотики | доксициклин, ципрофлоксацин, левофлоксацин, офлоксацин, триметоприм (особенно опасны фторхинолоны и тетрациклины) |
| Сульфаниламиды (сульфонамиды) | сульфадиазин, сульфаметоксазол, сульфасалазин |
| НПВС | кетопрофен, пироксикам, напроксен, целекоксиб, ибупрофен, |
| Антигистаминные средства | преимущественно первого поколения: прометазин, дифенгидрамин |
| Антигипертензивные препараты | гидрохлоротиазид, дилтиазем |
| Гипогликемические средства | глипизид, глибурид |
| Диуретики | фуросемид, буметанид, гидролоротиазид |
| Статины | аторвастатин, ловастатин, правастатин, симвастатин |
| Средства от аритмии | хинидин, амиодарон |
| Антидепрессанты и анксиолитики | трициклические антидепрессанты, особенно доксепин; препараты на основе зверобоя; алпразолам, хлордиазепоксид |
| Нейролептики | хлорпромазин, флуфеназин, перфеназин, тиоридазин, тиотиксен |
| Химиотерапевтические препараты | доксорубицин, флутамид, гемцитабин, фторурацил, метотрексат, винбластин, дакарбазин |
| Топические анестетики | бензокаин |
| Местные антисептики | хлоргексидин, гексахлорофен |
| Другие средства | парааминобензойная кислота (ПАБК, витамин Bx, витамин В10, n-аминобенозойная кислота); 5-аминолевулиновая кислота; производные каменноугольной смолы (деготь); |
Опасны не только синтетические лекарства. Растения, которые содержат фурокумарины, также фототоксичны – их метаболиты точно так же, как и лекарственные, активируются ультрафиолетом, что приводит к поражению кожи. В разных количествах фурокумарины содержатся в инжире, луке, чесноке, корне петрушки, укропе, траве клевера, ячмене, горчице. Очень высокий риск фотосенсибилизации связан с двумя наиболее распространенными семействами растений: зонтичные (Apiaceae) и рутовые (Rutaceae). Морковь, сельдерей и петрушка являются наиболее известными представителями первого семейства, что качается второго, то на даче они менее распространены (это лимон, апельсин, бергамот и грейпфрут). Использовать косметику с этими ароматическими маслами, разумеется, тоже не стоит.
Фоточувствительность на коже: две реакции
Как видно из приведенной выше таблицы, соединения, под влиянием которых кожа становится сверхчувствительной к ультрафиолету, содержатся во многих лекарствах. Попадая в организм, они преобразуются в различные метаболиты и накапливаются в тканях, а при активации ультрафиолетом вызывают фототоксические или фотоаллергические реакции. Первые проявляются как солнечный ожог: они возникают довольно быстро и протекают весьма бурно. В развитие вторых всегда вовлечена иммунная система, и они не столь молниеносны, зато более коварны – кожные поражения не всегда проявляются в месте, которое подвергалось воздействию ультрафиолетового излучения. Эта разница связана с различиями в механизмах развития этих двух реакций:
Фоточувствительность и косметика
Нежелательную реакцию может спровоцировать прием не только серьезных рецептурных препаратов – опасны в этом отношении эфирные масла, парабены и салицилаты, также часто входящие в состав косметических средств.
Чувствительность кожи к ультрафиолету повышается и при местном применении некоторых веществ, например, бензофенонов. Как ни парадоксально, но производные дифенилметанона нередко включают в состав солнцезащитных продуктов – они выступает там в качестве. фильтров ультрафиолета. Проблемы способен доставить и известный компонент, при помощи которого уничтожают прыщи, – бензоилпероксид (перекись бензоила). Ну, а избегать косметики с ароматизаторами, или отдушками советуют не только потому, что они могут вызвать сверхчувствительность и покраснения на коже: многие из данных ингредиентов также потенциально фототоксичны.
Однако наиболее опасны в отношении фототоксичности ретиноиды, как местные, в составе кремов (ищем ретиналь, микроретинол и т.д), так и те, что принимают внутрь (ацитретин, изотретиноин). Если вещества, указанные выше, вызывают фототоксичность у единиц, то ретиноиды в сочетании с солнцем почти наверняка дадут эту побочную реакцию. Поэтому человеку, который собирается использовать средство с ретиноидами, следует посоветовать отложить курс до более пасмурных времен.
Фоточувствительность на коже: профилактика и первая помощь
Методы лечения фототоксических и фотоаллергических реакций просты: выявление и элиминация раздражителя, параллельно – защита от ультрафиолета, то есть регулярное использование солнцезащитных средств с высоким показателем SPF. Эффективная защита от солнца часто предотвращает реакции фоточувствительности.
При этом специальных диагностических тестов для таких ситуаций не существует – можно заподозрить реакцию фоточувствительности, если сыпь на коже возникает только в местах, подверженных воздействию солнечных лучей. При этом симптоматика фототоксических реакций идентична проявлениям солнечного дерматита: в месте облучения кожи ультрафиолетом отмечается покраснение и отечность, пораженное место зудит. В более тяжелом случае могут появиться волдыри, как при солнечном ожоге, также отмечается выраженное жжение, покалывание.
Если нежелательной реакции избежать все же не удалось, то облегчить индуцированную лекарством кожную реакцию помогают холодные компрессы, в случае развития солнечной аллергии – прием антигистаминного средства (предпочтение следует отдать антигистаминам второго поколения).
Фоточувствительность как… лечение
Если для большинства препаратов реакция фотосенсибилизации – крайне нежелательный побочный эффект, то для определенной группы препаратов это прямое терапевтическое действие.
Фотосенсибилизирующие препараты для чего
Возрастающая полирезистентность патогенных микроорганизмов и особенно их госпитальных штаммов стала одной из наиболее грозных проблем здравоохранения многих стран мира [2, 7, 13]. Если в 1970-е гг. впервые были замечены микроорганизмы, устойчивые к целым группам антибактериальных препаратов, то в конце 1990-х гг. уже появились штаммы, приобретшие устойчивость ко всем известным тогда антибиотикам. Казалось бы, с открытием антибиотиков такие тяжелые инфекционные процессы, как сепсис, перитонит, гангрена стали совершенно управляемыми, однако уже сегодня, вследствие предопределенной генетически высокой приспосабливаемости бактерий к условиям среды, они опять уносят жизни миллионов людей.
Генетический аппарат бактерий достаточно прост и включает всего лишь одну хромосому, содержащую порядка 3000 генов, и плазмиды – содержащие не более пары сотен генов, которые, однако, очень мобильны. Многие из этих участков ДНК, являясь транспозонами, легко перемещаются из плазмиды в плазмиду или непосредственно в хромосому, что обеспечивает их быстрое распространение внутри популяций, видов и даже между различными видами бактерий. Эти процессы в ходе борьбы за существование, наряду со спонтанными мутациями, являются основными причинами появления приобретенной устойчивости микроорганизмов к еще вчера высокоэффективным препаратам [6, 13]. Изменения проницаемости клеточной стенки, модификация мишени, выработка ферментов являются основными общепризнанными причинами постепенно развивающейся устойчивости микроорганизмов к антибактериальным препаратам [6, 13]. В частности, хорошо известно [3], что применение большинства лекарственных средств класса бета-лактамов в терапии современных внутрибольничных инфекций сопряжено с высоким риском неудачи, что требует назначения дорогостоящей и не всегда возможной целевой эмпирической комбинированной антибиотикотерапии. В этой связи, очевидно, что поиск новых эффективных методов борьбы с бактериальными инфекциями, и в особенности с их нозомикальными штаммами, обладающими перекрестной резистентностью, является одним из несомненных приоритетов отечественного здравоохранения.
Антибактериальная фотодинамическая терапия (ФДТ) представляет собой принципиально отличную от антибиотикотерапии стратегию лечения множества заболеваний, основанную на селективном накоплении и удерживании в атипичных или поврежденных клетках человека, а также непосредственно в клетках микроорганизмов окрашенных веществ – фотосенсибилизаторов (ФС). Эти вещества при воздействии видимого света определенной длины волны и соответствующей мощности генерируют активные формы кислорода, что позволяет эффективно инактивировать атипичные клетки и микроорганизмы путем запуска каскада фотохимических реакций [8, 9, 11, 12, 15]. К настоящему времени в клинической практике используется ряд ФС для диагностики и лечения онкологических заболеваний, гнойно-воспалительных заболеваний ЛОР-органов, обработки ран и т.д. [8, 9, 11, 12, 15]. В отличие от антибиотиков противомикробное действие ФДТ не снижается со временем, а у патогенов не развивается устойчивости к ней [11, 15]. Бактерицидный эффект при этом лимитируется зоной лазерного облучения сенсибилизированных тканей, что позволяет избежать при проведении ФДТ генерализации побочных эффектов, наблюдаемых при применении антибиотиков и антисептиков. Заживление происходит по типу естественных репаративных процессов, поэтому метод является наиболее органосохраняющим, а также легко переносимым, что позволяет повторять лечение при необходимости многократно.
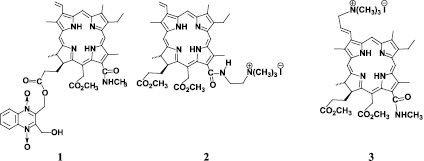
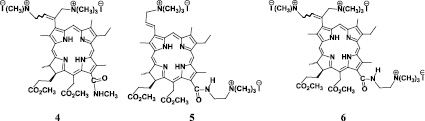
Вместе с тем использование существующих фотосенсибилизаторов для антибактериальной ФДТ имеет свои недостатки. В меру нашего понимания данной проблемы важнейшими из них являются высокая стоимость лечения, длительная остаточная фототоксичность для ряда препаратов, таких как «Фотогем» и «Фотосенс», недостаточная степень чистоты ряда ФС, часто представляющих собой смесь родственных соединений [8, 9]. Нами был синтезирован, очищен и идентифицирован ряд соединений хлоринового типа (соед. 1–6) с целью разработки препаратов для антибактериальной ФДТ. С целью моделирования внутриклеточного транспорта была изучена их способность к генерации синглетного кислорода, распределение между псевдолипидной и водной фазами [4, 5, 16].
В настоящей работе представлены результаты лабораторного исследования антимикробной активности полученных препаратов в отношении дрожжеподобных микроскопических грибов (Candida аlbicans ССМ 8261 АТСС 90028), грам-положительных (Staphylococcus aureus 6538-Р АТСС = 209-Р FDA), грам-отрицательных (Escherichia coli М-17) бактериальных штаммов.
Материалы и методы исследования
Синтез, очистка и идентификация препаратов
Изученные фотосенсибилизаторы (соед. 1–6): 1 – 17(3)-(2,3-дигидроксиметил-1,4-хиноксалин)-13(1)-N-метиламид хлорина е6, 2 – 13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 йодид; 3 – 3(2)-(N′N′′N′′′-триметиламинометил)-13(1)-N-метиламид хлорина е6 йодид; 4 – 3(1),3(2)-бис-(N′N′′N′′′-триметиламинометил)-13(1)-N-метиламид хлорина е6 дийодид; 5 – 3(2)-(N′N′′N′′′-триметиламинометил),13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 дийодид и 6 – 3(1),3(2)-бис-(N′N′′N′′′-триметиламинометил),13(1)-(N′N′′N′′′-триметиламиноэтил)амид хлорина е6 трийодид были получены путем химической модификации хлорофилла, а точнее, его производного метилфеофорбида а, выделенного экстракцией из сине-зеленой водоросли Spirulina Platensis [1, 10, 14]. Очистку препаратов проводили путем колоночной хроматографии, а также перекристаллизацией. Спектральную идентификацию полученных соединений проводили методами масс-спектрометрии, ядерного магнитного резонанса и электронной спектроскопии. Подробная методика синтеза и идентификации соединений будет описана позднее в специализированной статье.
Растворы ФС готовились следующим образом. Препараты 2–6 готовились путем непосредственного растворения заданного количества вещества в воде для достижения концентрации 10–4 моль/кг. Нерастворимый в воде ФС 1 предварительно был растворен в небольшом количестве ацетона, содержащем расчетное количество ТВИН 80. Затем ацетон был выпарен под вакуумом при температуре 50 °С и постоянном перемешивании. Далее к полученной вязкой жидкости под действием ультразвука (40 кГц; 70 Вт) постепенно добавлялось расчетное количество 10 % водного раствора этанола до образования мицеллярного раствора ФС с содержанием ПАВ 1 мас. %. Проведенный анализ показал, что полученный раствор оставался стабильным в течение 2–3 недель.
Методика подготовки посевной дозы тест-культур
Суточные культуры тест-штаммов на скошенном мясопептонном агаре смывали физиологическим раствором и доводили до концентрации 500 млн микробных клеток в 1 мл (5 единиц по оптическому стандарту мутности). Посевную дозу 1000 клеток в 1 мл готовили из исходной стандартной взвеси многократным разведением.
Посев тест-культур на плотные питательные среды
На плотные питательные среды проводили посев описанных тест-культур. В чашки Петри с плотной питательной средой вносили 1 мл (1000 клеток) тест-культуры бактерий или грибов. Посев Staphylococcus aureus проводили в чашки Петри с желточно-солевым агаром (ЖСА), Escherichia coli – в чашки Петри со средой Эндо, Candida albicans – в чашки Петри со средой Сабуро. На подсушенные среды с тест-культурой накладывали исследуемые образцы, представляющие собой обработанные водным раствором соответствующего ФС кусочки фильтровальной бумаги, размером 7,5*7,5 мм. Через полчаса проводили сеанс ФДТ. Далее чашки Петри инкубировали 24 часа в термостате при 37 °С. О результатах испытаний судили по степени угнетения зоны роста тест-культуры вокруг исследуемых образцов.
Посев тест-культур в жидкую питательную среду
В этой серии экспериментов в каждую лунку четырех стандартных луночных планшетов вносили 0,5 мл мясопептонного бульона с тест-культурой микроорганизмов (посевная доза 1000 клеток) и 0,5 мл раствора фотосенсибилизатора. Через полчаса инкубации проводили сеанс ФДТ. Далее планшеты выдерживали 24 ч при температуре 37 °С. Для подтверждения наличия бактерицидных свойств у исследуемых образцов проводился высев из всех лунок на чашки Петри с плотной питательной средой для подсчета колониеобразующих единиц (КОЕ).
Моделирование ФДТ in vitro
Моделирование антибактериальной ФДТ проводили в затемненном помещении при комнатной температуре путем облучения чашек Петри или планшетов с тест-культурами с помощью специального светодиодного источника видимого света («БМЦ», Минск) с регулируемой мощностью излучения и водяным охлаждением. Максимальная мощность излучения светодиодного планшета 0,2 Вт/см2, площадь засвечиваемой поверхности 100 см2, диапазон длин волн падающего света 660 ± 15 нм. Мощность излучения, расстояние до образца и время воздействия подбирались таким образом, чтобы обеспечить равномерное засвечивание исследуемых бактериальных культур, сообщив им дозу излучения 40 Дж/см2 за время проведения обычной физиотерапевтической процедуры в клинике
Результаты исследования и их обсуждение
Антибактериальная ФДТ на плотных питательных средах
Результаты проведенных исследований показали, что при нанесении красителей на фильтровальную бумагу и помещении ее на плотную питательную среду с микроорганизмами, не все исследуемые образцы после проведенного облучения подавляют рост тест-культур: Staphylococcus аureus, Escherichia coli и грибов Candida albicans. В первой серии экспериментов при нанесении одной капли раствора ФС концентрацией 0,0001 моль/кг на фильтровальную бумагу, относительно высокую активность в отношении золотистого стафилококка продемонстрировали образцы 2, 3, 4 (рисунок), показавшие зоны задержки роста на среде ЖСА 15, 14 и 14 мм соответственно. В отношении Escherichia coli и грибов Candida albicans какой-либо антибактериальной активности установить не удалось.
Рост колоний Staphylococcus aureus (а, а?), Candida Albicans (б, б?) и Escherichia coli (в, в?) на питательных средах, содержащих ФС (нумерация на рисунке соответствует номерам соединений) до (а, б, в ) и после однократного облучения (а?, б?, в?).видимым светом с дозой 40 Дж/см2. Нумерация секторов соответствует номерам соединений 1–6
Во второй серии экспериментов исследуемые образцы наносили на фильтровальную бумагу путем погружения ее в раствор ФС и далее раскладывали в чашки Петри со средами ЖСА, ЭНДО, Сабуро, содержащими тест-культуры. И в этом случае была подтверждена незначительная активность ФС в отношении микроорганизмов. Лишь образцы 3 и 4 показали зону задержки роста (по 12 мм) в отношении золотистого стафилококка. Был сделан вывод, что при нанесении красителя на бумагу он достаточно сильно связывается с целлюлозой, что наряду с использованием в экспериментах плотной питательной среды ослабляет диффузию ФС и накопление его в достаточном количестве в микробных клетках. Отсюда следует, что использование, например, любых текстильных материалов, пропитанных растворами препаратов, при нанесении на раневую поверхность для проведения ФДТ может оказаться неэффективным из-за недостаточного увлажнения раны и малого времени инкубации. Для плотных сред это время должно быть, по-видимому, значительно больше 30 минут.
Результаты испытаний образцов в жидкой питательной среде
В эксперименте с жидкими питательными средами перед проведением ФДТ смешивали в равных количествах раствор ФС с концентрацией 0,0001 моль/кг и мясопептонного бульона, содержащего исследуемую тест-культуру. Далее раствор выдерживали при комнатной температуре в течение получаса и проводили сеанс ФДТ. Оценивали как темновую, так и световую токсичность исследуемых препаратов с рабочей концентрацией 0,00005 моль/кг.
Как видно из рисунка, до облучения образцы 1 и 2 дали сплошной рост культуры стафилококка и, таким образом, не обладали темновой цитотоксичностью (собственным антибактериальным действием), остальные образцы роста не показали. После облучения образец № 1 – дал рост 43 КОЕ, образец № 2 – не дал роста, что демонстрировало их высокую антимикробную активность после облучения сенсибилизированной культуры (95,7 и 100 % эффективность – соответственно), остальные образцы не дали роста.
При исследовании темновой цитотоксичности в отношении грибов Candida albicans образцы 1, 2, 4 не дали роста, то есть фактически обладали темновой цитотоксичностью. Наоборот, образцы, обладавшие темновой цитотоксичностью в отношении стафилококка 3, 5, 6 дали рост – 30, 12 и 8 КОЕ соответственно. После сообщения препаратам дозы 40 Дж/см2 рост дал только образец 3 (6 КОЕ), что демонстрировало прекрасный антимикробный эффект (80 % у образца № 3 и 100 % у образцов № 5 и 6, которые не дали роста).
Изучение антибактериальной активности ФС в отношении грамотрицательного патогена – кишечной палочки привело к весьма неожиданным результатам. Как видно, до облучения все образцы дали сплошной рост культуры E. coli. После облучения образец 1 продемонстрировал хорошее антимикробное действие, дав рост 30 КОЕ (эффективность 97 %). В остальных случаях был зафиксирован сплошной рост. Очевидно, что наблюдаемая картина связана исключительно с уникальным строением внешней оболочки грамотрицательных бактерий, имеющих внешнюю липополисахаридную мембрану. Как видно, лишь один самый гидрофобный препарат (1) оказался в состоянии преодолеть липополисахаридный слой и проявить выраженную антибактериальную активность. Остальные положительно заряженные и значительно более гидрофильные ФС, которые в принципе могли бы проникнуть в клетку через пориновые каналы, во время проведения эксперимента находились, по-видимому, на внешней поверхности мембраны, что и предопределило отсутствие антибактериального действия.
Выводы
Проведенное нами исследование антибактериальной активности пяти ФС хлоринового ряда в отношении фирмикутных бактерий Staphylococcus aureus, грациликутных бактерий Escherichia coli и грибов Candida albicans показало, что использование ФС, адсорбированных на твердых поверхностях, в случае плотных питательных сред в целом малоэффективно. По результатам испытаний установлено, что лишь моно- и дизаряженные ФС (соед. 2 и 5) демонстрируют достаточно высокую активность в отношении золотистого стафилококка. В отношении остальных микроорганизмов активности практически не обнаруживается.
При использовании жидких питательных сред показано, что катионные ФС соед. 2–6) в зависимости от величины заряда и положения заряженной группы в молекуле ФС обнаруживают как темновую, так и световую токсичность в отношении Staphylococcus aureus и Candida albicans при очень незначительных концентрациях порядка 0,00005 моль/кг. В ряде случаев после облучения удается достичь 100 % гибели всех микроорганизмов. Однако в случае кишечной палочки заряженные ФС оказались неэффективными, хотя в работах [14, 15] отмечается, что именно катионные ФС должны проявлять антимикробную активность в отношении грамотрицательных микроорганизмов, что и было зафиксировано, в частности, для синегнойной палочки [15]. По-видимому, в нашем случае необходимо использовать более концентрированные растворы ФС и значительно увеличить время инкубации, дав возможность препаратам в достаточном количестве проникнуть внутрь микробной клетки. Увеличение дозы светового излучения также должно повысить эффективность ФДТ.
Среди исследованных соединений лишь гидрофобное диоксидиновое производное хлорина е6 (соед. 1) обнаружило достаточно эффективное действие в отношении всех трех видов микроорганизмов при малой темновой токсичности, что позволяет на данном этапе считать его достаточно перспективным для проведения антибактериальной ФДТ.
Работа выполнена при поддержке Российского научного фонда – проект № 15-13-00096.
Фоточувствительные дерматозы: лечение и профилактика
Несмотря на достаточное количество публикаций, посвященных фотодерматозам, дерматологами этой проблеме уделяется мало внимания. Термином «фотодерматоз» обозначают избыточную реакцию кожи на световое, обычно солнечное, излучение. Единой классификации не
Несмотря на достаточное количество публикаций, посвященных фотодерматозам, дерматологами этой проблеме уделяется мало внимания. Термином «фотодерматоз» обозначают избыточную реакцию кожи на световое, обычно солнечное, излучение. Единой классификации не существует, но общепринятым является разделение фотодерматозов на острые и хронические. При острых фотодерматозах различают фототоксические и фотоаллергические реакции на солнечные лучи. Эти реакции вызываются совместным действием солнечного света и химического вещества (растения, медикаменты, косметика и т. д.). В первом случае реакции могут развиться у любого человека и протекают по типу солнечного ожога (эритема, отек, пузыри с последующей гиперпигментацией), а в другом — наблюдаются только у сенсибилизированных людей, опосредуются иммунными механизмами и клинически выражаются высыпаниями в виде папул, везикул, мокнутия и т. д.). Наконец, остро могут протекать идиопатические фотодерматозы, к ним относятся реакции на солечный свет, объединенные общим собирательным термином «полиморфный фотодерматоз», при котором установить причину заболевания не представляется возможным. При всех фотодерматозах наиболее восприимчивыми участками кожного покрова являются открытые для солнца места: лицо, уши, шея, область «декольте», тыльная поверхность верхних конечностей, где обычно локализуются высыпания.
Для хронических фотодерматозов характерны самые различные клинические проявления многолетнего воздействия солнечного света, приводящего к преждевременному старению кожи (солнечный кератоз, сенильное лентиго, актинический ретикулоид
и т. п.). Выраженность клинических проявлений напрямую связана с кумулятивным эффектом ультрафиолетовых лучей (УФ). Прежде всего страдают люди, длительно находящиеся под прямыми лучами солнца (из-за работы на улице, регулярной инсоляции, проживания в южных географических зонах, особенно если речь идет о людях с I–III фототипом). В последнее время в развитии заболевания особо отмечают роль загара.
Сегодня всем хорошо известно, что чрезмерное облучение солнечным светом вредно для нашей кожи. Дерматологи и косметологи всегда утверждали, что ультрафиолетовое излучение среди всех внешних факторов является наихудшим.
Солнечный загар стал считаться символом здоровья только после индустриальной революции. До этого «ценилась» бледная кожа — как свидетельство достатка, благополучия и отсутствия необходимости работать вне дома и подставлять свое тело под солнце. Но пришла индустриальная революция и отношение к загару переменилось: наоборот, загорелая кожа стала символом благополучия — ведь у человека, живущего в достатке, остается много времени для пребывания на свежем воздухе и солнце. Загар прочно вошел в моду в 40-е гг. ХХ в. — с подачи французской законодательницы мод Коко Шанель. Но связывать солнечный загар со здоровьем начали раньше, в начале 1900-х гг., когда предложили метод лечения солнечными лучами, названный гелиотерапией, и вплоть до 40–50-х гг. ХХ в. врачи искренне считали, что таким образом можно лечить всех.
Популярность солнечного загара как признака здоровья, благополучия и моды держалась несколько десятилетий, причем в пользе загара никто не сомневался. Действительно, солнечные ванны оказывают прекрасное укрепляющее действие: усиливается обмен веществ, улучшается работа желез внутренней секреции, увеличивается количество гемоглобина, синтезируется витамин Д (он особенно важен при беременности для предотвращения рахита у плода, а также для профилактики остеопороза у пожилых людей). Солнечные лучи обладают выраженным антидепрессивным действием, они способствуют положительной динамике в лечении псориаза, атопического дерматита, различных форм ихтиоза и др. Однако стремительное распространение рака кожи и уменьшение озонового слоя в последние несколько лет заронили сомнения в неоспоримости пользы загара. Началась нелегкая «противозагарная кампания»: люди за прошедшие десятилетия свято уверовали в пользу загара, и переубедить их оказалось непросто. В течение нескольких десятилетий большинство представителей белой расы находили особую привлекательность в загорелой коже, загар ассоциировался со здоровьем, отдыхом, спортом, успехом, однако с некоторого времени загар стал выходить из моды, по крайней мере загар любой ценой. Сейчас уже многие информированы о необходимости защищать кожу от солнца и об опасности возникновения рака кожи, и все же большинство людей убеждены, что от загара больше пользы, нежели вреда.
Конечно, без УФ-лучей жизнь на Земле невозможна — это общеизвестный факт. Со времен Древнего Египта солнце обожествлялось как податель жизненной энергии «анх», ведущий каждого человека по земной жизни и сопровождающий избранных в загробной.
Что же представляет из себя УФ-излучение и как можно объяснить его столь противоречивое воздействие на человеческий организм? Солнечный свет состоит из лучей с разной длиной волны: УФ-излучение, инфракрасное и видимое излучение. Самое опасное из них в плане повреждения кожи и необходимости защиты — это УФ-излучение, которое делят на УФ-А (320–380 нм), УФ-В (280–320 нм) и УФ-С (200–280 нм). УФ-С — это излучение, наиболее губительное для флоры и фауны, но оно по большей части поглощается озоновым слоем в стратосфере и не достигает земной поверхности. Достаточно долго основное внимание уделялось УФ-лучам спектра В, действие которых основано преимущественно на расширении сосудов дермы, но основные изменения, вызванные ими, имеют место в эпидермисе. УФ-В-лучи ответственны за появление солнечных ожогов, которые, в свою очередь, могут явиться причиной возникновения в дальнейшем на этих местах рака кожи.
Вместе с тем кумулятивное действие УФ-А-лучей может причинить гораздо больше вреда, чем УФ-В. Несмотря на то что ультрафиолетовые В-лучи обладают энергией, в 1000 раз превышающей энергию УФ-А, 90% УФ-В-лучей блокируются роговым слоем эпидермиса, в то время как 50–60% УФ-А-лучей способны проникать глубоко в кожу. Так, проникая в сосочковый и сетчатый слои дермы, эти лучи снижают ее эластичность, упругость, вызывая появление морщин, складок, пигментных и кератотических высыпаний в результате преждевременного старения кожи. Важно отметить, что признаки фотостарения могут наблюдаться задолго до появления симптомов возрастного старения кожи, однако эти изменения появляются только на открытых участках, попавших под действие солнечных лучей (шея, область «декольте», лицо, предплечья и кисти рук). Большинство клинических проявлений обусловлены дермальными изменениями.
Лучи спектра А воздействуют главным образом опосредованно, способствуя продуцированию свободных кислородных радикалов, которые, в свою очередь, активизируют перекисное окисление липидов, факторы транскрипции и могут приводить к появлению разрывов в цепочках дезоксирибонуклеиновой кислоты (ДНК). При этом УФ-В-лучи, также в некоторой степени способные продуцировать свободные формы кислорода, в основном оказывают прямое повреждающее действие на ДНК посредством прямой активации факторов транскрипции: активирующего белка (АР-1) и ядерного фактора (NF-kB). Данные факторы запускают процесс наработки в клетке металлопротеиназ — ферментов, обладающих высокой протеолитической активностью в отношении строительных белков клетки.
Различают еще одну группу фотодерматозов, которые могут быть острыми и хроническими; к ним относятся порфирии (поздняя кожная, вариегатная, эритропоэтическая протопорфирия), пеллагра, пигментная ксеродерма и дерматозы, обостряющиеся под воздействием солнечных лучей (красная волчанка, актинический порокератоз, розацеа, герпес и др.).
Очень важным аспектом негативного влияния солнечных лучей являются также злокачественные опухоли кожи. Наибольшее опасение у врачей-дерматологов и онкологов вызывает неуклонное распространение мелано-мы — самой опасной злокачественной опухоли кожи, на долю которой приходится 2% всех онкологических заболеваний. Особенно это касается детей и молодых людей с I и II фототипом (светло- и рыжеволосые люди, которые всегда обгорают на солнце, но никогда не загорают или загорают с трудом). В связи с тем, что озоновый слой атмосферы за последние десятилетия стал более тонким, ученые прогнозируют значительное увеличение количества заболеваний раком кожи.
Нет никакого сомнения, что имеется прямая связь между общим количеством УФ-излучения и частотой рака кожи. Приведем некоторые факты, подтверждающие этот тезис.
Независимо от патогенеза того или иного заболевания, основным пусковым фактором в развитии этих состояний является извращенная реакция кожи на УФ-излучение, поэтому весь комплекс лечебных и профилактических мероприятий должен быть направлен на защиту от солнечных лучей. Кожа располагает своими собственными средствами защиты. При УФ-облучении в ней начинают происходить процессы, направленные на защиту от повреждающего действия лучей: утолщается роговой слой (при этом в роговом слое происходит абсорбция УФ-В-лучей), усиливается пигментация, появляется загар (индуцированная меланиновая пигментация). Действительно, для большинства людей загар является достаточно эффективным средством защиты от солнечных лучей, но при условии, что воздействие солнца на кожу не слишком длительное и у кожи есть время восстановиться, так как механизмы естественной защиты кожи включаются не сразу. Кроме того, существует конституциональная меланиновая пигментация, которая определяет цвет кожи человека и имеет шесть типов: чем больше меланина, тем смуглее кожа и тем выше степень защищенности от воздействия солнечных лучей. Соответственно фотодерматозами страдают чаще люди с белой кожей, которые совсем не загорают или загорают с трудом.
Переходя к вопросам лечения фотодерматозов, напомним о некоторых очень важных рекомендациях: прежде всего как можно меньше находиться на солнце, при необходимости сменить работу, не загорать под прямыми лучами, постоянно использовать фотозащитные средства, с осторожностью относиться к медикаментам, имеющим фотосенсибилизирующее действие (тетрациклины — доксициклин, тетрациклин; сульфаниламиды; противозачаточные препараты; противогрибковые средства — гризеофульвин; нейролептики; диуретики — фуросемид; псоралены; ненаркотические анальгетики — напроксен; и др.). Пищевые продукты, содержащие фурокумарин, такие, как лайм, инжир, петрушка, горчица, морковь и сельдерей, также содержат фотосенсибилизирующие вещества и могут усугубить течение заболевания, то же самое можно сказать об использовании чрезмерного количества парфюмерных изделий, особенно на пляже.
Основной задачей терапии всех разновидностей фотодерматозов является снижение фотосенсибилизации, поэтому средствами первого ряда при лечении больных являются препараты, обладающие фотодесенсибилизирующими свойствами. К их числу относятся препараты хинолинового ряда (делагил и плаквенил), β-каротин, парааминобензойная кислота (О. Л. Иванов, 1997). При порфириях целесообразно назначать никотиновую кислоту, которая входит в состав коферментов — никотинамидадениндинуклеотида и никотинамидадениндинуклеотида фосфата, принимает участие в окислительно-восстановительных процессах, снижая содержание порфиринов в крови. Кроме того, в комплексную терапию при фотодерматозах входят витамины А, Е, которые являются мощнейшими природными антиоксидантами, защищающими различные вещества от патологических реакций окисления. Применение антиоксидантов возможно и в составе косметических средств: экстракты виноградных косточек, зеленого чая, гинкго, ромашки аптечной, коры приморской сосны, василька синего, календулы лекарственной.
Наружное лечение зависит от остроты воспалительной реакции и включает различные средства — от примочек до противовоспалительных мазей, в том числе кортикостероидных. С целью более активного снижения степени фотосенсибилизации назначают энтеросорбенты, гемосорбцию и плазмаферез.
Ассортимент отбеливающих средств при лентиго для местного нанесения не так уж велик. К ним можно отнести азелаиновую кислоту, арбутин, экстракт солодки и другие вещества растительного происхождения, аскорбиновую кислоту, гидрохинон, койевую кислоту, топические кортикостероиды (низкопотентные, т. е. слабого действия), ретиноиды, руцинол (М. В. Халдина, М. В. Черкасова, 2005).
С учетом морфологических изменений, происходящих в коже при хронических фотодерматозах, усилия дерматологов в основном оказываются направлены на то, чтобы помочь коже вернуться в нормальное состояние. С середины 80-х гг. ХХ в. наиболее популярными средствами в борьбе с фотостарением стали фенол (глубокий пилинг) и трихлоруксусная кислота (средний пилинг), на уровне дермы стимулирующие пролиферацию фибробластов и замедляющие дегенерацию коллагена. Эти методики до сих пор сохранили актуальность. Но в 1990-е годы внимание дерматологов привлекли α-гидроксикислоты — гликолевая, молочная, лимонная, винная, яблочная. Наиболее часто для лечения кожи, поврежденной УФ-излучением, используется гликолевая кислота, хорошо проникающая в дерму. Применяя высокую концентрацию гликолевой кислоты (50–70%) во время пилинга, можно добиться не только отшелушивающего эффекта, но и достичь стимуляции фибробластов с существенным ростом продукции коллагена.
Отшелушивание кожи можно проводить аппаратными методами — с помощью дермабразии и лазерной шлифовки. Однако эти процедуры достаточно дорогостоящие и должны проводиться только в медицинских учреждениях.
Очень перспективным методом считается мезотерапия с использованием таких мезотерапевтических препаратов, как гиалуроновая кислота, экстракты плаценты и эмбриональных тканей, нуклеотиды (Х-АDN).
Большой интерес в настоящее время вызывает технология интенсивного пульсирующего света, применяемая в борьбе с фотостарением и основанная на методике селективного фототермолиза. Мощный импульс света, генерируемый ксеноновой лампой-вспышкой, предварительно фильтруется для удаления опасного УФ-излучения и передается с помощью сапфирового кристалла на флуоресцентный фильтр, который в зависимости от «пропитки» специальными веществами может пропускать и дополнительно излучать волны в диапазоне от 535 до 1000 нм. При этом используется отфильтрованный свет, который усилен в определенной части спектра за счет эффекта флуоресценции. Этот свет в зависимости от длины волны воздействует на меланин, гемоглобин и коллаген. Клинические испытания показали, что селективное нагревание дермального коллагена до температуры 55°С вызывает продолжительное образование нового коллагена. Увеличение синтеза коллагена начинается с 8–10-й недели после последнего сеанса и продолжается в течение 6–12 мес. Биохимический механизм метода основан на фототермической стимуляции фибробластов, которые начинают активно синтезировать коллаген.
Основная роль в профилактике фотодерматозов принадлежит фотозащитным средствам, которые должны отвечать строгим требованиям, а именно поглощать лучи в широком диапазоне, быть устойчивыми к свету, нагреванию, воде, иметь низкую проникающую способность через роговой слой, быть безопасными, не обладать токсичностью, канцерогенностью, сенсибилизирующим действием, эффективно предотвращать появление видимых (солнечные ожоги) и невидимых (фотостарение, фотодерматозы, канцерогенез) эффектов УФ-излучения.
В состав солнцезащитных препаратов входят физические или химические фильтры, задерживающие солнечные лучи. Физические представляют собой минеральные соединения титана или цинка; они остаются на поверхности кожи и подобно маленьким зеркалам блокируют солнечное облучение, отражая лучи. Химические фильтры, улавливая УФ-лучи, преобразуют их в безвредное для кожи тепло. Новейшее поколение фильтров защищает кожу не только от УФ-В-, но и от УФ-А-лучей. Главный критерий при выборе того или иного фотозащитного средства — фактор солнечной защиты (SPF — sun protection factor).
В 1956 г. M. Schulze ввел понятие фактора солнечной защиты и установил его как отношение минимальной эритемной дозы (МЭД) защищенной УФ-фильтром кожи к МЭД незащищенной кожи после 24 ч облучения (МЭД оценивали визуально). Индекс солнечной защиты, например, 60 обозначает, что доза облучения УФ, необходимая для получения эритемы при наличии защиты, требуется в 60 раз большая, чем без защиты. Вместе с тем использование фильтра с индексом 60 не предполагает в 60 раз более длительного пребывания на солнце.
Уже несколько лет для лечения и профилактики фоточувствительных дерматозов применяется серия препаратов Фотодерм МАХ с максимальным фактором солнечной защиты (SPF)-100, показывающим, во сколько раз данное средство повышает естественную защиту кожи. Данные препараты были разработаны французской фирмой «Биодерма» специально для профилактики и лечения фотодерматозов и для использования у пациентов, которые по различным причинам не переносят воздействия солнечных лучей. При этом достоинством этой серии является наличие фотозащитных средств для любого типа кожи (для нормальной и сухой кожи лица выпускается крем, для жирной — эмульсия, для тела — молочко, при дисхромии, например витилиго, — тональный крем). Одним из преимуществ препаратов серии Фотодерм МАХ можно считать наличие в них нигде ранее не использовавшегося органического экрана «Тиносорб М», который абсорбирует солнечные лучи как органический фильтр, не проникая в кожу, и отражает их как минеральный экран, обеспечивая оптимальную фотозащиту от УФ-А- и УФ-В-лучей.
Помимо указанной серии препаратов, может применяться серия средств с высокой защитой от УФ-А- и УФ-В-лучей Антгелиос французской фармацевтической лаборатории Ля Рош-Позе. Средства изготовлены на основе термальной воды Ля Рош-Позэ и включают систему фильтров Антгелиос MEXORYL SX и MEXORYL XL, обеспечивающих оптимальную защиту от УФ-лучей и предотвращающих повреждения организма, связанные с солнечным излучением.
Применяется также солнцезащитная гамма с термальной водой дерматологической лаборатории Авен, включающая средства для чувствительной и сверхчувствительной кожи (не переносящей химические фильтры и ароматические отдушки) для детей и взрослых. Серия содержит экраны нового поколения MPI-SORB, защищающие кожу не только от коротких УФ-А- и УФ-В-лучей, но и от длинных УФ-А-лучей, губительно действующих на глубокие слои кожи.
В заключение хотелось бы отметить, что относиться к своему здоровью нужно как к дару, который необходимо беречь, не забывая о необходимости «разумного» отношения к солнцу и применения фотозащитных средств.
О. Ю. Олисова, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва