Фтор что означает название
Значение слова «фтор»
[От греч. φθόρος — гибель, разрушение]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Фтор — чрезвычайно химически активный неметалл и сильнейший окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
ФТОР, а, м. [греч. phthoros — гибель] (хим.). Химический элемент, бесцветный газ с едким запахом.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
1. хим. химический элемент с атомным номером 9, обозначается химическим символом F, галоген
2. хим. неисч. простое вещество F2, в нормальных условиях — газ бледно-жёлтого цвета с резким запахом
3. хим. физ. исч. разг. атом, ион или ядро фтора [1]
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: погончик — это что-то нейтральное, положительное или отрицательное?
Глоссарий. Химия
Фтор — элемент 17-й группы периодической системы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), второго периода, с атомным номером 9. Обозначается символом F (лат. Fluorum). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Очень ядовит.
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение. Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит. Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина: 2F2 + 2H2O → 4HF + O2 К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например: 2CoF3 → 2CoF2 + F2 MnF4 → MnF3 + 1/2 F2 Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2. Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Фтор (F, Fluor)
История фтора
Как и многие элементы, фтор сначала был «предсказан» теоретически, как атом плавиковой кислоты (которую открыл в 1771 году Карл Шееле) в 1810 году, и только в конце XIX столетия Анри Муассан выделил фтор в свободном виде. Своим названием фтор обязан древнегреческому слову φθόρος которое переводится как разрушение.
Общая характеристика фтора
Фтор является элементом XVII группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 9. Принятое обозначение – F (от латинского Fluorum).
Нахождение в природе
Фтор в природе находится как правило в минерале под названием флюорит, который встречается в небольших количествах в почве и водах рек и океанов.
Физические и химические свойства
Фтор является химически активным неметаллом, это самый лёгкий галоген, представляет собой бледно-жёлтый газ с резким запахом, является агрессивным и ядовитым (calorizator). Температура плавления фтора – аномально низкая, поэтому элемент хранится в жидком или газообразном состоянии.
Суточная потребность во фторе
Суточная норма во фторе увеличивается по мере роста человека, от 0,5 до 0,9 мг у детей и 1,5-4 мг у взрослых женщин и мужчин.
Продукты питания богатые фтором
Полезные свойства фтора и его влияние на организм
Фтор в организме человека:
Признаки нехватки фтора
Основными признаками нехватки фтора являются заболевания зубов и дёсен – пародонтоз и кариес.
Признаки избытка фтора
Признаками переизбытка фтора в организме человека являются замедление обмена веществ, поражение эмали зубов, деформация костей скелета, тошнота и рвота.
Применение фтора в жизни
Основное применение фтор находит как сильный окислитель в производстве ракетного топлива и химических полимеров, в медицине используется как кровезаменитель и ингредиент многих лекарственных препаратов.
Фтор что означает название
(при −188,14 °C, ж.) 1,108 г/см³
a=5,50 b=3,28 c=7,28 β=90,0 Å
Содержание
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание, |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека [4] | 0,01 |
В природе значимые скопления фтора содержатся в основном в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Относительно богаты фтором чечевица и лук.
Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Ядерные свойства изотопов фтора
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Квантовохимический терм атома фтора — 2 P3/2
Строение молекулы
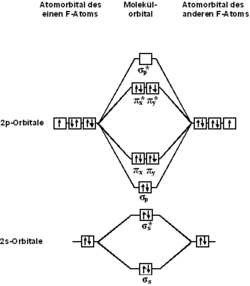
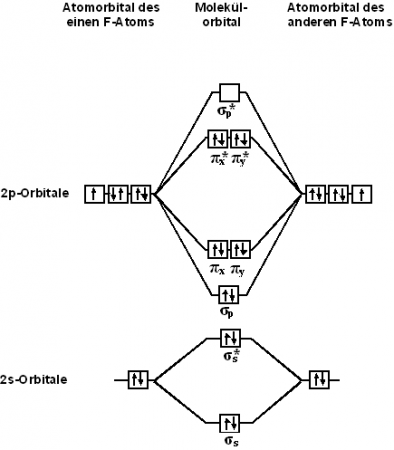
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
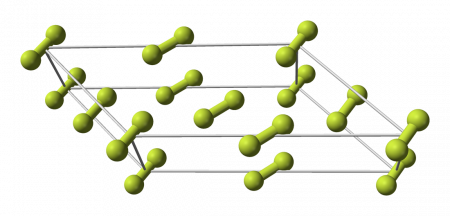
Кристаллическая решётка
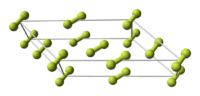
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
Лабораторный метод
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:

К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:

Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов [10] ).
Применение
Применение в химии
Газообразный фтор используется для получения:
Ракетная техника
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
Применение в медицине
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
Биологическая и физиологическая роль
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Предельно допустимая концентрация связанного фтора [13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
См. также
Литература
Примечания
Ссылки
 Органические соединения фтора Органические соединения фтора | |||
|---|---|---|---|
| Алканы и циклоалканы |
| ||
| Алкены и алкины |
| ||
| Спирты и кетоны |
| ||
| Кислоты и ангидриды |
| ||
| Элементоорганические соединения (N,S,P) |
| ||
| Ароматические соединения |
| ||
| Высокомолекулярные соединения |
| ||
Полезное
Смотреть что такое «Фтор» в других словарях:
фтор — фтор, а … Русский орфографический словарь
фтор — фтор/ … Морфемно-орфографический словарь
фтор — а; м. [от греч. phthoros гибель, разрушение] Химический элемент (F), светло жёлтый газ с едким запахом. Добавлять в питьевую воду ф. * * * фтор (лат. Fluorum), химический элемент VII группы периодической системы, относится к галогенам. Свободный… … Энциклопедический словарь
Фтор — F (от греч. phthoros гибель, разрушение, лат. Fluorum * a. fluorine; н. Fluor; ф. fluor; и. fluor), хим. элемент VII группы периодич. системы Mенделеева, относится к галогенам, ат. н. 9, ат. м. 18,998403. B природе 1 стабильный изотоп 19F … Геологическая энциклопедия
ФТОР — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2шC. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Современная энциклопедия
Фтор — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2°C. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Иллюстрированный энциклопедический словарь
ФТОР — (символ F), газообразный токсичный элемент группы ГАЛОГЕНОВ (элементы VII группы периодической таблицы), впервые выделенный в 1886 г. Его основными источниками являются флюорит и криолит. Это бледно желтое вещество, получаем в результате… … Научно-технический энциклопедический словарь
ФТОР — ФТОР, фтора, муж. (греч. phthoros гибель) (хим.). Химический элемент, бесцветный газ с едким запахом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ФТОР — ФТОР, а, муж. Химический элемент, ядовитый бесцветный газ с едким запахом. | прил. фтористый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФТОР — ФТОР, см. флюор. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
| Фтор | |
|---|---|
| Жёлтая жидкость (при криогенных температурах), бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.) | |
 |
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Ядерные свойства изотопов фтора
Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.