Фуразолидон или метронидазол что лучше при лечении кишечника
Этиотропная терапия острых кишечных инфекций
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается.
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается. Сложности в получении объективной информации о фактической этиологической структуре ОКИ ведут к тому, что практические врачи ориентируются в большинстве случаев на собственный опыт и региональные данные. Активное внедрение в практическую деятельность стационаров страховой медицины требует максимального снижения стоимости обследования и лечения пациентов и, как следствие, ведет к упрощению диагностики, зачастую в ущерб ее качеству, а также применению препаратов преимущественно отечественного производства.
Ежегодно в США патогенные микроорганизмы, передающиеся пищевым путем, вызывают около 76 млн случаев кишечных инфекций, в том числе 325 000 больных госпитализируется и 5 000 умирает. Только число случаев шигеллеза по оценкам экспертов составляет около 450 000, из них около 6 000 госпитализируется; а инфекции, вызванной норовирусами, — около 23 млн., из которых почти 40% связано с пищевым путем передачи. Число же официально регистрируемых случаев ОКИ в Российской Федерации в десятки раз меньше и не превышает 700 000 в год.
Немаловажной проблемой диагностики кишечных инфекций является формальный подход не только к назначению диагностических исследований, но и к оценке их результатов. Так, например, проведенный нами анализ 1522 историй болезни пациентов гражданских и военных стационаров, перенесших ОКИ в 2003–2006 гг., показал, что при поступлении их в стационар осмотр стула не проводился или данные о результатах осмотра отсутствуют в 31,4% историй болезни при легком течении заболевания, 16,6% — средней степени тяжести и 42,7% при тяжелом течении. Отсутствие патологических примесей в испражнениях отмечено у 32,8% больных с легким течением кишечной инфекции, 21,9% — среднетяжелым и даже у 6,1% — тяжелым.
Копрологические исследования чаще всего не проводятся при тяжелом течении болезни — 36,14%, в то время как при легком течении и средней степени тяжести болезни таких случаев было достоверно меньше — 11,06% и 5,78% соответственно (p > 0,001). При копрологическом исследовании патологических изменений в копрограмме не обнаружено в среднем у 29,83% больных при легкой степени тяжести кишечной инфекции, 11,02% — средней и 7,84% тяжелой. В то же время, несмотря на выявление копрологических признаков колита у 13,6% пациентов с острым гастроэнтеритом и у 25,5% острым энтеритом, изменения в окончательный диагноз внесены не были. А в тех случаях, когда в диагнозе отмечено наличие колита, копрологические признаки отсутствовали у 50,6% больных острым гастроэнтероколитом 46,1% — острым энтероколитом.
Диагностические посевы испражнений выполнялись у 49,0% пациентов двукратно, 23,5% — трехкратно и 17,0% — однократно. С увеличением степени тяжести эпизода ОКИ увеличивалась доля пациентов, у которых диагностические исследования проводились однократно. Так, при легком течении заболевания в 57,5% случаев выполнены три и более диагностических посева испражнений для выявления патогенной микрофлоры и всего лишь в 18,8% случаев исследования выполнялись однократно. При средней степени тяжести инфекции трехкратные посевы проведены в 19,9%, а однократные — в 15,6% случаев, в то время как у 64,5% больных выполнено два посева. При тяжелом течении заболевания в 44,4% случаев микробиологические исследования выполнены лишь один раз. Вместе с тем серологические исследования с целью установления этиологии заболевания проводятся чаще при тяжелом течении болезни — 58,54%, чем при среднетяжелом — 25,2% и легком — 19,22% (p Купить номер с этой статьей в pdf
Лечение обострений хронических заболеваний органов пищеварения
Создание ряда высокоэффективных фармакопрепаратов обеспечило существенное повышение эффективности лечения больных с патологий органов системы пищеварения. Среди этих лекарственных средств заслуживают внимание блокаторы Н2-рецепторов гистамина (ранитидин,
П. Я. Григорьев, доктор медицинских наук, профессор
Э. П. Яковенко, доктор медицинских наук, профессор
А. П. Яковенко, кандидат медицинских наук
Н. А. Агафонова, А. С. Прянишников, П. В. Гуляев, Е. В. Таланова, С. Б. Кальнова
Создание ряда высокоэффективных фармакопрепаратов обеспечило существенное повышение эффективности лечения больных с патологий органов системы пищеварения. Среди этих лекарственных средств заслуживают внимание блокаторы Н2-рецепторов гистамина (ранитидин, фамотидин и др.), ингибиторы протонной помпы (омепразол, лансопразол, пантопразол, рабипразол), прокинетики (цизаприд, домперидон, прукелоприд и др.), полиферментные препараты (креон, панцитрат, мезим-форте, ликреаза и др.), противовирусные (интерфероны, рибавирин, ламивудин и др.), а также антибактериальные и противопаразитарные средства. При оптимальном их использовании быстро и надежно достигается ремиссия гастроэзофагеальной рефлюксной болезни, язвенной болезни желудка и двенадцатиперстной кишки, предупреждается развитие осложнений язвенной болезни и геморрагического гастродуоденита. Нередко удается ингибировать репликацию вирусов, купировать активность и прогрессирование хронических вирусных гепатитов В и С и предупредить трансформацию хронического гепатита в цирроз и цирроз-рак печени.
В настоящее время в патогенезе острого и хронического гастрита, дуоденита, язвенной болезни желудка (ЯБЖ), язвенной болезни двенадцатиперстной кишки (ЯБДПК), MALT-лимфомы желудка и даже рака желудка доказана роль Helicobacter pylori (Нр). Обсуждается роль Нр-инфекции в патогенезе ряда экстрагастральных заболеваний: ишемической болезни сердца, мигрени, цирроза печени и др.
Разработка и внедрение в практику комбинированной антигеликобактерной лекарственной терапии ЯБЖ и ЯБДПК радикально изменили прогноз этих и некоторых других заболеваний желудка и двенадцатиперстной кишки.
Оптимальными вариантами эрадикационной терапии при ЯБЖ, ЯБДПК и эрозивных гастритах (гастродуоденитах), ассоциированных с Нр, признаны семидневные трех- или четырехкомпонентные схемы. Трехкомпонентная схема включает омепразол 20 мг, или лансопразол 30 мг, или пантопразол 40 мг, или пилорид (ранитидин висмут цитрат) 400 мг, которые принимаются с интервалом в 12 часов + кларитромицин 250 мг 2 раза в день или амоксициллин 500 мг 4 раза в день или 1000 мг 2 раза в день, или тетрациклин 500 мг 4 раза в день или 1000 мг 2 раза в день + метронидазол 400 мг 2 раза в день или фуразолидон 0,2 г 2 раза в день. Четырехкомпонентная 7-10-дневная эрадикационная терапия используется, если предыдущий вариант оказался неэффективным, и включает омепразол 20 мг 2 раза в день, или лансопразол 30 мг 2 раза в день, или пантопразол 40 мг 2 раза в день + препараты висмута (вентрисол или де-нол 120 мг 4 раза в день или бисмофальк 2 табл. 3 раза в день) + тетрациклина гидрохлорид 500 мг 4 раза в день, или амоксициллин 500 мг 4 раза в день + метронидазол 250 мг 4 раза в день или фуразолидон 0,1 г 4 раза в день. При этом все антибактериальные препараты необходимо принимать во время еды. В четырехкомпонентной схеме целесообразно использовать комбинированный препарат гастростат, в состав которого входят эти же ингредиенты. Другие комбинации использовать не рекомендуется в силу их малой эффективности.
После окончания 7-10-дневной эрадикационной терапии необходимо продолжить лечение при ЯБЖ в течение семи недель, при ЯБДПК — пяти недель, при эрозивном гастродуодените — трех недель одним из следующих антисекреторных препаратов: ранитидин 300 мг в сутки, фамотидин 40 мг в сутки, омепразол 20 мг в сутки, лансопразол 30 мг в сутки, пантопразол 40 мг в сутки. В качестве симптоматических средств дополнительно могут использоваться антациды (маалокс и др.) и цитопротекторы (вентер и др.).
Вышеуказанная терапия более чем в 90% случаев приводит к эрадикации Нр. В результате этого купируется активное воспаление в слизистой оболочке (СО) желудка и двенадцатиперстной кишки, обеспечивается заживление эрозий и язв, предупреждается развитие обострений и осложнений (кровотечение, прободение, стенозирование), лимфомы и, возможно, рака желудка.
Отечественные ученые обращают внимание практических врачей на то, что нередко имеет место гипердиагностика язвенной болезни и гастрита (гастродуоденита), не раскрываются причины возникновения болезней, не учитывается, что эрозивно-язвенный процесс в гастродуоденальной СО носит гетерогенный характер и не всегда связан с ЯБ. Так, например, при остром гастрите также могут появляться эрозии, локальные участки кровоизлияний в СО и кровотечения. При гистологическом исследовании у таких больных в СО выявляются умеренные признаки воспаления. Наиболее частыми причинами такого острого гастрита (гастродуоденита) являются: химические повреждения СО (алкоголь, нестероидные противовоспалительные средства, агрессивные щелочные жидкости), вирусы (цитомегаловирус, вирусы герпеса), бактерии (гемолитические стрептококки и др.), уремия, радиационные облучения. Изредка некоторые микробы вызывают даже острый флегмонозный гастрит. Ученым удалось установить причины стрессового гастрита, факторами риска развития которого являются: гипоксия, заболевания печени и почек, тяжелые операции, ожоги, сепсис, травмы ЦНС. Нередко в течение 24 часов после воздействия стрессовых факторов в СОЖ возникают острые эрозии и язвы. При этом приблизительно у 30% больных наблюдаются желудочно-кишечные кровотечения, причем у части из них они бывают массивными, угрожающими жизни. У пострадавших с ожогами часто диагностируются повреждения СО верхних отделов пищеварительного тракта, которые получили название «язвы Курлинга», при которых, особенно локализующихся в ДПК, существует большой риск не только развития кровотечений, но и перфораций. У больных с травмой головы и инсультом нередко в гастродуоденальной СО обнаруживаются острые язвы (язвы Кушинга). При этих язвах, особенно дуоденальной локализации, также существует большой риск развития кровотечений и перфораций. Поэтому необычайно важно выделять людей с высоким риском возникновения стрессовых повреждений ЖКТ и как можно раньше начинать лечение антисекреторными препаратами для профилактики развития кровотечения и перфорации.
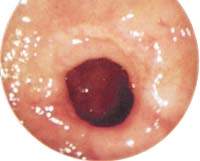 |
| Поверхностная язва привратника |
Отечественными учеными проведено немало исследований с целью установления связи между приемом нестероидных противовоспалительных средств (НПВС) и повреждениями ЖКТ. У больных, принимающих данные препараты по поводу ревматоидного артрита, остеоартроза и других болезней, язвообразование отмечается в 15-20% случаев, часто возникают осложнения (кровотечения и перфорации), особенно у лиц, имеющих в анамнезе ЯБ. Суммарный риск поражения ЖКТ у принимающих НПВС приблизительно в три раза выше, чем у не принимающих эти препараты. У пожилых пациентов (старше 65 лет) такой риск возрастает в пять раз. Врачи, назначающие данные препараты, обязаны предусмотреть решение трех задач: предупреждение развития НПВС-индуцированных язв (особенно при наличии факторов риска), их лечение (часто в условиях, когда требуется продолжение приема НПВС), а также профилактика повреждений СО тонкой и толстой кишки, возникающих при длительном их приеме. Несмотря на то что в лечебную практику начинает внедряться новый класс НПВС (селективные ингибиторы циклооксигеназы-2), которые не должны оказывать повреждающего эффекта на СО ЖКТ, их безопасность требует клинического подтверждения, и данные исследования к настоящему времени еще не завершены.
Главная задача профилактики стрессового гастрита и в известной мере НПВС-ассоциированных повреждений гастродуоденальной СО — увеличение рН внутрижелудочного содержимого до 4 и выше, так как при данном уровне рН происходит инактивация протеолитического фермента пепсина и повышение коагуляции крови. На сегодняшний день с этой целью целесообразно воспользоваться блокаторами Н2-рецепторов гистамина (ранитидин, фамотидин и др.) или ингибиторами протонной помпы (омепразол, лансопразол, пантопразол).
Отечественные и зарубежные ученые большое внимание уделили также изучению различных форм хронического гастрита (ХГ). Наряду с ХГ, связанным с Нр, и ХГ типа А, выделяются эозинофильный, лимфоцитарный и гранулематозный (болезнь Крона, туберкулез, гистоплазмоз, сифилис, саркоидоз и др.) гастриты, а также гипертрофические гастропатии (болезнь Менетрие, псевдолимфома желудка, синдром Золлингера — Эллисона), застойная гастропатия при портальной гипертензии (не является истинным гастритом), щелочной (желчный) рефлюкс-гастрит. При некоторых формах ХГ развивается гипо- и ахлоргидрия и недостаточность витамина В12. По мнению отечественных ученых, клиническая значимость ХГ состоит в том, что он может считаться ранним предраковым заболеванием, развитие которого происходит от атрофии СО к кишечной метаплазии и далее к раку желудка. Диагноз ХГ должен всегда основываться только на результатах квалифицированного гистологического исследования прицельно взятых биоптатов СОЖ, на что имеются указания в упомянутых выше государственных стандартах.
Одним из наиболее распространенных кислотозависимых заболеваний является гастроэзофагеальная рефлюксная болезнь (ГЭРБ), для лечения которой разработаны рекомендации и определены обязанности больного и врача.
Больному рекомендуется: спать на кровати с приподнятым не менее чем на 15 см головным концом; снизить массу тела, если имеется патологическое ожирение; не ложиться после еды в течение 1,5 часа; не принимать пищу перед сном, ограничить прием жира; прекратить курить и употреблять алкоголь; избегать тесной одежды, тугих поясов, а также работы в наклонном положении тела; по возможности ограничить прием лекарственных средств, оказывающих отрицательное влияние на моторику пищевода и тонус нижнего пищеводного сфинктера (пролонгированные нитраты, антагонисты кальция, теофиллин, миогенные спазмолитики, а также препараты, повреждающие СО пищевода (аспирин и другие аналоги).
Медикаментозное лечение назначается дифференцированно в зависимости от выраженности клинических, функциональных и морфологических изменений в верхних отделах пищеварительного тракта. При гастроэзофагеальном рефлюксе без эзофагита (есть симптомы, но нет видимых изменений СО пищевода) используются два варианта терапии. В случаях если ГЭРБ сочетается с замедлением эвакуации из желудка, снижением тонуса нижнего пищеводного сфинктера, гипомоторной дискинезией кишечника, целесообразно назначать внутрь прокинетики — мотилиум (домперидон) 10 мг или координакс (цизаприд, перистил и другие аналоги) 5-10 мг 4 раза в день в сочетании с буферными антацидами (маалокс или аналоги) по одной дозе через час после еды и одну дозу непосредственно перед сном. После достижения клинической ремиссии продолжается «терапия по требованию», то есть прерывистое симптоматическое лечение (при изжоге — мотилиум + антацид или быстрорастворимый зантак — 150 мг). При наличии выраженной недостаточности нижнего пищеводного сфинктера и/или высокого уровня интрагастральной кислотности целесообразно использовать блокаторы Н2-рецепторов гистамина (ранитидин 150 мг 2 раза в сутки или фамотидин 20 мг 2 раза в сутки), а при их неэффективности — ингибиторы протонной помпы (омепразол 20 мг в сутки или ланзопразол 30 мг в сутки) до достижения клинической ремиссии. В дальнейшем назначается «терапия по требованию», предусматривающая при появлении симптомов ГЭРБ прием антисекреторных препаратов в половинной суточной дозе или антацидов.
При рефлюкс-эзофагите I степени в течение 6 недель используются блокаторы Н2-рецепторов гистамина — ранитидин 150 мг, или фамотидин 20 мг 2 раза в день с интервалом в 12 часов, или ингибиторы протонной помпы — омепразол 20 мг в сутки или ланзопразол 30 мг в сутки. При наступлении ремиссии (в среднем через 6 недель) больного переводят на терапию «по требованию» с использованием антацидов, или Н2-блокаторов, или ингибиторов протонной помпы.
При рефлюкс-эзофагите III-1V степени на 4 недели назначается ингибитор протонной помпы омепразол 20 мг или лансопразол 30 мг 2 раза в день с интервалом в 12 часов. Далее, при купировании симптомов ГЭРБ продолжается прием омепразола 20 мг в сутки или лансопразола 30 мг в сутки до 8 недель с последующим переходом на постоянную поддерживающую терапию с использованием вышеуказанных препаратов в половинной суточной дозе в течение года. При недостаточной эффективности данной терапии возможно сочетание антисекреторных средств с прокинетиками-мотилиумом или координаксом в обычных суточных дозах. К дополнительным средствам терапии рефрактерных форм ГЭРБ относят сукральфат (вентер, сукрат-гель) 1,0 г 4 раза в день за 30 минут до еды в течение одного месяца.
Практический врач часто встречает больных с синдромом избыточного бактериального роста (СИБР) и изменением состава микрофлоры в кишечнике, называемым дисбактериозом. К возникновению этого синдрома могут приводить разные причины: болезни органов пищеварения, сопровождающиеся секреторно — моторными нарушениями, особенно при наличии очагов воспаления; перенесенные острые кишечные инфекции (бактериальная дизентерия, иерсиниозный энтероколит и др.); длительный прием лекарственных средств, влияющих на секрецию пищеварительных желез, регенерацию эпителия и моторно-эвакуаторную функцию пищеварительного тракта; длительный, а иногда и нерациональный прием антибактериальных препаратов; неполноценное питание; алкоголизм. Клинические проявления синдрома избыточного бактериального роста в кишечнике связаны с гиперизбыточной продукцией органических кислот и преждевременной деконъюгацией желчных кислот, выделением бактериальных токсинов, разрушением пищеварительных ферментов, развитием моторных расстройств.
Для СИБР характерно наличие абдоминальных болей или дискомфорта в животе, нарушение стула (изменение формы и нарушение пассажа), вздутие и чувство распирания живота, потеря массы тела, слабость, повышенная утомляемость, раздражительность. Лечение СИБР наряду с соответствующей диетой включает один-два семидневных курса антибактериальной терапии, назначение ферментных препаратов, лекарственных средств, регулирующих моторно-эвакуаторную функцию кишечника и интракишечный уровень рН, устраняющих дефицит витаминов, минеральных элементов и др., то есть проводится комбинированное лечение. Показаниями для назначения антибактериальной терапии являются: 1) избыточный бактериальный рост в тонкой кишке; 2) наличие воспалительных изменений в слизистой оболочке кишечника; 3) выявление условнопатогенной микрофлоры в посевах кишечного содержимого.
При СИБР в тонкой кишке в основном используется один из следующих антибактериальных препаратов: тетрациклина гидрохлорид 250 мг 4 раза в сутки, ципрофлоксацин 250 мг 2 раза в сутки, бисептол 960 мг 2 раза в сутки, метронидазол 500 мг 2 раза в сутки, фуразолидон 100 мг 3-4 раза в сутки, эрсефурил 200 мг 4 раза в сутки, интетрикс 1 капс. 4 раза в сутки, цефалексин 250 мг 4 раза в сутки. В ряде случаев можно применить энтерол 2-4 капсулы или пакета в сутки. При СИБР в толстой кишке предпочтение отдается одному из нижеперечисленных препаратов: фталазол или сульгин 1,0 г в сутки, эрсефурил 800 мг в сутки, интетрикс 4 капсулы в сутки, метронидазол 1,0 г в сутки, бактисубтил 4-6 капсул в сутки.
После окончания курса антибактериальной терапии назначаются пробиотики — препараты, содержащие нормальные штаммы кишечной флоры и пребиотики — средства, обеспечивающие их рост и функциональную активность. Для восстановления микрофлоры тонкой кишки используются пробиотики, содержащие аэробные штаммы (бифиформ 2-4 капсулы в сутки или лактобактерин 5-10 доз в сутки), толстой кишки — пробиотики, включающие анаэробные штаммы (бифидумбактерин 5-10 доз в сутки или колибактерин 5-10 доз в сутки,), толстой и тонкой кишки — комбинированные препараты (бифиформ 2-4 капсулы в сутки или бификол 5-10 доз в сутки). Продолжительность их приема составляет 2-4 недели.
Бифиформ — пробиотик, одна капсула которого содержит бифидумбактерин и энтерококки в объеме не менее 10 в седьмой степени каждого вида бактерий. Капсулы препарата покрыты энтеросолюбильной оболочкой, благодаря чему бактерии доходят до кишечника в неизмененном виде. Наличие в препарате анаэробной флоры делает его универсальным для восстановления микробиоценоза тонкой и толстой кишки. Кроме того, каждая капсула содержит особую питательную среду, необходимую для роста и размножения молочнокислых бактерий, что позволяет выживать и быть метаболически активной микрофлоре, содержащейся в препарате бифиформ.
В проведенном нами исследовании участвовали 119 больных, из них 68 женщин и 51 мужчина в возрасте от 21 до 76 лет (средний возраст 39,7 лет).
Для разработки эффективных подходов к назначению бифиформа нами апробированы три схемы терапии. Первая схема, при которой бифиформ назначался без предшествующей терапии, направленной на деконтаминацию кишечника, была использована у 37 больных. Вторая схема, предусматривающая прием бифиформа после предшествующей деконтаминации кишечника, назначалась 28 больным. Третью схему, при которой лечение бифиформом проводилось в виде монотерапии, получали 24 больных. Больные контрольной группы получали терапию, аналогичную второй схеме, но они не получали бифиформ или другие пробиотики.
Бифиформ назначался по 1 капсуле два раза в день в течение 15 дней. Однако если к седьмому дню лечения тяжесть клинических проявлений уменьшалась менее чем на одну степень, дозу препарата увеличивали до 2 капсул два раза в день и терапия продолжалась еще две недели. Для деконтаминации кишечника и снятия воспалительных явлений у больных с хроническими заболеваниями органов пищеварения проводились от одного до трех курсов противомикробной терапии продолжительностью от пяти до семи дней со сменой препаратов в очередном курсе.
Прием бифиформа оказал положительный эффект на состав кишечной микрофлоры. К концу лечения у 35 (76,1%) больных отмечено восстановление нормальной кишечной микрофлоры, и лишь у 11 (23,9%) состав ее оставался измененным. У большинства больных нормализовалось общее количество кишечной флоры, отмечено увеличение количества кишечной палочки, бифидобактерий, нормализация содержания энтерококков и исчезновение условно-патогенных энтеробактерий (лактозонегативных, гемолизирующих штаммов кишечной флоры, представителей родов Klebsiella, Enterobacter, Proteus, Pseudomonas, Citrobacter и др.). Следует отметить, что у значительной части больных, у которых оставались изменения в составе кишечной флоры, имели место и клинические симптомы (боли в животе, метеоризм, нарушения стула), что подтверждает их патогенетическую связь.
Бифиформ как в комплексном лечении, так и в виде монотерапии показал свою эффективность в купировании клинических проявлений диспепсии, в нормализации процессов пищеварения и восстановлении нормального состава кишечной флоры при широком спектре заболеваний органов пищеварения. Доза бифиформа по 1-2 капсулы два раза в день в течение двух недель является достаточно эффективной в ведении больных с хроническими заболеваниями органов пищеварения.
Отсутствие эффекта от проводимого лечения может быть связано с диетическими нарушениями, психоэмоциональными расстройствами, употреблением алкоголя, но чаще — неполным восстановлением нормальной кишечной микрофлоры в результате неадекватной терапии лекарственными средствами. Успех лечения в известной степени зависит не только от лекарственной терапии, предписываемой врачом, но и от пациента, которому необходимо избавиться от вредных привычек, изменить стиль жизни, пунктуально принимать лекарства и т. д.
Все материалы, поступающие в редакцию, рецензируются независимыми рецензентами и при необходимости редактируются. Редакция не несет ответственности за пропажу рукописи.
Направление в редакцию работ, ранее опубликованных или представленных для публикации в другие издания, не допускается.
Не забывайте указать точный почтовый адрес и телефон для контакта.
Рациональная антибактериальная терапия кишечных инфекций
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– В этой секции у нас прямое включение из Санкт-Петербурга. Профессор Захаренко Сергей Михайлович.
«Рациональная антибактериальная терапия кишечных инфекций».
Сергей Михайлович Захаренко, профессор, доктор медицинских наук:
– Добрый день, уважаемые коллеги! У нас в Санкт-Петербурге тепло. Кишечные инфекции пока не свирепствуют. Но мы морально должны быть готовы к тому, что проблема, как ни была решена до появления нас на свете, так, вероятно, и не будет решена в ближайшее время.
Если посмотреть на оценки Всемирной Организации Здравоохранения (ВОЗ), то кишечные инфекции занимают достаточно высокое место как причина смерти в мире. Четвертое место в странах с низким уровнем дохода. Шестое место в целом в странах всего мира.
Самой интересной, наверное, является самая нижняя строчка на этом слайде. Доля населения, умирающего по причине кишечных инфекций, в развитых странах и во всем мире отличается буквально на 0,001%. Если сравнить со странами, которые считаются высокоразвитыми, то разница будет составлять всего лишь 0,006%.
Как для России, так и для США или каких-то стран африканского континента проблема сохраняет актуальность на долгие годы.
Принято считать, что сегодня наибольшую актуальность имеют инфекции, вызванные вирусной природой. Но если мы посмотрим на результаты европейского исследования по эффективности диагностики бактериальных кишечных агентов, то видим, что на один случай кампилобактериоза, который диагностируется в Европе, в среднем приходится 274 недиагностированных случая.
Это касается и сальмонеллеза, и шигеллиоза и эшерихиоза. Мы должны себе отдавать отчет в том, что около половины случаев может быть связано с вирусами. Но около половины случаев – это бактериальные агенты, которые требуют специфического внимания.
Этот домик здоровья и пути к выздоровлению больного с кишечной инфекцией базируется на режиме питания. 4 столба в виде этиотропной терапии, регидратации, патогенетической терапии и симптоматической терапии обязаны быть полностью представлены, но грамотно и взвешено у каждого пациента.
Сегодня мы говорим лишь об одном крайнем столбе – это этиотропная терапия, которая имеет свои проблемы. Не существует единой схемы, выучив которую можно вылечить каждого больного. Нет препарата, которому можно было бы отдать стопроцентное преимущество во всех случаях. Проблему антибиотиковой резистентности не решили пока ни для одного возбудителя, ни для одного антибиотика.
Особая неприятность связана с тем, что резистентность формируется как мультирезистентность изначально.
В тех условиях, когда пациенты и врачи имеют рекомендации, в которых равнозначно позиционируются как препараты первой линии (2-3 средства), как препараты второй линии (3-4 средства), мы должны иметь какие-то основания для дополнительного положительного или отрицательного решения в пользу того или иного препарата.
Кроме антимикробного действия есть смысл учитывать и другие эффекты, о которых сейчас мы и попробуем поговорить.
Принципиальное значение имеет разделение диарей на случаи, которые случаются у резидентов (тех, кто проживает в данном регионе) и нерезидентов (или диарея путешественников). Важное значение имеет выделение групп пациентов, у которых болезнь протекает с гемоколитом или без гемоколита.
Говоря о диареях путешественников, что следует учесть. Основные этиологические агенты, мешающие жить нашим путешественникам – кишечные палочки. Главный возбудитель – энтеротоксигенные палочки. Обратите внимание на зависимость от исследований страны пребывания и времени года. Доля энтероагрегативных и энтерогеморрагических штаммов меняется.
ВОЗ и классики, занимающиеся терапией диареи путешественника, ранее рекомендовали 4 группы препаратов с разной степенью доказательности. Сегодня это «Триметоприм» («Trimethoprim»), «Сульфаметоксазол» («Sulfamethoxazole») в связи с ростом глобальной резистентности. С хорошим уровнем доказательности мы можем оперировать тремя группами препаратов: фторхинолоны, «Рифаксимин» («Rifaximin») (невсасывающийся препарат) и «Азитромицин» («Azithromycin»).
Если по уровню доказательности они сопоставимы, то вы видите в комментариях, что для фторхинолонов следует не забывать о побочных эффектах и формировании внекишечной резистентности. Для «Рифаксимина» при хорошем уровне безопасности не снимается вопрос о терапии с гемоколитом. «Азитромицин», несмотря на всю свою прелесть, все-таки не может применяться абсолютно для всех инфекций и инфекций, протекающих с гемоколитом. Есть проблемы формирования резистентности.
Так выглядят рекомендации на сегодняшний день по лечению диареи путешественника. Антибиотики не рекомендованы для лечения легких случаев. Даже «Лоперамид» («Loperamide»), который активно предлагается в этих случаях, не обязателен.
Средняя часть слайда посвящена четырем препаратам, которые стоят последовательно и равно одинаково. Возникает вопрос: как их выбирать.
Сравнивая эффективность, мы видим, что «Рифаксимин» не уступает по своей эффективности фторхинолонам, как с точки зрения выбора дозировки (двукратно можно применять), так и с точки зрения получения конечного результата в виде прекращения диареи.
Какие факторы могут быть учтены. Если мы посмотрим на первую строчку, то мы видим, что фторхинолонам никуда не деться от фотодерматитов в ряде случаев. Никуда не деться от ограничения по возрасту, по наличию беременности и проблеме формирования внекишечной резистентности.
Для макролидов большинство ограничений снято, за исключением того, что у взрослых достаточно быстро формируются резистентные штаммы. Они регистрируются.
«Рифаксимин» занимает позицию, достаточно выгодную с точки зрения сравнения по этим ограничениям. Вместе с тем существует определенная настороженность в отношении резистентности, которая может быть преодолена данными, которые мы получаем по выживаемости мутантов, резистентных к «Рифаксимину».
Обсуждая проблему резистентности возникающих штаммов мутантов к «Рифаксимину», следует учесть несколько факторов. Первое – частота формирования этой резистентности. Второе – последствия. «Ципрофлоксацин» дает резистентность 10-8 в отношении кишечных палочек. Приблизительно на один порядок «Рифаксимин» отличается от тестового препарата.
Достаточно нечасто формируется резистентность у кластридий, анаэробных или аэробных кокков и бактерий. Но самое интересное, что формирование резистентности к «Рифаксимину» не сопровождается формированием резистентности к другим антибактериальным препаратам. Мультирезистентность в комплексе не характерна.
Формирование резистентности хромосомного типа снижает жизнеспособность штаммов и уменьшает вероятность передачи генов резистентности, горизонтально другим близким микроорганизмам.
Широкий диапазон ингибирующих концентраций «Рифаксимина» позволяет бороться с абсолютным большинством энтеропатогенов, с которыми мы можем столкнуться, обсуждая проблему диареи. Высокая концентрация в относительно небольшом биообъеме, распределение препарата в пристеночном слое слизи создает повышенные локальные концентрации. Они сохраняются в течение 3-4 дней, даже после отмены препарата, сопровождая слизью препарат вдоль кишечной стенки.
Дополнительным преимуществом «Рифаксимина», применяемого в дозах от 600 мг до 1200 мг, является активность в отношении протозойных агентов. В этом американском исследовании представлено лечение пациентов, у которых были микст-инфекции.
Антипаразитарная активность достаточно заметна и интересна. Диарея путешественника – это, конечно, замечательное событие. Но желательно не болеть. С точки зрения профилактики антибактериальные препараты использовались, используются и, наверное, будут использоваться еще долгое время.
В 1970-е годы активно применялись препараты всасывающиеся, с системными эффектами. Но с середины 1980-х годов было рекомендовано ограничить применение препаратов, перейдя к поступившим на рынок препаратам невсасывающимся. С 1992-го года применение невсасывающихся препаратов рассматривается достаточно перспективным, за исключением тех случаев, когда есть основания использовать препараты системного эффекта при выезде в регионы, где распространены чувствительные к ним инфекции или, возможно, высокий риск заражения.
Сравнение эффективности «Рифаксимина» с плацебо показывает, безусловно, в несколько раз большую эффективность. Здесь не идет речь о случайности. Речь идет о достаточно хорошем качестве и работе препарата. Дозировки, которые могут использоваться при практическом применении – всего лишь 200 мг в сутки.
Одно-двухнедельный прием не приводит к катастрофическим изменениям в составе ни микрофлоры толстой кишки, ни микрофлоры тонкой кишки.
Особым свойством «Рифаксимина» является растворимость в зависимости от объемов присутствующей желчи. Высокая растворимость в тонкой кишке обеспечивает и высокий профилактический эффект и высокую эффективность при наличии синдрома избыточного бактериального роста в тонкой кишке.
Достаточно плавно снижающаяся концентрация препарата по ходу толстой кишки обеспечивает микробиоцитосохраняющий эффект и возможность сохранения нормальной микрофлоры. Или, как будет показано далее, применение с пробиотиками.
Говоря о диарее резидентов, то есть тех, кто болеет на своей территории, следует обратить ваше внимание на несколько принципиальных моментов, связанных, прежде всего, с эшерихиозами.
Эшерихиозы в прошлом году показали, какими они могут быть тяжелыми на примере вспышки в Германии. Уроки этой вспышки я вам сейчас постараюсь продемонстрировать. Энтеротоксигенные эшерихиозы, диарея путешественников и диарея резидентов лечатся приблизительно по одинаковой схеме. Тут никаких особенностей нет.
Также эти схемы применяются для лечения диарей, вызванных энтеропатогенными и кишечными палочками. Сложности возникают в отношении энтероагрегативных штаммов и энтерогеморрагических штаммов.
Рассматривая эффективность «Рифаксимина», в отношении этой группы возбудителей обоснованно показано, что в течение 4-8-ми часов уменьшается степень активности продукции энтеротоксигенными кишечными палочками как термолабильного, так и термостабильного токсина.
(Неразборчиво, 10:35) и энтероагрегативные штаммы в меньшей степени продуцируют факторы патогенности. При этом на фоне применения «Рифаксимина» отмечена меньшая продукция интерлейкина-8, играющего роль в патогенезе этих состояний.
Применение «Рифаксимина» позволяет контролировать жизнеспособность и популяцию энтероагрегативных кишечных палочек. Вся группа эшерихиозов попадает под более эффективное влияние всасывающегося препарата, чем применение системных препаратов.
Слайд, посвященный итогам эпидемии, вызванной E. сoli О104 в Германии. Справа вы видите хорошие препараты, которые эффективно используются для лечения сальмонеллеза, дизентерии или каких-то других инфекций. Не работали на этой группе больных.
На сегодняшний день тактика терапии эшерихиозов, вызванных энтерогеморрагическими кишечными палочками с высоким риском развития гемолитико-уремического синдрома, основаны на применении карбопенемов в тех случаях, когда требуется системная терапия. «Рифаксимина» как невсасывающегося препарата в случаях, когда местная терапия показана, и нет необходимости в системных действиях.
Рекомендованные дозы неоднозначны – от 600 мг до 1200 мг. Они не превышают средних терапевтических рекомендаций.
Трудно поставить диагноз по первому знакомству с больным. Но можно разделить пациентов хотя бы на 2 группы: больные с гемоколитом и без гемоколита. Здесь представлены схемы терапии больных без гемоколита. Эффективное применение «Рифаксимина» возможно, если посмотреть на ограниченные опыты, которые мы провели, сравнивая «Альфа Нормикс» («Alfa Normix») вместе с «Ципрофлоксацином».
Видно, что различия в длительности диареи в ключевом синдроме при этом заболевании меньше полусуток. Препараты опять равноэффективны как при диарее путешественника, так и при диарее резидентов.
Огромная проблема, которая встала в полный рост в течение последних лет. Вспышки с. difficile-ассоциированных заболеваний в Канаде с тридцатью летальными исходами говорят о том, что сегодня мы, к сожалению, мало знаем об этом заболевании и плохо диагностируем. Но терапевтическую тактику мы отчетливо представляем как по зарубежным публикациям, так и по собственному клиническому опыту.
«Метронидазол» («Metronidazole») позиционируется как препарат выбора по многим позициям. Прежде всего, по стоимости. Он используется для лечения легких и тяжелых первичных эпизодов. В случае отсутствия эффекта в течение трех дней от терапии переходим на применение «Ванкомицина» («Vancomycin»).
«Ванкомицин» – это «золотой стандарт» в лечении этого заболевании. Но достаточно дорогой, поэтому первично он рекомендуется при тяжелом течении заболевания либо при рецидивах.
Что делать, если не получается вылечить пациента этими двумя лекарственными средствами. На сегодняшний день за рубежом существует «Фидаксомицин» («Fidaksomicin»), который включен в рекомендации. У нас существует только «Рифаксимин».
«Рифаксимин» может использоваться для лечения этой группы пациентов в дозах от 400 мг до 800 мг в сутки в течение 10 – 14 дней. Особое преимущество он имеет у больных с поражениями печени. На сегодняшний день к нам, к сожалению, еще не пришли иммуноглобулины, которыми можно пользоваться для лечения этой группы больных. Нет у нас бактериофагов.
Интересным и принципиально важным для позиционирования «Рифаксимина», как минимум, третьим средством антикластридиозной направленности является очень высокий уровень бактериологической эффективности, достигающей 73%. В то время как для «Метронидазола» и «Ванкомицина» этот показатель составляет порядка 65%.
В этом исследовании антибиотики назначались в течение 14-ти дней. Меньший курс имеет больший шанс на рецидив.
Еще одно обстоятельство. Сегодня крайне сложно найти пациентов, которые не имеют никаких проблем со стороны метаболических расстройств или болезни печени.
Как взаимодействуют антибиотики с печенью, и есть ли какие-то риски. Дисульфирамоподобные реакции, известные достаточно хорошо, числятся за «Метронидазолом», за «Фуразолидоном», за «Цефаперазоном» («Cefoperazone»). Достаточно широкий спектр препаратов, попадающих в эту зону.
Ряд препаратов откровенно не рекомендован при заболеваниях печени. Весь спектр антимикробных средств представлен на этом слайде. Всегда ли мы вспоминаем, что эти препараты ограниченно разрешены.
Риск гепатотоксичности возрастает и по фторхинолонам. В частности, здесь присутствует «Моксифлоксацин» с риском 4.3 на фоне болезни печени.
Лекарственное взаимодействие – немаловажная проблема, как на уровне кишечника, так и внекишечное взаимодействие. «Рифаксимин», обладая другими механизмами метаболизма и всасываясь в крайне малом объеме, еще способен стимулировать цитохром Р450. Это способствует метаболизму других ксенобиотиков.
Этого мало. Как оказалось, применение этого препарата у больных с пораженной печенью способствует не только уровню циркулирующего эндотоксина и провоспалительных цитокинов, но имеет и определенные вазо- и кардиотропные эффекты. Конечно, они не прямые, а опосредованные. Тем не менее, это дополнительный «бонус», который получают эти тяжелые пациенты.
Сегодня достаточно активно предлагается применять антибиотики вместе с пробиотиками. Насколько эта терапия эффективна и безопасна для пробиотиков. Эти два исследования, представленные на слайде, показывают возможность применения, как минимум, бифидосодержащих препаратов вместе с «Рифаксимином».
Пробиотические свойства штаммы в присутствии «Рифаксимина» не теряют. Эта комбинированная терапия оказывается вполне возможной.
Еще интересные данные получены буквально в течение последних 5-7-ми лет. Они касаются сродства «Рифаксимина» с pregnane X-рецептором, участвующим в регуляции адекватного неспецифического и иммунологического ответа. Эти свойства являются интересными и важными с точки зрения применения препарата при лечении не только кишечных инфекций, но и воспалительных заболеваний кишечника.
Таким образом, на сегодняшний день не вызывает сомнения то, что наши представления о частоте и выявляемости кишечных инфекций несколько занижены. На самом деле этих пациентов больше. Но не надо рассматривать каждого пациента с диареей как инфекционного. Надо искать и другие факторы и причины и полноценно обследовать больных.
Мы должны сохранять настороженность в отношении возможной причины кишечной инфекции, вызванной бактериальными агентами, и адекватно выбирать антибактериальную терапию. Далеко недооцененными на сегодняшний день являются диареи путешественников и нозокомиальные диареи, вызванные в том числе с. difficile.
Терапия диарей и кишечных инфекций не может быть безальтернативной. Грамотная оценка выраженности симптомов, лихорадки позволяет выбрать препараты с системным или местным действием. Среди препаратов с системным действием нет альтернативы фторхинолоном. А среди препаратов невсасывающихся на нашем рынке нет альтернативы «Рифаксимину».
С. Difficile-ассоциированные заболевания должны быть второй целью для применения этой группы препаратов. В частности, «Рифаксимина».
Лишь грамотное использование всех современных возможностей (как эта черепаха выбралась из загона), наверное, может позволить нам выбраться из проблемы лабиринта кишечных инфекций.