Хеликобактер негативный что это
Хеликобактер пилори: мифы и реальность
Человек является «хозяином» мириад микроорганизмов, число которых в десять раз превышает количество клеток в его организме.
Основную массу бактерий, колонизирующих человеческий организм, составляет популяция комменсалов (commensal – франц. – «сотрапезник») – бактерий, использующих хозяина для своей жизнедеятельности, но не причиняющих ему вреда. Для их взаимоотношений с человеком характерны коэволюция, коадаптация и взаимозависимость.
Значительно распространены и симбионтные бактерии, полезные для жизнедеятельности человека. Симбионтные бактерии, населяющие наш организм, участвуют в образовании энергии из пищи, образуют факторы роста, стимулируют функции врожденного и приобретенного иммунитета, противодействуют инвазии патогенных бактерий. Патогенных бактерий известно несколько сотен.
В 1983 г. австралийские ученые J.R. Warren и B.J. Marshall обнаружили в желудке человека ранее неизвестную бактерию, первоначально названную Campylobacter pyloridis, но затем переименованную в Helicobacter pylori (Hp). Сам факт обнаружения неизвестной ранее бактерии не является каким-то чрезвычайным событием в микробиологии, поскольку помимо огромного количества известных бактерий, существуют и пока еще неизвестные, которые ждут своего «открытия».
Первоначальный скепсис ученых в отношении вновь открытой бактерии Helicobacter pylori (Hp) вскоре сменился всеобщим ажиотажем, своеобразным «хеликобактерным бумом». Стало популярным утверждение, что хеликобактер пилори является главной причиной развития хронического гастрита (ХГ) и язвенной болезни (ЯБ), а затем – рака желудка (РЖ) и MALT-лимфомы (мальтомы) желудка низкой степени злокачественности. Но и этим дело не ограничилось. Присутствие Нр в желудке связывали с развитием многих внежелудочных заболеваний, в том числе: сердечно-сосудистых, неврологических, болезней печени и желчных путей, кишечника, системы крови и др.
С момента «открытия» хеликобактер пилори и появления концепции о ведущей роли микроба в развитии основных гастродуоденальных заболеваний (ХГ, ЯБ, РЖ) многие ученые высказали сомнение в ее достоверности. По мере накопления научных фактов и аргументов, опровергающих данную концепцию, они выступили с обоснованной критикой и отрицанием ее постулатов. И даже присуждение «первооткрывателям» микроорганизма J.R. Warren и B.J. Marshall Нобелевской премии по медицине (2005 г.) не изменило их негативное отношение к концепции о ведущей роли Hp бактерии в развитии гастродуоденальной патологии, поскольку, как справедливо отметил великий российский физиолог И.П. Павлов: «Факты в тысячу раз важнее слов».
Подтвержденные факты о хеликобактер пилори (Helicobacter pylori (Hp))
Установленные факты о Нр-инфекции и ее свойствах:
Мифы о хеликобактер пилори (Helicobacter pylori (Hp))
А теперь расскажем о мифах, связанных с хеликобактерной инфекцией, научных фактах и аргументах, опровергающие ведущую роль Нр-инфекции в развитии основных гастродуоденальных заболеваний.
Миф 1. Все люди, имеющие хеликобактерную инфекцию обязательно имеют заболевания гастродуоденальной зоны, т.е. хеликобактер пилори 100% патогенный микроорганизм.
Среди инфицированных Нр людей, различные заболевания развиваются менее, чем у 1%, а 70% людей, у которых обнаруживают хеликобактер пилори – это здоровые бактерионосители. Известный микробиолог С.В. Сидоренко утверждает: «Широкое распространение Нр-инфекции среди лиц без признаков патологии – это весомый аргумент, опровергающий ведущую роль Нр в развитии гастродуоденальных заболеваний».
Предпринимавшиеся неоднократно попытки установить связь цитотоксических штаммов Нр с конкретными гастродуоденальными заболеваниями, ассоциированными с Нр, не увенчались успехом: «ульцерогенных», «канцерогенных» и т.п. штаммов Нр в природе не существует. Более того, цитотоксические штаммы Нр были обнаружены не только у больных хроническим гастритом и язвенной болезнью, но и при синдроме функциональной (гастродуоденальной) диспепсии, не связанной с Нр-инфекцией (в 46%), и даже у здоровых бактерионосителей (в 27%), не причиняя им никакого вреда.
Миф 2. Утверждают, будто у Нр в желудке нет конкурентов. Благодаря уникальной способности к рекомбинантным мутациям только они сумели приспособиться к существованию в резко кислой среде желудка. В случае обнаружения другой микрофлоры ее считают транзиторной, неспособной колонизировать желудок.
Российским ученым Циммерманом Я.С. и соавторами были проведены исследования микрофлоры, колонизирующей желудок, чтобы выяснить, действительно ли у Нр в желудке нет конкурентов, или это суждение ошибочно.
Наиболее высокой степень колонизации антрума желудка оказалась у Haemophilus spp. – 5,0 lg KOE/г и Streptococcus spp. – 4,4 lg KOE/г. В среднем концентрация микробов в желудке при остром и хроническом гастрите составила 3,4 lg KOE/г. Выделенная микрофлора обладала, как правило, адгезивностью и в значительной части случаев – инвазивностью (в отличие от Нр) и патогенными свойствами (45,5%), в том числе и уреазной активностью (27,3%).
В среднем концентрация микробных клеток в периульцерозной зоне у больных ЯБ составила 2,7 lg KOE/г, т.е. оказалась невысокой. При изучении вирулентных свойств выделенной микрофлоры в 27,3% случаев была установлена их уреазная активность, в 36,6% – наличие природных или приобретенных в процессе адаптации к агрессивной среде желудка патогенных свойств, в 45,5% – резистентность к действию различных антибактериальных средств, используемых для эрадикации Нр. В целом, признаки патогенности определялись у 56,4% выделенных бактерий.
Все бактерии, колонизирующие желудок у больных ХГ и ЯБ, обладали адгезивностью, а значительная часть из них – инвазивностью (в отличие от Нр) и патогенными свойствами. Это дает основание отнести их не к транзиторной, а к мукозной микрофлоре (М-микрофлоре), способной вызвать развитие воспалительно-эрозивно-язвенных поражений желудка наряду с Нр и независимо от Нр.
Таким образом, у больных ХГ и ЯБ определяется не хеликобактериоз, а дисбактериоз. Аналогичные или близкие результаты были получены в последнее время и за рубежом. Было установлено, что основной микрофлорой, колонизирующей желудок при его заболеваниях, являются стрептококки, превателла, фузобактерии. Эти данные были получены при изучении бактериального состава желудка методами глубокого секвенирования амплифицированной 16SpRNA (клонирование). В общей сложности было выявлено 127 филотипов и 5 доминирующих родов (Streptococcus, Prevatella, Fusobacterium, Rothia, Veilonella).
Миф 3. Хеликобактер пилори (Hp) – главная причина язвенной болезни.
Инфекционная теория происхождения язвенной болезни по-прежнему не дает ответа на ряд принципиальных вопросов:
Для признания микроба этиологическим фактором любого заболевания требуется выполнение ряда обязательных условий, так называемых «постулатов Р. Коха»:
В последние 15–20 лет было доказано, что помимо ЯБ, ассоциированной с Нр-инфекцией, со значительной частотой встречается Нр-негативная ЯБ, при которой использование даже нескольких диагностических методов идентификации Нр не выявляет их присутствия. Нр-негативные формы ЯБ выявляют с частотой 38% среди дуоденальных язв и 56% – желудочных.
Один из «первооткрывателей» Нр B.J. Marshall, чтобы доказать этиологическую роль Нр при ЯБ, ввел себе в желудок концентрированную суспензию чистой культуры Нр (109 микробных тел). Через 7–10 дней у него развилась типичная клиническая картина острого гастрита (а не ЯБ), которая вскоре исчезла без всяких последствий. Другие добровольцы, повторившие эксперимент с самозаражением культурой Нр, получили аналогичный результат.
Инфекционной концепции происхождения ЯБ противоречит и тот факт, что без всякого лечения язва самопроизвольно рубцуется в течение 4–5 недель, несмотря на присутствие в желудке Нр.
Не находит объяснения с точки зрения инфекционной концепции этиологии ЯБ (Нр) то, что при рецидиве болезни образуется, как правило, одиночная язва, а не множественные эрозивно-язвенные поражения, а течение ЯБ характеризуется спонтанной цикличностью со сменой рецидивов и ремиссий.
Опровергает этиологическую роль Нр при ЯБ и такой важнейший факт, как отсутствие положительных сдвигов в ее распространении в большинстве стран мира, несмотря на эрадикацию Нр. Даже такой убежденный сторонник ведущей этиологической роли Нр при ЯБ, как И.В. Маев, в статье, посвященной современным тенденциям в изучении заболеваний желудка и двенадцатиперстной кишки, вынужден был признать: «Несмотря на уже многолетнюю активную борьбу с Нр-инфекцией, распространенность ЯБ в нашей стране и в большинстве стран мира не снижается; стабильно высокой (на уровне 10%) остается и частота ее грозных осложнений (кровотечение, пенетрация, перфорация)».
Следовательно, проводившаяся на протяжении последних 20 с лишним лет активная антибактериальная терапия, направленная на уничтожение Нр и излечение ЯБ, оказалась безрезультатной! Так, в США состоит на учете более 4 млн больных ЯБ, протекающей с ежегодными рецидивами, и их число за последние годы не снижается, а растет. Известный сторонник ведущей роли Нр в происхождении гастродуоденальных заболеваний В.А. Исаков в своей докторской диссертации, посвященной ЯБ (Москва, 2000) подтверждает: «Доказать этиологическую роль Нр при ЯБ пока не удалось».
Таким образом, приведенные бесспорные научные факты и аргументы дают достаточно оснований утверждать, что ЯБ – это не инфекционное (Нр), а идиопатическое (с неизвестной этиологией) гастроэнтерологическое заболевание.
В тоже время нельзя отрицать, что Нр участвует в патогенезе язвенной болезни, являясь местным фактором патогенеза. Местными факторами патогенеза язвенной болезни наряду с Нр также являются:
При этом необходимо отметить, что повышенная ацидопептическая активность желудочной секреции – это облигатный фактор патогенеза ЯБ («нет кислоты – нет язвы»), а колонизация желудка Нр – факультативный, так как ЯБ может развиться и без всякого участия Нр (Нр-негативные формы ЯБ). Еще М.П. Кончаловский (1922) писал: «Язва не есть местная болезнь слизистой оболочки, а есть болезнь всего организма».
Поэтому в патогенезе язвенной болезни играет роль наследственная предрасположенность плюс воздействие на организм человека различных сочетаний неблагоприятных внешнесредовых факторов (психоэмоциональный стресс, резкое колебание метеоусловий, характерное для весны и осени, курение и т.д.). Для того чтобы образовался язвенный дефект необходимо сочетание 2-3 патогенных факторов одновременно и Нр только один из них.
Миф 4. Нр вызывает рак желудка.
Рак желудка (РЖ) при колонизации желудка Нр развивается только в 1% случаев, а среди населения Индии и Африки, где инфицированность населения Нр достигает 90–95%, РЖ диагностируют значительно реже, чем в Западной Европе и США, где распространенность Нр не превышает 35–50%.
Было установлено, что Нр непосредственно не участвуют в развитии РЖ, не вырабатывают мутагенных и канцерогенных веществ, поэтому нет оснований рассматривать бактерию в качестве истинного канцерогена. Возможно, она является коканцерогеном, но и это требует доказательств.
Важно подчеркнуть, что в исследованиях было установлено, что Нр-инфекция повышает риск развития только дистального (пилороантрального) РЖ, а проксимальный (кардиальный) РЖ не связан с Нр. Более того, колонизация Нр антрума желудка, особенно их cagAположительными штаммами, каким-то образом препятствует развитию кардиального РЖ и рака нижней трети пищевода, выполняя протективную функцию.
В связи с этим М.J. Blaser высказал мнение, что: «Существует некий баланс между отрицательным и положительным действием Нр на человека». РЖ может развиваться и при аутоиммунном ХГ (тип А), не связанном с Нр-инфекцией, который нередко сочетается с мегалобластной анемией (Аддисона–Бирмера).
При РЖ Нр в желудке обнаруживают редко. Преобладают, как правило, анаэробы, нарастает количество Streptococcus, Veilonella, Leptotrichia. Описаны и другие более важные кофакторы РЖ. Так, РЖ непосредственно связан с мутацией или депрессией онкогенов, ответственных за развитие РЖ, в частности с канцерогеном метилнитронитрозогуанидином (MNNG), даже малые дозы которого вызывают развитие РЖ. Среди факторов риска развития РЖ определенное значение придают отягащенному семейному анамнезу, накоплению в желудке продуктов перикисного окисления, диетическим погрешностям (избыточному употреблению поваренной соли, консервированых продуктов, содержащих нитраты, копченостей, маринадов).
Некоторые исследователи (P.Correa, П.Сиппонен, К.Сеппала) пробовали в эксперименте воспроизвести развитие рака желудка, обусловленного Нр-инфекцией. Ни одному исследователю это не удалось. Эрадикация Нр может привести к ликвидации воспаления в слизистой оболочке желудка, но не задерживает рост рака желудка, не вызывает регрессии опухолевого процесса в слизистой даже на стадии раннего рака желудка, не ликвидирует атрофию и кишечную метаплазию.
Нр не синтезируют ни мутагенных, ни канцерогенных веществ.
По заключению экспертов ВОЗ, Нр-инфекция не является безусловно канцерогенной для человека. Из этого следует, что для развития рака желудка одного наличия Нр-инфекции в слизистой оболочке желудка недостаточно.
В то же время нельзя не отметить важную роль Нр в образовании мальтом желудка. MALT-лимфомы (mucosa-¬associated lymphoid tissue — лимфомы из лимфоидной ткани, ассоциированные со слизистыми оболочками), или мальтомы, которые могут возникать практически в любом органе, однако чаще они развиваются в желудке, слюнных железах и щитовидной железе, тоесть в органах, в которых лимфоидная ткань появляется после хроничес¬кого персистирующего воспаления.
Основной причиной развития MALT-лимфомы является наличие аутореактивной лимфоидной ткани вследствие аутоиммунного или воспалительного процесса, как например при инфекции Helicobacter pylori (H. pylori) в желудке.
Эпидемиологические исследования в Европе продемонстрировали, что в районах с высокой заболеваемостью лимфомой желудка H. pylori выявляют чаще, чем в районах с низкой заболеваемостью. Более того, у больных с лимфомой желудка чаще, чем в контрольной группе, имеются антитела к H. pylori. По некоторым признакам, появление лимфоидной ткани в желудке и возникновение MALT-лимфомы тесно связаны с длительной антигенной стимуляцией слизистой оболочки.
При проведении антихеликобактерной терапии, H.pylori и лимфоидная ткань слизистой оболочки желудка со временем исчезают, то есть исчезает субстрат, из которого развивается MALT-лимфома и приводит к регрессии гистологически подтвержденных MALT-лимфом низкой степени злокачественности. Еще предстоит установить, насколько профилактическая антибактериальная терапия способствует снижению риска развития лимфомы желудка. Взаимосвязи между этим возбудителем и лимфомами другой локализации не выявлено.
Миф 5. Нр вызывает различные заболевания в других органах и системах.
В последнее время появилось очень много публикаций, утверждающих, что Нр-инфекция способствует развитию ряда заболеваний: сосудистые (церебральные и коронарные), аутоиммунные заболевания, кожные поражения, бронхиальная астма, глаукома, головная боль, мигрень и целый ряд других.
Надо отметить, что Нр – неинвазивный микроб; он обнаруживается в толще желудочной слизи, на наружной мембране поверхностного эпителия (между ворсинками), к которой прикрепляется благодаря способности к адгезии, а также в межклеточном пространстве. При этом, Нр не проникают через слизистую оболочку желудка. Излюбленым местом колонизации Нр является антральный отдел желудка, где более высокий уровень рН, впоследствии возможно распространение в антрокардиальном направлении. Ни цилиндрический эпителий кишечника, ни многослойный плоский эпителий пищевода Нр колонизировать не могут.
Нет ни одного подтвержденного исследованием факта ведущей роли Нр в развитии непищеварительных заболеваний. Исследование HOPE, проведенное в 2003-2004гг. не смогло подтвердить достоверную ассоциацию между инфекцией H.pylori и риском возникновения патологии сердца и сосудов. Было обследовано 3168 канадских больных с ИБС на наличие серологических маркеров к H.pylori, цитомегаловирусу, C.рneumoniae и вирусу гепатита А.
Результаты показали, что наличие маркеров цитомегаловирусной инфекции ассоциировалось с развитием сердечно-сосудистых событий, однако связи с маркерами бактерий H. pylori и другими патогенами выявлено не было.
Только в том случае, если будет безусловно доказано, что Нр – инвазивный микроб, персистирующий в кровяном русле человека, что он способен вызывать образование очагов инфекции в других тканях и органах, можно всерьез обсуждать возможность существования Нр-ассоциированных внежелудочных заболеваний, изучать причинно-следственные связи между ними, признать роль Нр в их появлении и развитии.
Миф 6. Если у вас выявлен Нр обязательно необходимо провести эрадикацию (уничтожение) этого микроорганизма.
В настоящее время проводить эрадикацию Нр-инфекции рекомендуется:
Нет необходимости проводить эрадикацию у больных с синдромом функциональной диспепсии, гастроэзофагеальной рефлюксной болезнью, НПВС-гастропатией, поскольку роль Нр в развитии этих заболеваний не доказана. Безусловным противопоказанием для эрадикации Нр также является здоровое бактерионосительство.
Автор публикации Гасанова Е. В., гастроэнтеролог, КМН, врач высшей категории.
В статье использованы данные печатных работ Циммерман Я.С., Blaser MJ, Кончаловский М.П., Correa P., Сиппонен П., Сеппала К.
Бактерия хеликобактер пилори
7 февраля 2018
Многие желают узнать, как передается и лечится хеликобактер пилори – опасная бактерия, живущая в желудке, виновница хронического гастрита, эрозий, язв и даже рака желудка.
Что это за бактерия?
Как же воздействует хеликобактер на желудок? Уничтожает париетальные (пристеночные) клетки слизистой (внутренней) оболочки желудка, выбрасывая ядовитые продукты – токсины. Защитные клетки крови – нейтрофилы, лимфоциты и другие, преследуют вредителя, пытаясь уничтожить и его, и измененные париетальные клетки – возникает воспаление. Количество защитной слизи на участке пребывания бактерии заметно снижается, на измененный участок стремительно воздействует соляная кислота, усугубляя неизменное воспаление слизистой. Это проявляется болью в желудке «под ложечкой», изжогой, отрыжкой, налетом на языке, неприятным запахом изо рта, постоянной тошнотой, то есть симптомами хронического гастрита. Хроническое длительное воспаление слизистой оболочки желудка приводит к изменению ее клеток, вплоть до развития рака желудка.
Так что же теперь и в кафе со своей посудой ходить? К счастью, хеликобактер не устойчивая бактерия и обработки посуды в посудомоечной машине достаточно, чтобы ее уничтожить. Хорошие рестораны и кафе конечно оборудованы такими машинами, и посещать их можно без риска заражения.
Как узнать, есть ли у меня инфекция хеликобактер пилори?
У меня выявлен хеликобактер пилори – что делать?
При выявлении положительного анализа на хеликобактер пилори нужно обратиться за консультацией к гастроэнтерологу или терапевту. В лечении инфекции используются антибиотики, и назначает их только врач.
Можно ли вылечить хеликобактер приемом препарата де-нол, как показывают в рекламе, или народными средствами? Полностью избавиться от инфекции хеликобактер пилори можно только определенными антибиотиками.
Нужно ли мне травить себя антибиотиками, если меня ничего не беспокоит, а результат анализа на хеликобактер положительный? Инфекция может и не беспокоить, в 70% случаев так и происходит, гастрит годами протекает «молча», но через несколько лет вследствие вялотекущего воспаления возникает атрофия слизистой оболочки и нельзя исключить ее переход в рак желудка. В каждом конкретном случае решение о проведении лечения принимает лечащий врач.
Инфекция хеликобактер пилори очень распространена среди населения, есть ли смысл в лечении, если потом можно повторно заразиться? Да, повторное инфицирование возможно, но происходит не часто – примерно 6 человек из 100 пролеченных приобретают инфекцию вновь при несоблюдении правил профилактики. Они очень просты – мыть руки перед едой, не пробовать чужую еду, не есть в сомнительных забегаловках, где нет уверенности в правильной обработке посуды, не целовать не очень близких людей. Важно также при выявлении инфекции хеликобактер пилори проверить на нее всех членов семьи, начиная с подросткового возраста, и в идеале – пролечиться одновременно всем инфицированным. Детей, если ничего не беспокоит, лечат с подросткового возраста – с 12-13 лет. Если ребенок жалуется на боли в животе или тошноту, то обследование и лечение проводят по показаниям в более раннем возрасте.
Люди очень часто жалуются на обострение гастрита. А ведь во многих случаях его можно вылечить, избавившись от бактерии, которая вызвала воспаление желудка. Если инфекцию оставить без внимания, со временем, гастрит перейдет в атрофический. Тогда пациенту нужно будет минимум раз в год брать биопсию в 5-7 местах желудка, чтобы не пропустить рак.
Хеликобактер негативный что это
Хронический гастрит является наиболее распространенным заболеванием и занимает одно из первых мест в структуре заболеваний тракта. По оценке различных авторов, он встречается у 50–80% населения нашей страны [1, 2]. Открытие Н.pylori австралийскими учеными и в 1983 году явилось поистине революционным и вызвало невероятный прогресс в гастроэнтерологии. Современным интернистам это принесло «понимание того, что микроорганизм H.pylori является важным участником формирования таких патологических состояний, как острый и хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, рак и желудка» [3] и позволило выйти на разработку новых, более эффективных этиопатогенетических принципов лечения и профилактики этих заболеваний.
Helicobacter pylori (Н.pylori) — грамотрицательная микроаэрофильная бактерия, колонизирующая слизистую оболочку желудка и ассоциированная с атрофическим гастритом, язвенной болезнью желудка и двенадцатиперстной кишки, аденокарциномой и экстранодальной желудка. H.pylori является одним из самых распространенных возбудителей инфекционных заболеваний. Согласно некоторым оценкам, более половины населения мира инфицированы этим микроорганизмом. Инфекция H.pylori часто не имеет клинических проявлений. Только у определенной части инфицированных с течением времени развивается хронический атрофический гастрит и рак желудка. В 2005 году первооткрыватели бактерии — Робин Уоррен (Robin Warren) и Барри Маршал (Barry Marshall) — были удостоены Нобелевской премии по физиологии и медицине «за открытие бактерии Helicobacter pylori и ее роли в развитии гастрита и язвы желудка». Интенсивное изучение H.pylori показало, что у 80% больных, страдающих раком желудка, в анамнезе была зафиксирована инфекция H. pylori. Это явилось одной из причин, по которым в 1995 году Международная ассоциация по изучению рака (IARC, ВОЗ) признала H.pylori канцерогеном I класса.
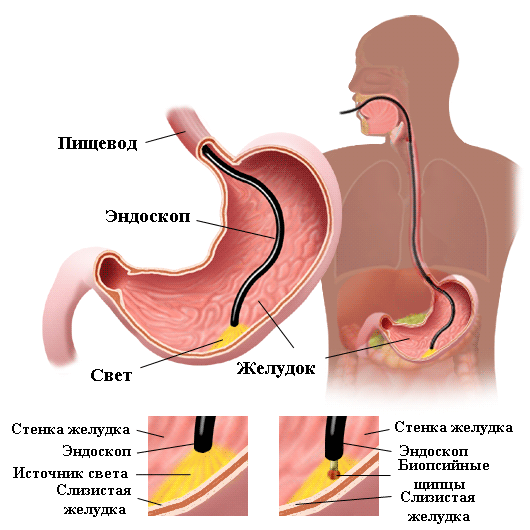
Новые европейские рекомендации по инфекции H.pylori, представленные на очередном XXIV заседании Международной рабочей группы по изучению Helicobacter pylori и родственным бактериям при хронических воспалительных процессах пищеварительного тракта и раке желудка (XXIVth International Workshop on Helicobacter and related bacteria in chronic digestive inflammation and gastric cancer) 11–13 cентября 2011 года, были посвящены не только новым подходам к терапии, но и современным методам диагностики инфекции Н.pylori. Эти методы делятся на инвазивные и неинвазивные. Все инвазивные методы диагностики предусматривают проведение эндоскопического исследования с забором биопсийного материала — биоптатов слизистой оболочки желудка. Эндоскопическое исследование является одним из самых важных методов оценки слизистой оболочки желудка у пациентов с H.pylori ассоциированной патологией. Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Неинвазивные методы — это различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена Н.pylori в фекалиях, ПЦР исследование с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест с С13 или С14 меченным атомом углерода.
История открытия Helicobacter pylori
Таблица 1. Распространенность инфекции H.pylori и смертность от рака желудка в странах с различным уровнем
| Страна | Инфицированность H. pylori, % | Смертность (рак желудка) |
| Китай Россия и Япония | 80-100 60-80 | Более 30 человек на 100 000 населения |
| Алжир Коста-Рика Кот-Дивуар Нигерия Чили Эквадор | 75-95 | Более 30 человек на 100 000 населения |
| Австралия Бельгия Великобритания Израиль Канада Новая Зеландия США Франция | 4 5 9 15 13,6 5 23 20 | Менее 10 человек на 100 000 населения |
Приведенные данные свидетельствуют о более высокой заболеваемости раком желудка в тех регионах, где выше показатели заболеваемости H.pylori ассоциированным гастритом.
Современные методы лабораторной диагностики инфекции Helicobacter pylori
С момента открытия Н.pylori прошло чуть более тридцати лет. За этот период времени было разработано большое количество методов лабораторной диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Однако в настоящее время ни один из существующих методов лабораторной диагностики инфекции Н.pylori не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую, зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции. Все существующие на сегодняшний день методы лабораторной диагностики инфекции Н.pylori делятся на две большие группы: инвазивные и неинвазивные методы (табл. 2).
Таблица 2. Методы лабораторной диагностики инфекции Н.pylori
| Инвазивные методы | Неинвазивные методы |
| Бактериологический метод Гистологический метод Молекулярно-биологический метод (ПЦР) Фазово-контрастная микроскопия Быстрый Уреазный тест | Серологический метод Молекулярно-биологический метод (ПЦР) Уреазный дыхательный тест |
Принципиальное значение для практики имеет проведение диагностики Н.pylori инфекции до лечения (первичная диагностика), и после проведения противохеликобактерной терапии (контроль эффективности выбранной схемы лечения). Первичная диагностика Н.pylori инфекции должна осуществляться методами, непосредственно выявляющими бактерию или продукты ее жизнедеятельности в организме больного. Таким требованиям удовлетворяют следующие методы диагностики:
1. Бактериологический метод — посев биоптата слизистой оболочки желудка или двенадцатиперстной кишки на среду с целью выделения чистой культуры Н.pylori.
2. Дыхательный тест — определение в выдыхаемом больным воздухе изотопов С13 или С14, которые выделяются в результате расщепления в желудке больного меченой мочевины под действием фермента уреазы Н.pylori.
3. Быстрый Уреазный тест — определение уреазной активности в биоптате слизистой оболочки желудка или двенадцатиперстной кишки путем помещения его в жидкую или гелеобразную среду, содержащую субстрат, буфер и индикатор.
4. Гистологический метод — золотой стандарт диагностики Н.pylori инфекции и хронического гастрита.
Бактериологический метод является единственным методом исследования, обладающим 100% специфичностью. Он позволяет выделить чистую культуру Н.pylori, провести ее идентификацию, изучить морфологические, биохимические и биологические свойства бактерий. В эпидемиологической практике выделение чистой культуры Н.pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием инфекции, которое может быть обусловлено тем же штаммом. В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Н.pylori и изготовлять препараты для серологической диагностики. Как и любой метод диагностики, бактериологический метод исследования обладает не только достоинствами, но и недостатками, которые зачастую ограничивают его широкое использование в клинической практике. К недостаткам этого метода относятся, прежде всего, необходимость специального лабораторного оборудования, реактивов, специальных питательных сред, а также обученных специалистов. Все это сопряжено с большими материальными затратами. Результаты бактериологического исследования отсрочены от момента взятия биопсийного материала минимум на 3–5 дней, а при необходимости получения данных о чувствительности Н.pylori к антибактериальным препаратам длительность исследования увеличивается и составляет в среднем 6–7 дней. Кроме того, для проведения бактериологического исследования необходимо проведение эзофагогастродуоденоскопии с забором биопсийного материала.
Быстрый урезаный тест основан на определении в биоптате слизистой оболочки желудка местной уреазной активности H.pylori. Быстрота изменения окраски индикатора (с желтого цвета на красный или малиновый) зависит от уреазной активности, которая в свою очередь зависит от количества бактерий. К недостаткам теста относится его инвазивность, невозможность морфологической оценки состояния слизистой оболочки желудка, а также получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных результатов (контаминирование материала другими уреазопродуцентами, например H.heilmannii — спиралевидной бактерии рода Helicobacter, которую возможно обнаружить у 0,25% пациентов при проведении гастроскопии [12]).
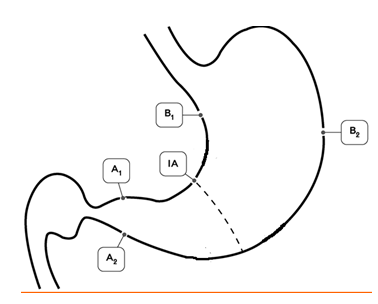
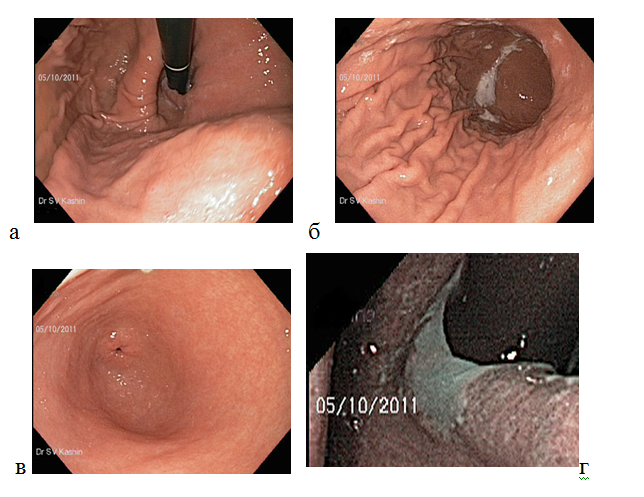
Гистологический метод — золотой стандарт диагностики инфекции H.pylori, который является наиболее объективным методом, так как позволяет обнаружить возбудитель инфекции, определить положение бактериальных тел в слизи, покрывающей слизистую оболочку желудка, наблюдать взаимоотношение Н.pylori с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия бактерии с тканями макроорганизма (рис. 2). Забор биопсийного материала производится из зон слизистой оболочки желудка с признаками наиболее активного воспалительного процесса (максимально выраженная гиперемия и отeк). Биопсия и забор материала для диагностики инфекции из области дна язв и эрозий, а также из их краев, является ошибкой, так как в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации Н.pylori. Поскольку бактерии Н.pylori могут быть распределены неравномерно в различных отделах желудка, для повышения чувствительности метода, а также для оценки состояния слизистой оболочки и определения типа и локализации гастрита, степени его выраженности биоптаты целесообразно брать из антрального, фундального отделов, а также области угла желудка (рис. 1).
Рисунок 1. Схема выполнения биопсии слизистой оболочки желудка с целью достоверной диагностики инфекции H.Pylori и гастрита в пяти зонах желудка: две биопсии — в антральном отделе (А1 и А2), две биопсии — в теле желудка (В1 и В2) и одна биопсия в зоне угла желудка (IА).
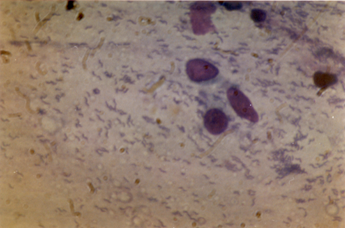
Рисунок 2. Диагностика инфекции Н.pylori при окраске гистологического препарата красителем акридиновым оранжевым, бактерии определяются в виде мелких, слегка извитых палочек, находящихся в слое слизи над поверхностью эпителия желудка в непосредственной близости от слизистой оболочки желудка и на поверхности эпителиальных клеток.
Классификация количественной и качественной оценки инфекции H. pylori, степени воспаления при гастрите, атрофии и кишечной метаплазии была предложена в Сиднейской системе и ее Хьюстонской модификации, однако эта система не позволяла оценивать прогноз повреждения. Современная классификация и оценка степени и стадии гастрита OLGA (Operative Link for Gastritis Assessment) основана на оценке стадийности и степени выраженности атрофического гастрита в фундальном и антральном отделах желудка [13, 14]. Под степенью гастрита понимается выраженность суммарной воспалительной инфильтрации (нейтрофильными лейкоцитами и мононуклеарными клетками), под стадией — выраженность атрофии. Чем выше выраженность атрофии и больше объем поражения слизистой оболочки желудка, тем выше риск развития неоплазии. Таким образом, новая система определения стадии гастрита OLGA обеспечивает определение прогноза развития предраковых изменений, позволяет клиницисту получить представление о распространенности повреждения слизистой оболочки желудка и степени риска развития рака желудка [15, 16].
В последние годы в клинической практике начал использоваться серологический скрининг заболеваний желудка, включающий определение в сыворотке крови антител класса G к H.pylori (.pylori IgG), пепсиногена I (РG1) и гастрина 17 (G17). Анти- H.pylori IgG являются наилучшим маркером наличия гастрита и обладают высокой чувствительностью и низкой специфичностью в диагностике атрофического гастрита. РG1 и G17 указывают на наличие атрофического гастрита с высокой специфичностью и низкой чувствительностью. Комбинация этих трех тестов (Гастропанель, Биохит, Финляндия) обладает высокой чувствительностью (83%) и специфичностью (95%) в диагностике атрофического гастрита [17]. В проведенном на базе Ярославской областной клинической онкологической больницы и Медицинском центре диагностики и профилактики (г. Ярославль) исследовании, заключавшемся в определении у больных ранним раком желудка и мультифокальным атрофическим гастритом, была обнаружена функциональная недостаточность слизистой оболочки тела желудка (низкий уровень PG1), полученные значения PG1 в этих группах пациентов были достоверно ниже по сравнению с группами больных антральным атрофическим и неатрофическим гастритами. Это свидетельствует о том, что сывороточный PG1 может рассматриваться в качестве маркера риска развития рака желудка. При атрофии антрального отдела желудка происходит снижение выработки постпрандиального G17. Серологический метод с определением G17, РG1 и анти H. pylori IgG может служить методом скрининга атрофического гастрита и рака желудка в крупнопопуляционных исследованиях ввиду его очевидных преимуществ — удобства и безопасности для пациента наряду с высокой эффективностью. Использование серологического теста для выявления предопухолевой патологии и рака желудка на ранних стадиях может способствовать улучшению своевременной диагностики данной патологии, что в итоге должно положительным образом сказаться на уровне заболеваемости и смертности [18].
Генотипирование Helicobacter pylori
Новые эндоскопические технологии диагностики хронического гастрита, ассоциированного с H.pylori
Эндоскопическое исследование — один из самых важных методов оценки слизистой оболочки желудка. Применение дополнительных методик и техник, таких как эндоскопия в узком спектре света, эндоскопия с оптическим увеличением изображения, хромоэндоскопия, позволяют детально изучить структурные особенности слизистой оболочки желудка.
Увеличительная эндоскопия
Первое эндоскопическое исследование с применением оптического увеличения эндоскопического изображения желудка было выполнено еще в 1967 году в Японии (Okuyama) [24]. Это послужило отправной точкой для развития новых эндоскопических технологий, направленных на изучение мельчайших структур поверхности слизистой оболочки. В настоящее время существует два способа увеличения — электронное и оптическое. Изображение, полученное при помощи электронного увеличения, имеет такое же разрешение, как и обычное эндоскопическое изображение. В то время как при применении оптического увеличения становятся видимыми мельчайшие детали, которые невозможно обнаружить при обычном исследовании. Эндоскопы с увеличением оснащены с подвижными линзами в дистальной части аппарата и по своей функциональности сопоставимы с обычными световыми микроскопами. Довольно часто эндоскопическое исследование с увеличением применяется совместно с хромоскопией. Однако применение красителей не позволяет визуализировать микрососудистую архитектонику, что очень важно в дифференциальной диагностике неопластических изменений, к тому же эта дополнительная манипуляция увеличивает время исследования.
Узкоспектральная эндоскопия (narrow band imaging — NBI) — это новая оптическая диагностическая методика, которая основана на использовании специальных оптических фильтров, суживающих спектр световой волны. Обычные эндоскопические системы используют практически весь видимый световой спектр от 400 до 800 нм. Новая система использует преимущества в основном двух световых волн длиной 415 и 445 нм в диагностике сосудистых структур слизистой оболочки пищеварительного тракта, так как эти световые волны хорошо поглощаются гемоглобином. Таким образом, световые фильтры позволяют получить детальное изображение сосудистого рисунка тканей, его изменений, характерных для патологических участков воспалительного генеза, а также для предраковых заболеваний и ранних форм рака. Кроме этого, новая эндоскопическая система повышает контрастность изображения, что создает эффект виртуальной хромоскопии. С технической точки зрения применение функции узкого спектра света в желудке без оптического увеличения нецелесообразно в связи с тем, что получаемое изображение оказывается слишком темным и «шумным». Это происходит того, что при растяжении стенок желудка воздухом во время исследования его просвет становится слишком большим. Поэтому гораздо важнее и актуальнее проводить исследование в узком спектре света совместно с увеличением [25]. Первоначально хромоскопия и эндоскопия в узком спектре света в комбинации с увеличением применялись для оценки раннего рака желудка перед эндоскопической резекцией слизистой оболочки. С дальнейшим внедрением этих технологий в клиническую практику методики оценки микрососудистой архитектоники и микроструктуры поверхности слизистой оболочки стали успешно применятся для диагностики многих других патологических состояний желудка, таких как H.pylori ассоциированный гастрит, кишечная метаплазия, атрофия [26].
Нормальная слизистая оболочка желудка
В желудке выделяют четыре анатомических зоны: кардия, фундальный отдел (дно желудка), тело желудка, пилорический (антральный) отдел. Поверхность слизистой оболочки всех отделов желудка выстлана однослойным призматическим железистым эпителием. Для рельефа внутренней поверхности желудка характерно наличие трех видов образований — продольных желудочных складок, желудочных полей и желудочных ямочек. Желудочные складки (plicae gastricae) образованы слизистой оболочкой и подслизистой основой. Желудочные поля (areae gastricae) представляют собой отграниченные друг от друга бороздками участки слизистой оболочки. Они имеют многоугольную форму и размер поперечника от 1 до 16 мм. Наличие полей объясняется тем, что железы желудка располагаются группами, отделенными друг от друга прослойками соединительной ткани. Поверхностно лежащие вены в этих прослойках просвечивают в виде красноватых линий, выделяя границы между полями. Желудочные ямочки (foveolae gastricae) — это углубления эпителия в собственной пластинке слизистой оболочки. Они встречаются по всей поверхности желудка. Число ямочек в желудке достигает почти трех миллионов. Желудочные ямочки имеют микроскопические размеры, но величина их неодинакова в различных отделах желудка. В кардиальном отделе и теле желудка их глубина составляет всего ¼ толщины слизистой оболочки. В пилорической части желудка ямочки более глубокие. Они занимают около половины толщины всей слизистой оболочки [27]. При обычном эндоскопическом исследовании нормальная слизистая оболочка желудка цвета, ее цвет зависит от степени васкуляризации и растяжения — чем больше растяжение, тем бледнее слизистая оболочка. Слизистая оболочка имеет мелкозернистую поверхность благодаря наличию желудочных полей (рис. 4) [28].
Рисунок 4. Нормальная слизистая оболочка тела желудка при стандартном осмотре в белом световом режиме. Вид тела желудка (а) при инверсии (изгибе дистального конца эндоскопа на 180о) и (б) — при прямом осмотре эндоскопом; (в) — слизистая оболочки антрального отдела желудка; (г) — осмотр в узкоспектральном режиме: более контрастное изображение поверхности слизистой оболочки кардиального и субкардиального отделов желудка, мелкозернистая структура эпителия, четкая граница с плоским эпителием пищевода (указана стрелками).
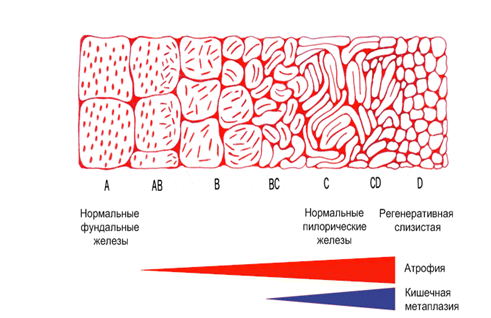
Применение узкоспектральной эндоскопии в комбинации с оптическим увеличением изображения позволяет дифференцировать патологические изменения, которые при обычной эндоскопии не могут быть выявлены. Однако следует отметить, что применение этих технологий не может полностью обеспечить различение абсолютно нормальной слизистой оболочки от гастрита с минимальными изменениями. При осмотре слизистой оболочки с увеличением оцениваются две основные характеристики — микроструктура поверхности слизистой оболочки (ямочный рисунок — pit pattern) и микрососудистая структура (рисунок субэпителиальной капиллярной сети (subepithelial capillary network — SECN). Более тридцати лет назад Sakaki предложил классификацию типов рисунка слизистой оболочки желудка при использовании фиброскопа с увеличением в 30 раз. Согласно этой классификации (рис. 5), выделяют чистые типы (А, В, С, D) и смешанные типы (АВ, ВС, CD). Типы, А и В соответствуют нормальной слизистой оболочке. Дальнейшие изменения рисунка ямок свидетельствуют о более выраженных предопухолевых изменениях, таких как атрофия и кишечная метаплазия (показаны красной и синей полосами в нижней части рисунка). Для диспластических изменений и опухолевого процесса типы рисунка могут соответствовать С (полосатый тип) и D (нерегулярный, зернистый, ячеистый рисунок) типам рисунка.
А — точечные ямки (dotted pits)
В — короткие линейные ямки (short linear pits)
С — полосатые борозды (striped grooves)
D — ячеистые борозды ( grooves)
Рисунок 5. Схема классификации типов рисунка поверхности слизистой оболочки желудка при увеличительной эндоскопии (по Sakaki).
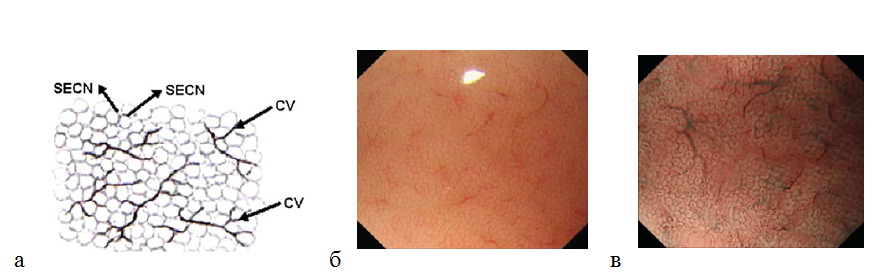
Оценивая микрососудистую архитектонику в теле желудка, можно определить рисунок субэпителиальной капиллярной сети (SECN) в виде пчелиных сот ( network) с коллекторными венулами. Полигональные петли субэпителиальных капилляров окружают каждую желудочную ямку, формируя под эпителием сеть в виде пчелиных сот. Далее ветви сосудистой сети сходятся в коллекторные венулы. При осмотре в узкоспектральном режиме с оптическим увеличением изображения микроструктура поверхности слизистой оболочки становиться более отчетливой: определяются ямки округлой или овальной формы. Ямки гистологически соответствуют желудочным железам. Коллекторные венулы (CV) располагаются глубже, чем субэпителиальная капиллярная сеть, поэтому при осмотре в узком спектре света имеют более насыщенный зеленый цвет. Так как в режиме NBI участки с большей васкуляризацией становятся темными, наблюдается специфическая картина слизистой оболочки тела желудка: светлые участки окружены темным ободком [29] (рис. 6). Правильная форма и взаиморасположение сосудов и структур слизистой оболочки являются наиболее важными ее характеристиками для дифференцировки нормальной и патологически измененной слизистой оболочкой желудка.
Рисунок 6. (а) — рисунок (схема) субэпителиальной капиллярной сети (SECN) в виде пчелиных сот с коллекторными венулами (CV); (б) — нормальная слизистая оболочка тела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: субэпителиальный капиллярный рисунок в виде пчелиных сот с коллекторными венулами; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо видны желудочные ямки округлой или овальной формы, сосудистый рисунок.
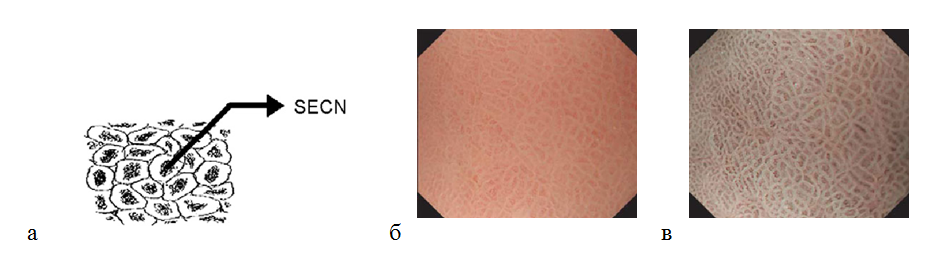
Нормальная слизистая оболочка в антральном отделе
Слизистая оболочка антрального отдела желудка имеет другую картину. При исследовании микрососудистой архитектоники определяется кольцеобразная () субэпителиальная капиллярная сеть. Коллекторные венулы визуализируются реже, так как они находятся в более глубоких частях собственной пластинки, в отличие от тела желудка. Ямки имеют линейный или сетчатый рисунок. Каждый субэпителиальный капилляр расположен в апикальной части желудочной ямки в виде кольца, которое разделяется линейными или сетчатыми бороздками. В отличие от слизистой оболочки тела желудка, в антральном отделе более темные участки окружены светлым ободком (рис. 7). По размерам эти структуры в антральном отделе больше, чем в теле желудка.
Рисунок 7. (а) — кольцеобразная субэпителиальная капиллярная сеть (SECN) в антральном отделе желудка; (б) — нормальная слизистая оболочка антрального отдела желудка: эндоскопическое изображение поверхности слизистой оболочки с увеличением изображения: кольцеобразный субэпителиальный капиллярный рисунок; (в) — эндоскопия с увеличением изображения в узкоспектральном световом режиме: более отчетливо определяется кольцеобразный субэпителиальный капиллярный рисунок и сетчатая микроструктура поверхности слизистой оболочки.