Хелирование тяжелых металлов что это
Хелатирование (хелирование) – эффекты и побочные эффекты
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/10/Хелатирование-хелирование-–-эффекты-и-побочные-эффекты.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/10/Хелатирование-хелирование-–-эффекты-и-побочные-эффекты.jpg?fit=825%2C550&ssl=1″ />
Хелатирование — метод, используемый для удаления атеросклеротических отложений и тяжелых металлов из организма. Однако действительно ли можно очистить вены таким быстрым и легким способом?
Хелатирование – что это такое?
Хелатирование – это метод терапии, первоначально используемый для удаления тяжелых металлов из организма. Однако в последнее время его все чаще рекламируют как способ для очищения сосудов от атеросклеротических отложений.
Для проведения хелатной терапии используется ЭДТА — этилендиаминтетрауксусная кислота, представляющая собой синтетическое аминокислотное соединение. Кислота при введении в организм захватывает вредные минеральные соединения или тяжелые металлы, прочно связываясь с ними. В итоге вены очищаются от липидных отложений и тяжелых металлов.
Изначально хелатирование использовалось для очищения организма от свинца. В настоящее время метод используется:
Хелатирование может быть использовано в терапии людей, страдающих аутизмом. Однако следует подчеркнуть, что для большинства заболеваний и симптомов достоверных данных об эффективности хелирования нет, и результаты не подтверждены никакими научными исследованиями.
Хелатирование в лечении атеросклероза
Атеросклероз – опасное заболевание, на начальной стадии не дающее никаких симптомов. Болезнь разрушает кровеносные сосуды. Атеросклеротические бляшки блокируют кровоток и, таким образом, меньше кислорода достигает сердца. Как следствие, организм становится менее эффективным, что вначале приводит к проблемам с памятью, головной боли, а на более поздней стадии, когда сосуды блокируются полностью, у больного человека происходит инсульт или инфаркт.
Хелатирование ЭДТА — все более используемый метод в лечении атеросклероза. Кислота выводит из артерий накопившиеся атеросклеротические отложения и препятствует их повторному образованию. Она очищает кровеносные сосуды от атеросклеротических бляшек, таким образом, устраняя потенциальные закупорки и восстанавливая нормальное кровообращение.
Кроме того, ЭДТА снижает вязкость и повышает эластичность артерий.
Как работает хелатирование?
В первую очередь следует обратиться к врачу, который на основании проведенных анализов решит, стоит ли выполнять процедуру. Пациенту ставят капельницы с хелаторами, которые прочно связываются с тяжелыми металлами. Хелатирование в атеросклеротической терапии обычно состоит из 20 процедур, выполняемых в течение двух месяцев.
Есть и таблетки, используемые для хелатирования, в которых активным агентом является ЭДТА. Пероральное хелатирование также очищает сосуды, благотворно влияет на работу сердца, выводит тяжелые металлы, а также нейтрализует действие свободных радикалов, ускоряющих процессы старения организма и повышающих риск развития атеросклеротического заболевания. Прием препаратов возможен только после обследования, включающего анализы на холестерин, биохимию крови и др.
Хелатирование волос
Хелатирование применяется не только в медицине, но и нашло применение в дерматологии и косметологии. В частности существуют средства для хелатирования волос. Косметика, а чаще всего шампуни с ЭДТА, облегчают выведение вредных веществ из волос и кожи головы, содержащиеся в водопроводной воде – в частности фтора.
Показания к хелатации
В настоящее время хелатирование применяется при лечении заболеваний, связанных с нарушением кровообращения. Метод используется у пациентов с атеросклерозом и сердечными заболеваниями. Кроме того, хелатная терапия рекомендуется больным с головокружением, мигренями, депрессией, болезнью Альцгеймера, проблемами кровообращения в нижних конечностях.
Противопоказания
Хелатирование нельзя проводить пациентам:
Беременность и грудное вскармливание также являются противопоказанием.
Побочные эффекты хелатирования
Хелирование — безопасный метод, но при выполнении капельниц могут возникнуть побочные эффекты. Введение ЭДТА в организм может вызвать падение уровня глюкозы в крови, что вызывает головную боль. Иногда больные жалуются на тошноту, повышенную утомляемость, сыпь, лихорадку и неприятный запах от кожи. Самый распространенный побочный эффект — быстро прекращающееся жжение в месте введения хелатора в вену.
Добавить комментарий Отменить ответ
Вы должны быть авторизованы, чтобы оставить комментарий.
Что такое хелирование
Предполагают, что источником ртути могут являться вакцины. Для консервации вакцин применяются препараты ртути. В течение первого года жизни ребенок получает несколько прививок, и суммарная доза ртути из них получается довольно высокой. Организм большинства детей справляется с этим, но некоторые не выдерживают такой массированной атаки. Многие матери аутистов вспоминают, что странности в поведении их детей начались после болезненной, с высокой температурой, реакции на прививку. Кроме того, амальгамные зубные пломбы (так называемые «серебряные» ), традиционно считающиеся безопасными, содержат до 50% ртути. Есть сведения, что плод в утробе подвергается риску отравления ртутью, если мать во время беременности имеет старые или ставит новые амальгамные пломбы.
Терапия, заключающаяся в выведении ртути из организма, помогает уменьшить или устранить аутичные симптомы, как поведенческие, так и биохимические (так, дети после лечения переносят пищевые продукты, которые до того представляли большие проблемы; уменьшаются или исчезают аллергии и др.)
Существует несколько препаратов, выводящих ртуть из организма. Среди них:
DMPS (натрия 2,3. димеркаптопрона сульфанат, или Унитиол, Димавал)
DMSA (димеркаптосукциновая кислота), использующаяся также для выведения из организма свинца. Выводит ртуть из организма, но не из мозга
Надо помнить, что ЕСЛИ ВО РТУ ЕСТЬ СЕРЕБРЯНЫЕ (АМАЛЬГАМНЫЕ) ПЛОМБЫ, ХЕЛИРОВАНИЕ ПРОВОДИТЬ НЕЛЬЗЯ, иначе можно не только не помочь, но и навредить еще больше. Необходимо перед началом хелирования заменить все «серебряные» пломбы на белые.
Как проводить хелирование (протокол Анди Катлера)
Общие положения
ВСЕ методы хелирования и ВСЕ хелаторы могут представлять собой некоторый риск
Внимательно следите за вашим ребенком / за собой, если вы хелируете себя, чтобы понять, что происходит. Ваши наблюдения более важны, чем чьи-то теории о том, что может происходить или должно произойти.
НЕ проводите хелирования, если у вашего ребенка / у вас есть «серебряные» пломбы в зубах.
Какой хелатор использовать:
Это сложный вопрос, на который нет одного для всех ответа. Анди Катлер советует следующие варианты:
DMSA, а затем DMSA + ALA
DMPS, а затем DMPS + ALA.
ALA имеет тенденцию уменьшать выведение меди из организма, поэтому те, кто принимают ALA, могут испытывать увеличение количества меди. Это может быть проблемой для тех, у кого уровень меди уже высок (что токсично). Это тоже следует принимать во внимание, решая, когда использовать ALA.
DMSA плохо отражается на печени, и оказывает значительную нагрузку на почки. ALA поддерживает печень.
Все хелаторы являются серными продуктами. Для одних это хорошо, для других плохо. Если у вас повышенная чувствительность к серным продуктам, вам может оказаться полезно начинать с меньших доз хелаторов, и/или ограничить серосодержащие продукты в процессе хелирования. Некоторые добавки, входящие в рекомендуемую витаминно-минеральную поддержку («базовый протокол») во время хелирования, могут помочь с серной чувствительностью.
Частота приема хелатора:
DMSA: каждые 4 часа, в том числе ночью
ALA: каждые 3 часа, в том числе ночью. (Можно давать ее каждые 4 часа ночью, если это помогает вам выспаться, но днем надо продолжать давать через каждые три часа)
DMPS: каждые 8 часов
Дозировка:
DMSA (одна или вместе с ALA): от 1/4 до 1 мг DMSA на кг живого веса на каждую дозу
ALA (одна или вместе с DMSA): от 1/ 4 до 1 мг ALA на кг живого веса на каждую дозу
Соотношение DMSA и ALA (если используются оба):
Длительность и частота раундов:
Промежуток между раундами должен быть не меньше количества дней раунда. Если вы делаете длиннее раунды, то должны увеличивать и промежуток между ними.
Следующие варианты являются наиболее часто применяемыми: 3 дня раунд, 4 дня перерыв (получается цикл длиной в неделю), или 3 дня раунд, 11 дней перерыв (двухнедельный цикл). Существует много других разумных вариантов, но они должны соответствовать приведенным выше рекомендациям о длине раунда и промежутка между ними.
Сколько ждать после замены «серебряных» пломб на белые до начала хелирования:
для DMSA: минимум 4 дня
для ALA: минимум 3 месяца.
Хелирование тяжелых металлов что это
В последнее время большое внимание уделяется изучению влияния ионов тяжелых металлов на устойчивость эритроцитов крови человека.
Основной мишенью токсического воздействия тяжелых металлов является биологическая мембрана [5].
Эритроцит – универсальная модель для изучения процессов, происходящих в клеточной мембране под действием самых различных агентов. Детальное исследование изменений морфофункциональных показателей эритроцитов под влиянием различных химических раздражителей, с которыми человек сталкивается в процессе естественных взаимоотношений с природой, позволяет полнее установить возможные последствия и определить наиболее эффективные пути их коррекции в условиях действия эколого-химических факторов окружающей среды. Токсическое действие различных соединений тяжелых металлов преимущественно обусловлено взаимодействием с белками организма, поэтому их называют белковыми ядами. Одним из таких металлов является кадмий [6].
А.А. Тугаревым предложен комплекс информативных критериев для оценки токсического влияния ионов кадмия на морфофункциональные показатели эритроцитов периферической крови человека и животных [6, 7].
Д.В. Большим изучено распределение металлов между различными фракциями крови при экспозиции Zn, Cd, Mn, Pb in vitro [1]. Автором подтверждены данные литературы о преимущественном первичном связывании металлов в крови с альбумином. По проникающей способности исследованные металлы распределились Cd > Mn > Pb > Zn.
Внешняя оболочка клеток крови богата функциональными группами, способными связывать ионы металлов [1].
Биологическая роль вторичного связывания металлов весьма разнопланова и зависит как от природы металла, так и его концентрации и времени экспозиции [7].
В работах С.М. Охрименко показано повышение степени гемолиза эритроцитов после введения животным солей CaCl и HgCl2 [4].
Ионы кобальта способны непосредственно инициировать перекисное окисление липидов (ПОЛ), вытеснять железо из гема и гемопротеинов, в то время как механизм действия ртути заключается в связывании SH-групп белковых и небелковых тиолов. Предварительно введенный триптофан частично ограничивает усиление спонтанного гемолиза эритроцитов, вызванное ввдением хлорида кобальта. Отсутствие такого эффекта в случае введения в организм хлорида ртути свидетельствует о наличии другого механизма, видимо, связанного с высоким сродством ионов ртути к тиогруппам мембранных белков [4].
М.О. Трусевичем изучено влияние тяжелых металлов (хлориды Со, Mn, Ni, Zn) в конечных концентрациях от 0,008 до 1 мМ. На основании полученных результатов авторами сделан вывод о том, что все тяжелые металлы в концентрации свыше 0,008 мМ оказывают токсическое воздействие на резистентность эритроцитарной мембраны, исключая значения концентрации 0,04 мМ. Для хлорида Zn отмечено снижение уровня гемолиза эритроцитов в концентрации 0,04 мМ [5].
Материалы и методы исследования
В настоящей работе изучено влияние тяжелых металлов (Pb2+, Co2+, Zn2+) на мембранную устойчивость эритроцитов крови здорового человека и различных больных (сахарный диабет, опухоль щитовидной железы, острая пневмония).
Для опытов использовали кровь, взятую из пальца. Набирали 20 мм3 крови в 2 мл физиологического раствора.
Эритрограмма строилась по методу кислотных эритрограмм, предложенных Гительзоном и Терсковым [2].
Для наблюдения за кинетикой гемолиза использовали фотоэлектрический колориметр КФК-2. За стандартную принята концентрация эритроцитов, оптическая плотность которой в данных условиях составляла 0,700.
Результаты исследования
и их обсуждение
В суспензию эритроцитов добавляли растворы тяжелых металлов (хлориды Pb, Co, Zn) в конечных концентрациях от 10–5 до 10–3 М. Полученные образцы инкубировали в течение 10–60 минут. Затем определялась оптическая плотность эритроцитов в зависимости от концентрации и времени воздействия ионов тяжелых металлов. Кроме того, изучена кинетика кислотного гемолиза эритроцитов в крови здорового человека и крови больных в зависимости от концентрации ионов тяжелых металлов. Известно, что в зависимости от возраста человека изменяется мембранная устойчивость эритроцитов крови. В связи с этим при взятии крови учитывали возраст.
Установлено, что использованные ионы тяжелых металлов оказывают влияние на мембранную устойчивость эритроцитов, которая выражается в изменении плотности последних. Так, например плотность суспензии эритроцитов, подвергнутых воздействию ионов Pb2+ в концентрации 10–3 М в течение 60 минут, уменьшается на 90 %, а при влиянии ионов Co2+ и Zn2+ соответственно на 70 и 60 % (время действия 60 минут, концентрация 10–3 М), тогда как плотность суспензии эритроцитов необработанных ионами не изменяется.
Таким образом, установлено, что плотность суспензии эритроцитов изменяется в зависимости от концентрации и длительности воздействия ионов тяжелых металлов – чем выше концентрация и время воздействия, тем больше уменьшение плотности эритроцитов.
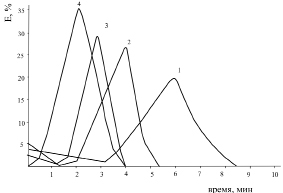
Из эритрограммы, характеризующей кислотный гемолиз эритроцитов крови здорового человека, видно, что начало гемолиза на 2-й минуте, длительность гемолиза составляла 8 минут, максимум 6 минут. Скорость кислотного гемолиза крови изменяется при действии ионов тяжелых металлов. Так, если сравним эритрограммы образцов крови, которые подвергались влиянию ионов Pb2+ (концентрация 10–3 М, время воздействия 30 минут), то можно заметить, что гемолиз длится в среднем 4 минуты и максимум распределения эритроцитов 2 минуты; по сравнению с ионами Pb2+ и Co2+ ионы Zn2+ оказывают слабое воздействие, и кислотный гемолиз длится 6, 5 минут, максимум 4 минуты (рис. 1, 2).
В представленной работе также изучена кинетика кислотного гемолиза эритроцитов крови больных сахарным диабетом, опухолью щитовидной железы и острой пневмонией. Как видно из полученных данных, в крови больных пневмонией и опухоли щитовидной железы происходит накопление в группе пониженно-стойких, среднестойких эритроцитов и уменьшение количества повышенно-стойких эритроцитов. А у больных сахарным диабетом эритрограмма крови с правой стороны приподнята. Это указывает на увеличение уровня эритропоэза в крови [2].
Влияние использованных в работе ионов тяжелых металлов на эритроциты крови больных отличается (рис 3, 4, 5). Так, например, ионы Zn2+ оказывают сильное воздействие на эритроциты крови больного острой пневмонией и опухолью щитовидной железы по сравнению с эритроцитами крови здорового человека. Подтверждением наших данных явились результаты исследований, проведенных у больных со злокачественными опухолями различной локализации, где были выявлены выраженные нарушения белкового состава (снижение содержания высокомолекулярных полипептидов при одновременном увеличении доли низкомолекулярных белков), а также показано, что с низкомолекулярными белками в основном связываются ионы Zn2+ [3,1]. При влиянии ионов Pb2+ на эритроциты крови больных наблюдается смещение всей эритрограммы влево, следовательно, теряет стойкость вся масса эритроцитов.
Рис. 1. Эритрограмма крови здорового человека после воздействия ионов Co2+:
1 – контроль; 2 – 10–5 M; 3 – 10–4 M; 4 – 10–3 M.
Время воздействия 30 мин P
Хелирование тяжелых металлов что это
В последнее время все больший интерес представляет изучение токсического воздействия тяжелых металлов на растения, животных и людей в связи с катастрофически возросшим уровнем загрязнения окружающей среды. Эта проблема особенно актуальна для Казахстана. Металлодобывающие индустриальные комплексы (РЬ, Zn в Ащисае и Лениногорске, Сu в Балхаше, Алмалыке, Жезказгане, Лениногорске, Pb используемый при обработке фосфора, в Таразе и т.д.), были построены в регионах с плодородными почвами и открытыми источниками воды для ирригации. В результате, твердые металлы в высоких концентрациях обнаружены в сточных водах, почве, заброшенных рудниках, городских свалках и отстойниках. Значительная площадь земель, пригодных для использования в сельском хозяйстве, также загрязнена твердыми металлами до крайней степени и их эксплуатация представляется небезопасной.
Повышенный интерес к этой новой технологии объясняется еще тем, что растения-гипераккумуляторы тяжелых металлов, с высокой эффективностью могут быть использованы на больших площадях. Это в свою очередь требует, чтобы используемые для очистки загрязненных почв растения, помимо способности к гипераккумуляции ТМ, были приспособлены к конкретным условиям произрастания [2]. Последнее обстоятельство особенно важно для Казахстана с преобладающим резко континентальным климатом и выраженным отрицательным антропогенным воздействием.
К настоящему времени около 400 видов растений идентифицированы как аккумуляторы токсичных металлов. Некоторые виды растений имеют эволюционно возникшие устойчивые формы, которые могут выживать и процветать на почвах с повышенной концентрацией тяжелых металлов. Существующие естественные растения-аккумуляторы, которые могут накапливать большое количество тяжелых металлов, чаще всего, медленно растут и имеют незначительную биомассу. Для растений, которые можно использовать для фиторемедиации, требуется быстро увеличивать свою биомассу с одновременным поглощением большого количества металлов (как минимум 1-3 % от своего сухого веса).
В связи с этим необходим широкий поиск растений-аккумуляторов ТМ в популяциях злаков, сорняков, хорошо растущих в загрязненных областях Казахстана и разработка технологий для десорбции токсичных металлов из почвы и их аккумуляции в вегетативных органах растений. В последнее время интенсивно проводятся исследования с целью расширения географии использования в сельскохозяйственной практике и медицине, однолетние растения семейства амарантовых (Amaranthaceae). Травянистые растения с мощной корневой системой и надземной частью, с интенсивным ростом и высокой продуктивностью биомассы. Фото ассимиляционный метаболизм С4 позволяет амаранту более эффективно использовать влагу и адаптироваться к условиям засоления и засухе [3]. Виды амаранта широко распространены во многих странах мира, в том числе и в Казахстане. На сегодняшний день амарант характеризуется, как перспективная кормовая культура, с ценными народнохозяйственными признаками.
Тяжелые металлы оказывают различное действие на растения. Они могут выступать в роли микроэлементов, без которых растения не способны существовать или как тяжелые металлы, оказывая губительное действие на живое. К группе тяжелых металлов относится ряд химических элементов, с атомной массой более 40. Не обязательно все тяжелые металлы являются токсичными, так как в эту группу попадают Cu, Zn, Mo, Co, Mn, Fe, т.е. элементы, положительное биологическое значение которых давно обнаружено и доказано. Тяжелые металлы делятся на несколько групп:
В отдельную группу следует включить радиоактивные изотопы многих элементов и их продукты деления, так как эти элементы представляют немалую опасность для окружающей среды и их поведение в почве и растениях наименее изучено.
Если говорить о тяжелых металлах, как о микроэлементах, то обнаруживается целый ряд положительных сторон. Микроэлементы представляют собой группу незаменимых минеральных элементов, выполняющих важные функции в жизнедеятельности растительных организмов. Их содержание в растениях составляет малые количества. Микроэлементы принимают участие в окислительно-восстановительных процессах, фотосинтезе, азотном и углеводном обменах, входят в состав активных центров ферментов и витаминов, повышают устойчивость растений к болезням и неблагоприятным условиям внешней среды. Недостаток микроэлементов вызывает ряд заболеваний и нередко приводит к гибели растений.
Содержание минеральных элементов в растениях значительно варьируется в зависимости от следующих причин:
1) доступности и концентрации минеральных соединений в среде (почва, питательные растворы);
2) уровня кислотности среды;
3) условий влажности, температуры, аэрации в зоне корней;
4) возраста растений и анализируемого органа. Зависимость относительно содержания того или иного минерального элемента в растении от уровня его доступности в питательной среде имеет форму кривой насыщения [4].
К числу интересных растений универсального использования относятся виды рода AmaranthusL., которое признаны Американской Академией Наук наиболее перспективной культурой XXI века. Амарант в различных странах используется для пищевых (зерно, молодые листья), кормовых (зеленый корм для свиней, силос для всех видов скота и птицы) и технических (масло) целей. Высокое содержание белка с адекватным балансом незаменимых аминокислот, витаминов, жиров, крахмала и минеральных солей делает семена амаранта важным элементом в питании людей. По содержанию белков, имеющих в своем составе лизин, и питательной ценности Amaranthuscruentus и другие культурные виды 1,5-2 раза превосходят подсолнечник, кукурузу и другие традиционные культуры.
Виды рода A.lividusL., A.retroflexusL., A.blitum – являются завезенными; A.blitoidusL., A.lividusL., A.albusL., A.blitumL., AretroflexusL. – известны как широко распространенные сорняки; A.panicylatus, A.caudatus, A.tricolor – разводятся как декоративные растения. Важными достоинствами амаранта являются его высокая ритмика роста (особенно при повышенной температуре и солнечной погоде) за счет этого амарант может успешно конкурировать с сорняками, а также его неприхотливость к почвам (за исключением кислых), высокая засухоустойчивость и солеустойчивость, устойчивость к болезням и вредителям, пластичность, легкая адаптируемость к условиям обитания. Было показано, что листья A.tricolorпри pH 6,4 накапливает Al до 562мг/кг почвы. Алюминий, однако, не является необходимым для роста растений, но он считается третьим наиболее распространенным элементом в почве. Были изучены механизмы накопления меди и стронция корнями амаранта, а также накопления As, Cu, Ni, Mn, Zn и Fe в листьях Amaranthushybrids.
Поглощение ионов из почвы или питательного раствора корневыми системами осуществляется разными путями, от которых зависит вероятность поступления иона непосредственно в цитоплазму клеток и скорость его перемещения по тканям и органам растений.
В случае обратимого связывания иона компонентами клеточной стенки путем обменной физико-химической сорбции, он может пассивно диффундировать в симпласт при наличии концентрационного градиента, что обеспечивает транспорт иона по растению. Участки, задействованные в обменной адсорбции, не обладают селективностью. С их участием поступают Cd, Zn, Сu, Hg и другие металлы. Накопление ионов металлов в свободном пространстве клеточной стенки определяется величиной ионообменного коэффициента, которая в значительной степени зависит от количества гистидильных групп белков, а также карбоксильных групп, размещенных на поверхности пектинов. Обменно-связанная фракция ионов металла легко вымывается из корневых систем растений при замене питательного раствора на не содержащий данный элемент. Проникая через клеточную стенку, одна часть ионов связывается с реактивными компонентами апопласта, другая поступает в цито золь. В случае повышенных концентраций тяжелых металлов в питательной среде указанные механизмы не могут полностью исключить поступление ионов через плазматическую мембрану в цито золь. Транспорт молекул через мембраны осуществляется разными путями в зависимости от химических свойств элементов и их биологической значимости.
Транспортные системы биологических мембран принято разделять на системы ионных каналов и переносчиков. Ионные каналы селективный, они катализируют диссипативный транспорт [6]. Переносчики не обладают высокой избирательностью. При этом вещество соединяется с переносчиком в участке связывания и транспортируется через мембрану, где освобождается в результате конформационных перестроек белка-переносчика. Транспорт ионов часто осуществляется не одним, а системой последовательных переносчиков.
Поступившие в цитоплазму ионы могут связываться там с биомолекулами. В этом случае хелатный комплекс либо выводится из клетки, либо аккумулируется в ней (чаще всего в вакуолях). Аккумуляция токсичных ионов в вакуолях в виде малоподвижных соединений в большей мере характерна для растений, толерантных к тяжелым металлам.
Таким образом, концентрация поступившего в растение иона сложным образом зависит от качественного и количественного ионного состава среды. Увеличение или снижение числа поступающих в растение ионов определенного элемента в присутствии других ионов или молекул может обусловить неаддитивный биологический эффект в случае сочетанного действия тяжелых металлов и тяжелых естественных радионуклидов.
Соотношение концентраций элемента, находящегося в растении в прочно связанном и подвижном состоянии, обусловливает, очевидно, не только степень влияния данного иона на метаболизм, но также определяет клеточные структуры и связанные с их функцией процессы, подверженные максимальному воздействию со стороны десиканта. Прочно связанные с биомолекулами ионы металлов могут депонироваться в определенных органах, что ограничивает их транспорт и влияние на жизнедеятельность растения. Этот процесс, относимый к механизмам детоксикации, существенно снижает биологическую эффективность тяжелых металлов. Однако следует иметь ввиду, что тяжелые естественные радионуклиды являются не только химически токсичными элементами, но и излучателями. Поэтому, если радионуклид поступил в организм растений и депонировался в прочно связанном состоянии в определенной ткани, он в меньшей мере будет действовать как химический токсикант, нежели как излучатель [8].
Усиление техногенного воздействия на окружающую среду требует детальных исследований поведения загрязняющих веществ в компонентах биосферы. Большую сложность представляет изучение поведения соединений тяжелых металлов техногенного происхождения в почвах.
Наличие разных форм нахождения тяжелых металлов, отличающихся как по подвижности и биологической доступности, так и по механизмам из закрепления в почве, предполагает их более детальное изучение. Для того, чтобы иметь возможность обсуждения проблем изучения форм нахождения тяжелых металлов в почве, необходимо провести определение понятий, которые мы будем использовать в дальнейшем.
В отечественной литературе чаще всего используют такое понятие, как «формы соединений химических элементов в почвах». В почвоведении и агрохимии применение понятия «формы соединений» вполне уместно, когда речь идет о химических элементах, присутствующих в почве в макроколичествах. Нахождение тяжелых металлов в почвах между тем коренным образом отличается от нахождения тяжелых металлов в природных месторождениях. Хотя почвы и наследуют содержание элементов от почвообразующих пород, дальнейшая их судьба существенно меняется. Происходит перераспределение тяжелых металлов между теми почвенными компонентами, которые обладают большим сродством к катионам металлов. Как показывают исследования, проводящийся в течение длительного времени разными авторами, в почве существует набор реакционных центров, способных поглощать ионы тяжелых металлов с образованием связей разной прочности. Традиционные способы выделения из почвы форм соединений тяжелых металлов не отличаются высокой избирательностью именно из-за возможного наличия в почве реакционных центров, близких по своей энергии, но относящихся к разным почвенным компонентам.
Если состав соединения тяжелых металлов с каким-либо почвенным компонентом можно точно идентифицировать, возникает проблема его количественного определения. К сожалению, традиционные аналитические методы, применяемые в почвоведении, часто не обладают достаточной селективностью. Определяемые с их помощью количества «форм соединений ТМ» могут сильно отличаться от их истинного содержания в почве в ту или иную сторону. Например, для оценки содержания тяжелых металлов, связанных с органическим веществом, часто применяют вытяжки из почв с использованием раствора Н2О2 при pH 2. Полученные результаты могут быть завышенными, так как этот раствор способен оказывать сильное воздействие и на минеральные почвенные компоненты, переводя в раствор дополнительное количество ионов тяжелых металлов [9].
Имеется несколько факторов, от которых зависит включение тяжелых металлов в естественный круговорот вещества и определяющих количество разных форм нахождения тяжелых металлов в почвах.
Таким образом, по результатам исследования предлагается лабораторный регламент технологии очистки почв, загрязненных тяжелыми металлами, в частности цинком и кадмием с использованием двух видов амаранта растений-аккумуляторов Amaranthuspaniculatus, Amaranthustricolor.