Хгб болезнь что это
Хроническая гранулематозная болезнь
Хроническая гранулематозная болезнь — это редкая форма первичного иммунодефицита, при которой нарушается бактерицидная функция фагоцитов. Является наследственным заболеванием, в основном передается по Х-сцепленному рецессивному типу. Патология проявляется рецидивирующими инфекциями легких, ЖКТ, кожи и других органов. Для диагностики используется проточная цитометрия, генетическое тестирование, микробиологические исследования. Лечение включает антибиотикотерапию, противогрибковые препараты, иммуномодуляторы, в отдельных случаях рекомендована трансплантация костного мозга.
МКБ-10
Общие сведения
Заболевание известно с 1954 г. благодаря ученому C.A. Джейнвею и его коллегам, а генетические причины патологии начали изучаться только в 1980-х гг. Хроническая гранулематозная болезнь (ХГБ) встречается редко, в США ее регистрируют у 1 ребенка на 200-250 тысяч новорожденных. Данные по распространенности в России отсутствуют. Редкость проблемы, недостаточная осведомленность педиатров и терапевтов, сложности в подборе адекватной поддерживающей терапии — все это обуславливает большую актуальность этой хронической наследственной болезни в медицине.
Причины
Болезнь вызвана генетическими мутациями, которые передаются по наследству. Самым частым вариантом является Х-сцепленная мутация в гене gp91-фокс (60-70%). Болеют мужчины, а женщины являются носителями дефектного гена. Оставшиеся случаи приходятся на аутосомно-рецессивный тип наследования, связанный с генными мутациями p22-фокс, p47-фокс, p67-фокс. Этот подтипом заболевания могут страдать больные обоего пола.
Патогенез
В основе хронической гранулематозной болезни лежит дефицит НАДФН-оксидазного комплекса, который образуется при участии цитозольных и мембраносвязывающих белковых единиц. Вследствие мутации генов образование этих протеинов нарушается, в организме пациента не синтезируются ферменты, способные превращать молекулярный кислород в активные формы — супероксидный анион, перекись водорода, синглетный кислород.
Эти окислители в норме вырабатываются гранулоцитами (фагоцитами), составляют основу кислородозависимого этапа фагоцитоза. Он необходим для переваривания отдельных видов бактерий и грибков, продуцирующих фермент каталазу (например, Klebsiella sp, Candida albicans, Aspergillus niger). Остальные звенья клеточного иммунитета не нарушены, поэтому вирусные и паразитарные инфекции встречаются не чаще, чем в среднем в популяции.
Симптомы
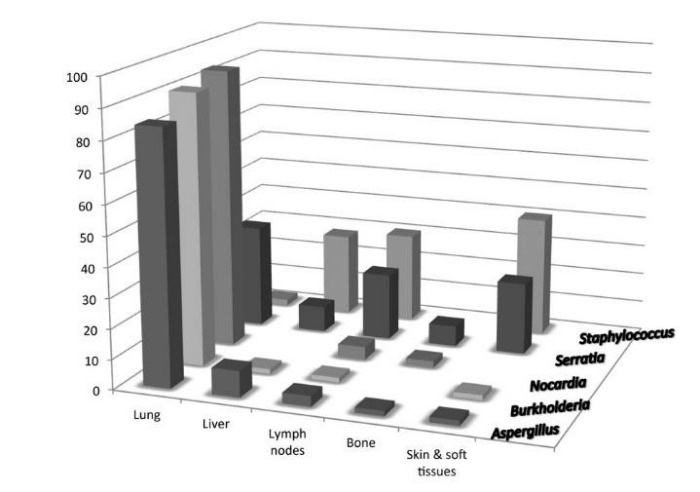
Дети с ХГБ рождаются здоровыми, клинические признаки заболевания у них появляются в первые 2 года жизни. В атипичных случаях симптомы Х-сцепленного варианта хронической патологии манифестируют к 5 годам, а при аутосомно-рецессивном наследовании — к 9 годам. Основным признаком болезни являются инфекции, вызванные каталазоположительными Грам+ (Staphylococcus aureus) или Грам- бактериями (E. coli, Serratia liquefaciens, Klebsiella sp., P. aeruginosa, Proteus sp.).
Первичный иммунодефицит в 70-80% случаев манифестирует с рецидивирующих бактериальных инфекций дыхательных путей: тонзиллитов, бронхитов, пневмоний. Инфекционные заболевания отличаются тяжелым течением, умеренным ответом на стандартную антибиотикотерапию, частым переходом в нагноительные процессы. При этом образуются буллы, абсцессы, гангрена легкого.
В дальнейшем у 75-100% пациентов развиваются хронические гнойные лимфадениты, которые проявляются покраснением, припухлостью, болезненностью лимфоузлов. При поражении подмышечных или паховых узлов беспокоит резкая боль при движениях конечностями. В 24-41% случаев формируются гнойные воспаления печени, у 20-30% больных наблюдаются рецидивирующие желудочно-кишечные инфекции, бактериальные и грибковые поражения костей.
Характерным признаком гранулематозной болезни является генерализованный «бецежит», возникающий как осложнение после проведения первой прививки БЦЖ, проявляющийся спустя 1-2 месяца после иммунизации. Патология связана с недостаточностью клеточного иммунитета при введении ослабленных микобактерий Коха. Также после вакцинации есть вероятность начала остеита — формы костного туберкулеза.
Осложнения
Опасное последствие хронической гранулематозной болезни — аспергиллез легких, который провоцирует до 25% случаев смерти среди пациентов. Абсцессы печени чреваты развитием тяжелого гепатолиенального синдрома. Поражение костной ткани грибковым процессом, особенно в области позвоночника и ребер, сопряжено с массивной диссеминацией возбудителя, отличается крайне неблагоприятным прогнозом.
Типичным осложнением иммунодефицита у страдающих гранулематозной болезнью являются неконтролируемые микробные инфекции, которые распространяются по организму с возникновением сепсиса, септицемии, септического шока. При критическом снижении иммунитета, отсутствии своевременной помощи эти заболевания заканчиваются смертью больного. Также при гранулематозной болезни у детей отмечаются задержка роста, отставание в физическом развитии.
Диагностика
При первичной диагностике устанавливаются общие признаки иммунодефицита, выясняется семейный анамнез, степень риска генетической патологии. При физикальном осмотре патогномоничные проявления хронической гранулематозной болезни не определяются. Для постановки диагноза требуется комплексное лабораторно-инструментальное обследование:
Лечение хронической гранулематозной болезни
Консервативная терапия
При острых эпизодах микробных инфекций, возникших у пациентов с ХГБ, назначаются стандартные антибиотики из класса макролидов, цефалоспоринов, фторхинолонов. Для терапии грибкового поражения наиболее эффективен амфотерицин В, который принимается длительными курсами. Поддерживающее лечение, которые направлено на снижение риска инфекционных осложнений, включает следующие лекарства:
Экспериментальное лечение
Наиболее перспективным методом терапии больных хронической гранулематозной болезнью считается трансплантация гемопоэтических стволовых клеток, чтобы полностью восстановить нормальную иммунную защиту. Однако пересадка сопряжена с высоким риском осложнений, поэтому проводится ограничено в рамках исследовательских программ. На стадии разработки находятся различные методы генной терапии.
Прогноз и профилактика
Несмотря на применяемые методы лечения, нередко развиваются системные грибковые и бактериальные инфекции с летальным исходом. Прогноз относительно неблагоприятный, наблюдается ухудшение качества и снижение продолжительности жизни больных. Профилактика осложнений предполагает обеспечение постоянной поддерживающей терапии, проведение вакцинации в полном объеме (за исключением БЦЖ), максимальное ограждение пациента от инфекций.
Хгб болезнь что это
При хронической гранулематозной болезни нейтрофилы и моноциты сохраняют способность поглощать каталазаположительные микроорганизмы, но из-за отсутствия метаболитов кислорода не уничтожают их. Это заболевание встречается редко (4-5:1 000 000) и наследуется рецессивно. Причиной служат мутации генов, кодирующих компоненты НАДФ-оксидазы (одного на Х-хромосоме и трех аутосомных генов).
Генетика и патогенез хронической гранулематозной болезни. Активация НАДФ-оксидазы в нейтрофилах требует сборки в клеточной мембране отдельных субъединиц фермента. Вначале происходит фосфорилирование катионного цитоплазматического белка p47phox (белок «оксидазы фагоцитов» с молекулярной массой 47 кДа). Фосфорилированный p47phox вместе с двумя другими цитоплазматическими компонентами оксидазы — р67phox и низкомолекулярной гуанозинтрифосфатазой (Rac-2) — транслоцируется в клеточную мембрану, где все эти белки взаимодействуют с цитоплазматическими доменами трансмембранного флавоцитохрома b558, образуя активную оксидазу.
Флавоцитохром представляет собой гетеродимер, состоящий из двух пептидов — p22phox и богатого углеводными остатками gp91phox. Согласно современной модели, три трансмембранных домена N-концевой части флавопротеида содержат остатки гистидина, определяющие связывание гема. Пептид р22phoxстабилизирует gp91phox. Роль p40phox в активации оксидазы остается неясной. Пептид gp91phox необходим для транспорта электронов с участием НАДФ-, флавин- и гемсвязывающего доменов. Пептид р22phox не только стабилизирует gp91phox, но и содержит сайты связывания цитоплазматических субъединиц фермента. Цитоплазматические р47phox, р67phox и Rac-2, по-видимому, играют регуляторную роль, активируя цитохром b558.
Примерно 2/3 больных с хронической гранулематозной болезнью — это мужчины, наследующие мутации расположенного на Х-хромосоме гена, который кодирует gp91phox, а 1/3 больных аутосомно-рецессивно наследуют мутацию гена, кодирующего р47phox (хромосома 7). Около 5% больных аутосомно-рецессивно наследуют дефекты генов р67phox (хромосома 1) и р22phox (хромосома 16).
Нормальная фагоцитарная функция нейтрофилов требует активации НАДФ-оксидазы. Электроны переносятся с НАДФ-Н на флавин, затем на гемовую простетическую группу цитохрома b558 и, наконец, на молекулярный кислород, приводя к образованию О2-. При неэффективном функционировании этой системы О2- не образуется.
Нарушения окислительного обмена в нейтрофилах при хронической гранулематозной болезни создают условия для выживания микробов. Среда в вакуолях фагоцитов остается кислой, и бактерии не перевариваются. Окраска макрофагов больных гематоксилин-эозином выявляет золотистый пигмент, отражающий накопление в клетках поглощенного материала, что и лежит в основе диффузного гранулематоза, давшего название этой патологии.
Клинические проявления хронической гранулематозной болезни
Подозревать хроническую гранулематозную болезнь следует у любого больного с повторными или необычными лимфаденитами, печеночными абсцессами, множественным остеомиелитом, частыми инфекциями в семейном анамнезе или инфекциями, вызываемыми каталазаположительными микробами (например, S. aureus).
Клинические признаки и симптомы хронической гранулематозной болезни могут возникать как в грудном, так и в раннем зрелом возрасте. Частота возникновения и тяжесть инфекционных заболеваний крайне непостоянны. Возбудителем обычно является S. aureus, хотя возможно инфицирование любыми другими каталазаположительнымим микроорганизмами. К частым возбудителям инфекций относятся Serratia marcescens, Burkhoderia cepacia, Aspergillus, Candida albicans и Salmonella. Обычно возникают пневмонии, лимфадениты и поражения кожи.
Осложнения хронических инфекций включают анемию, лимфаденопатию, гепатоспленомегалию, хронический гнойный дерматит, рестриктивные нарушения, гингивит, гидронефроз и стеноз привратника. На возможность хронической гранулематозной болезни указывают также парапроктиты и повторные кожные инфекции, в том числе фолликулиты, гранулемы и дискоидная красная волчанка. Гранулемы и воспалительные процессы, если они вызывают стеноз привратника, сужение мочеиспускательного канала или свищи прямой кишки, напоминающие болезнь Крона, требуют безотлагательного подтверждения диагноза.
Современные представления о хронической гранулематозной болезни (ХГБ)
Хроническая гранулематозная болезнь (ХГБ) — достаточно неплохо изученное на сегодняшний день наследственное заболевание, связанное с недостаточностью фагоцитарной системы, следствием которой является иммунодефицит. Впервые ХГБ была описана в 1959 году у детей, для которых болезнь оказалась смертельной [1]. Болезнь не поддавалась лечению; на аутопсии выявляли генерализованное гранулематозное воспаление, отличающееся по своей специфике от известных на тот момент инфекционных и неинфекционных заболеваний.
Сегодня нам известно намного больше. Заболевание в большинстве случаев более не является смертельным, выявляется в основном у детей (врожденный иммунодефицит проявляется достаточно быстро), неплохо купируется. Однако до сих пор ХГБ относится к заболеваниям неизлечимым.
Этиология и патогенез
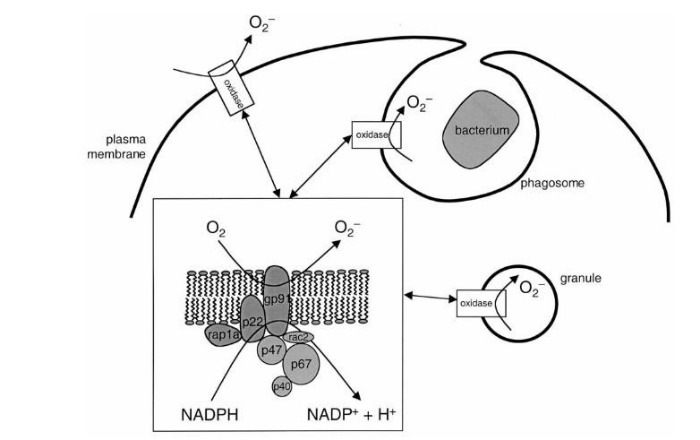
Сущность хронической гранулематозной болезни — в недостаточности фермента НАДФ-оксидазы, который представляет собой комплекс каталитических протеинов. Этот фермент, находясь в фагоцитирующих клетках, обеспечивает перенос электрона с НАДФ на молекулярный кислород: происходит т. н. «респираторный взрыв» (см. Рис. 1). Строго говоря, данный фермент есть не только у фагоцитов: единственным специфичным для них белком является трансмембранный gp91, остальные же компоненты встречаются в самых разных клетках [2].
Обратимся к рисунку 1. Белки gp91 и p22 объединяют в цитохром b558 — мембраносвязанную часть фермента НАДФ-оксидазы, остальные протеины называют цитозольными. При активации фагоцита различными медиаторами цитозольные p47 и p67 фосфорилируются и связываются вместе. Комплекс приобретает сродство к белкам p47 и rac2 — таким образом, присоединяясь к ним, данные протеины вызывают конформационные изменения в мембранном цитохроме b558, — и комплекс приобретает оксидазную активность [2, 5]. НАДФ-оксидаза переносит электрон от своего кофермента НАДФ на кислород с формированием активных форм кислорода (АФК) — O 2- и H2O2. Вот здесь и начинается самое интересное.
Классически считается, что фагоцит убивает микробы, образуя фаголизосому с бактерией или грибом, воздействуя на них большими дозами высокотоксичных АФК; однако в последнее время приобретает актуальность иная точка зрения. В 2002 году в Nature была опубликована статья, авторы которой пересмотрели всю парадигму деактивации поглощенных микробов.
Ученые обнаружили, что если в фагоцитах мышей определяется нормальный уровень активных форм кислорода, но имеется недостаточность лизосомальных ферментов — животные будут беззащитны против стафилококковых и кандидозных инфекций. То есть, несмотря на наличие нормального респираторного взрыва, иммунодефицит все равно присутствует. Стало быть, эффекторами в инактивации микроба являются не сами АФК [6].
Согласно новой модели, АФК являются медиаторами в уничтожении микроба, а непосредственные «убийцы» — ферменты лизосом, обладающие протеолитической активностью. Как известно, при захвате фагоцитом микроба формируется вакуоль — (фагосома), с которой впоследствии сливается лизосома макрофага [7]. На мембране этой вакуоли и функционирует НАДФ-оксидаза, постоянно увеличивая концентрацию АФК. Однако как уже было сказано, данный процесс — не конечный эффекторный механизм.
Наследование и генетика
Хроническая гранулематозная болезнь имеет наследственную природу. Приблизительно данной патологией страдает 1 на 250 000 [9], что делает заболевание достаточно редким и потому трудным в диагностическом отношении. Заболевание вызывает мутация любого из четырех генов, кодирующих субъединицы ключевого фермента фагоцитоза НАДФ-оксидазы. Более двух третей случаев связаны с X-сцепленным наследованием (дефект гена CYBB, кодирующего белок p-91); остальные случаи связаны с аутосомно-рецессивным наследованием генов CYBA, NCF-1 и NCF-2, кодирующих белки p22, p47 и p67 соответственно. Исходя из этого болезнь обозначают как ХГБ X91, A22, A47 и A67 (в зависимости от типа наследования и локуса гена) [10].
Примечательно, что в литературе нет (или крайне мало) доказанных случаев наследственного дефекта других субъединиц. Однако в последнее время обнаруживаются все новые мутации генов, следствием которых становится ХГБ: например, в 2009 году выделили еще один подвид ХГБ, связанный с аутосомно-рецессивной мутацией гена p-40 [11], имеются также сведения о единственном пациенте с недостаточностью белка Rac2 — [10]. Вполне вероятно, что могут существовать и другие генетические патологии, вызывающие данное заболевание.
Диагностика
Диагностика ХГБ основана на выявлении клинических признаков, кроме того, важно выявить наличие или отсутствие респираторного взрыва. Последнее можно осуществить несколькими гистологическими и иммунологическими методами, например, окрашивание нитросиним тетразолием (НТЗ) позволяет определить, вырабатывают ли клетки АФК — НТЗ будет утилизироваться активными формами кислорода, в результате чего из бледно-желтого тетразолия образуется голубой формазан [12].
Среди наиболее ярких клинических симптомов можно выделить: пиодермию, пневмонию, воспалительные процессы желудочно-кишечного тракта, лимфаденит, абсцесс печени и остеомиелит [13] на фоне рецидивирующих бактериальных и грибных инфекций.
В крови выявляется гипергаммаглобулинемия и анемия. В местах дренажей — хроническое воспаление с образованием гранулем. Также гранулемы могут формироваться в различных тканях и органах: например, в желудке гранулематозное воспаление способно привести к обструкции желудочного канала, в урогенитальном тракте — к циститу. Также следует упомянуть, что почти 20 % больных ХГБ страдает от гранулематозного колита, который легко перепутать с болезнью Крона [14].
Также следует упомянуть о недавно открытой бактерии, выявленной у пациентов с ХГБ, которую исследователи предложили назвать Granulobacter bethesdensis. Это грамотрицательная палочка, которая на данный момент не может быть отнесена ни к одной из существующих таксономических групп; бактерия поражает лимфоузлы, кроме того, резистентна к антибиотикам in vitro и, скорее всего, — in vivo [18, 19]. Предполагается, что это — лишь первая из подобных бактерий, возникшая в эру антибиотиков. На данный момент Granulobacter bethesdensis не слишком распространена, однако имеет к этому весьма опасную тенденцию.
Лечение
В настоящее время активно разрабатываются методики, которые смогут не просто позволить больным с ХГБ жить полноценно, но и в перспективе совершенно избавить их от бремени заболевания. Поскольку болезнь наследственная, крайне трудно придумать что-то существенное, однако такие попытки предпринимаются, и некоторые из них обнадеживают.
Одна из них — лечение хронической гранулематозной болезни с помощью генной инженерии [20]. В 2006 году в Nature Medicine была опубликована статья, авторы которой сообщили об успешной коррекции генома двух пациентов с X-сцепленной формой ХГБ. После лечения у пациентов определяли активность нейтрофилов с помощью позитронно-эмиссионной томографии, а также других инструментальных методов. Исследование показало, что в обоих случаях фагоциты после проведенного лечения смогли оказать сопротивление инфекции. На данный момент это — одна из самых многообещающих методик.
Еще одним способом терапии является пересадка гемопоэтических клеток [21]. Двадцати семи пациентам после миелоаблативного режима кондиционирования (подготовка пациента к трансплантации с помощью лучевой или цитостатической терапии — прим. автора) пересадили гемопоэтические стволовые клетки от наиболее подходящих доноров (по белкам HLA — главного комплекса гистосовместимости). Двадцать три пациента вполне успешно перенесли операцию, а дальнейшее наблюдение позволило говорить об излечении этих пациентов от хронической гранулематозной болезни. Однако еще 4 пациента умерли от последующих инфекций (15 %).
В остальном же современная медицина может предложить крайне немного. Это — патогенетическая и симптоматическая терапия с использованием антибиотиков, дренажей и прочего. Излишне говорить, что подобное лечение не способно избавлять пациентов от ХГБ.
Профилактика инфекций.
Крайне важно предотвращение развития инфекционного процесса. Пациенты с ХГБ испытывают невероятные трудности в повседневной жизни, например, некачественная чистка зубов спокойно может окончиться гингивитом, а царапина — тяжелой бактериемией. Потому больным необходимо тщательным образом следить за гигиеной, выполнять профессиональную чистку зубов, обрабатывать все царапины антисептиком. И, разумеется, такие пациенты должны быть привиты по всем правилам [14]. В противном же случае даже достаточно простая инфекция может окончиться летально.
Источники:
Первичный иммунодефицит
Первичный иммунодефицит (ПИД) — это гетерогенная группа редких, преимущественно наследственных заболеваний, характеризующихся нарушением работы одного или нескольких компонентов иммунной системы.
Такие нарушения иммунитета приводят к повышенной уязвимости организма к различным патогенам, выражающейся в частых и рецидивирующих инфекционных заболеваниях, развитии хронических и системных болезней (аутоиммунных, онкологических).
Причины
В отличие от вторичных иммунодефицитов, возникающих в результате развития хронических заболеваний, иммуносупрессии, вызванной приемом лекарств, наличия ВИЧ-инфекции, естественного старения или недостаточности питания, большинство случаев первичного иммунодефицита ассоциированы с генетическими нарушениями. Дефектные гены передаются по наследству ребенку от одного или обоих родителей.
На данный момент известны более 350 первичных иммунодефицитов, почти все они ассоциированы с генетическими нарушениями. При этом до 70-90% людей, живущих с ПИД, не диагностированы, особенно в регионах с низкой доступностью лабораторного и генетического тестирования.
Первичные иммунодефициты классифицируют в зависимости от того, какая часть многокомпонентной иммунной системы поражена:
Распространенность ПИД варьируется в зависимости от типа патологии. Более половины ПИД связаны с недостаточностью B-лимфоцитов. Примерно две трети пациентов — дети.
Симптомы
Клиническая картина первичных иммунодефицитов весьма разнородна и зависит от типа расстройства, она может включать не только иммунологические нарушения, но и желудочно-кишечные расстройства, гематологические и аутоиммунные заболевания, атопию, злокачественные новообразования. Кроме того, заболевания каждой группы ПИД имеют частично совпадающие симптомы и общие признаки типичных заболеваний.
Главной отличительной чертой ПИД являются частые, длительные, рецидивирующие инфекции, тяжело поддающиеся лечению, а также т. н. оппортунистические инфекции, которые для человека без иммунодефицита не опасны.
Симптомы первичного иммунодефицита могут включать:
У некоторых пациентов с ПИД может наблюдаться целый комплекс связанных признаков заболевания. Например, для пациентов с хронической гранулематозной болезнью характерны рецидивирующие бактериальные или грибковые инфекции, а также хроническое воспаление ЖКТ и дыхательных путей. Для пациентов с синдромом Вискотта — Олдрича (Х-сцепленное рецессивное заболевание) характерны такие проявления, как экзема, рецидивирующие бактериальные инфекции и тромбоцитопения.
По сравнению с людьми со здоровой иммунной системой, у пациентов с ПИД выше риск злокачественных новообразований: лимфомы, лейкемии, опухолей пищеварительного тракта и вирус-индуцированного рака.
Диагностика
Первичные иммунодефициты достаточно сложно диагностировать и дифференцировать — в связи с неоднородным характером клинических проявлений и их схожестью с симптомами типичных болезней (синусита, бронхита, пневмонии, гастроэнтерита, менингита).
Иммунологические нарушения подтверждаются лабораторными исследованиями. Например, может проводиться оценка гуморального иммунитета и клеточного иммунитета, фагоцитарной функции, функции NK-клеток (естественных киллеров), системы комплемента. Необходимость в конкретных лабораторных исследованиях (оценке уровня сывороточных иммуноглобулинов, количественном измерении иммуноглобулинов, количественном измерении T-лимфоцитов, определении внутриклеточных цитокинов и белков, пролиферативной активности, клеточного цикла, цитотоксичности и др.) определяет иммунолог, в зависимости от клинической картины.
Генетическое тестирование (хромосомный анализ, флуоресцентная гибридизация in situ, полное секвенирование генома и экзома) играет важную роль для подтверждения диагноза, лечения и прогноза. Критерии выбора метода генетического тестирования основаны на стремлении к точной и быстрой постановке диагноза с минимальной финансовой нагрузкой для пациента.
Лечение первичного иммунодефицита
Лечение ПИД включает профилактику и контроль рецидивирующих инфекций, устранение основной причины иммунного нарушения, терапию заболеваний с ним связанных (аутоиммунных или онкологических).
Для профилактики и лечения частых и рецидивирующих инфекций назначается курс антибиотикотерапии (только инфекции, вызванные бактериями или грибками), прицельная (!) противовирусная терапия и симптоматическая терапия.
Для коррекции иммунитета могут назначаться иммуноглобулинотерапия (восполнение дефицита конкретных антител), интерферон-гамма терапия (синтетический аналог интерферонов, блокирующих репликацию вируса и стимулирующих клетки иммунной системы, используется для лечения хронической гранулематозной болезни, одной из форм ПИД), терапия факторами роста (при ПИД, вызванном недостатком лейкоцитов).
Защитный иммунитет пациентов с ПИД, более подверженных риску инфекции, обеспечивает регулярная и своевременная иммунизация, однако живые вакцины (от полиемиелита, кори, краснухи и паротита) для детей с первичными иммунодефицитами подходят не всегда.
Трансплантация костного мозга или трансплантация гемопоэтических стволовых клеток может рассматриваться как вариант лечения жизнеугрожающего ПИД, в частности тяжелого комбинированного иммунодефицита (или тяжелой комбинированной недостаточности — ТКИН). В последние годы достигнут значительный прогресс в лечении ТКИН (аденозиндезаминаза-ТКИН, X-сцепленный ТКИН, хроническая гранулематозная болезнь, синдром Вискотта — Олдрича) с помощью генной терапии. Переливание генно-скорректированных клеток показывает многообещающие результаты, однако пока метод применяют очень осторожно, поскольку такое лечение может приводить к неконтролируемому развитию у пациентов лейкемии.
Прогноз для пациентов с ПИД варьируется в зависимости от иммунных нарушений и тяжести течения заболевания. К сожалению, без трансплантации костного мозга или гемопоэтических стволовых клеток дети с тяжелой комбинированной недостаточностью умирают в течение первых 2 лет жизни. У детей, перенесших трансплантацию в возрасте до 3 месяцев, прогноз улучшается. У пациентов с менее тяжелыми формами ПИД, получивших адекватное лечение, показатели долгосрочной выживаемости и качества жизни намного выше.
Особенности и преимущества лечения первичного иммунодефицита в клинике Рассвет
Если у вашего ребенка или у вас наблюдаются частые или рецидивирующие инфекции с тяжелым течением, обязательно запишитесь на прием к педиатру или терапевту Рассвета. При подозрении на первичный (или вторичный) иммунодефицит эти специалисты направят вас к иммунологу.
Научно обоснованные и доказанно эффективные методы диагностики и лечения первичного иммунодефицита, которые используют иммунологи Рассвета, позволят вам сохранить хорошее качество жизни и здоровье надолго.
Наши врачи-иммунологи помогут исключить или выявить и устранить иммунодефицит, при необходимости вашим лечением займется мультидисциплинарная команда специалистов — терапевты, пульмонологи, ревматологи.