Хиазмальная область что это
Хиазмальная область что это
Опухоли хиазмально-селлярной области представлены аденомами гипофиза и их очень редкими злокачественными формами, известными как рак гипофиза и краниофарингиомы. Аденомы гипофиза могут быть эндокринно активными или неактивными и обычно приводят к акромегалии, синдрому Кушинга и т.д. Они относятся к более частым внутричерепным опухолям (8-12%) с равным распределением между мужчинами и женщинами и без четкого возрастного пика.
Аденомы гипофиза могут быть представлены как мономорфными маленькими круглыми клетками, так и папиллярными образованиями. Краниофарингиомы встречаются и у детей, и у взрослых, соотношение между мужчинами и женщинами одинаковое. Кроме того, в этой локализации встречаются несколько кист, наиболее распространенная из которых киста кармана Ратке.
Аденомы гипофиза определяют как эндокринологически активные, если они вырабатывают пролактин и гормон роста (чаще) или АКТГ (редко), или другие гормоны (очень редко). Соответствующие популяции клеток в опухолях могут быть выявлены специальными окрасками, с помощью иммуногистохимии и электронной микроскопии. Но однозначное соответствие морфологических данных с эндокринологическими не предполагается. Краниофарингиомы содержат полосы частично многослойного эпителия и могут быть двух форм: папиллярной и адамантиноматозной.
Они имеют различные гистологические особенности, распределение по возрасту и уровень рецидивирования, последняя форма склонна к образованию кератина и кальцификатов и встречается почти исключительно у взрослых.
Аденомы гипофиза и обе формы краниофарингиом классифицируются как класс I. Рак гипофиза, который встречается крайне редко, имеет IV степень. Киста кармана Ратке не является собственно опухолью, но может рассматриваться в качестве приостановившейся в развитии краниофарингиомы.
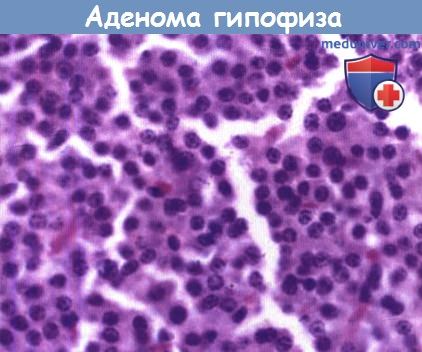
состоят из плотного скопления мелких клеток, которые плохо ограничены и образуют мономорфные пласты. 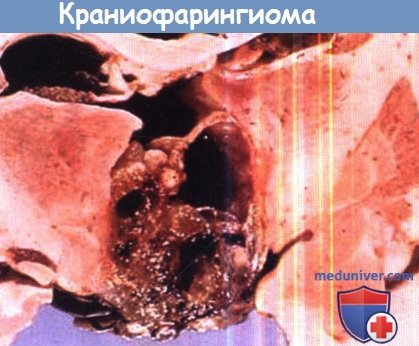
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика и лечение метастатических опухолей в хиазмально – селлярную область
Анализ результатов диагностики и нейрохирургического лечения метастатических опухолей, локализованных в хиазмально – селярную область
Введение
Клинически метастазы в ХСО проявляются общемозговой симптоматикой, нарушением секреции гормонов гипофиза, глазодвигательными и зрительными нарушениями, симптомами поражения ветвей тройничного нерва (Bagan, 1980).
Диагностика метастазов в ХСО сложна. По литературным данным в 56% случаев метастатические опухоли ХСО являются первыми проявлениями онкологического заболевания (Abrams, 1950). Отсутствие онкологического анамнеза, патогномоничных симптомов, специфических признаков нейровизуализации усложняют дифференциальную диагностику между метастатическим поражением ХСО и первичными опухолями данной локализации (Bell, 2001; Buonaguidi, 1983). Окончательная диагностика возможна только на основе патоморфологического и иммуногистохимического исследований (ИГХ) (Nelson, 1987).
Лечение метастазов в ХСО комбинированное. В большинстве случаев первым этапом является нейрохирургическое вмешательство, направленное на гистологическую верификацию опухоли и на декомпрессию зрительных и глазодвигательных нервов, с последующей химиотерапией, лучевой терапией или стереотаксической радиохирургией (Roessmann, 1970). Многие авторы считают, что удаление опухолей не существенно влияет на продолжительность жизни, но в сочетании с последующими лучевыми методами лечения улучшает качество жизни больных (Bell, 2001; Gsponer, 1999).
Материал и методы
С 2007 по 2013 гг. в НИИ нейрохирургии им. акад. Н. Н. Бурденко наблюдались 163 больных с метастатическими опухолями основания черепа. В 19 (20, 4%) случаях метастазы локализовались в ХСО. Соотношение М: Ж было около 1: 2; Женщин в данной группе было 12 (63, 2%), мужчин – 7 (36, 8%). Средний возраст больных с метастазами в ХСО составлял 40 лет (минимальный возраст 13 лет, максимальный – 72 года). Предоперационно всем больным выполнялось МРТ головного мозга с внутривенным контрастированием.
Всем больным выполнено нейроофтальмологическое обследование, оценивались острота зрения, поля зрения, осматривалось глазное дно.
Проводилось исследование гормонов аденогипофиза. Наличие или отсутствие несахарного мочеизнурения оценивалось клинически, а также на основе осмолярности и электролитного состава мочи и крови.
Окончательная диагностика выполнялась на основе патоморфологического и или иммуногистохимического исследования биоптата или аутопсийного материала в одном случае. Иммуногистохимическое исследование выполнялось в 14 наблюдениях.
19 больным были выполнены оперативные вмешательства с целью гистологической верификации опухоли, и уменьшения ее размеров. Оперативные вмешательства выполнялись 2 способами – транскраниальным и трнсназальным. В большинстве случаев трансназальные оперативные вмешательства выполнялись с применением эндоскопической техники.
В 5 случаях после оперативных вмешательств выполнялись стереотаксическая рад
Результаты
Диагностика метастатических опухолей ХСО основывалась на анамнезе, клинической картине, данных нейровизуализации и результатов патоморфологического и иммуногистохимического исследований.
Клиническая картина складывалась из дисфункции гипофиза, зрительных, глазодвигательных нарушений, симптомов поражения лобной и височной долей и общемозговой симптоматики. Нарушения функций аденогипофиза в нашем наблюдении отмечались в 5 (26, 3%) случаях. У 2 (10, 5%) пациентов гормональные нарушения проявлялись в виде гипокортицизма и гипотиреоза, в 3 (15, 8%) случаях в виде пангипопитуитаризма. Картина поражения нейрогипофиза с синдромом несахарного мочеизнурения наблюдалось у 3 (15, 8%) больных. Сочетание несахарного мочеизнурения и дисфункция аденогипофиза наблюдались у 2 (10, 5%) больных.
Дисфункция ветвей тройничного нерва в виде снижения чувствительности на лице наблюдалась у 3 больных.
Общемозговая симптоматика проявлялась в 4 (23, 5%) случаях в виде головных болей. У 1 больного с преимущественно супраселлярным ростом опухоли с компрессией дна 3 желудочка наблюдался Корсаковский синдром.
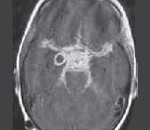
Всем больным была выполнена МРТ головного мозга с внутривенным контрастированием, оценивались МР характеристики опухоли, локализацию, соотношение с окружающими структурами (рис. 1). В 15 (79%) наблюдениях из 19 дооперационно установлен диагноз метастаз в ХСО, как наиболее вероятный на основе онкологического анамнеза и данных МРТ. В 4 случаях больные поступали с результатами КТ головного мозга, на которой определялись образования ХСО, вызывающие деструкцию турецкого седла, ската (рис. 2).
В нашем наблюдении в 7 (36, 8%) случаях метастазы имели эндо – супра – латероселлярный рост с односторонним распространением в кавернозный синус. В остальных 12 (63, 2%) случаях опухоли распространялись эндо – супраселлярно. Характер роста опухоли определял хирургическую тактику.
Редко при метастатическом поражении ХСО в морфологическом препарате возможно визуализировать ткань метастаза с тканью гипофиза (рис. 3)
19 больным выполнено 23 оперативных вмешательств. Срок от момента проявления симптомов поражения структур ХСО до хирургического вмешательства составлял в среднем 5, 4 месяца (от 1 месяца до 1 года).
В 19 (82, 6%) случаях производились эндоскопические трансназальные оперативные вмешательства, 9 из которых описаны как «парциальное удаление», 5 «удаление», 4 «биопсия опухоли». В одном случае проводилась пластика ликворной фистулы аутотканями. Одному больному с метастазом почечноклеточного рака выполнена трехкратная трансназальная резекция опухоли через 12 месяцев после первой и через 4 месяца после второй операций, в связи с увеличением размеров опухоли ХСО и нарастанием зрительных нарушений.
Одной больной через 19 месяцев после транскраниальной операции в связи с продолженным ростом опухоли выполнена трансназальная резекция рецидива опухоли.
Неврологический статус оценивался у всех больных в раннем послеоперационном периоде к моменту выписки из клиники. В 15 (88, 2%) случаях больные были выписаны из клиники без неврологического ухудшения, а улучшение в виде регресса головных болей наблюдалось у 3 пациентов.
Улучшения гормонального статуса больных после оперативных вмешательств не отмечалось. У 2 (11, 8%) больных было усугубление электролитных нарушений, которые регрессировали на фоне заместительной терапии. Предсуществующий несахарный диабет не регрессировал.
После нейрохирургических вмешательств по поводу метастатических опухолей ХСО не наблюдается драматического улучшения зрительных и глазодвигательных функций, характерного для хирургии доброкачественных образований (менингиом, аденом) данной локализации. Из 19 случаев, зрительные функций в раннем послеоперационном периоде оценивалось у 15 (79%) больных. Из них зрительные и глазодвигательные функций остались без динамики в 8 (53, 3%) случаях, ухудшение наблюдалось в 4 (26, 7%) наблюдениях, и улучшение у 3 (15, 8%) пациентов. В отдаленном периоде (более чем 3 месяцев) зрительная и глазодвигательная функций оценивались в 7 (36, 8%) случаях. Среди них улучшение отмечалось в 3 случаях, прогрессивное ухудшение в 3 наблюдениях, и в 1 случае не отмечалось динамики. Отсутствие изменений а так же ухудшение зрительной функции при хирургии метастазов основания черепа обусловлено невозможностью радикального удаления данных опухолей и инфильтативным тесным соотношением в зрительными и глазодвигательными нервами, вследствие чего излишняя радикальность приводит к отрицательным результатам.
Интраоперационные и ранние послеоперационные осложнения наблюдались у 5 (26%) пациентов. В 2 случаях была интраоперационная кровопотеря до 2, 5 литров (рак почки и рак простаты). У 1 больной в раннем послеоперационном периоде возникла назальная ликворея. В раннем послеоперационном периоде неврологическое ухудшение наблюдалось в 2 случаях при транскраниальных оперативных вмешательствах. В одном наблюдении отмечалось нарастание пареза отводящего нерва, регрессировавшего после проведенного лечения. У 1 больной после транскраниальной резекции метастаза рака молочной железы возник стойкий правосторонний амавроз.
Летальных исходов вследствие оперативных вмешательств не было.
В послеоперационном периоде в 2 случаях проводилась СТРХ, еще 3 пациентам проводилась лучевая терапия на хиазмально – селлярную область. В одном наблюдении через 6 месяцев после проведения лучевой терапии было снижение зрения с 0, 7 до 0, 1 вследствие лучевых изменений в зрительном нерве.
Обсуждение
В различных сочетаниях встречаются нарушения секреторной функции аденогипофиза. Гипопитуитаризм проявляется гипотиреозом в 33, 3%, гипокортицизмом в 30, 6%, гипопролактинемией в 11, 1% случаев, низким уровнем тестостерона в 11, 1% наблюдений. В 22, 2% случаев описывается пангипопитуитаризм (Bell, 2001).
При метастазах ХСО зрительные нарушения в виде снижения зрения, а так же сужения и выпадения полей зрения встречается в 7-50% случаев (Branch, 1987).
Вследствие частой и прогрессирующей инвазии метастазов в кавернозный синус наблюдается быстро нарастающая головная боль в сочетании с глазодвигательными нарушениями и выпадениями чувствительности на лице (Bell, 2001). Частота глазодвигательных нарушений при метастатических поражениях ХСО достигает 15-43% (Cox, 1979), при менингиомах кавернозного синуса встречаются в 42% (Gasponer, 1999), при хордомах основания черепа – в 70% (Bagan, 1980). Глазодвигательные нарушения при аденомах гипофиза встречаются значительно реже: в 6, 7% случаев по данным Калинина П. Л. и в 8, 3% по наблюдениям Шкарубо А. Н (Калинин, 2009; Шкарубо, 2007).
Лечение метастазов ХСО комплексное, включает хирургические вмешательства, лучевую терапию, химиотерапию (Шкарубо, 2007). Тотальное удаление метастазов ХСО практически невозможно ввиду интенсивной васкуляризации опухоли, локальной инвазии в окружающие костные структуры и в кавернозный синус, инфильтрации гипоталамуса и зрительных путей (Gsponer, 1999). В наблюдаемой нами серии больных в 12 случаях опухоль была удалена парциально или была выполнена биопсия, в 10 случаях было достигнуто субтотальное удаление.
Вероятность осложнений при хирургических вмешательствах по поводу метастазов ХСО значительно выше по сравнению с доброкачественными образованиями той же локализации (Kattah, 1985). По данным литературы из 21 больных, прооперированных по поводу метастазов в ХСО отмечены такие осложнения как, ликворея в 2 (9, 5%) случаях, карциноматозный менингит у 1 (4, 6%) пациента, ухудшение эндокринной функции в 3 наблюдениях (Bell, 2001).
Продолжительность жизни пациентов с метастазами в ХСО колеблется от 6 месяцев до 5 лет (с момента выявления метастаза) и зависит от распространенности онкологического процесса, локализации других метастазов, возраста пациента, проведенного лечения (Molinatti, 1985). Так, наименьшая продолжительность жизни наблюдается в группе больных старше 65 лет, с мелкоклеточным раком легкого, при обнаружении метастаза в ХСО в период до 1 года с момента диагностики первичной опухоли (Cox, 1979).
По литературным данным метастазы в ХСО становятся непосредственной причиной летального исхода в около 14 % (Molinatti, 1985).
Заключение
В клинической практике метастатические опухоли ХСО встречаются редко. Ввиду отсутствия онкологического анамнеза, патогномоничных клинических признаков и характерных данных нейровизуализации, окончательная диагностика возможна только на основе результатов патоморфологического и иммуногистохимического исследований.
Метастатические опухоли ХСО в основном доступны для трансназальных оперативных вмешательств, однако при преимущественно супраселлярном или латероселлярном росте солитарных метастазов предпочтительны транскраниальные операций.
При единичном метастазе, исходном хорошем состоянии больного, ожидаемой большой продолжительности жизни показана широкая резекция опухоли. В противоположных случаях нейрохирургическое вмешательство выполняется только с целью гистологической верификации опухоли.
Как правило, нейрохирургические вмешательства не улучшают функций гипофиза и только в редких случаях приводят к улучшению зрительных и глазодвигательных функций.
Продолжительность жизни больше при агрессивной хирургической тактике с последующим лечением химиотерапией и лучевой терапией. При исходно тяжелом состоянии больных, которым проводилась только биопсия для верификации диагноза без последующего лечения, летальный исход наступал в течение 3 месяцев после оперативного вмешательства вследствие прогрессии опухоли ХСО.
Список литературы:
Дис. …доктора мед. наук: 14. 00. 28 / НИИ нейрохирургии им. акад Н. Н. Бурденко. Москва. 2007. 389 с.
Автор статьи:
Степанян Мушег Агоевич
Оптико-хиазмальный арахноидит
Оптико-хиазмальный арахноидит – базальный менингоэнцефалит средней черепной ямки, при котором поражаются зрительные нервы и хиазма. Основные проявления патологии – боль в области глазницы, ухудшение зрения, общая слабость, повышенная зрительная утомляемость. Диагностика базируется на проведении офтальмоскопии, периметрии, визометрии, исследовании реакции зрачков на свет и краниографии. Консервативная терапия оптико-хиазмального арахноидита включает назначение антибиотиков, глюкокортикостероидов, антигистаминных средств, витаминов группы В и С. При низкой эффективности медикаментозного лечения осуществляется оперативное вмешательство.
Общие сведения
Оптико-хиазмальный арахноидит – наиболее распространённая форма воспаления паутинной оболочки, при которой патологический процесс локализируется в области основания головного мозга. Согласно статистическим данным, в 60-80% случаев причиной развития заболевания становится наличие хронических очагов инфекции в области придаточных синусов носа. В 10-15% установить этиологию болезни не удается, такие варианты рассматриваются как идиопатические. Ученые изучают роль аутоиммунных механизмов в возникновении арахноидита. Патология с одинаковой частотой встречается среди лиц мужского и женского пола. Базальный менингоэнцефалит распространён повсеместно.
Причины оптико-хиазмального арахноидита
Ведущее значение в развитии данной патологии отводится воспалению околоносовых пазух. Инфекционные агенты (вирусы, микроорганизмы) попадают в черепную коробку через естественные отверстия синусов. Реже появление симптомов оптико-хиазмального арахноидита связано с острым течением отита, мастоидита. Основные этиологические факторы болезни:
Патогенез
В основе механизма развития лежит воздействие инфекционного агента (чаще – вирусной природы) на мозговые оболочки. В первую очередь поражается паутинная оболочка, а следом за ней и мягкая. Изменения в структуре нервной ткани сильнее выражены в зоне хиазмы и прилежащих зрительных нервов. Из-за локального воспаления расширяются сосуды, увеличивается их проницаемость. Наблюдается повышенная экссудация и формирование клеточных инфильтратов в зоне оболочек мозга. Затем возникают циркуляторные расстройства, провоцирующие нарастание гипоксических проявлений и развитие аллергических реакций.
Со временем воспалительный процесс приводит к фибропластическим изменениям арахноидеи в области зрительного перекрёста и оптических нервов. Разрастание соединительной ткани обуславливает формирование обширных синехий между твёрдой и паутинной оболочками. Помимо фиброзных тяжей образуются кисты, полости которых заполнены серозным содержимым. Выделяют множественные мелкие или единичные крупные кистозные образования. Кисты могут окружать хиазму со всех сторон, приводить к сдавливанию зрительных нервов. Компрессия нервов является основной причиной их дегенеративно-дистрофических изменений, а в последующем – атрофии.
Классификация
Различают острое и хроническое течение заболевания. К хроническому варианту относят наследственную семейную атрофию зрительных нервов (амавроз Лебера). Прослеживается чёткая генетическая предрасположенность к развитию этой формы болезни. Согласно клинической классификации принято рассматривать 3 типа оптико-хиазмального арахноидита, в симптоматике которых доминируют следующие признаки:
Симптомы оптико-хиазмального арахноидита
Для патологии характерно острое начало. Пациенты предъявляют жалобы на двухстороннее ухудшение зрения, сильную головную боль, которая не купируется приемом анальгетиков. Возникает повышенная утомляемость при выполнении зрительных нагрузок (чтение книг, работа за компьютером, просмотр фильмов). Прогрессирование заболевания приводит к сильной боли в окологлазничной области, иррадиирующей в лоб, переносицу, надбровные зоны, виски. Болевой синдром может локализироваться непосредственно в орбите.
Больные отмечают, что острота зрения снижается очень быстро. При тяжелом течении зрительная дисфункция достигает максимума уже через несколько часов, но чаще этот процесс занимает 2-3 дня. Постепенно из зрительного поля выпадают отдельные участки. Зрачки могут быть разного размера. У пациентов страдает цветоощущение, особенно – восприятие красного и зеленого цвета. В этот временной промежуток могут возникать диспепсические расстройства (тошнота, рвота). В дальнейшем острый процесс сменяется хроническим. При сопутствующем поражении черепных нервов снижается обоняние. Из-за нарушения иннервации лицевого нерва визуализируется опущение латерального уголка глаза или рта.
При распространении зоны поражения на гипоталамическую область больные страдают частыми вегетососудистыми кризами, нарушается терморегуляция, наблюдаются судорожные подергивания мышц. Отмечается повышенная потливость, жажда, субфебрилитет, нарушения сна. В отличие от острого процесса, при хроническом течении патологии симптоматика нарастает постепенно. Некоторые пациенты отмечают, что после проведения диагностической цистернографии зрение восстанавливается на короткий промежуток времени.
Осложнения
Распространённое осложнение патологии – атрофия зрительного нерва. У больных существует высокая вероятность дислокации структур головного мозга. При увеличении кистозных образований наблюдается компрессия мозговой ткани и очаговая симптоматика. Распространение патологического процесса на другие оболочки мозга становится причиной менингита, менингоэнцефалита. При осложненном течении возможно формирование внутричерепных абсцессов. При вторичном поражении желудочков мозга возникает вентрикулит. Пациенты входят в группу риска развития острого нарушения мозгового кровообращения.
Диагностика
На ранних стадиях постановка диагноза затруднена. Поскольку наиболее частой причиной патологии является поражение околоносовых синусов, на этапе первичной диагностики проводится рентгенография. Для большей информативности выполняется МРТ пазух. При этом удаётся выявить небольшую пристеночную отечность слизистой оболочки клиновидного синуса и поражение задних ячеек решетчатого лабиринта. Инструментальные методы диагностики включают:
При односторонней форме патологии обследование пациента необходимо повторить через 1-2 недели из-за высокого риска отсроченного поражения второго глаза. Также для болезни характерно явление «мигрирующих дефектов», при котором отельные изменения поля зрения определяются в других участках.
Лечение оптико-хиазмального арахноидита
При остром течении болезни назначается медикаментозное лечение. Продолжительность консервативной терапии составляет 3-6 месяцев. После купирования острого процесса показана физиотерапия. При помощи электрофореза вводятся препараты кальция, витамин РР. Эффективно применение иглорефлексотерапии продолжительностью 10 сеансов. Для устранения симптоматики оптико-хиазмального арахноидита назначают:
При отсутствии эффекта от медикаментозной терапии показано проведение люмбальной пункции с введением кислорода в оптико-хиазмальную цистерну. Цель данной манипуляции – разрушить соединительнотканные сращения. Хирургическое лечение арахноидита сводится к рассечению спаек и удалению кист в области хиазмальной цистерны и у основания мозга. Оперативное вмешательство противопоказано при менингеальной симптоматике, плеоцитозе или признаках отека ДЗН. С целью профилактики рецидива заболевания в послеоперационном периоде назначается противовоспалительная терапия. Для контроля эффективности лечения выполняют спинномозговую пункцию. Лечение проводится совместно офтальмологом и неврологом. Требуется консультация нейрохирурга.
Прогноз и профилактика
Исход оптико-хиазмального арахноидита определяется степенью тяжести и характером течения заболевания. При лёгком течении болезни прогноз благоприятный, поскольку зрительные нарушения мало выражены. Прогрессирование патологии может привести к стойкой потере зрения. Специфические профилактические меры не разработаны. Неспецифическая профилактика направлена на своевременное лечение инфекций головного мозга и воспаления околоносовых синусов. При возникновении симптоматики в отдаленном периоде после ЧМТ пациент должен состоять на диспансерном учете у невропатолога.
Хиазмальная область что это
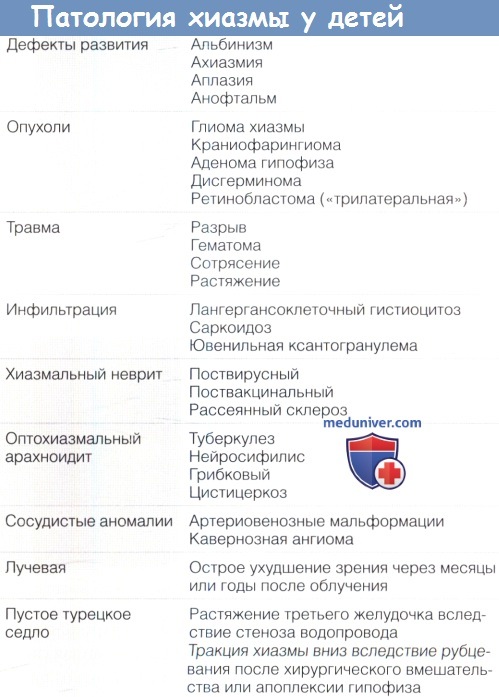
Дефекты развития и супраселлярные опухоли у детей встречаются часто. Причиной большинства синдромов поражения хиазмы являются неопластические процессы, аномалии развития, лучевые поражения, воспаление, инфекция, демиелинизация, нарушения кровообращения, перерезка, разрыв или гипоплазия хиазмы. Доминантная атрофия зрительного нерва может манифестировать битемпоральной гемианопсией, симулирующей поражение хиазмы.
Зачастую у маленьких детей патология хиазмы выявляется поздно, поскольку ребенок компенсирует развивающиеся изменения, и подозрения возникают уже при развитии выраженного двустороннего ухудшения зрения.
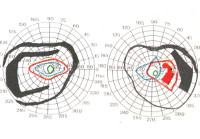
Характерным признаком патологии хиазмы является битемпоральная гемианопсия. Большое значение имеют некоторые методы периметрии. Новообразования, лежащие ниже хиазмы, вырастают до крупных размеров еще до появления симптомов компрессии хиазмы. Сначала они сдавливают нижненосовые волокна и, как правило, вызывают развитие двусторонних верхневисочных дефектов поля зрения.
Лежащие выше хиазмы новообразования обычно вызывают дефекты нижних секторов полей зрения. К моменту развития дефекта полей зрения хиазма обычно истончается под действием сдавливающего ее новообразования, и характер дефектов полей зрения не всегда ясен.
Часто отмечается снижение остроты зрения. Разрыв хиазмы, например, при травме, не вызывает значительного снижения остроты зрения, поскольку носовые квадранты полей зрения и носовая часть центральной ямки не поражены, но поражение зрительного нерва или обширное поражение и перекрещенных, и неперекрещенных волокон хиазмы вызывает снижение остроты зрения. Часто наблюдается очень тяжелое снижение остроты зрения на одном глазу при относительно сохранных зрительных функциях на другом, за исключением развития дефекта поля зрения.
При хронических процессах часто отмечается сохранение высокой остроты зрения несмотря на офтальмоскопические признаки массивной потери нейронов.
При поражении зрительного нерва наблюдается выраженное нарушение цветовосприятия. У пациентов с подозрением на сдавление хиазмы информативны тесты на остроту стереоскопического зрения и тесты Bagolini с полосчатыми стеклами. При патологии хиазмы часто отмечается снижение остроты стереоскопического зрения, даже если еще не удается выявить дефекты поля зрения. При полном рассечении хиазмы стереопсис может обеспечиваться посредством гаплоскопической стимуляции интактных височных квадрантов сетчатки.
Это демонстрирует компенсаторные возможности механизмов поддержания стереопсиса при рассечении хиазмы, тогда как отсутствие моторной фузии полностью исключает возможность стереопсиса. У пациентов с патологией хиазмы при тесте Bagolini с полосчатыми стеклами определяется бинокулярный «рисунок горы». У детей рано развившиеся заболевания хиазмы могут проявляться нистагмом. Классическим считается возвратно-поступательный нистагм, но у большинства пациентов развивается смешанный нистагм с вертикальным, горизонтальным и ротаторным компонентами.
Проявления патологии хиазмы:
— Потеря стереопсиса
— Постфиксационная слепота
— Потеря моторной фузии
— Слайд-феномен полуполей
— Битемпоральная гемианопсия
— Полосчатая атрофия диска зрительного нерва
— Возвратно-поступательный нистагм
— «Spasmus nutans»
Патология хиазмы часто сопровождается атрофией зрительного нерва. Может развиваться генерализованная гибель нейронов или, вследствие гибели волокон, идущих от височных квадрантов сетчатки с сохранением волокон от интактных носовых квадрантов, полосчатая атрофия. При дефектах развития хиазмы и опухолях часто развиваются аномалии диска зрительного нерва, например гипоплазия. Врожденные супраселлярные опухоли могут вызывать развитие горизонтальной экскавации типа «галстука-бабочки» с селективными дефектами слоя нервных волокон носовых и височных квадрантов.
В таких случаях застой диска зрительного нерва развивается главным образом у его верхнего и нижнего полюсов.
Из-за близости гипоталамуса и гипофиза могут развиваться эндокринные аномалии и нарушение роста. У младенцев с распространяющимися на гипоталамус опухолями может развиться диэнцефальный синдром Russell: кахексия с исчезновением подкожной жировой клетчатки, ускоренное увеличение длины тела относительно веса и изменения личности с эйфорией и гиперактивностью. Следует производить общий осмотр и измерять антропометрические параметры младенца, а также интересоваться тем, как он набирает вес.
При битемпоральной гемианопсии может наблюдаться слайд-феномен полуполей. Когда полностью функционируют только носовые квадранты зрительных полей, отсутствуют и корреспондирующие точки обеих сетчаток. Сенсорная фузия становится невозможной, а моторная фузия не способна обеспечивать выравнивание глаз. Сначала состояние проявляется гетерофорией. Эзофория вызывает выпадение букв или слов. При экзофории буквы или слова кажутся продублированными. При слайд-феномене вертикальных полуполей ребенок теряет строчку в тексте, который читает. Такие дети жалуются не на диплопию, а на удвоение средних частей слов или объектов.
Для развития слайд-феномена полуполей не обязательно наличие полной битемпоральной гемианопсии, он может быть первым проявлением заболевания. Проявления патологии хиазмы перечислены в таблице ниже. Изредка первым симптомом опухолей хиазмы бывает светобоязнь.
Дополнительные методы обследования хиазмы. Дополнительные методы обследования включают в себя исследования эндокринной системы, нейрофизиологическое обследование и лучевые методы диагностики. При нейрофизиологических исследованиях может выявляться дефект перекреста (особенно у еще не говорящих детей); они также позволяют качественно и количественно оценивать нарушения зрительных функций. Магнитно-резонансная томография (МРТ) позволяет детально оценить анатомию хиазмы и окружающих ее структур. Компьютерная томография (КТ) может дать ценную информацию об опухолях и костных изменениях параселлярной зоны.
а) Гранулемы и хронические воспалительные процессы. Поражение хиазмы и окружающих структур может развиваться при аномалиях основания черепа, например, при лангергансоклеточном гистиоцитозе. Описан вариант этого заболевания, для которого характерны несахарный диабет и зрительные дефекты. Зона хиазмы также может поражаться при саркоидозе, ювенильной ксантогранулеме и псевдотуморе.
Поражение клиновидной пазухи. Синдром поражения хиазмы или даже быстро развившаяся слепота могут возникать вследствие формирования и роста мукоцеле, даже при отсутствии клинической картины заболевания клиновидной пазухи.
б) Хиазмальный неврит. Хиазмальный неврит характеризуется ухудшением зрения и битемпоральной гемианопсией. Большинство случаев заболевания связано с демиелинизирующим процессом, хотя Purvin et al. наблюдали мальчика с хиазмальным невритом на фоне инфекционного мононуклеоза. При МРТ определяется отек и повышение контрастности хиазмы.
в) Оптохиазмальный арахноидит. Оптохиазмальный арахноидит вызывает локальное утолщение паутинной оболочки в основании головного мозга, процесс может окружать хиазму и зрительные нервы и вызывать их сдавление. Туберкулезный менингит, кистозный эхинококкоз, цистицеркоз и грибковое поражение (особенно у ослабленных детей с иммунодефицитом) могут поражать супраселлярную цистерну и вызывать поражение хиазмы и окружающих структур. Хотя такая формулировка диагноза подразумевает, что для восстановления зрительных функций требуется хирургический лизис интракраниальных адгезий, эффективность оперативного лечения все еще не доказана. Сообщается, что в некоторых случаях оказались эффективными кортикостероиды и цитотоксические препараты. Вероятно, современные методы визуализации сделают диагноз оптохиазмального арахноидита анахронизмом.
г) Расширение третьего желудочка. При гидроцефалии расширение третьего желудочка может вызывать поражение хиазмы, развитие дефектов полей зрения и тяжелые нарушения зрения вследствие растяжения или сдавления зрительных нервов и хиазмы. Описано одностороннее ухудшение зрения вследствие прижатия одного зрительного нерва к внутренней сонной артерии.
д) Сосудистые мальформации. Аневризмы крайне редко являются причиной хиазмальных дефектов у детей. У детей внутричерепные аневризмы могут достигать больших размеров и сопровождаться поликистозом почек, коарктацией аорты и синдромами Marfan и Ehlers-Danlos. Множественные аневризмы (как правило, мелкие) также могут развиваться при «грибковых» аневризмах на фоне подострого бактериального эндокардита и болезни моямоя: поражаются, в основном, полушария головного мозга.
Локализованные в хиазме артериовенозные или кавернозные мальформации могут стать источником кровоизлияний и вызывать внезапное развитие хиазмальных дефектов зрения, сопровождающихся головной болью (называемые апоплексией хиазмы).
е) Лучевой некроз. Радиационные поражения хиазмы — нечастое, но тяжелое осложнение лучевой терапии. При наличии нарушений зрения диагностическим критерием считается увеличение контрастности хиазмы после введения гадолиния. Также может отмечаться увеличение размеров хиазмы. Эти рентгенологические изменения могут развиваться за несколько месяцев до развития нарушений зрения. В патогенезе этого состояния играет роль поражение капиллярного ложа. Риск лучевого некроза, как оказалось, увеличивается при одновременном сочетании с химиотерапией.
ж) Синдром пустого турецкого седла. При синдроме пустого турецкого седла субарахноидальное пространство расширяется и заполняет турецкое седло, а гипофиз распластывается по дну или стенкам седла. Иногда развиваются хиазмальные дефекты поля зрения. Пролапс хиазмы может вызываться расширением третьего желудочка, который выталкивает хиазму вниз в турецкое седло, или рубцеванием и контрактурами, втягивающими хиазму в седло. Расширение третьего желудочка и выпячивание хиазмы вниз особенно характерно для стеноза водопровода. Апоплексия гипофиза или хирургическое вмешательство в турецком седле может вызвать формирование спаек, тянущих хиазму вниз, в турецкое седло. Хотя псевдоопухоль головного мозга является наиболее частой причиной пустого турецкого седла, она, как представляется, не вызывает пролапс хиазмы в пустое турецкое седло.
Остальные причины поражения хиазмы подробно расписаны в последующих статьях на сайте.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021