Хилак форте или линекс что лучше взрослому
Пробиотики: деньги в унитаз или того хуже?
С ростом интереса к лечению природными средствами, растёт и популярность пробиотиков. В 2012 г. почти 4 млн взрослых американцев принимали пробиотики или пребиотики, что в 4 раза превышает показатель 2007 г. Пробиотики использовали в более чем 50 000 случаях госпитализации в 139 американских лечебных учреждениях в 2012 г. В одном только прошлом году американские потребители потратили, по приблизительным расчётам, 2,4 млрд долларов на пищевые добавки.
Однако недавно были опубликованы два исследования, в которых учёные из Израиля задаются вопросом: действительно ли столь широкое применение пробиотиков с целью улучшения общего самочувствия и восстановления микрофлоры кишечника после применения антибиотиков целесообразно.
Первое исследование показало, что бактерии из пробиотические микроорганизмы, содержащиеся в пищевой добавке, не способны колонизировать надлежащие отделы кишечника, и, предположительно, они могут миновать ЖКТ без всякого на него влияния. В другом исследовании, те же бактерии поселялись в кишечнике после курса антибиотиков, однако при этом наблюдалась задержка восстановления собственной микробиоты. Оба исследования, проведённые на здоровых добровольцах, были опубликованы в журнале Cell в октябре 2018 года.
Термин «пробиотики» означает «живые микроорганизмы, которые при их введении в адекватной дозе, способствуют полезны для здоровья организма-хозяина». Однако некоторые эксперты заявляют, что любые доказательства пользы, ограниченны незначительным количеством показаний, являются спорными, а их качество зачастую неудовлетворительно. Проведённый в 2018 г. Кокрановский анализ показал, что в данные 10 из 14 систематичного обзоров клинических исследований, были недостаточными для определения того, чтобы установить улучшают ли пробиотики состояние ЖКТ.
Казалось бы, что лучше дела должны обстоять у пациентов с диареей. Несмотря на то, что многие исследования свидетельствуют о том, что прием пробиотиков может предотвращать или лечить антибиотико-ассоциированную диарею и инфекцию Clostridium difficile, в других исследованиях (как детей, так и взрослых) не было отмечено эффектна при этих состояниях. Два последних, наиболее актуальных исследования, опубликованных в конце предыдущего года в журнале New England Journal of Medicine, не показали эффективности пробиотиков Lactobacillus rhamnosus для детей с гастроэнтеритом или желудочным гриппом.
Среди учёных и практикующих врачей, использующих бактериальную терапию, такая неопределённость «вызвала крайне большую путаницу», как заявляет Эран Элинав (Eran Elinav), доктор медицинских наук, профессор Института имени Вецмана в Реховоте (Израиль), ведущий автор нового исследования в опубликованного в Cell.
Оценка колонизации
В 2015 г. Элинав со своим коллегой Эраном Сегалом (Eran Segal), специалистом в области вычислительной биологии, продемонстрировали, что одна и та же пища может по-разному влиять на сахар крови у различных лиц, не страдающих диабетом, что частично зависит от микрофлоры их кишечника.
Эти учёные разработали метод прогнозирования пиков глюкозы в крови после приёма пищи, основанный на широком наборе клинических и лабораторных показателей, в т. ч. микробиоты стула. Прогнозируемуые изменения глюкозы в крови использовали для разработки персонализированного режима питания, способствующего снижению пиков глюкозы крови после приёма пищи. Впоследствии, данный подход зарегистрировали в качестве инновации в области питания.
Элинав и Сегал, в своей последней работе, предполагают, что наиболее эффективным средством восстановления микрофлоры кишечника является тот, который является персонализированным. В своём новом исследовании они, вместе с Замиром Хальперн (Zamir Halpern), главным терапевтом гастроэнтерологического института при медицинском центре Сураски в Тель-Авиве (Израиль), вновь рассмотрели основные вопросы, которые, как им кажется, они в недостаточной мере осветили в своих предыдущих работах: в какой степени пробиотики колонизируют кишечник человека и какой эффект они на него оказывают?
В первом исследовании девятнадцать здоровых добровольцев принимали либо представленную на рынке пробиотическую добавку с 11 штаммами, либо плацебо дважды в день в течение 4 недель. По словам Элинав, добавка включала 4 основных рода бактерий, используемых в пробиотиках по всему миру.
Не полагаясь только на исследования кала (что являлось обычной практикой при исследованиях кишечной микрофлоры), учёные также изучили участки на всём протяжении ЖКТ, как до, так и во время курса пробиотиков. С помощью колоноскопии и глубокой эндоскопии верхних отделов пищеварительного тракта учёные собрали пробы содержимого и слизистой оболочки кишечника, а также провели биопсию его ткани. Затем, пробы подвергли тщательному генетическому секвенированию для определения состава микробиоты, её фунционирования и экспрессии генов клеток кишечника организма-хозяина
Пробы оболочки кишечника, отобранные спустя 3 недели после начала курса пробиотиков, показали, что субъектов, принимавших антибиотики, можно разделить на 2 лагеря: «восприимчивых» и «резистентных». Восприимчивые добровольцы продемонстрировали значительное содержание пробиотических штаммов в оболочке кишечника, тогда как в кишечниках резистентных добровольцев значительной колонизации выявлено не было. У восприимчивых лиц также отмечали изменения индигенного микробиома и профиля экспрессии генов по всей длине кишечника, чего не отмечали у резистентных субъектов, а также в группе плацебо.
По словам Колин Келли (Colleen Kelly), врача-гастроэнтеролога и профессора Медицинской школы Уоррена Альперта Брауновского Университета, не привлечённой к данному исследованию, данная работа первой продемонстрировала, что у некоторых людей слизистая оболочка кишечника резистентен к пробиотической колонизации, «где и происходит всё действие».
Исходная естественная микробиом кишечника добровольцев во многом определяет, будут ли они восприимчивы или резистентны к пробиотикам. Интересно отметить, что в пробах кала не было обнаружено подобной разницы: как у восприимчивых, так и у резистентных субъектов выявили сравнимое количество пробиотических бактерий, причём большее количество бактерий было обнаружено в стуле добровольцев, получавших плацебо.
Согласно Элинав, данные результаты позволяют предположить, что «наш текущий подход к пробиотикам, вероятно, неправильный». Такая вариабельность между индивидуумами означает, что некоторые люди могут выиграть от приёма пробиотиков, а другие — нет.
Такой результат не удивителен, заявляет Роб Найт (Rob K, доктор наук, руководитель Инновационного микробиома при Университете Калифорнии (г. СанДиего), не принимавший участия в исследовании. Он отметил, что разные люди по-разному реагируют на те же самые продукты питания, лекарственные средства и патогены. «Это распространяется и на полезные организмы», — сказал он относительно данного исследования и добавил, что в предшествующей работе была выявлена аналогичная вариабельность.
Среди врачей и общественности сложилось мнение, что употребление внутрь «хороших» бактерий может вытеснить «плохие» бактерии и улучшить состояние кишечника даже у здорового человека. В большинстве опубликованных до сих пор клинических исследований на здоровых добровольцах не было выявлено значительных изменений микрофлоры кишечника. С публикацией исследования Института Вейцмана, заявление о пользе пробиотиков вызывает ещё больше сомнений, чем когда-либо. Келли говорит: «Идея того, что люди принимают пробиотики только для улучшения общего самочувствия может быть пустой тратой денег».
После антибиотиков
В своём втором исследовании учёные рассмотрели, что происходит в кишечнике, когда человек принимает пробиотики после курса антибиотиков. Двадцать один здоровый доброволец прошёл лечение антибиотиками широкого спектра (ципрофлоксацин и метронидазол) в течение одной недели. После чего они либо в течение 4-х недель, дважды в день принимали ту же добавку, что и в первом исследовании, либо аутологичный трансплантат фекальной микробиоты, представляющий образец собственной микрофлоры субъектов до приема антибиотиков, взятый с помощью эндоскопии верхней части ЖКТ, либо ничего и составляли группу контроля.
На этот раз никто из субъектов, принимавших пробиотики не был резистентен к колонизации. Антибиотики убили большую часть естественного микробиома, что позволило экзогенным штаммам распространиться. Однако за это пришлось заплатить: естественные бактерии кишечника восстанавливались в течение более длительного периода в группе, принимавшей пробиотики, по сравнению с группой контроля. Возврат к исходному показателю экспрессии генов клеток кишечника организма-хозяина также подавлялся в группе пробиотиков в течение шестимесячного периода последующего наблюдения.
Александр Хоруц (Alexander Khoruts), врач-гастроэнтеролог и руководитель медицинской программы по кишечной микрофлоре Университета Миннесоты, не принимавший участия в исследовании, заявил, что был удивлен, что пробиотики продемонстрировали вообще сколь-нибудь явный эффект, даже столь незначительный. Он отметил: «Я не ожидал, что эти микробы были активны настолько, чтобы повлиять на восстановление микробиома».
В основном, Хоруц занимается пациентами с инфекцией, вызванной C. difficile и с трудом поддающейся лечению, и едва ли не все его пациенты заявляют, что принимали пробиотики. Хотя он и не спорит с ними, а лишь подталкивает к употреблению большего количества ферментируемых продуктов питания, Хоруц всё же говорит, что доказательства, подтверждающие пользу применения пробиотиков, слабее, чем многие думают. «В своём литературном обзоре (хотя многие могут с ним не согласиться), я не обнаружил никаких убедительных доказательств, по меньшей мере в отношении инфекции C. difficile, о каком-либо положительном влиянии приёма пробиотиков», — заявляет врач.
Одним из значительных недостатков является очевидная нехватка рандомизированных исследований, предоставляющих данные по безопасности пробиотиков — именно эту тему поднимает системный обзор, представленный в журнале Annals of internal medicine.
Несмотря на результаты исследования Института Вейцмана, до сих пор неизвестно действительно ли приём пробиотиков во время или после курса антибиотиков замедляет восстановление естественного микробиома, и могут ли подобные пертурбации вызвать проблемы. Состав пробиотиков различен и, согласно Найту, исследователи вводили чрезвычайно высокую дозу. К тому же, дизайн исследования не включал анализ клинических результатов.
Тем не менее, длительные нарушения после курса антибиотиков связаны с рядом проблем со здоровьем, в т. ч. с инфекциями, ожирением, аллергией и хроническими воспалениями, заявляет Элинав. По его мнению, длительные нарушения, вызванные пробиотиками, исследованием которых занималась его команда, «потенциально могут привести к долгосрочным побочным эффектам у потребляющих их лиц».
Найт отмечает, что исследование проводили на здоровых добровольцах, которым вводили антибиотики только для целей научного исследования. В действительности же люди принимают антибиотики, страдая от какого-либо заболевания. Замедлят ли пробиотики восстановление естественной микрофлоры кишечника в этом случае?
«В этом исследовании абсолютно не рассматривается данный вопрос», — говорит Найт. — «В нём обсуждают введение антибиотиков здоровым субъектам, ситуация с которыми может в корне отличаться от клинической популяции пациентов».
Хоруц полагает, что ущерб от приёма большинства пробиотиков, вероятно, будет минимальным. Однако для него «и этого вполне достаточно, чтобы прекратить их назначение и задуматься над тем, чему верить. Полагаю, лечащий врач должен обладать здоровой степенью скептицизма в отношении заявлений, которые делают касательно подобных продуктов».
Применение результатов
Как и Хоруц, Келли занимается пациентами с инфекцией C. difficile, лечение которых затруднительно. В прошлом она советовала им принимать пробиотики, если лечение включало антибиотики. Ныне она стала сомневаться в таком подходе: «Правильно ли я поступаю? Выписывая им пробиотики, не замедляю ли я восстановление естественных бактерий?» Аналогично Найту, она полагает, что для окончательного решения вопроса необходимо провести исследование на клинической популяции. В настоящее время Американская гастроэнтерологическая ассоциация рекомендует «в целом, воздержаться от неизбирательного применения пробиотиков».
Тем не менее, в исследовании был и светлый момент. У субъектов, которым их собственную микрофлору пересаживали с помощью аутологичного фекального трансплантата, микрофлора возвращалась к состоянию до приёма антибиотиков и исходному профилю экспрессии генов клеток кишечника в течение нескольких дней, «что доказывает эффективность персонализированного подхода к вмешательству в микрофлору», — отмечает Элинав
Однако размножение аутологичной фекальной микробиоты может стать проблемой: необходимо собрать образцы, когда человек ещё здоров, и после хранить его в течение неограниченного срока. Но в этом случае, можно будет создать персонализированный банк пробиотических бактерий с индивидуально подобранными характеристиками.
Элинав полагает, что в не столь отдалённом будущем станет возможным использовать алгоритмы машинного обучения для индивидуального подбора специфических пробиотических штаммов для пациента на основании исходной микробиоты кишечника и профиля экспрессии генов, что повысит шансы оказания клинического эффекта пробиотиками. Так как вероятно, что универсальную пробиотическую колонизацию отмечают только после курса антибиотиков, такой подход применим только к лицам, не принимающим антибиотики.
Элинав также отмечает в результатах позитивный момент касательно торможения пробиотиками восстановления микрофлоры после антибиотиков. Почему бы не использовать комбинацию антибиотиков и пробиотиков для перезапуска экосистемы кишечника и, в идеале, лечения заболеваний, связанных с микрофлорой (например, воспаления кишечника), и даже ожирения? «Полагаю, это крайне перспективный и интересный аспект, требующий дополнительных исследований», — заявляет учёный.
Пробиотики для кишечника: список препаратов
Ребенок появляется на свет со стерильным кишечником, но уже к году состав микрофлоры совпадает со взрослым человеком. На протяжении жизни под влиянием питания, болезней и других факторов баланс микроорганизмов в пищеварительном тракте изменяется, но постепенно восстанавливается до нормальных концентраций. Иногда этот процесс затягивается. Тогда врач может рекомендовать пребиотики и пробиотики для кишечника.
Виды пробиотиков
Для восстановления кишечника применяют два типа лечебных средств. Пробиотики – это препараты, которые содержат полезные бактерии в высушенном или растворенном виде. Чаще всего это микроорганизмы из рода Lactobacillus и Bifidobacterium, которые в норме доминируют в пищеварительном тракте человека.
Пребиотиками называются вещества, необходимые для роста хорошей микрофлоры. В некоторых случаях без них можно обойтись, но после тяжелых болезней, лечения антибиотиками или отравления они ускорят восстановление за счет создания благоприятной среды для бактерий.
В пищеварительном тракте здорового взрослого человека обитает несколько десятков видов бактерий, но преобладают два типа микробов: бифидобактерии и лактобактерии. Другие находятся в меньшинстве. Поэтому выделяют следующие виды пробиотиков в зависимости от состава:
Восстанавливать нормальную микрофлору можно разными формами препаратов. Пробиотики выпускают в сухой форме, из которой перед применением самостоятельно готовят суспензию. Существуют готовые жидкие формы лекарства, которые удобно давать маленькому ребенку. Некоторые средства производят в капсулах в желатиновой оболочке. Она не повреждается в желудке и растворяется только в кишечнике. Это защищает бактерии от действия соляной кислоты.
Создание препаратов для решения проблем с пищеварением проходило в несколько этапов. Поэтому фармацевты выделяют несколько поколений пробиотиков:
Какой препарат подойдет в конкретном случае, должен решать врач с учетом состояния пациента, его возраста. Для взрослых требуется большая дозировка и кратность приема пробиотиков.
ТОП-10 лучших пробиотиков
В аптеках продается большое количество пробиотиков, из которых тяжело выбрать нужный препарат. Правильное решение – обратиться к врачу-гастроэнтерологу или терапевту, чтобы назначили лекарственное средство с хорошим эффектом.
Чтобы решить, какой из них лучше, можно ориентироваться на список ТОП-10:
Советы по выбору
Какой из перечисленных пробиотиков поможет справиться с проблемами пищеварения, зависит от заболевания. Если организму необходима помощь после курса лечения антибиотиками, лучше использовать комплексные препараты, где добавлен пребиотик. Он ускорит заселение бактериями слизистой кишечника.
Вне зависимости от названия, для взрослых походят препараты в виде порошка, капсул или раствора. Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
При использовании средств с пробиотическими эффектами, симптомы вздутия живота, урчания, метеоризм могут усилиться из-за процесса брожения. Но это проходит самостоятельно и не требует отмены терапии. Если на фоне приема пробиотиков появилась аллергическая сыпь, лечение прекращают.
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Нормальная микробная флора кишечника
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
Клинические особенности дисбактериоза
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз. Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
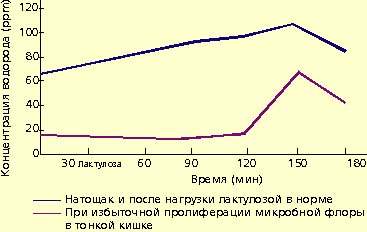 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
 |
Лечение
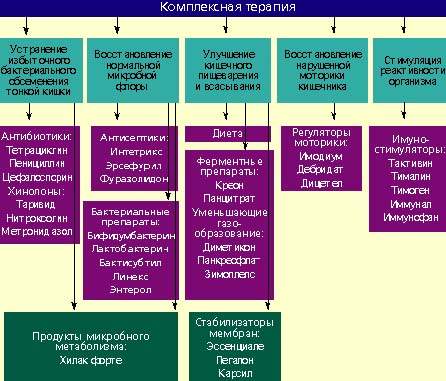
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.


