Химические процессы что такое
Химическая реакция
Из Википедии — свободной энциклопедии
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при котором ядра атомов не меняются, при этом происходит перераспределение электронов и ядер, и образуются новые химические вещества. В отличие от ядерных реакций, при химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов, так как ядра остаются прежними, а все изменения происходят в электронной оболочке.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
Химическая реакция
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Содержание
Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
По изменению степеней окисления реагентов
В данном случае различают
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Химические процессы что такое
54. ХИМИЧЕСКИЕ ПРОЦЕССЫ
Химический процесс – это совокупность процессов, обеспечивающих условия протекания химической реакции. Включают процессы транспортировки реагентов к зоне реакции, продуктов реакции из зоны реакции и др.
Явления, в результате которых не происходит изменения состава ядер атомов, но одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, называются химическими. Существуют различия между физическими и химическими явлениями. При физических явлениях изменяются физическое состояние или форма веществ или образуются новые вещества за счет изменения состава ядер-атомов (ядерные реакции).
Все химические реакции классифицируют по различным признакам.
1. По признаку изменения числа реагентов и продуктов реакции делят на следующие типы: соединения, разложения, замещения и обмена. Реакции, в результате которых образуется одно новое вещество из двух или нескольких, называют реакциями соединения.
Реакцией разложения называется реакция, в результате которой из одного вещества образуется несколько новых веществ.
Реакцией замещения называется реакция между простыми и сложными веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества.
Реакцией обмена называется реакция, в результате которой вещества обмениваются своими составными частями, образуя новые вещества.
2. По признаку выделения или поглощения теплоты. Те реакции, которые протекают с поглощением теплоты, называют экзотермическими:
N2(,)+O2(,)= 2NO(,), H0=180,8 кДж.
Реакции, протекающие с выделением теплоты, называют экзотермическими:
2H2 + O2 = 2H2O, H0 = – 571,6 кДж.
3. По признаку обратимости.
Обратимыми называют реакции, которые протекают во взаимно противоположных направлениях. Эти реакции характеризуются тем, что продукты прямой реакции могут взаимодействовать между собой, образуя исходные вещества (обратная реакция).
Необратимыми называют реакции, которые протекают только в одном направлении.
4. По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления – это условный заряд атомов в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
Степень окисления равна нулю у свободных атомов и атомов, входящих в состав неполярных молекул (Си, H2, N2).
2K+1Cl+5O3-2= 2K+1Cl-1+ 3O20,
C0+ 2Cu+2O-2= C+4O2-2+ 2Cu0
Окислительно-восстановительными реакциями называют реакции, протекающие с изменением степеней окисления элементов.
Примеры реакций, протекающих без степени окисления атомов:
Химические процессы



Возникновение структурной химии означало, что появилась возможность для целенаправленного качественного преобразования веществ, создания схемы синтеза любых химических соединений, в том числе и ранее неизвестных.
Характер любого химического соединения зависит не только от качественного и количественного состава, но и от взаимного влияния атомов и строения молекулы.
Структура вещества и его свойства
Вещества, имеющие одинаковый состав, но разное строение, называют изомерами,а само явление — изомерией.Например, формулу С4Н8O имеет 21 вещество.
Для описания свойств веществ нужно знать не только состав, но и структуру соединения. Особую важность это имеет для органической химии. Электроны одного химического элемента, взаимодействуя с ядром и электронами другого химического элемента, оказываются строго локализованными (размещенными) в пространстве. Так как электрон – это электромагнитная волна с определенной областью распространения, то эта область имеет направление. То есть химическая связь образуется в определенном направлении в пространстве и задает пространственную ориентацию атомов.
Структура молекулы – пространственная и энергетическая упорядоченность системы, состоящей из атомных ядер и электронов.
С пространственной структурой молекулы связано важное явление в органической химии, называемое изомерией.
Изомеры – вещества, имеющие одинаковый состав, но разную структуру молекулы.
Структурная химия стала более высоким уровнем по отношению к учению о составе вещества. При этом химия из науки преимущественно аналитической превратилась в науку синтетическую. Главным достижением этого этапа развития химии стало установление связи между структурой молекул и реакционной способностью веществ.
В твердом состоянии углерод может быть кристаллическим и аморфным и каждое его состояние имеет свое название.
Современная структурная химия достигла больших результатов. Синтез новых органических веществ позволяет получить полезные и ценные материалы, отсутствующие в природе. Так, ежегодно в мире синтезируют тысячи килограммов аскорбиновой кислоты (витамина С), множество новых лекарств, среди которых — безвредные антибиотики, лекарства против гипертонии, язвенной болезни и др.
Самым последним достижением структурной химии является открытие совершенно нового класса металлорганических соединений, которые за свою двухслойную структуру получили название «сэндвичевых» соединений. Молекула этого вещества представляет собой две пластины из соединений водорода и углерода, между которыми находится атом какого-либо металла.
Исследования в области современной структурной химии идут по двум перспективным направлениям:
1) синтез кристаллов с максимальным приближением к идеальной решетке для получения материалов с высокими техническими показателями: максимальной прочностью, термической стойкостью, долговечностью в эксплуатации и др.;
2) создание кристаллов с заранее запрограммированными дефектами кристаллической решетки для производства материалов с заданными электрическими, магнитными и другими свойствами.
3. Общая характеристика растворов
Физические свойства воды совершенно аномальны. Самое удивительное из них — это способность ее при нормальных условиях быть жидкостью. Молекулы похожих на нее химических соединений (H2S или H2Se) намного тяжелее воды, но при этих условиях газообразны.
Тройная точка воды, т.е. равновесие воды, льда и пара, наблюдается при температуре 0,01 °С и давлении 611 Па (рис. 8.1). Переохлажденная вода, т. е. остающаяся в жидком состоянии ниже 0°С, ведет себя странно: с одной стороны, плотность ее уменьшается при понижении температуры, с другой — приближается к плотности льда
В отличие от большинства других жидкостей при повышении температуры ее удельный объем уменьшается, а плотность увеличивается, достигая минимума (соответственно максимума) при 4 °С. В обычных жидкостях плотность всегда уменьшается с уменьшением температуры.
При замерзании объем воды увеличивается до 10 %. Плотность воды больше плотности льда. При плавлении кристаллов, когда регулярность упаковки ионов нарушается, плотность уменьшается на 2—4 %. Это свойство воды предохраняет водоемы от сплошного промерзания, спасая в них жизнь. Лед — плохой проводник теплоты.
Очень высока теплоемкость воды — при плавлении льда она увеличивается более чем вдвое. Поэтому моря и океаны являются гигантскими термостатами, сглаживая все колебания температуры воздуха. Кстати, эти же функции может выполнять и водяной пар в атмосфере. Отсутствие водяного пара в пустынях приводит к резким колебаниям ночной и дневной температур.
Вода – универсальный растворитель. Правило растворения – подобное растворяется в подобном.
Главное отличие воды — в водородных связях (рис. 8.2),
Комплекс молекул водысуществует в газообразном состоянии, в жидкой воде и во льду. Но, как установил Л. Полинг, лед не является кристаллом с полной упорядоченностью даже при О К. Структура льда достаточно рыхлая: каждая полость окружена шестью молекулами Н20, а каждая молекула — шестью полостями. Размер этих полостей таков, что в них может разместиться одна молекула, не нарушая каркаса водородных связей.
Вещество является кислотой, если оно диссоциирует в воде с образованием ионов водорода, и основанием, если способно в растворе присоединять ионы водорода или образовывать гидроксид ионы ОН. Кислотность или щелочность раствора характеризуется показателем рН, шкала которого охватывает значения от 0 до 14. Эта шкала логарифмическая, т.е. на ней отложены логарифмы концентрации водородных ионов. Кислотность раствора с рН 5 в 10 раз больше, чем с рН 6, и в 100 раз больше, чем с рН 7. Раствор с рН 6 содержит одну миллионную моля ионов водорода на 1 л, нейтральной среде соответствует рН 7, ниже идут более кислые среды, а выше — щелочные.
Химический процесс (от лат. processus— продвижение) представляет собой последовательную смену состояний вещества, представляющий собой непрерывное, единое движение. Процесс превращения одних веществ в другие вещества называется химической реакцией. Вант-Гофф, используя термодинамический подход, классифицировал химические реакции, а также сформулировал основные положения химической кинетики.
В каждой клетке идёт около 10 000 химических реакций.
Химические процессы подразделяются на:
гомо-и гетерогенные(в зависимости от агрегатного состояния реагирующих систем),
экзо-и эндотермические(в зависимости от количества выделяющейся и поглощаемой теплоты),
окислительно-восстановительные(в зависимости от изменения степени окисления вещества, связанной с переходом электронов от одних атомов (восстановитель) к другим атомам (окислитель).
Изучением скорости и особенностей протекания химических реакций занимается химическая кинетика.
На скорость химической реакции также влияют следующие условия и параметры:
1) природареагирующих веществ (например, щелочные металлы растворяются в воде с образованием щелочей и выделением водорода и реакция протекает при обычных условиях моментально, а цинк, железо и другие реагируют медленно и с образованием оксидов, а благородные металлы не реагируют вообще);
2) температура. При повышении температуры на каждые 10 °С скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа). Со многими веществами кислород начинает реагировать с заметной скоростью уже при обыкновенной температуре (медленное окисление). При повышении температуры начинается бурная реакция (горение);
3) концентрация.Для веществ в растворенном состоянии и газов скорость химических реакций зависит от концентрации реагирующих веществ. Горение веществ в чистом кислороде происходит интенсивнее, чем в воздухе, где концентрация кислорода почти в 5 раз меньше. Здесь справедлив закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ;
4)площадь поверхности реагирования.Для веществ в твердом состоянии скорость прямо пропорциональна поверхности реагирующих веществ. Железо и сера в твердом состоянии реагируют достаточно быстро лишь при предварительном измельчении и перемешивании: горение хвороста и полена;
5)катализатор.Скорость реакции зависит от катализаторов, веществ которые ускоряют химические реакции, но сами при этом не расходуются. В.Оствальд, исследуя условия химического равновесия, пришел к открытию явления катализа. Разложение бертолетовой соли и пероксида водорода ускоряется в присутствии оксида марганца (IV) и др.
Катализаторы бывают положительными, ускоряющими реакцию, и отрицательными (ингибиторы) — замедляющими ее. Каталитическое селективное ускорение химической реакции называется катализом и является приемом современной химической технологии (производство полимерных материалов, синтетического топлива и др.). Считается, что удельный вес каталитических процессов в химической промышленности достигает 80%.
Понятие о химическом процессе
Химико-технологическим процессом, как было показано выше, называют сочетание связанных друг с другом и проводимых в определенной последовательности химических, физико-химических, физических и механических операций с целью получения конечного продукта. Собственно химический процесс это вторая и главная подсистема ХТС. Эффективность его требует соблюдения некоторых условий, содержание которых определяется технологическим режимом.
Технологический режим– это совокупность параметров, обеспечивающих устойчивое и максимально эффективное проведение химического процесса.
Параметром технологического процессаназывают величину,характеризующую один из показателей режима работы аппарата. Как правило, параметр – это количественная величина, позволяющая дать количественную оценку работы аппарата. Основными параметрами химического процесса являются температура, давление, соотношение реагентов, их расход в единицу времени, время контакта, объемная скорость подачи сырья, активность катализатора, коэффициент рециркуляции, сила тока, напряжение и т.д. Сочетание оптимальных параметров позволяет вести процесс с максимально возможными выходом и качеством целевого продукта с высокой скоростью и минимальной себестоимостью.
Как было сказано выше, химический процесс составляет главную подсистему – химического превращения сырья. Он протекает в одну или несколько химических реакций, сопровождаемых явлениями массо- и теплообмена. Если процесс химического превращения протекает в одну стадию в соответствии со стехиометрическим уравнением, то его называют простым. Остальные реакции являются сложными. К ним можно отнести обратимые, цепные, параллельные, последовательные, сопряженные и другие реакции. Химические реакции классифицируются по ряду признаков:
— по фазовому состоянию реакционной системы (гомофазноеилигетерофазное);
— по механизму взаимодействия;
— по обратимости (обратимые и необратимые);
— по знаку теплового эффекта [экзотермические(+ 

— по применению катализатора (каталитические и некаталитические);
— по температуре (низкотемпературные и высокотемпературные);
— по порядку реакции.
Ниже представлена табл. 5.1 технологической классификации химических реакций.
Интенсификация гомогенных процессов.Если реакция протекает в объеме фазы, то она называется гомогенной. К гомогенным реакциям относят, например, реакции в растворах.В гомогенных системах реакция протекает во всем объеме реактора. Скорость реакции в таких процессах возможно интенсифицировать изменением состава реакционной среды, температуры и давления.
Влияние состава реакционной среды зависит от величины концентрации реагентов и их физико-химических свойств.
Известно, что, согласно закону действующих масс, для гомогенной реакции типа
aA + bB 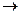
где (VA) – скорость химической реакции;
СА, СВ – молярные концентрации реагентов А и В;
А, В – исходные реагенты;
V – скорость реакции;
Таким образом, скорость реакции пропорциональна произведению концентраций реагентов, взятых в степенях, равным порядку реакции, на основе чего следуют выводы:
1) чем выше значение концентраций, тем больше скорость реакции;
2) скорость реакции в большей степени зависит от реагента, входящего в уравнение скорости с большей степенью;
3) если одновременно протекают реакции с разными порядками, то изменение концентрации сильнее скажется на скорости реакции с более высоким порядком.
Данные закономерности лежат в основе технологического приема – избытка одного из реагентов. При этом выгоднее в избытке брать реагент, входящий в уравнение реакции с более высоким стехиометрическим коэффициентом. Но существует ряд причин, по которым во многих газофазных и жидкофазных процессах реагенты разбавляют растворителем, т.е. понижая их концентрацию. Этому есть несколько причин:
а) возможность перегрева реакционной массы при проведении сильно экзотермической реакции с большой скоростью;
б) использование низких концентраций – требование селективного протекания сложных реакций, если побочная реакция более высокого порядка;
в) улучшения условий протекания сопровождающих реакцию физических процессов, т.к. разбавление позволяет понизить вязкость, облегчить равномерное перемешивание реакционной массы и ее транспорт, обеспечить более интенсивный и равномерный теплообмен.
Влияние температуры на скорость реакции описывается уравнением Аррениуса:
где k – константа скорости;
А – предэкспоненциальный множитель;
Е— энергия активации, кДж/моль;
Из этого уравнения следует, что, поскольку температура входит в показатель степени, то она оказывает очень большое влияние на скорость реакции. По этой же причине существенно влияние на скорость значения энергии активации, но с другим знаком.
Применяемый в химической технологии диапазон давлений очень широк. В нефтепереработке в большой части процессов давление составляет в пределах 1-5 МПа, но есть процессы с давлением до 32МПа (гидрокрекинг) и в вакууме (ректификация мазута). В нефтехимии известны процессы при давлении до 100Мпа (полимеризация этилена). Имеется несколько причин, по которым повышенное давление, несмотря на высокие энергозатраты, широко применяется в химической технологии:
1. Давление существенно повышает скорость газофазных процессов, т.к. в этом случае резко повышается концентрация реагентов.
2. Давление влияет на положение химического равновесия для обратимых реакций, при этом повышение давления смещает равновесие в сторону прямой реакции, если процесс протекает с уменьшением объема.
3. Давление повышает температуры кипения и плавления. Этот эффект используется для проведения процессов жидкой фазе для веществ, которые при стандартном давлении находятся в газообразном состоянии.
4. Повышение давления во многих случаях позволяет снизить температуру синтеза, что важно в системах с низкой термостабильностью реагентов или продуктов процесса.
Интенсификация гетерогенных процессов. Гетерогенные системы состоят из непрерывной (сплошной) среды и дискретной фазы, включающей один или более компонентов. Примеры таких систем приведены в табл. 5.2.
В гетерогенной системе областью химического взаимодействия являются поверхности раздела фаз.
Скорость гетерогенной реакции является сложной функцией параметров нескольких процессов, протекающих параллельно: массопередачи извне в реакционную среду, собственно химической реакции и выведения продуктов процесса из реакционного пространства.
Элементарные стадии гетерогенной реакции протекают с разной скоростью. При этом в условиях стационарного процесса скорости всех стадий будут одинаковы и равны скорости самой медленной стадии. Эту стадию называют лимитирующей. Поэтому, в гетерогенных процессах их интенсификация связана с ускорением лимитирующей стадии.
Для решения этой проблемы в теорию гетерогенных процессов введено понятие области протекания реакции. По этой теории гетерогенная реакция может протекать в кинетической, диффузионной или переходной (диффузионно-кинетической) области. Название этих областей связано непосредственно с лимитирующей стадией.
Типы дисперсных систем
Г – газ; Ж – жидкость; Т – твердое тело
Если лимитирующей стадией является химическое превращение, то говорят о кинетической области протекания процесса. К числу кинетических факторов относят температуру, давление, концентрацию реагентов и катализатора, природу и активность последнего и др.
Если лимитирующей стадией является скорость массопередачи, то реакция протекает в диффузионной области. Известно, что для процессов, протекающих в этой области, скорость пропорциональна площади границы раздела фаз и движущей силе процесса (изменению концентрации), под действием которой происходит массопередача:
где k – коэффициент пропорциональности;
S – площадь поверхности раздела фаз;

Из данного уравнения следует, что скорость процесса можно поднять, увеличив площадь соприкосновения фаз. Эта цель достигается измельчением твердого катализатора и развития его внутренней структуры (пористости). В системах с участием жидких продуктов для увеличения поверхности контакта применяют такие приемы, как использование насадочных устройств, барботаж, пенный слой и т.д. Значение константы скорости определяется следующим соотно-шением:
k = D/ 
где D – коэффициент диффузии;

С повышением температуры коэффициент диффузии возрастает, но в значительно меньшей степени, чем скорость химической реакции. Тем не менее, температурный фактор часто используется для повышения скорости диффузионных процессов. Более эффективным является прием интенсификации перемешивания контактирующих фаз, чем достигается уменьшение толщины диффузионного слоя, что приводит к резкому увеличению константы скорости процесса массопередачи.
Для увеличения движущей силы процессов массопередачи ( 
1) повышение концентрации компонентов сырья;
2) удаление продуктов процесса из реакционной зоны;
3) смещение равновесия в направлении, повышающем градиент концентрации 
Таким образом, к диффузионным факторам, определяющим интенсивность процессов массопередачи, можно отнести линейные скорости движения фаз, число оборотов перемешивающих устройств, характеристики границы раздела фаз и др. Поскольку диффузионные факторы во многом определены гидродинамикой потоков, то их часто называют гидродинамическими.
Если скорости массопередачи и реакции соизмеримы, то говорят, что процесс протекает в переходной области.
Проведение реакции в кинетической области (отсутствует диффузионное торможение) наиболее предпочтительно с точки зрения кинетики, однако ряд промышленных процессов реально осуществляют в диффузионной области. Это касается прежде всего высокотемпературных процессов, когда трудно избежать диффузионных торможений по причине высоких скоростей химических реакций.
Подводя итоги, можно сделать следующие выводы:
— скорость гетерогенной реакции определяется скоростью лимитирующей стадии;
— в качестве лимитирующих могут быть как процессы химического превращения, так и процессы массопередачи;
— для интенсификации гетерогенной реакции следует использовать как кинетические, так и диффузионные факторы;
— для интенсификации процессов, протекающих в кинетической области, следует применять кинетические факторы, а в диффузионной – диффузионные.
Интенсификация процессов, основанных на необратимых реакциях.К необратимым относят реакции, протекающие только в прямом направлении. При разработке технологии проведения такого процесса преследуют две основные цели: повышение скорости реакции и выхода целевого продукта. Выход продукта в таких процессах пропорционален степени пре При разработке технологии проведения сложной необратимой реакции все внимание уделяют повышению селективности процесса. Эта цель достигается подбором оптимальных концентраций реагентов и температур, а также подбором наиболее селективных катализаторов.
Селективность S реакции можно оценить соотношением скоростей основной и побочной реакций:
На основе данного уравнения можно сделать выводы о влиянии концентрации на селективность:
1) при a > b (порядок целевой реакции выше побочной) селективность пропорциональна максимальному значению концентрации;
Катализ – наиболее сильное воздействие на селективность реакции. Катализ – это сложная система реакций, в результате которых снижаются многие затруднения в протекании реакции по сравнению с некатализируемым процессом. Этот эффект связан с понижением энергии активации и / или увеличением предэкспоненциального множителя в кинетическом уравнении реакции.
Интенсификация процессов, основанных на обратимых реакциях.К обратимым относят реакции, протекающие одновременно в прямом и обратном направлениях.
В обратимой реакции aA + bB = dD в соответствии с законом действующих масс, скорости прямой и обратной реакций будут следующие:
где С – концентрация;
a, b, d –стехиометрические коэффициенты (порядки реакции) при участниках процесса A, B, D.
где КР – константа равновесия.
Степень превращения, при которой устанавливается равновесие, называют равновесной. В производственных условиях систему, как правило, не доводят до состояния равновесия, т.к. в состоянии равновесия производительность реактора равна нулю. Реактор работает в режиме, удаленном от состояния равновесия, в зависимости от стоимости затрат на смещение равновесия в направлении образования продуктов реакции.
Существуют реакции с легко смещаемым равновесием и с неблагоприятным положением равновесия, для которых приемлемая конверсия может составлять 30 % и даже меньше.
Смещение равновесия при изменении давления, температуры, концентрации подчиняется принципу Ле-Шателье, которое гласит: внешнее воздействие на систему с установившимся равновесием смещает его в сторону уменьшения этого воздействия.
В качестве примера действия принципа Ле-Шателье рассмотрим реакцию синтеза аммиака: 3Н2 + N2 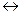
Такой же эффект можно получить при увеличении давления в системе. Действительно, повышая давление, мы увеличиваем концентрацию всех участников процесса, но увеличение концентрации реагентов будет более значительным, т.к. число молей исходных веществ больше, чем продуктов реакции. Движущей силой этого процесса является разность объемов конечных и исходных продуктов. Поэтому, в случае равенства объемов конечных и исходных продуктов сместить равновесие путем изменения давления в системе невозможно.
Влияние изменения температуры на смещение равновесия в данной реакции таково. Поскольку реакция экзотермическая, то сместить равновесие в направлении образования аммиака возможно путем понижения температуры процесса. Движущей силой в этом случае является абсолютная величина такого изменения температуры.
Принцип Ле-Шателье позволяет качественно оценить влияние основных параметров процесса на направление протекания обратимой химической реакции. Количественную оценку на смещение равновесия при изменении температуры или саму возможность протекания данной реакции при постоянном давлении (а именно при постоянном давлении в промышленных химико-технологических процессах, как правило, ведут химические реакции) можно, если известны знак и величина изменения в этом процессе свободной энергии Гиббса:
где Gнач. и Gкон. – значения свободной энергии Гиббса реагентов и продуктов процесса.
Отрицательное значение этой разности означает принципиальную возможность протекания реакции в прямом направлении. Чем больше абсолютная величина этой разности, тем больше движущая сила процесса.
где 

Ннач., Нкон., Sнач., Sкон. – состояния системы, отвечающие начальным и конечным значениям энтальпии и энтропии соответственно.
В соответствии с этим уравнением значение и знак 
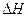

Согласно 1-му закону термодинамики:

Изменение энтропии в первом приближении можно оценить, учитывая, что ее можно рассматривать как меру беспорядка системы. Процессы, протекающие с его возрастанием (расширение газа, растворение, испарение, плавление, реакции разложения), которые протекают с увеличением объема, характеризуются возрастанием энтропии. Процессам, протекающим с уменьшением беспорядка (конденсация, кристаллизация, реакции присоединения, комплексообразования), соответствует уменьшение энтропии.
При выборе оптимальных параметров ведения технологического процесса в случае обратимых реакций, кроме термодинамических закономерностей следует учитывать и особенности процессов, связанных с их кинетикой. Характер влияния температуры на скорость и положение равновесия для обратимых экзо- и эндотермических реакций различен.
Для обратимой экзотермической реакции при малых степенях превращения, когда концентрация исходных продуктов в реакционной массе достаточно велика и мала концентрация продуктов реакции, обратимая реакция протекает, как необратимая. Поэтому с повышением температуры ее скорость возрастает. По мере увеличения концентрации конечных продуктов и снижения концентрации исходных, разность скоростей между прямой и обратной реакциями сокращается и наступает момент, когда они сравниваются и наступает равновесие, при этом технологический процесс прекращается. Чтобы этого не происходило, в непрерывных химико-технологических процессах при стационарном режиме имеет место непрерывная подача свежего сырья и непрерывный вывод продуктов процесса.
В обратимой эндотермической реакции при увеличении температуры скорость прямой реакции возрастает быстрее, чем обратной. В результате этого разность скоростей между прямой и обратной реакциями также возрастает.
На основе вышеизложенного можно обосновать выбор температурного режима химико-технологического процесса для обратимых реакций следующим образом:
1) поскольку в случае обратимой эндотермической реакции повышение температуры положительно влияет на оба критерия оптимизации (на скорость и на смещение равновесия), такую реакцию лучше проводить при постоянной повышенной температуре.
2) неоднозначное влияние температуры на критерии оптимизации обратимой экзотермической реакции требует использования режима понижающейся температуры: начинают процесс при более высокой температуре, а затем ее снижают по линии оптимальных температур. Такой прием применим для периодических процессов. В непрерывных процессах поддерживают постоянную температуру, т. к. нет явления накопления конечных продуктов и невозобновляемого расхода исходного сырья.
Контрольные вопросы
1. Объясните понятие «химико-технологический процесс».
2. Дайте определение понятия «технологический режим». Какие параметры его определяют?
3. Представьте классификацию реакций, определяющих основу ХТП.
4. Напишите уравнение закона действующих масс. Объясните с позиции этого закона влияние концентрации на приемы интенсификации гомогенных процессов.
5. Напишите уравнение Аррениуса. Объясните на основе этого уравнения влияние температуры и энергии активации на скорость химических процессов.
6. Объясните влияние давления на скорость гомогенных процессов. Какие давления по абсолютной величине применяют в химической технологии? Приведите примеры.
7. Приведите классификацию гетерогенных систем. Приведите примеры.
8. Назовите элементарные стадии гетерогенных процессов.
9. Дайте определение лимитирующей стадии процесса. В каких областях может протекать гетерогенная реакция?
10. От каких факторов зависит скорость гетерогенной реакции, протекающей в диффузионной области? Дайте соответствующее уравнение этой зависимости.
11. Что такое движущая сила процесса массопередачи? Как она влияет на скорость гетерогенных процессов? Как можно повысить градиент концентраций?
12. Дайте определение понятия «химическое равновесие». Как его можно нарушить? Принцип Ле-Шателье.
13. Напишите уравнение Гиббса. На его основе объясните принципиальную возможность протекания химической реакции и величину движущей силы процесса.
ТЕМА 6
ПРОМЫШЛЕННЫЙ КАТАЛИЗ
Современную нефтепереработку и нефтехимию в настоящее время без применения катализаторов представить невозможно. Около 90 % промышленных химико-технологических процессов ведут с применением катализаторов в качестве активаторов. В качестве примеров можно привести технологии производства аммиака, азотной и серной кислот, метанола, стирола, бутадиена, в нефтепереработке – это каталитический крекинг и риформинг, гидроочистка и гидрокрекинг, алкилирование изобутана и изомеризация парафиновых углеводородов, производство оксигенатов и т.д.
Каталитические процессы имеют ряд важных преимуществ, по сравнению с некаталитичес-кими. Кроме того, что применение катализаторов резко ускоряет скорости химических реакций, процессы с их применением могут быть организованы как непрерывные, безотходные, менее энергоемкие. Они отличаются высокими технико-экономическими показателями, обеспечивают более высокий выход целевых продуктов.
Применение катализаторов позволяет интенсифицировать химико-технологические процессы, а в ряде случаев осуществлять процессы, которые на практике без применения катализаторов не могут быть реализованы. Особое значение имеет применение катализаторов при обратимых экзотермических процессах, в которых использование катализаторов позволяет существенно снижать температуру процесса и добиться приемлемой степени превращения сырья.
Катализ является наиболее эффективным методом повышения скорости и селективности химических реакций. Понятие катализа включает сложную систему реакций, в результате которых снижаются энергетические, стерические и прочие затруднения на реакционном пути по сравнению с процессом без катализатора. В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ. Если реагенты и катализатор находятся в одной жидкой или газовой фазе, то это гомогенный катализ, если – в разных (газ – твердое тело или жидкость – твердое тело), то это гетерогенный катализ. Существует и гомогенно-гетерогенный катализ, когда начавшаяся на гетерогенном катализаторе реакция продолжается затем в объеме другой фазы.
Гетерогенный катализ
Этот вид катализа наиболее распространен в химической технологии. Он имеет ряд достоинств, например, простота разделения с продуктами процесса, высокая термостойкость, сравнительная легкость регенерации.
Каталитические гетерогенные реакции сопровождаются рядом явлений, связанных со свойствами твердых тел, неоднородных по химическому и фазовому составу. Важнейшую роль играют нарушения структуры (дефекты) кристаллической решетки катализаторов. Эти нарушения обуславливают энергетическую неоднородность поверхностных атомов и обеспечение определенной сорбционной способности поверхности катализатора. В целом эффективность применения катализаторов определяется комплексом его химических и физических свойств.
Химические свойства катализаторов. К основным свойствам катализаторов относятся активность (А), селективность (S) и производительность (П).
Активность (кг / м 2 ч) – общая скорость реакции на катализаторе и может быть рассчитана по формуле
А = Gп / F 
Весь цикл работы катализатора можно разделить на три периода:
1) разработка катализатора;
2) период постоянной активности – срок жизни катализатора;
3) дезактивация катализатора.
Под термином «разработка» понимают самопроизвольный рост активности катализатора под воздействием реакционной среды. Период постоянной активности для разных катализаторов может меняться в широких пределах: от нескольких минут до нескольких лет, требования к сроку жизни катализатора определяются стоимостью замены дезактивированного катализатора свежим и возможностью его регенерации. При высокой стоимости замены сокращение числа этих операций дает весьма ощутимый экономический эффект. Явление падения активности катализатора называют старением, утомлением или отравлением.
Старение – это естественный процесс, при котором активность уменьшается по всему слою катализатора. Утомление – это неравномерное падение активности в слое катализатора – опасный процесс, т.к. проявляется задолго до истечения срока жизни катализатора в результате неправильной его эксплуатации.
В числе основных причин дезактивации катализатора можно назвать следующие: зауглероживание, синтеринг, отравление контактными ядами и минерализацию.
Зауглероживание происходит в процессах переработки углеводородного сырья. Катализатор покрывается углеродистыми отложениями (коксом) в форме высоко-конденсированных ароматических структур, которые образуются в результате глубоких химических превращений. Среди подобных процессов можно назвать каталитический крекинг и риформинг, гидрокрекинг, дегидрирование и изомеризацию. Отложения кокса блокируют поверхность катализатора, вследствие чего его активность резко снижается за короткое время, которое иногда составляет 10-30 мин.
Синтеринг (спекание) обычно является результатом окислительной регенерации, во время которой температура катализатора достигает 600 о С и выше, либо следствием высокотемпературного процесса с плохо организованным теплоотводом. Спекание сокращает величину активной поверхности в результате укрупнения кристаллитов металлического или оксидного катализатора и повышает гидравлическое сопротивление аппарата. Поэтому одной из задач в решении этой проблемы является стабилизация структуры компонентов катализатора. Стабилизация осуществляется путем структурного промотирования. Таким промотором, например, при синтезе аммиака служит оксид алюминия Al2O3, который, внедряясь между кристаллами железа, предотвращает их агломерацию. Аналогичное действие оказывает на никелевый катализатор в процессе гидрирования углеводородов оксид хрома Cr2O3. Не менее важной является также стабилизация носителя, ибо он обеспечивает металлическому катализатору высокоразвитую поверхность.
Отравление – это частичная, либо полная потеря активности катализатора под действием веществ, называемые контактными ядами. При отравлении наблюдается специфическое действие яда по отношению и к катализатору, и к самой реакции.
Механизм отравления бывает различным. По действию на металлические катализаторы контактные яды можно разделить на три типа:
1) молекулы, содержащие неметаллы N, P, As, O, S, Se, в т.ч. и свободные элементы из этой группы, кроме азота, связывающие металл катализатора за счет неподеленных электронных пар (сероводород, тиофен, арсин, фосфин и др.);
2) отсоединения металлов (ионы ртути, свинца, висмута, олова, кадмия, железа и т.д.) с образованием интерметаллических соединений с участием d –электронов;
3) молекулы, содержащие кратные связи (СО, НСN и др.), с более высокими адсорбционными характеристиками, чем другие вещества реакционной массы.
Защиту катализаторов от контактных ядов ведут несколькими способами:
1) переводом яда в неактивное состояние;
2) очисткой сырья от контактных ядов на стадии его подготовки;
3) применением катализаторов, устойчивых к контактным ядам.


Примером второго способа защиты катализатора является предварительная гидроочистка бензиновых фракций от серо-, азот- и кислородсодержащих соединений перед направлением их на риформинг на платиновом катализаторе:
Приведенные выше реакции протекают на алюмо-кобальт-молибденовом катализаторе (АКМ).
Наиболее интересным и перспективным направлением является разработка каталитических композиций, стойких к ядам.
Указанные выше способы защиты катализаторов от ядов не являются независимыми друг от друга и поэтому могут применяться в одном процессе одновременно.
Еще одной причиной падения активности катализатора является отложение на его поверхности минеральных примесей, содержащихся в сырье. Эти примеси хемосорбируются, изменяя химический состав поверхности катализатора.
Селективность (избирательность) – важнейший показатель качества катализатора, который заключается в преимущественном ускорении целевой реакции в сравнении с побочными. Она измеряется величиной относительной скорости образования целевого продукта:
где VА – скорость образования целевого продукта, рассчитанная по реагенту А;
A=R – общая скорость реакции (активность).
Величина селективности может изменяться довольно в широких пределах, в зависимости от самого катализатора и от технологического процесса. Принято считать приемлемой селе