Химический плевродез что это
Химический плевродез что это
а) Терминология:
• Определение: склерозирование плевры химическим веществом, выполняемое для лечения пациентов с рефрактерным злокачественным плевральным выпотом и спонтанным пневмотораксом
• Используемые для химического плевродеза вещества:
о Тальк (гидратированный силикат магния)
о Блеомицин
б) Лучевые признаки:
• Рентгенография после плевродеза:
о Очаговое или многоочаговое диффузное утолщение плевры о Равномерное или узловое утолщение плевры
• КТ после плевродеза:
о Одностороннее равномерное или узловое утолщение задних/ базальных отделов плевры
о Равномерное или узловое утолщение плевры в междолевых щелях
о Повышенная плотность
о Осумкованная жидкость в плевральной полости
• ФДГ-ПЭТ/КТ после плевродеза:
о После выполнения плевродеза тальком в плевре выявляются участки поглощения ФДГ
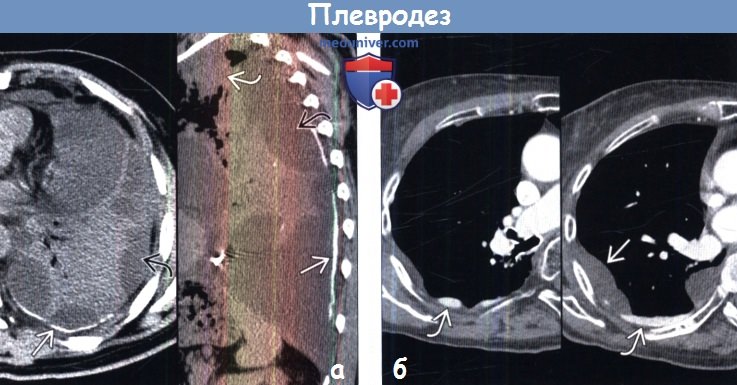
На совмещенных изображениях при нативной КТ в аксиальной (слева) и сагиттальной (справа) плоскостях после плевродеза тальком вдоль задних отделов плевры определяется гиперденсный материал. Тальк характеризуется повышенной плотностью при КТ.
(б) Пациент, страдающий раком легкого (не показано). На совмещенных изображениях при КТ с контрастным усилением вдоль задних отделов плевры справа визуализируются множественные участки повышенной плотности. Рядом с ними в плевральной полости выявляется осумкованная жидкость. 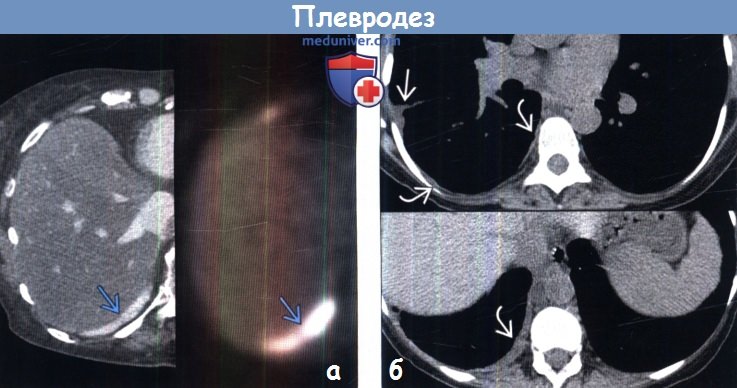
(б) Пациент, перенесший механический плевродез по поводу рецидивирующего пневмоторакса. На совмещенных изображениях при нативной КТ визуализируются множественные участки утолщения задних отделов плевры. Утолщение распространяется и на висцеральный листок плевры в главной междолевой щели справа.
в) Дифференциальный ряд наиболее частых заболеваний:
• Солидные метастазы в плевре
• Злокачественная мезотелиома плевры
• Туберкулез плевры
• Плевральная или экстраплевральная гематома
• Кальцифицированные плевральные бляшки
д) Диагностические пункты:
• При наличии после хирургического вмешательства гиперденсного узлового утолщения плевры следует заподозрить, что был выполнен плевродез
Редактор: Искандер Милевски. Дата публикации: 22.2.2019
Способ химического плевродеза при лечении пневмоторакса
Владельцы патента RU 2295333:
Изобретение относится к медицине, а именно к торакальной хирургии, и может быть использовано у больных при лечении пневмоторакса. Для этого в плевральную полость устанавливают дренаж, через который вводят специально приготовленный раствор. Данный раствор включает в себя хлоргексидин в концентрации не менее 0,05% и спирт этиловый в концентрации не менее 70 объемных процентов. После введения дренаж перекрывают не менее, чем на 1 час. Затем производят подключение к активной аспирации с давлением не менее 20 мм водного столба. Способ позволяет обеспечить более безопасную и надежную облитерацию плевральной полости за счет введения данного состава.
Изобретение относится к медицине, а именно к хирургии.
Известен способ облитерации плевральной полости с помощью плеврэктомии. Плеврэктомию выполняют на протяжении от II до VII межреберья. Рассекают плевру вдоль ребра электрокоагуляционным крючком или ножницами, отслаивают от подлежащих тканей и удаляют (Эндоскопическая хирургия под редакцией B.C.Савельева, Москва, 2001, стр.227).
Недостатком этого способа является его травматичность, а также риск повреждения межреберных сосудов.
Недостатком этого способа является дороговизна Блеомицетина и невысокий процент полной облитерации плевральной полости (46,2%).
Наиболее близким к заявляемому является способ химического плевродеза тальком.
После торакоцентеза с активной аспирацией экссудата до полного осушения плевральной полости, плевродез производится путем инсуфляции 5-10 мл стерильного талька. Плевральная полость дренируется 1-2 дренажами на 5-10 суток до прекращения экссудации (Д.Н.Пилькевич, Вторая научно-практическая конференция «Торакальная онкология», Тезисы докладов, п.Ольгинка, 2004, стр.50).
Недостатком этого способа является высокий риск такого осложнения, как эмпиема плевры, что делает этот способ достаточно опасным для его применения.
Техническим результатом изобретения является снижение стоимости процедуры и повышение клинической эффективности облитерации плевральной полости.
Технический результат достигается тем, что после выполненной торакоскопии по стандартной методике под эндобронхиальным наркозом, плевродез производится путем введения в плевральную полость, через установленный дренаж раствора антисептика группы бигуанидов, например хлоргексидина, в концентрации не менее 0,05% на спирте этиловом в концентрации не менее 70% спирте в объеме 20-30 мл. Дренаж перекрывают на 1-1,5 часа, затем подключают к активной аспирации, создавая отрицательное давление 20-30 мм водного столба. Дренаж удаляют через 3-5 суток после прекращения экссудации. Спиртовый раствор антисептика группы бигуанидов, например хлоргексидина, вызывает обжигающий эффект висцеральной и париетальной плевры, что приводит к асептическому воспалению в плевральной полости и впоследствии надежной ее облитерации.
Больной Е., история болезни №307/1. Диагноз: Рецидивирующий спонтанный пневмоторакс справа. Операция: Видеоторакоскопическое лигированние булл. Химический плевродез 16.01.2004.
Больной находился на стационарном лечении с 14.01.2004 по 30.01.2004. На 3 сутки экссудация прекратилась, дренаж удален. На контрольной R-грамме органов грудной клетки признаки облитерации правой плевральной полости. Больной выписан на амбулаторное лечение в удовлетворительном состоянии.
Использование предлагаемого способа является экономически выгодным, малотравматичным высокоэффективным способом химического плевродеза при лечении пневмоторакса и других заболеваний органов грудной клетки, что делает его наиболее значимым для практического здравоохранения.
Способ химического плевродеза, отличающийся тем, что в плевральную полость по дренажу вводят хлоргексидин в концентрации не менее 0,05% на спирте этиловом в концентрации не менее 70 об.%, при этом дренаж перекрывают не менее чем на 1 ч с последующим подключением к активной аспирации с давлением не менее 20 мм водного столба.
Химический плевродез при печеночном гидротораксе

Египетское общество болезней грудной клетки и туберкулеза
Egyptian Journal of Chest Diseases and Tuberculosis
(Египетский журнал болезней грудной клетки и туберкулеза)
Asem A. Hewidy a,*, Nasef Abdelsalam A. Rezk a, Ahmed Abdel-Razik b
a Отдел заболеваний грудной клетки, Университет Мансуры, Египет
b Отдел тропических заболеваний, Университет Мансуры, Египет
Получено 1 сентября 2015 г.; принято 5 октября 2015 г.
Доступно в режиме онлайн 20 октября 2015 г.
Реферат
Исходная информация: Лечение печеночного гидроторакса остается проблематичным, и можно рассматривать вопрос о химическом плевродезе.
Цели: Целью данного исследования является сравнение эффективности и безопасности химического плевродеза с помощью катетера малого диаметра с введением дренажной трубки при печеночном гидротораксе.
Методы: Рандомизированное клиническое исследование включало в себя 30 пациентов с печеночным гидротораксом, которые были приняты в Отдел заболеваний грудной клетки Больницы Университета Мансуры, Египет, с 2011 г. по 2014 г. Пациенты, у которых диагностировали экссудативный выпот, почечную недостаточность, гепатическую энцефалопатию, были исключены из исследования. Пациенты были разделены на 2 группы; группа A (20 пациентов), которым оказывали помощь посредством катетера малого диаметра, и группа B (10 пациентов) которым оказывали помощь посредством межреберной трубки, химический плевродез в обеих группах проводили с Вискум. Клинические, радиологические данные и продолжительность нахождения в больнице были утверждены таким образом, чтобы можно было проводить сравнение между обеими группами.
Результаты: Плевродез прошел успешно в группе A у 65% (13 пациентов) и в группе B у 70% (7 пациентов). Продолжительность нахождения в больнице была 10 дней для группы A и 11 дней для группы B. Боль в груди после проведения процедуры была меньше в группе A по сравнению с группой B, и это различие было статистически достоверным. Не наблюдали ни каких-либо серьезных осложнений, ни смертности.
Заключение: Катетер малого диаметра для химического плевродеза показал успешные результаты, меньшую боль в груди после проведения процедуры и минимальные осложнения при рефракторном печеночном гидротораксе.
© 2015 Авторы. Производство и размещение Elsevier B.V. от имени Египетского общества болезней грудной клетки и туберкулеза. Эта статья открытого доступа согласно лицензии CC BY-NC-ND
Введение
Печеночный гидроторакс определяют как плевральный выпот (более 500 мл) у пациентов с циррозом печени без первичных сердечных и легочных заболеваний [1,2]. Он представляет собой проявление декомпенсированного хронического заболевания печени, сходного с наличием асцитов, гепатической энцефалопатии или кровотечения из варикозно расширенных вен, его наиболее вероятным механизмом является прохождение асцитической жидкости из брюшной в плевральную полости через дефекты диафрагмы размером обычно менее 1 см, расположенные в сухожильной части диафрагмы [3].
Печеночный гидроторакс чаще всего расположен в правой стороне (вплоть до 85%) и связан с асцитами, начальное лечение предусматривает дренаж плеврального пространства путем торакоцентеза для диагностической оценки и для получения терапевтического эффекта. Рацион с ограничением натрия и разумное использование петлевых диуретиков с антагонистами рецепторов альдостерона (спиронолактона, 100 мг/день) могут обеспечивать уменьшение асцита и предотвратить развитие печеночного гидроторакса [4].
Традиционное лечение печеночного гидроторакса у пациентов, которые не отвечают на интенсивную терапию асцитов, остается проблематичным и противоречивым. Обзор литературы выявил, что в настоящее время нет идеального метода [5]. Целью данного исследования является сравнение эффективности и безопасности химического плевродеза с помощью катетера малого диаметра для химического плевродеза с традиционным химическим превродезом путем межреберного введения дренажной трубки.
Дизайн исследования
Это проспективное рандомизированное контролируемое испытание рассматривает две группы лечения рефракторного печеночного гидроторакса путем химического плевродеза с помощью катетера малого диаметра (группа A) и катетера большого диаметра (группа B). Клинические, радиологические данные и продолжительность нахождения в больнице были утверждены таким образом, чтобы можно было проводить сравнение между обеими группами. Пациентов отбирали случайным образом, используя метод закрытых конвертов.
Пациенты и методы
Это исследование включало в себя 30 пациентов с печеночным гидротораксом, которые были приняты в Отдел заболеваний грудной клетки Больницы Университета Мансуры, Египет, с января 2011 г. по август 2014 г. Одобрение Этического комитета было получено от местного Этического комитета. Пациенты подписывали свои согласия в письменной форме после детального разъяснения протокола исследования. В наше исследование включали пациентов с циррозом печени, портальной гипертензией, асцитами и рефракторным печеночным гидротораксом. В данном исследовании все пациенты не ответили на лечение медицинскими препаратами с различным медицинским контролем в виде ограничения натрия и жидкости, введения человеческого альбумина, проведения диуретической терапии и многократного терапевтического торакоцентеза. Пациенты, у которых диагностировали экссудативный выпот, туберкулез, карциному бронхов, злокачественный выпот, почечную недостаточность и гепатическую энцефалопатию, были исключены из исследования.
Для лучшего места проведения дренажа проводили полные лабораторные исследования, ультразвуковые исследования абдоминальной и трансторакальной части груди для обнаружения локализаций для лучшего места проведения дренажа. Обзорную рентгенограмму грудной клетки и КТ груди делали перед вмешательством и после него. Проводили аспирацию как плевральной жидкости, так и асцитической жидкости и отсылали для биохимического анализа, который включал в себя pH, ЛДГ, содержание белка и цитологический анализ, а также цитопатологическое исследование. ZN-окрашивание, окрашивание по Грамму и культуральные исследования выполняли в отношении аэробных и анаэробных микроорганизмов.
Пациенты были случайным образом разделены на 2 группы; группа A (20 пациентов), которым оказывали помощь с помощью вставки катетера малого размера, и группа B (10 пациентов) которым оказывали помощь с помощью вставки межреберной трубки. Химический плевродез в обеих группах проводили с Вискум (Вискум Фраксини 2®; ABNOBA Helmittel Gmbh-Германия), 5 ампул, разведенных в 100 мл 5% глюкозы.
В группе A катетер маленького диаметра (Angiocath 12-го размера, Lenacath, Haidylena Co., 6-го октября, Египет) вставляли в плевральную полость под трансторакальным ультразвуковым контролем и под местной анестезией, проводили дренаж плевральной жидкости 1,2–1,5 л/день до полной откачки жидкости. Катетер оставляли, пока дренаж жидкости не становился менее 100 мл/день. После полного расправления легких вводили лекарственное средство для плевродеза. Клапан катетера закрывали на 2 ч с вращением пациента во всех направлениях. Затем катетер открывали для отсасывания оставшейся жидкости. Катетер удаляли после полного расправления легких.
В группе B межреберную трубку (28F) вставляли в плевральную полость под трансторакальным ультразвуковым контролем и под местной анестезией, проводили дренаж плевральной жидкости 1,2–1,5 л/день, пока дренаж жидкости не становился менее 100 мл/день. После полного расправления легких применяли лекарственное средство для плевродеза к плевральной поверхности и пазухам. Трубку закрывали на 2 ч, затем открывали для отсасывания оставшейся жидкости и удаляли после полного расправления легких.
Легкая, не требующая применения лекарственных средств
Химический плевродез что это
Химический плевродез (ХП) – это процедура, направленная на создание сращения между париетальной и висцеральной плеврой, тем самым нивелируя наличие плевральной полости. Данный способ лечения успешно применяется в качестве предупреждения рецидива спонтанного пневмоторакса и накопления ПВ. Эффект адгезии плевральных листков достигается двумя основными способами: 1) физический, включающий прямое воздействие физических факторов на внутреннюю поверхность грудной клетки и на поверхность легкого; 2) химический, или медикаментозный, данный способ заключается в интраплевральном введении различных химических агентов с целью индукции асептического воспаления с последующим образованием плевральных спаек [1]. ХП получил повсеместное распространение благодаря своей малой инвазивности, так как для его осуществления достаточно установить катетер или дренаж в плевральную полость, через который будет введен плевросклерозант и осуществляться контроль за количеством отделяемой жидкости. Как было сказано выше, ХП показал эффективность в лечении рецидивирующих плевральных выпотов и рецидивирующего спонтанного пневмоторакса. В последнем случае индукция плевродеза способна окончательно предупредить развитие эпизода спонтанного пневмоторакса в будущем. В случае рецидивирующего или рефрактерного ПВ плевродез является симптоматическим лечением, не решающим основную причину накопления жидкости в плевральной полости.
Основными причинами рецидивирующего ПВ являются злокачественное поражение листков плевры, печеночный гидроторакс, застойная сердечная недостаточность, хроническая болезнь почек [2]. Злокачественный плевральный выпот (ЗПВ) является второй по частоте причиной экссудативного ПВ, уступая только парапневмоническому выпоту, который в отличие от первого редко требует проведения процедуры торакоцентеза [3]. Согласно литературным данным, ЗПВ диагностируется у 30% пациентов с раком легкого и в 7-11% случаев рака молочной железы [4]. Поскольку ЗПВ является отражением запущенного онкологического заболевания, зачастую с наличием метастатического поражения, радикальное лечение невозможно. Таким образом, ХП, как паллиативный способ лечения, весьма эффективная процедура предупреждения развития одышки, связанной с быстрой реаккумуляцией жидкости.
Основной причиной рефрактерного транссудативного ПВ является печеночный гидроторакс (ПГ). ПГ – это чрезмерное (>500 мл) скопление транссудата в плевральной полости у пациентов с декомпенсированным течением цирроза печени, при этом иные причины скопления ПВ исключены [5]. ПВ при хронической болезни почек (ХБП) является распространенным клиническим проявлением, особенно в терминальной стадии и у пациентов, находящихся на гемодиализе [6]. Накопление свободной жидкости в плевральной полости при ХБП статистически достоверно увеличивало смертность данной категории больных [7].
В результате ХП происходит образование постоянного сращения между висцеральной и париетальной плеврой, важным процессом при этом является образование спаек. К образованию плевральных спаек способно привести несколько путей, и воспалительный процесс является наиболее важным и общим механизмом плевродеза. Данный механизм включает образование и выход цитокинов, молекул клеточной адгезии, приводящих к запуску коагуляционного каскада и дисбалансу фибринолиза и фибриногенеза в пользу последнего. Таким образом, большинство плевросклерозантов являются местнораздражающими веществами, так или иначе вызывающими местный воспалительный процесс, который в конечном итоге приводит к образованию плевральных спаек [8]. Фактически, сам воспалительный процесс, помимо фибринообразования, приводит к таким побочным эффектам, как боль и температурная реакция организма. Тем не менее на сегодняшний день не существует легкодоступного и эффективного склерозирующего вещества, которое бы вызывало хороший проадгезивный, но не провоспалительный эффект. Считается, что идеальный склерозант должен обеспечивать прочное сращение плевральных листков при минимальном воспалении или даже в отсутствии последнего.
Хотя ХП активно используется в практике врача торакального профиля на протяжении многих лет, исчерпывающей информации о механизме действия различных химических веществ нет. Это относится, например, к йодповидону, который по-прежнему кажется интересным и многообещающим склерозантом, сочетающим в себе доступность, безопасность и эффективность [11]. При этом малоизученным остается вопрос эффективности ХП при транссудативных ПВ.
Цель исследования: оценить эффективность йодповидона в качестве агента для ХП в лечении пациентов с рефрактерными ПВ различной этиологии. Оценить безопасность применения йодповидона в процессе индукции плевродеза. Выявить общие признаки у пациентов, в случае которых ХП оказался не эффективным.
Материал и методы исследования
В данное исследование попали пациенты отделения торакальной хирургии Национального госпиталя при Министерстве здравоохранения Киргизской Республики. В период с сентября 2019 года по июнь 2021 года в отделении находилось 47 пациентов с ПВ различной этиологии, получивших йодповидон с целью ХП. При этом ни одному пациенту ранее процедур плевродеза не проводилось. Так как данное медицинское учреждение является ведущим в стране и процедур ХП здесь не проводилось, у всех пациентов было взято информированное согласие.
Были исключены пациенты с установленной гиперчувствительностью к препаратам йода, заболеваниями щитовидной железы, а также те, у кого имело место неполное расправление легкого после установления дренажа в плевральную полость, и пациенты с ожидаемым сроком жизни более 30 дней.
Разделение плевральной жидкости на транссудат и экссудат проводилось на основании лабораторных исследований жидкости и клинической картины заболевания. В некоторых случаях, когда цитологического исследования жидкости было недостаточно, была произведена торакоскопия с биопсией плевры для постановки окончательного диагноза.
Всем пациентам было произведено дренирование плевральной полости по Бюлау в VII межреберье по задней подмышечной линии трубкой fr24 для удаления жидкости и достижения полного расправления легкого. В течение 48-72 часов производился рентгенологический контроль, в случае полного расправления легкого следующим этапом являлась процедура индукции плевродеза. Одномоментно после постановки дренажной трубки эвакуировалось от 500 до 1500 мл жидкости, при объеме более 1500 мл жидкость удалялась поэтапно с целью предупреждения отека легкого и дислокации средостения.
С целью обезболивания интраплеврально вводилось 50 мл 1% раствора лидокаина, дренаж перекрывался у грудной клетки, экспозиция составляла 20 минут. Далее дренаж открывался с целью эвакуации анестетика, после удаления последнего через плевральную трубку вводилось 20 мл 10% раствора йодповидона с экспозицией 2 часа. После каждого введения медикаментов через торакостомическую трубку, будь то лидокаин или йодповидон, пациенту было рекомендовано совершать активные дыхательные движения и менять положение тела.
Эффективность плевродеза йодповидона оценивалась в уменьшении образования жидкости до 100 мл в сутки и в последующем удалении дренажной трубки. Истечение жидкости более 100 мл в сутки, повторное накопление ПВ после удаления дренажа расценивались как неудача. Контрольный осмотр, включающий клинический и рентгенологический осмотр, проводился через 1, 3 и 6 месяцев.
Статистическая обработка данных проводилась в программе IBM SPSS Statistics 22.0.
Результаты исследования и их обсуждение
У 18 пациентов (38,3%) на момент обращения имело место субтотальное или тотальное затенение гемиторакса, указывающее на массивный ПВ, таким пациентам эвакуация жидкости проводилась поэтапно, объем жидкости за первые сутки составил от 2500 до 4400 мл. В 28 случаях (59,6%) верхняя граница жидкости не доходила до переднего отрезка III ребра, а объем составил от 1000 до 2500 мл, в 1 случае (2,1%) жидкость располагалась ниже переднего отрезка V ребра и составила по объему менее 1000 мл.
На момент обращения у 8 пациентов (17,0%) имел место горизонтальный уровень жидкости, что указывает на наличие воздуха в плевральной полости, причиной стало нарушение техники торакоцентеза, состояние всех 8 пациентов расценивалось как тяжелое.
Причиной накопления жидкости в 22 случаях (46,8%) оказалось злокачественное заболевание, у 13 пациентов (27,7%) имел место цирроз печени, в 6 случаях (12,8%) диагностирована застойная сердечная недостаточность и также в 6 случаях (12,8%) хроническая болезнь почек.
Распределение пациентов по причине ПВ отображено в таблице.
Химический плевродез что это
ПВ – это патологическое накопление жидкости между листками плевры, которое происходит в результате нарушения баланса между её образованием и абсорбцией. При ХБП, согласно исследованиям O.J. Bintcliffe и соавт. (2016 г.), ПВ является весьма распространенным явлением, особенно у больных, находящихся на последней стадии данного заболевания, и у больных, получающих гемодиализ [1]. По мнению G.T. Kinasewitz (1997 г.), следует выделять два основных механизма образования ПВ при ХБП: 1. Развитие нефротического синдрома и, как следствие, снижение онкотического давления плазмы за счет протеинурии. 2. Гиперволемия, развивающаяся в результате нарушения экскреции жидкости и приводящая к повышению гидростатического давления в сосудах [2]. Согласно наблюдениям М.В. Шестаковой и соавт. (2011 г.), основной причиной возникновения ХБП во всем мире является сахарный диабет [3]. Согласно исследованиям E.M. DeBiasi (2015 г.) и S.P. Walker (2017 г.), у больных с ХБП при появлении ПВ статистически достоверно увеличивается смертность [4, 5].
ПВ при ХБП по своей природе является транссудатом, но в редких случаях терминальной стадии поражения почек может иметь место уремический плеврит, выпот при котором носит экссудативный характер [6]. Патогенез и лечение уремического плеврита до сих пор является вопросом до конца не решенным, последнее исследование H.M. Seo (2019 г.) показало успешное применение высоких доз преднизолона в лечении пациентки с двусторонним уремическим плевритом [7]. Медикаментозное лечение транссудативного ПВ при ХБП заключается в уменьшении потребления поваренной соли и жидкости, применение различных групп диуретиков, а также переливание раствора альбумина.
Хирургическая помощь пациентам с ПВ при ХБП имеет смысл только у пациентов, резистентных к медикаментозному лечению и проведению сеансов гемодиализа. Наличие одышки и рентгенологически подтвержденного ПВ является поводом для проведения периодического торакоцентеза, что, по мнению J. Nathan и соавт. (2011 г.), сопряжено с развитием таких осложнений, как пневмоторакс и эмпиема плевры [8]. Традиционно считается, что ведение пациентов с ПВ при ХБП сводится к лечению основного заболевания и периодической эвакуации выпота путем плевральной пункции, постановка дренажной трубки является нежелательной процедурой, которая приведет к неконтролируемой потере жидкости и вместе с ней белковых фракций и электролитов [9]. Возможно применение повторных терапевтических пункций плевральной полости при медленной реаккумуляции жидкости (меньше одного месяца). Одним из вариантов лечения является проведение процедуры химического плевродеза, который обширно применяется при злокачественном ПВ и спонтанном пневмотораксе [9, 10].
Химический плевродез (ХП) – процедура, направленная на создание асептического воспаления листков плевры с последующей их облитерацией, путем введения в плевральную полость различных химических агентов. Последние десятилетия данный вопрос активно изучается, и уже известно несколько эффективных веществ для успешного проведения данной процедуры. Условием возможности проведения ХП является полное расправление легкого, подтвержденное рентгенологически. Соответственно противопоказанием к данной процедуре является ригидное легкое или «панцирное легкое» и невозможность эвакуации плевральной жидкости при образовании осумкованных полостей.
Согласно работе А.П. Колесника и соавт. (2016 г.), наиболее распространенными агентами являются порошкообразный тальк, производные тетрациклина, блеомицин [11, 12]. Основными критериями для выбора вещества для ХП являются безопасность, доступность и эффективность. Несомненно, вышеописанные вещества удовлетворяют всем критериям, но для нашей страны проблемой является финансовая доступность данных препаратов. Практически все химические агенты вызывают неспецифическую воспалительную реакцию, развитие фибринозного плеврита, что ведёт к облитерации плевральной полости. Кроме того, тальк вызывает гистиоцитарную и гранулематозную реакцию как инородное тело. Таким образом, на эффективность процесса фибринообразования способно влиять одновременное с ХП применение гормональных препаратов и нестероидных противовоспалительных средств.
Наиболее доступными, но не менее эффективными с этой точки зрения являются такие вещества, как йодповидон и нитрат серебра [13, 14]. Малоизученным также является вопрос применения ХП при ПВ транссудативного характера. А.Л. Акопов и соавт. (2017 г.) поделились опытом применения блеомицина в качестве агента для ХП у пациентов с транссудативным ПВ при печеночной недостаточности, эффективность данной методики составила 86 % при минимальных побочных эффектах [15].
Цель исследования: провести оценку методики плевродеза, описанной С.А. Плаксиным (2014 г.). Оценить эффективность и безопасность применения йодповидона в лечении пациентов с транссудативным ПВ при ХБП.
Материалы и методы исследования
В отделении торакальной хирургии Национального госпиталя при Министерстве здравоохранения Кыргызской Республики в период с декабря 2019 по март 2021 г. находилось шесть пациентов с резистентным к медикаментозному лечению ПВ, осложнившим течение ХБП, четыре женщины и двое мужчин в возрасте от 47 до 82 лет. Все шесть пациентов длительно страдали сахарным диабетом, который в последующем осложнился ХБП, причем у двух пациентов сахарный диабет сочетался с застойной сердечной недостаточностью. Учитывая длительный анамнез основного заболевания, данные пациенты неоднократно получали консервативное лечение в эндокринологических и нефрологических отделениях. Несмотря на это, течение сахарного диабета осложнилось развитием ХБП. Двусторонний ПВ был диагностирован у четырёх пациентов (57,1 %), правосторонний характер накопления жидкости у двоих (28,6 %) и левосторонний у одного (14,3 %). Данным пациентам неоднократно производились пункции плевральной полости с эвакуацией жидкости от 600 мл до 3 л, на протяжении от трех месяцев до двух лет, интервал между торакоцентезами составил от двух недель до двух месяцев. Невзирая на проводимую медикаментозную терапию, направленную на восстановление онкотического давления плазмы крови и улучшение экскреторной функции почек, гидроторакс носил рецидивирующий характер.
Нами применялась методика плевродеза 10 % раствором бетадина (йодповидон) производства ЗАО «Фармацевтический завод Эгис» по лицензии фирмы «Мундифарма» (Швейцария) в сочетании с 40 % раствором глюкозы. Всем пациентам было произведено дренирование плевральной полости на стороне ПВ, при двустороннем гидротораксе постановка плеврального дренажа осуществлялась на стороне большего скопления жидкости. Основным требованием к проведению индукции плевродеза служило полное расправление легкого, что было подтверждено рентгенологическим исследованием.
Перед ХП, с целью обезболивания, интраплеврально было введено 50 мл 1 % раствора лидокаина. Из нашего опыта, введение 100 мл 1 % раствора лидокаина, предложенное в исследовании С.А. Плаксина, вызывало такие симптомы, как головокружение, нарушение координации движения, заторможенность сознания, повышенную жизнерадостность, снижение артериального давления и учащение пульса. По нашему мнению, объем в 50 мл не вызывает у пациентов симптомов, связанных с реабсорбцией лидокаина. После введения анестетика дренаж перекрывался, а пациенту было рекомендовано совершать активные дыхательные движения и менять положение тела, экспозиция составляла 20 мин, с последующим удалением анестезирующего средства. В это время подготавливался раствор для плевродеза, в одном шприце смешивалось 20 мл 10 % раствора йодповидона и 40 % раствора глюкозы в объеме 80 мл, после введения, дренаж перекрывался на 2 ч, при этом больному также было рекомендовано менять положение тела каждые 30 мин и увеличить дыхательную экскурсию грудной клетки.
Производился контроль отделяемой жидкости каждый день, при уменьшении ежесуточного объема до 100 мл дренаж из плевральной полости удалялся.
Контрольная рентгенография производилась через 1, 3 и 6 мес. Помимо индукции плевродеза все пациенты получали медикаментозную терапию под контролем эндокринолога и нефролога. Эффективность плевродеза оценивалась как рентгенологически, так и клинически.
Результаты исследования и их обсуждение
У трех пациентов (43 %) перед дренированием плевральной полости имел место субтотальный гидроторакс, рентгенологически затенение достигало переднего отрезка II и III ребра (рис. 1), у трех пациентов (43 %) уровень жидкости достигал IV и V ребра и у одного пациента (14 %) уровень ПВ был ниже V ребра. У всех пациентов имели место одышка разной степени, сухой кашель и тяжесть в грудной клетке, все симптомы были нивелированы после осушения плевральной полости.
Рис. 1. Рентгенограмма органов грудной клетки пациента А. Двусторонний гидроторакс. В прямой проекции слева отмечается субтотальное гомогенное затенение за счет большого количества жидкости, справа отмечается затенение в нижних отделах за счет малого объема жидкости
Ежесуточное отделение жидкости до проведения процедуры ХП составило от 300 до 950 мл. В момент введения химического агента болевой синдром не наблюдался у четырех пациентов (71,4 %), двое пациентов (28,6 %) отмечали болевые ощущения в одной половине грудной клетки, оценка проводилась по визуально-аналоговой шкале (ВАШ) и составила 6 и 8 баллов соответственно. Болевые ощущения были купированы однократным введением нестероидных противовоспалительных средств. В последующие 72 часа у одной пациентки отмечалось однократное повышение температуры тела до 39 °С без каких-либо дальнейших последствий.
Средняя продолжительность нахождения дренажной трубки в плевральной полости составила 3,43 дня. Объем жидкости в динамике уменьшился до 100 мл, после чего плевральная трубка была удалена. На контрольных рентгенограммах на стороне проведения ХП легкое полностью расправлено, жидкости в плевральной полости нет (рис. 2).
Рис. 2. Динамика рентгенологического снимка пациента А. В прямой проекции отмечается положительная динамика в виде полного расправления левого легкого, жидкости нет
На данный момент не все шесть пациентов прошли три контрольных осмотра, но эффект в виде отсутствия скопления ПВ на стороне ХП был достигнут у всех шести пациентов, что составило 100 %. Каких-либо поздних осложнений после проведения ХП у больных не наблюдалось.
Ведение пациентов с ХБП в терминальных стадиях, осложнившейся появлением ПВ, является вопросом сложным и до конца не решенным. Известно, что появление жидкости в плевральной полости у больных с ХБП значительно увеличивает смертность [4, 5].
Пункция плевральной полости с последующей эвакуацией ПВ является паллиативным видом помощи, эффективно устраняющим одышку, но не решающим проблему основного заболевания. Также с каждой порцией удаляемой жидкости из организма выводятся белковые фракции, что ведет к развитию порочного круга [16]. Дренирование плевральной полости также не является выходом из этой ситуации, так как ведет к постоянной потере жидкости и несет дополнительные осложнения в виде возможного развития эмпиемы плевры [2].
Химический плевродез – весьма эффективный способ борьбы с рецидивирующими злокачественными ПВ и в качестве завершающего этапа операции при буллезной болезни легких [9, 10]. Несмотря на широкую освещенность данного вопроса, в нашей стране нет опыта применения данного вида лечения в отношении транссудативных ПВ. Традиционным лечением больных с транссудативными ПВ является лечение их основного заболевания, но это не всегда дает значимый эффект, а состояние больных с каждым торакоцентезом способно ухудшаться.
В данной статье представлены результаты лечения шести пациентов с транссудативным ПВ, который развился на фоне ХБП. В качестве плевросклерозанта был выбран йодповидон, который при попадании в плевральную полость вызывает ожог ее листков и дальнейшую их адгезию между собой. Основным преимуществом йодповидона является его доступность и безопасность. Что касается его эффективности, то согласно исследованиям, он уступает таким агентам, как тальк, производные тетрациклина и нитрат серебра.
В литературе имеется ограниченное количество информации о применении йодповидона и глюкозы в качестве средств для ХП, а их применение при транссудативном ПВ является вопросом не затронутым. В нашем исследовании прекращение скопления ПВ было достигнуто во всех шести случаях (100 %). Большинство пациентов при этом не испытывали болевых ощущений, а температурная реакция наблюдалась только в одном случае. Такие распространенные плевросклерозанты, как тальк, тетрациклин, нитрат серебра, йодповидон, являются местно-раздражающими средствами и их фибриногенный эффект появляется опосредованно через воспалительный процесс. Несмотря на многолетний опыт применения ХП при рецидивных ПВ и спонтанном пневмотораксе, поиск химического вещества продолжается по сей день. Идеальным средством будет вещество, обладающее хорошим проадгезивным свойством и с отсутствием провоспалительного эффекта.
Заключение
1. Введение 50 мл 1 % раствора лидокаина перед индукцией плевродеза является эффективным способом обезболивания и не оказывает эффектов, связанных с его всасыванием.
2. Раствор йодповидона и глюкозы может успешно применяться у пациентов с транссудативным плевральным выпотом при ХБП. Данная методика отвечает всем критериям, предъявляемым к плевросклерозантам: эффективность, доступность и безопасность.