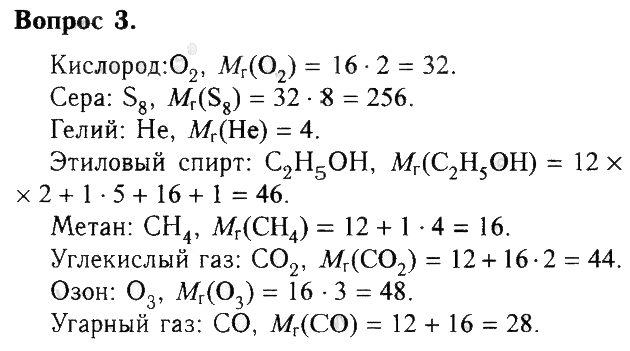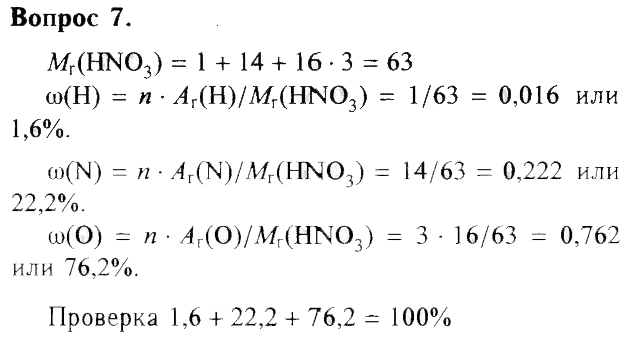Химия 8 класс что означают записи 3h 2h2o 5o2
Что означают записи: 3H; 2H2O; 5O2.
Вопросы:
1. Что означают записи: 3H; 2H2O; 5O2?
2. Запишите формулу сахарозы, если известно, что в состав её молекулы входят двенадцать атомов углерода, двадцать два атома водорода и одиннадцать атомов кислорода.
3. Используя рисунок 2 (см. с. 5), запишите формулы веществ и рассчитайте их относительные молекулярные массы.
4. Какой форме существования химического элемента кислорода соответствует каждая из следующих записей: 3O; 5O2; 4CO2?
5. Почему относительная атомная масса элемента и относительная молекулярная масса вещества не имеют единиц измерения?
6. B каком из веществ, формулы которых SO2 и SO3, массовая доля серы больше? Ответ подтвердите расчетами.
7. Вычислите массовые доли элементов в азотной кислоте HNO3.
8. Дайте полную характеристику глюкозы (C6H12O6, используя пример описания углекислого газа CO2 (см. с. 42).
Ответы:

Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Химическая формула
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H 2 SO 4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H 2 SO 4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10 −10 м и масса m = 19.94∙10 −27 кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Например: Ar(Mg) = 24,305
Относительная молекулярная масса (ОММ)
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
Определим ОММ, например:
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797
32) и путём сложения вычисляем Mr(H2S).
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10 −23 г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙10 23 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 10 24 молекул хлора?
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г /моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 10 23 структурных единиц.
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
Задача 7. Какую массу составляют 18.06 ∙10 23 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна