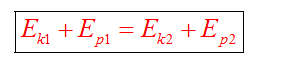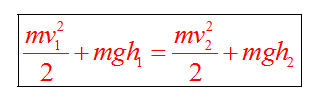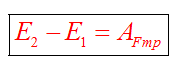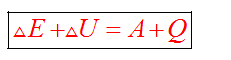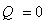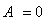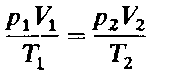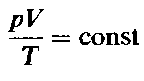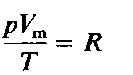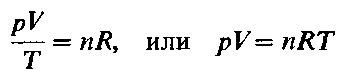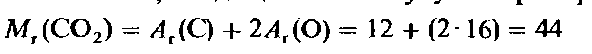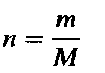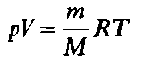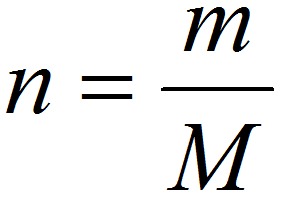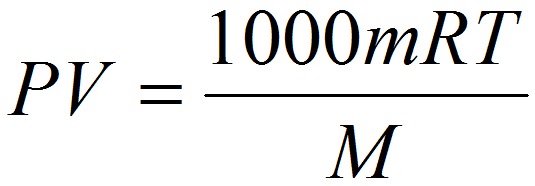Химия что нужно знать
ОСНОВЫ ХИМИИ ДЛЯ ЧАЙНИКОВ
Приветствую Вас на HIMI4KA.RU – образовательном ресурсе, посвященному изучению химии для тех, кто раньше не учил, либо подзабыл основы этого увлекательного предмета. Если вы думаете, что данная наука вам не по зубам, то имейте в виду: выдающийся русский ученый Дмитрий Иванович Менделеев оставался в школе на второй год, а в гимназии, так вообще имел по химии тройку. Но это не помешало ему стать блестящим химиком с мировым именем.
Безусловно, Менделеев стал известным ученым не за один день, а за долгие годы изучения химии с нуля, выполняя различные опыты и эксперименты, читая десятки учебников, и заучивая наизусть сотни формул и определений. А ведь раньше не было интернета и за книгами необходимо было идти в библиотеку, где приходилось часами стоять в очереди, чтобы получить заветный «гранит науки». И это было не единственной сложностью на пути к знаниям, потому как данная научно-естественная наука тогда только зародилась, и в ней бытовали многие ошибочные теории и гипотезы. Другими словами, учебники по химии того времени могли не только не дать новых знаний, но еще и обучить ошибочным, поэтому приходилось многие теории проверять на практике. Тем не менее, несмотря на все трудности обучения своего времени, Д.И. Менделеев добился того, что стены любого кабинета химии и лаборатории украшает его наследие.
Понять суть и выучить основы химии достаточно просто, хотя многие незаслуженно считают ее трудной и скучной наукой. На самом деле все сложные реакции и превращения описываются простыми закономерностями, в основе которых лежат законы физики и базовые математические соотношения. Главное — это желание и стремление: чем больше стремление — тем больше знаний вы получите. Причем это правило относится к любому делу, за которое вы беретесь. Еще на процесс обучения влияет отношение преподавателя к предмету и материал, который он преподносит. Если преподаватель не горит желанием донести знания до обучающихся, следовательно, время будет проходить впустую. Но это не беда, ведь всегда можно почитать уроки химии дома, используя книги и учебники, однако, если материал будет подан в неверной последовательности или основы химии в нем будут изложены чересчур научным языком, то толку от такого обучения будет мало, не так ли? Поэтому сайт «Химия для чайников» будет вам невероятно полезным в обучении химии с нуля!
САМОУЧИТЕЛЬ ПО ХИМИИ
Предлагаемый вашему вниманию Самоучитель — не обычный учебник по химии. В нём не просто излагаются какие-то факты, не просто описываются свойства веществ, как в обычном пособии. Этот курс по изучению химии объясняет и учит, особенно в тех случаях, если вы не можете или стесняетесь обратиться за разъяснениями к учителю. Данный самоучитель в виде рукописи использовался с 1991 г. школьниками, и не было ни одного ученика, который бы «провалился» на экзамене по химии и в школе, и в вузах. Большинство из них начинало с «нуля»!
Курс рассчитан на самостоятельную работу ученика. Главное, чтобы вы отвечали по ходу чтения на те вопросы, которые встречаются в тексте. Если вы не смогли ответить на вопрос, — читайте внимательнее ещё раз: все ответы имеются рядом. Желательно также выполнять все задания которые встречаются по ходу объяснения нового материала, а также задания ЕГЭ, которые взяты из реальных сборников ФИПИ разных лет издания. В этом вам помогут многочисленные обучающие алгоритмы, которые есть в каждой части Самоучителя по химии.
В интерактивном учебнике приведены, в основном, схемы химических реакций. Коэффициенты нужно расставлять самим, даже если об этом не сказано в задании. В конце каждого урока имеются упражнения, вопросы и задачи, которые проверяют степень усвоения предложенного материала. Если вы смогли, не подглядывая в текст урока, ответить на эти вопросы, сделать все упражнения, решить все задачи — замечательно. В противном случае ещё раз перечитайте урок. В последних уроках самоучителя приведены также способы решения базовых задач по химии. В случае затруднений при решении задачи, условие которой имеется в конце главы, найдите эту задачу среди задач для самостоятельного решения в уроках 29–32, а потом посмотрите, как решается такая задача.
Изучив данный Самоучитель, вы сможете легко ответить на многие вопросы ЕГЭ и просто понять и, возможно, полюбить этот непростой, но очень интересный предмет ХИМИЯ.
Урок 1. Основные понятия и законы предмета «Химия»
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
В этом определении встречаются такие понятия, как «вещество», «молекула», «атом». Разберём их подробнее.
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Выше приведены молекулярные формулы двух веществ. Следует отметить, что далеко не все вещества состоят из молекул, так как существуют вещества, которые состоят из атомов или ионов. Например, алмаз состоит из атомов углерода, а обычная поваренная соль — из ионов Na + и ионов Cl – (условная «молекула» — NaСl).
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
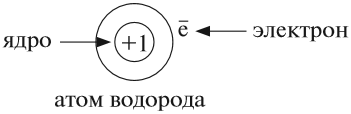
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
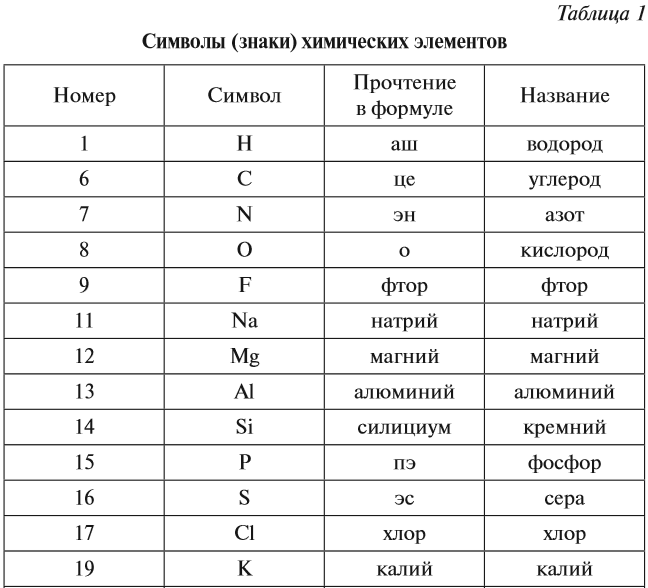
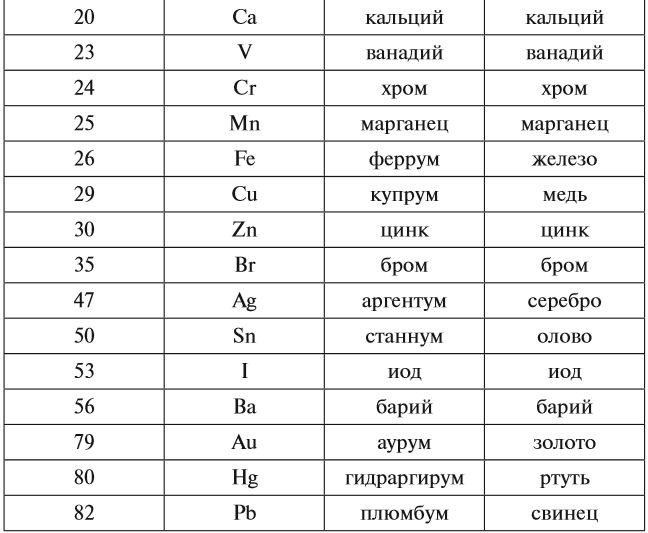
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
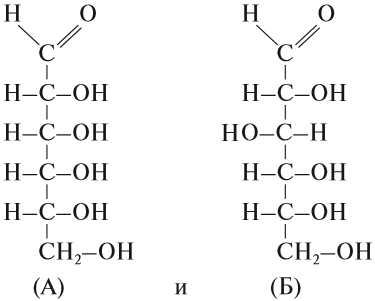
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
* В 2002 г. появилось сообщение о существовании ещё одного простого вещества кислорода — O4.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
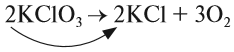
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
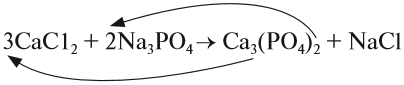
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
4. Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Основные понятия химии
Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки.
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Валентность — количество химических связей, которое образует один атом.
Молекула — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав (плотность, агрегатное состояние, температуры плавления и кипения и т. п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменяться под действием определённых условий. Результатом является превращение одного вещества или веществ в другие вещества.
Агрегатные состояния а веществ— состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw. Существуют и другие агрегатные состояния, например, жидкие кристаллыw или конденсат Бозе — Эйнштейнаw.
Моль — мера количества вещества, содержащая Число Авогадроw (NA ≈ 6,02 × 1023) любых структурных частиц. (NA — количество атомов в 12 граммах углерода 12Cw.)
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является Периодическая система химических элементовw, первоначальный вариант которой был разработан Д. И. Менделеевым в 1869—1871 годах.
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Относительная атомная масса — масса (а. е. м.) 6,02 × 1023 молекул простого вещества, где а. е. м. — атомная единица массыw.
Относительная молекулярная масса — масса (а. е. м.) 6,02 × 1023 молекул сложного вещества. Численно равна молярной массе, но отличается размерностью.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристаллаw как целого. Химическая связь определяется взаимодействием между заряженными частицамиw (ядрамиw и электронамиw).
Полимеры — высокомолекулярные соединения, молекулы которых состоят из повторяющихся фрагментов (структурных звеньев).
Степень полимеризации — число структурных звеньев, входящих в состав макромолекулы.
Гомополимеры — полимеры, образованные из одинаковых по составу и строению мономеровw.
Мономер — низкомолекулярное вещество, образующее полимер в реакции полимеризацииw.
Сополимеры — полимеры, образованные из двух и более мономеров.
Сополимеризация — реакция полимеризации с участием двух или более различных мономеров.
Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность».
Изомерия — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомеры — соединения, обладающие одинаковым элементарным составом, но различным химическим строением.
Химическое равновесие — это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Тепловой эффект реакции — это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым — реакции разложения.[1]
Катализатор — это вещество, которое изменяет скорость химической реакции, но количественно при этом не расходуется и в состав продуктов не входит.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Теплота — количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Тепловой эффект — выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
Внутренняя энергия системы — суммарная энергия внутренней системы, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической и потенциальной энергии системы, как целого.
Энтальпия — это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
Стандартная энтальпия (теплота) образования сложного вещества — тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (= 298 К и давлении 101 кПа).
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Скорость гомогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скорость гетерогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.[
Термодинамика — раздел науки, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц — термодинамические системы.
Термодинамическая система — некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям.
Первый закон термодинамики — для изолированной системы (для которой исключен любой материальный или энергетический обмен с окружающей средой) внутренняя энергия постоянна.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называется эквивалентной массой (mэкв).
Эквивалентную массу соединения можно определить по его химической формуле, например,
m экв(оксида) = М (оксида)/(число атомов кислорода*2);
m экв(основания) = М (основания)/число гидроксильных групп;
m экв(кислоты) = М кислоты/число протонов;
m экв(соли) = М соли /(число атомов металла*валентность металла).
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который гласит, что химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
m1/m2=Мэкв1/ Мэкв2, где
где m1 и m2 — массы реагирующих или образующихся веществ, m экв1 и m экв2 — эквивалентные массы этих веществ.
Основные законы химии
Закон сохранения массы веществ
Закон сохранения массы теоретически был описан в 1748 году, а экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной.
В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова.
Закон сохранения массы веществ формулируется так:
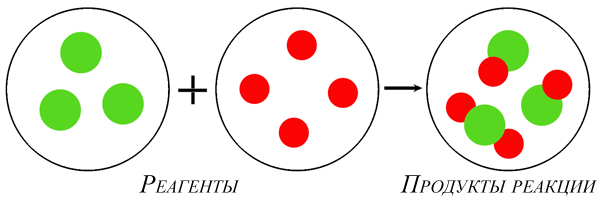
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
Модель химической реакции
На основе закона сохранения массы веществ проводят количественный химический анализ.
Приведём пример. Составим химическое уравнение реакции разложения воды:
Число атомов кислорода слева от стрелки, т.е. до реакции, меньше в два раза, чем справа, т.е. после реакции. Для уравнивания количества веществ до и после реакции, нужно поставить коэффициент 2 перед формулой воды в левой части уравнения:
Закон постоянства состава
Закон постоянства состава впервые сформулировал в 1808г. французский учёный-химик Жозеф Луи Пруст.
Закон постоянства состава формулируется так:
Вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими коэффициентами, например Н2О, НCl, СН4, СO2, С2Н5ОН.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
Массовая доля элемента ωЭ показывает, какую часть составляет масса данного элемента от массы всего вещества, где
n – число атомов;
ArЭ – относительная атомная масса элемента;
Mr – относительная молекулярная масса вещества.
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов и пр.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава:
Состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Периодический закон
Периодический закон сформулирован Д. И. Менделеевым в году. К этому времени было известно химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу. Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
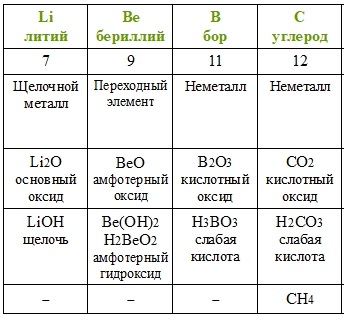
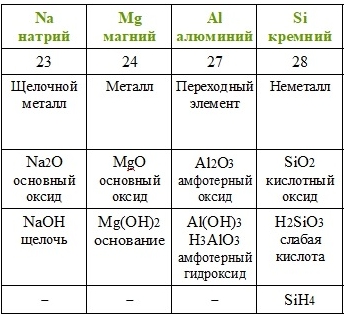
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
Закон сохранения массы
Закон сохранения энергии можно представить в виде:
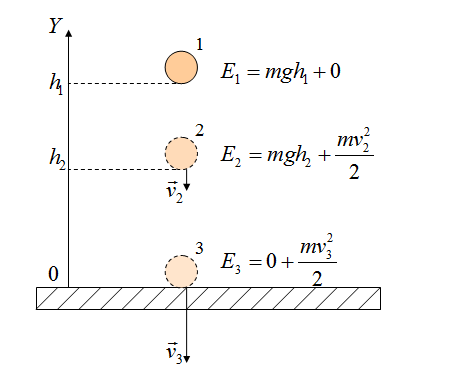
Если между телами действуют силы трения, то закон сохранения энергии видоизменяется. Изменение полной механической энергии равно работе сил трения.
Полные механические энергии равны между собой
А куда потом исчезает кинетическая энергия? Исчезает бесследно? Опыт показывает, что механическое движение никогда не исчезает бесследно и никогда оно не возникает само собой. Во время торможения тела произошло нагревание поверхностей. В результате действия сил трения кинетическая энергия не исчезла, а превратилась во внутреннюю энергию теплового движения молекул.
При любых физических взаимодействиях энергия не возникает и не исчезает, а только превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид:
Изучая тепловые процессы, мы будем рассматривать формулу
При исследовании тепловых процессов не рассматривается изменение механической энергии, то есть
В механике процессы теплопередачи не принимают во внимание, то есть
Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1 /2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Например, молярные массы эквивалентов простых веществ:
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Р o = 1 атм.; Т о = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Для кислорода эта величина составляет
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде
Закон кратных отношений
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
Пример: Относительная атомная масса водорода и кислорода соответственно равна 1,00794 и 15,9994, откуда следует, что соотношение масс атомов водорода и кислорода составляет 1 : 16. В молекуле воды H2O содержится два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2 : 16 или 1 : 8.
Соотношение атомных масс элементов в соединениях устанавливает закон постоянства состава, вывел его в начале XIX в. французский химик Жозеф Луи Пруст (1754-1826) на основании анализа химических соединений.
Его современная формулировка такова:
Каким бы способом ни было получено вещество, его химический состав остается постоянным
Отсюда следует, что если два или несколько простых веществ соединяются с образованием некоторого сложного вещества, то и массовое отношение реагирующих веществ постоянно для данного продукта. Так, при взаимодействии водорода и кислорода могут быть получены вода H2O и пероксид водорода H2O2; очевидно, что не только в самих продуктах массовое отношение водорода и кислорода равно соответственно 1 : 8 и 1 : 16, но и массовые отношения реагентов будут такими же.
На основании закона постоянства состава и закона кратных отношений английский исследователь Джон Дальтон (John Dalton, 1766-1844) в 1807 г. высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов.
Закон кратных отношений, открытый Дальтоном, гласит:
Если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Закон кратных отношений является фактическим объединением закона сохранения массы и закона постоянства состава на базе атомной гипотезы строения вещества.
Закон объемных отношений (закон Гей-Люссака)
Закон объёмных отношений впервые сформулировал в 1802 г французский учёный-химик Жозеф Луи Гей-Люссак.
Закон объёмных отношений формулируется так:
Объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся продуктов реакции как небольшие целые числа.
При этом подразумевается, что давление и температура неизменны.
Другими словами, стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объёмных отношениях реагируют и получаются газообразные вещества.
При взаимодействии 2 объёмов водорода и 1 объёма кислорода образуются 2 объёма водяного пара.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро:
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ – плотность г аза,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях, на основании отношения молярной массы М к объему моля:
Из этого уравнения можно определить молярную массу газа:
Следствия из закона Авогадро
Из закона Авогадро вытекают два важных следствия.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л. Этот объем называют молярным объемом
Следствие 2 из закона Авогадро. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью
Объединенный газовый закон
Реальные газы обычно хорошо подчиняются законам идеальных газов при давлениях, менее или несущественно превышающих атмосферное, и при температурах близких к температуре окружающей среды или более высоких. Поэтому законы идеальных газов находят широкое применение в природопользовании, в частности при расчетах количества, состава газов, выделяющихся при горении, и в других технологических процессах, сопровождаемых их образованием.
Объединенный газовый закон можно также записать в другой форме:
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
Объединенный газовый закон для одного моля газа приобретает вид:
где Vm- объем одного моля газа. Для п молей газа получается уравнение:
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемш уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода.
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает:
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
Уравнение Клайперона—Менделеева (для идеального газа)
n – число молей газа;
P – давление газа, Па;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева записывается в виде:
Из уравнения Клапейрона-Менделеева следует три закона:




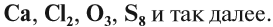

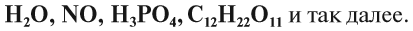




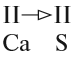
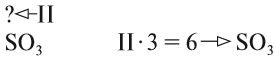

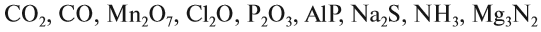
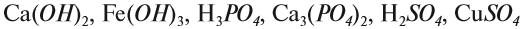
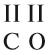
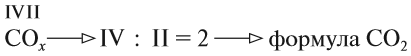
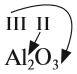
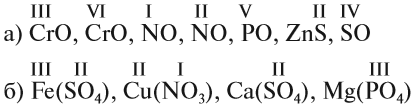

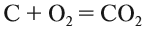
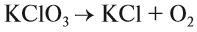
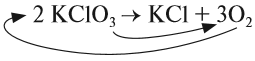
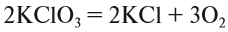
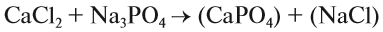
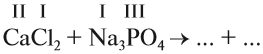
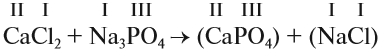
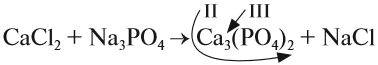
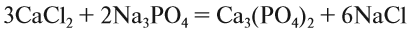
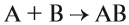
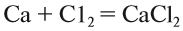
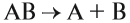
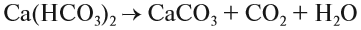

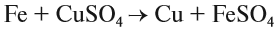
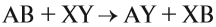
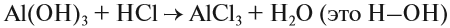
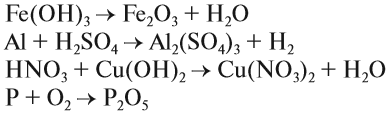


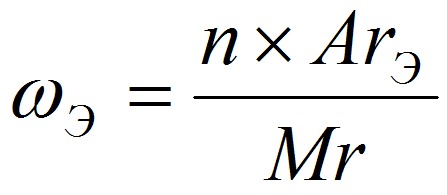
.png)
.png)