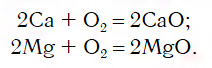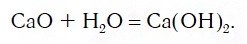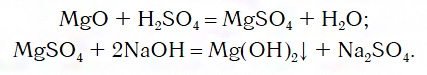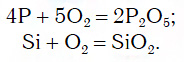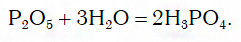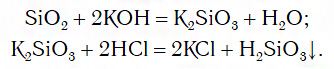Химия что с чем реагирует и что получается
Основные термины и понятия
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
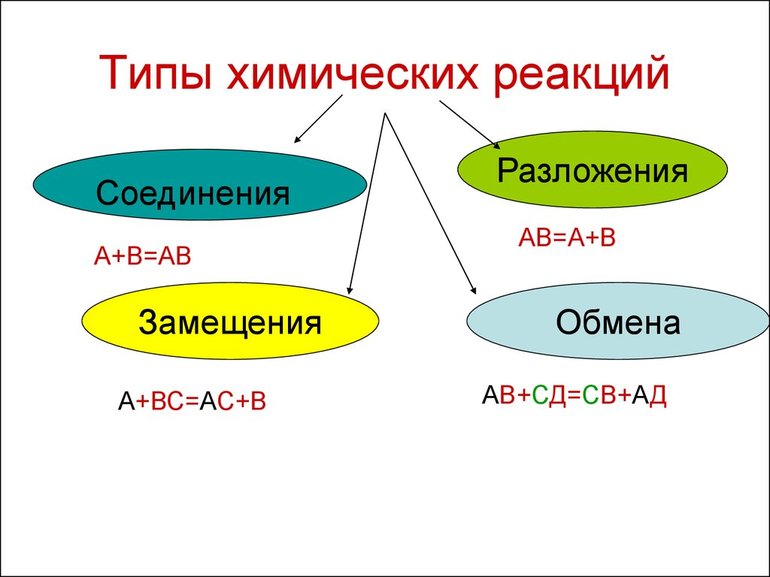
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
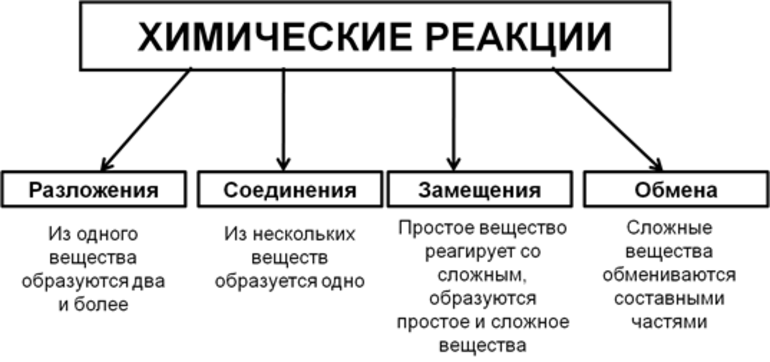
Всего существует 4 типа химического взаимодействия веществ:
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
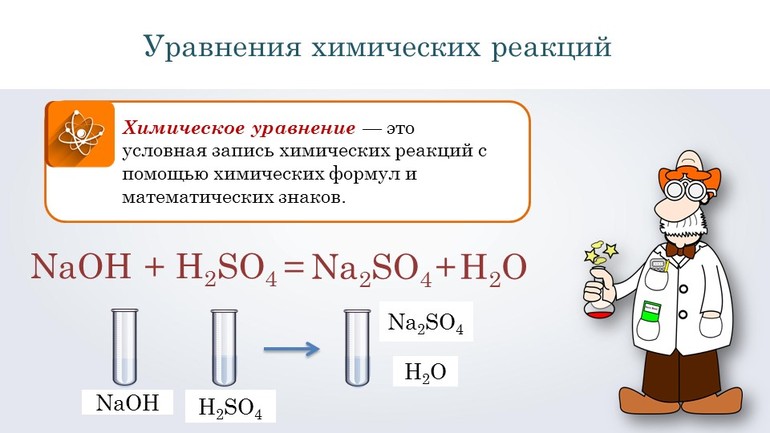
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Урок 42. Взаимосвязь между классами неорганических веществ
В уроке 42 «Взаимосвязь между классами неорганических веществ» из курса «Химия для чайников» мы подведём итоги проделанной работы, повторим пройденное и выясним, как связаны классы неорганических веществ.
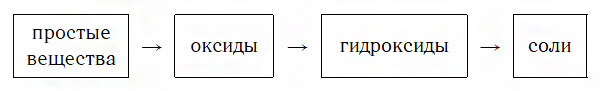
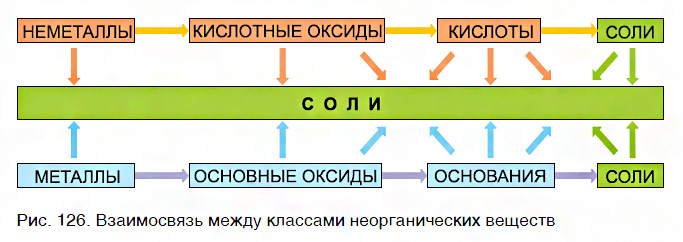
Вы уже знаете, что многие простые вещества — металлы и неметаллы — соединяются с кислородом, образуя основные и кислотные оксиды. Например, металл кальций при этом окисляется до основного оксида CaO, а неметалл фосфор — до кислотного оксида P2O5. Вам также известно, что основные и кислотные оксиды, присоединяя воду, превращаются в гидраты оксидов, или гидроксиды, которые делятся на основания и кислородсодержащие кислоты. Так, вышеуказанный оксид кальция в результате гидратации образует гидроксид — основание Ca(OH)2, а оксид фосфора(V) превращается в гидроксид, являющийся кислотой H3PO4. Гидроксиды же, реагируя с другими веществами, образуют соли. Последовательность всех перечисленных превращений можно изобразить в виде общей схемы, в которой переходы от веществ одних классов к веществам других классов условно изображены стрелками:
Из этой схемы видно, что простые вещества, оксиды, гидроксиды и соли последовательно, «порождая» друг друга, образуют ряд взаимосвязанных между собой веществ.
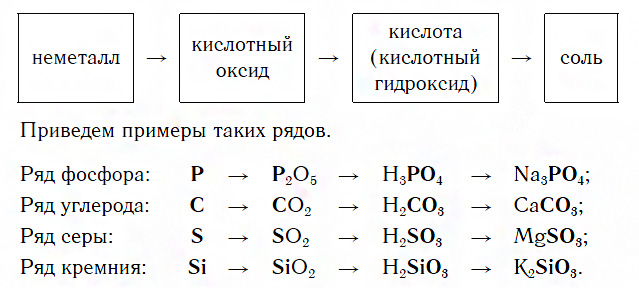
Известны два типа таких рядов — ряды металлов и их соединений и ряды неметаллов и их соединений.
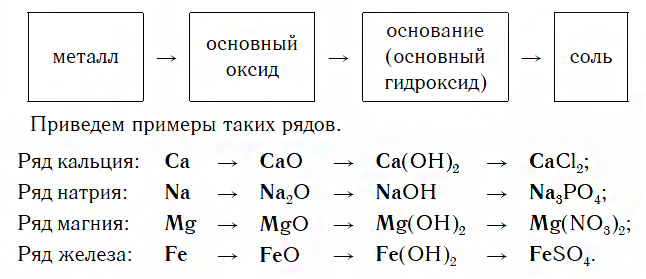
Ряды металлов и их соединений
Каждый такой ряд состоит из металла, его основного оксида, основания и любой соли этого же металла:
Для перехода от металлов к основным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от основных оксидов к основаниям в первых двух рядах осуществляется путем известной вам реакции гидратации, например:
Что касается последних двух рядов, то содержащиеся в них оксиды MgO и FeO с водой не реагируют. В таких случаях для получения оснований эти оксиды сначала превращают в соли, а уже их — в основания. Поэтому, например, для осуществления перехода от оксида MgO к гидроксиду Mg(OH)2 используют последовательные реакции:
Переходы от оснований к солям осуществляются уже известными вам реакциями. Так, растворимые основания (щелочи), находящиеся в первых двух рядах, превращаются в соли под действием кислот, кислотных оксидов или солей.
Нерастворимые основания из последних двух рядов образуют соли под действием кислот.
Ряды неметаллов и их соединений
Каждый такой ряд состоит из неметалла, кислотного оксида, соответствующей кислоты и соли, содержащей остаток этой кислоты:
Для перехода от неметаллов к кислотным оксидам во всех этих рядах используются реакции соединения с кислородом, например:
Переход от кислотных оксидов к кислотам в первых трех рядах осуществляется путем известной вам реакции гидратации, например:
Однако вы знаете, что содержащийся в последнем ряду оксид SiO2 с водой не реагирует. В этом случае его сначала превращают в соответствующую соль, из которой затем получают нужную кислоту:
Переходы от кислот к солям могут осуществляться известными вам реакциями с основными оксидами, основаниями или солями.
Эта схема отображает взаимосвязь между различными классами неорганических соединений и объясняет многообразие химических реакций между ними. Они постоянно происходят в природе и широко используются в практической деятельности людей.
Краткие выводы урока:
Надеюсь урок 42 «Взаимосвязь между классами неорганических веществ» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Неорганическая химия
Ни одна вещь не возникает, не уничтожается, но каждая составляется из смешения существующих вещей или выделяется из них. (Анаксагор)
Неорганическая химия изучает свойства и реакции неорганических соединений (т.е., кроме органических соединений углерода). Число неорганических веществ приближается к 400 тысяч.
Разделы страницы по химии неорганических соединений:
О %nbsp;свойствах химического элемента вы можете почитать, указав его в таблице Менделеева.
Когда появились молекулы?
Стюарт Кауфман из Института системной биологии в США и его коллеги Давид Еленфи и Габор Ваттаи из Будапештского университета в Венгрии построили модель формирования молекул на разных стадиях развития Вселенной, которая воспроизводит наблюдающееся сегодня распределение соединений в межзвездной и межгалактической среде. Так как количество возможных соединений растет быстрее экспоненты в зависимости от количества атомов, то авторы ограничились только рассмотрением общей массы образующихся молекул.
За основу ученые взяли базу данных PubChem, в которой содержится информация о 90 миллионах различных молекул, большинство из которых встречаются в природе. Масса наибольшего количество соединений составляет 290 дальтон, что примерно соответствует 24 атомам углерода. Эти данные ученые сравнили с содержанием веществ в Мурчисонском метеорите — древнем теле, появившемся во времена формирования Солнечной системы около 5 миллиардов лет назад. В нем было обнаружено не менее 58 000 различных молекул, распределение которых по массам напоминает полную базу данных, но больше всего молекул с массой около 240 дальтон.
Затем авторы привлекают теорию образования молекул, согласно которой есть два основных пути их формирования: посредством случайного скапливания атомов, которое быстро порождает всевозможные легкие комбинации, и предпочтительного присоединения, которое медленно порождает небольшое количество из всех возможных молекул с большой массой. Зная скорости этих процессов и различия в распределениях в Мурчисонском метеорите и на Земле в целом, можно экстраполировать данные в прошлое и вывести время образования соединений. Авторы приходят к выводу, что молекулы начали образовываться примерно 12,8 миллиардов лет назад, а аминокислоты появились спустя еще 165 миллионов лет.
Виды неорганических веществ
Неорганические вещества делятся на простые (металлы и неметаллы) и сложные (оксиды, соли, основания, кислоты). [Последние являются результатом окислительно-восстановительных реакций.]
Простые [моноатомные] вещества состоят из атомов одного химического элемента. По своим химическим свойствам они делятся на:
Сложные [гетероатомные] вещества состоят из атомов двух или более химических элементов. Они по своим химическим свойствам делятся на:
Существуют и другие сложные вещества:
Химические реакции между неорганическими веществами
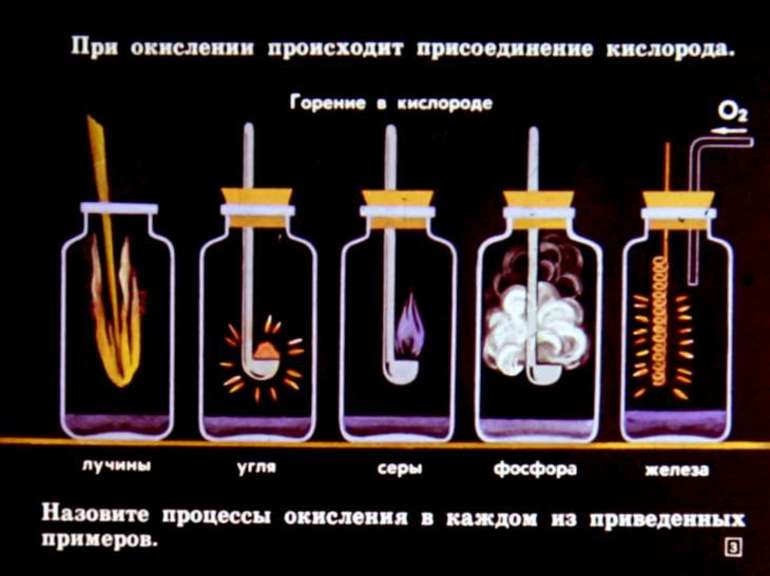
В основе реакционной способности атомов лежит незаполненность их электронного слоя. В ходе химической реакции металлы обычно отдают электроны, а неметаллы – принимают.
Металлы вступают в реакцию с неметаллами с образованием солей: 2Na + S = Na2S.
Металлы в реакциях с кислородом образуют обычно основные оксиды: 4Na + O2 = 2Na2O. Неметаллы в реакциях с кислородом образуют кислотные оксиды: S + O2 = SO2. Основные оксиды реагируют с кислотными оксидами с образованием солей: Na2O + SO2 = Na2SO3.
Основные оксиды реагируют с водой с образованием оснований: Na2O + H2O = 2NaOH. Кислотные оксиды реагируют с водой с образованием кислот: SO2 + H2O = H2SO3. Основания реагируют с кислотами с образованием солей: 2NaOH + H2SO3 = Na2SO3 + 2H2O.
Основные оксиды способны реагировать с кислотами, при этом образуются соли: Na2O + H2SO3 = Na2SO3. Кислотные оксиды реагируют с основаниями также с образованием солей: SO2 + 2NaOH = Na2SO3 + H2O.
Наибольшую реакционную способность проявляют типичные металлы и их соединения, и типичные неметаллы и их соединения. К типичным металлам относятся щелочные металлы, а также барий, стронций кальция. Активность всех остальных металлов и их соединений снижена. Так магний вступает в химическую реакцию только с кипящей водой и нагретыми парами воды, а оксид магния не реагирует с водой. Медь, к примеру, не реагирует с кислотами (не может быть окислена ионом водорода). Примерно тоже самое можно сказать о неметаллах. Наибольшую активность проявляют фтор, кислород, галогены.
Соли (состав и свойства)
Соли разделяются на растворимые в воде и нерастворимые в воде. О растворимости солей можно узнать из таблицы растворимости. Хорошо растворимы обычно соли щелочных металлов и аммония.
Средние соли состоят только из остатка кислоты и основания: CaSO4, Ba(NO3)2. Кислые соли кроме катиона металла содержат катион водорода, следовательно, они проявляют все свойства солей и кислот: Ca(HCO3)2 + Сa(OH)2 = 2CaCO3 + 2H2O.
Основные соли включают в свой состав также гироксильную группу и проявляют свойства солей и оснований: (MgOH)2SO4 + H2SO4 = 2MgSO4 + 2H2O.
Основания и щёлочи
Основания делятся на растворимые в воде и нерастворимые в воде. Растворимые основания называют щелочами.
Щелочами являются гидроксиды щелочных металлов, а также гидроксиды бария, стронция кальция.
Кислоты
Все изучаемые в школе кислоты, кроме кремниевой растворимы в воде. Кислоты можно разделить на сильные и слабые. Сильные кислоты: это азотная HNO3, серная H2SO4, хлорная HClO4, хлороводородная (соляная) HCl, бромоводородная HBr, йодоводородная HI.
Как реагируют амфотерные вещества (простые и сложные)
Кроме вышеописанных существуют амфотерные простые вещества, оксиды и гидроксиды.
Амфотерные простые вещества
Амфотерными простыми веществами изучаемыми в школе являются бериллий Be, алюминий Al и цинк Zn. Амфотерные простые вещества реагируют как с кислотами, так и с основаниями. Например: Zn + 2HCl = ZnCl2 + H2; Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2.
Амфотерные оксиды
К амфотерным оксидам относят BeO, Al2O3, ZnO, H2O, Cr2O3, Fe2O3. Амфотерные оксиды реагируют с кислотами и основаниями, а также основными и кислотными оксидами: ZnO + 2HCl = ZnCl2 + H2O; ZnO + 2KOH + H2O = K2[Zn(OH)4]; SO3 + H2O = H2SO4; K2O + H2O = 2KOH.
Амфотерные гидроксиды
Амфотерные гидроксиды – сложные вещества, которые имеют свойства и кислот, и оснований. Все они — твердые вещества, не растворимые в воде. Они растворяются в кислотах и щелочах: Zn + 2OH = Zn(OH)2 = 2H + ZnO2 Cr + 3OH = Cr(OH)3 = H + CrO2 + H2O
Окраска амфотерных гидроксидов зависит от характера входящих в их состав катионов металлов. К амфотерным гидроксидам относят Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3, Fe(OH)3.
Направления реакционной способности основных классов неорганических веществ
Все вышесказанное удобно представить в виде схемы:
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.