Химия что такое катионы
Химия что такое катионы
Вещество и его строение, модель атома
Сколько электронов в атоме и где их искать?
3. Ион
А.е.м., моль, концентрация
Молекулы, химические соединения
Степень окисления. Окислитель. Восстановитель. Редокс
Электрохимия. Электролиз. Гальванические элементы
Химическая термодинамика, система, энтальпия
Сколько времени займёт реакция? Что влияет на скорость реакции?
Равновесие обратимых реакций. Принцип Ле Шателье. Влияние внешних факторов на равновесие
Мера беспорядка, энергия вселенной, свободная энергия Гиббса
Основные классы химических соединений. Классификация
Неорганическая химия
Органическая химия
Прикладная химия
Участников: 371
Присоединиться
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr) 24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье «электронная конфигурация атома», каждый электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный заряд), схема для запоминания:
Аналогично при присоединении электрона:
Энергия ионизации
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные | |||
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона также выделит 13 эВ.
Катионы и анионы
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Пример
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять окислительно-восстановительные реакции!
Уроки химии: катионы и анионы – что это такое
Наверняка, каждому из читателей доводилось слышать такие слова, как «плазма», а также «катионы и анионы», это довольно интересная тема для изучения, которая в последнее время довольно прочно вошла в повседневную жизнь. Так, в быту широкое распространение получили так называемые плазменные дисплеи, которые прочно заняли свою нишу в различных цифровых устройствах – начиная от телефонов и заканчивая телевизорами. Но что такое плазма, и какое применение она находит в современном мире? Давайте попробуем ответить на этот вопрос.
Агрегатные состояния вещества
Еще с малых лет, в начальной школе рассказывали о том, что существует три состояния вещества: твердое, жидкое, а также газообразное. Повседневный опыт показывает, что это действительно так. Мы можем взять немного льда, растопить его, а затем испарить – все довольно логично.
Важно! Существует четвертое базовое состояние вещества, называемое плазмой.
Однако, прежде чем ответить на вопрос: что же это такое, давайте вспомним школьный курс физики и рассмотрим строение атома.
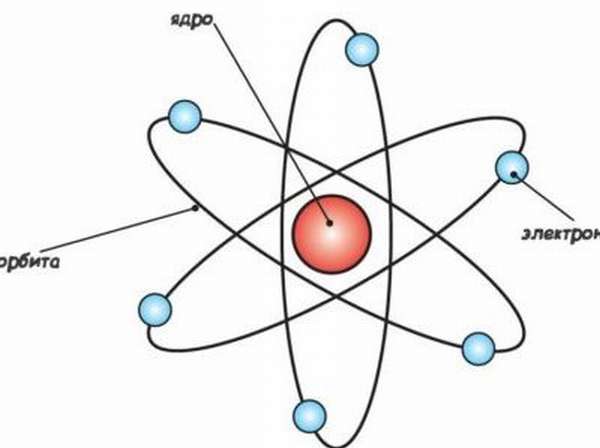
По результатам его опытов с альфа-частицами, стало известно, что атом является неким аналогом солнечной системы, где уже ранее известные электроны играли роль «планет», вращаясь вокруг атомного ядра.
Это интересно! Как самостоятельно определить валентность по таблице
Данная теория стала одним из наиболее значимых открытий в физике элементарных частиц. Но на сегодняшний день она признана устаревшей, а ей на замену принята другая, более совершенная, предложенная Нильсом Бором. Еще позднее, с появлением нового ответвления науки, так называемой квантовой физики, была принята теория корпускулярно-волнового дуализма.
В соответствие с ней, большинство частиц одновременно являются не только частицами, но и электромагнитной волной. Таким образом, невозможно на 100% точно указать, в каком месте находится электрон в определенный момент. Имеется возможность лишь предположить, где он может быть. Подобные «допустимые» границы впоследствии получили название орбиталей.
Как известно, электрон обладает отрицательным зарядом, в то время как протоны, находящиеся в ядре, – положительным. Так как число электронов и протонов равно, то атом обладает нулевым зарядом, или же, – электрически нейтрален.
Это интересно! Что такое ковалентная связь – полярная и неполярная
При различных внешних воздействиях атом получает возможность, как терять электроны, так и приобретать их, при этом меняя свой заряд на положительный или отрицательный, становясь при этом ионом. Таким образом, ионы представляют собой частицы с ненулевым зарядом – будь то ядра атомов, или оторванные электроны. В зависимости от заряда, положительного или отрицательного, ионы называются катионами и анионами соответственно.
Другой не менее интересный эффект можно наблюдать в космических туманностях. Подобные объекты чаще всего состоят из газа. Если поблизости имеется звезда, то ее излучение может ионизировать вещество туманности, в результате чего оно уже самостоятельно начинает излучать свет.
Глядя на эти примеры, можно ответить на вопрос о том, чем является плазма. Итак, ионизируя определенный объем вещества, мы заставляем атомы отдать свои электроны и приобрести положительный заряд. Свободные электроны, обладая отрицательным зарядом, могут либо остаться свободными, либо же присоединиться к другому атому, тем самым изменив его заряд на положительный. Так вещество никуда не уходит, а число протонов и электронов так и остается равным, оставляя плазму электрически нейтральной.
Это интересно! Основные факторы влияющие на скорость химической реакции
Роль ионизации в химии
Как было описано выше, электроны имеют свои строго определенные места – орбитали. Когда атомы образуют какое-либо вещество, то они, сливаясь в группу, также «делятся» своими электронами с соседями. И хотя молекула остается электрически нейтральной, одна ее часть может представлять собой анион, а другая катион.
Это интересно! Что такое алканы: строение и химические свойства
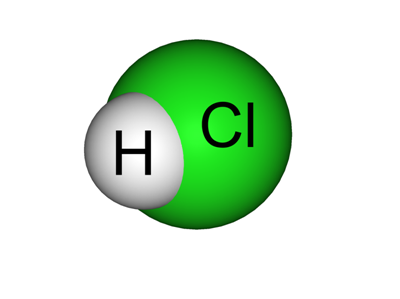
За примером далеко ходить не требуется. Для наглядности можно взять всем известную соляную кислоту, она же хлороводород – HCL. Водород в данном случае будет обладать положительным зарядом. Хлор же в данном соединении является остатком и называется хлоридом – тут он имеет заряд отрицательный.
На заметку! Довольно легко выяснить какими свойствами обладают те или иные анионы.
Таблица растворимости покажет, какое вещество хорошо растворяется, а какое сразу же вступает во взаимодействие с водой.
Полезное видео: катионы и анионы
Вывод
Мы выяснили, что представляет собой ионизированное вещество, каким законам подчиняется, и какие процессы за этим стоят.
Катионы
Катио́н — положительно заряженный ион. Характеризуется величиной положительного электрического заряда: например, NH4 + — однозарядный катион, Ca 2+ — двузарядный катион. В электрическом поле катионы перемещаются к отрицательному электроду — катоду.
См. также
Смотреть что такое «Катионы» в других словарях:
КАТИОНЫ — КАТИОНЫ, смотри в статье Ионы … Современная энциклопедия
Катионы — КАТИОНЫ, смотри в статье Ионы. … Иллюстрированный энциклопедический словарь
КАТИОНЫ — (от греч. kation, букв. идущий вниз) положительно заряж. ионы. В электрич. поле движутся к отрицат. электроду (катоду) … Большой энциклопедический политехнический словарь
КАТИОНЫ ПОГЛОЩЕННЫЕ — сорбированные катионы, содер. в глинах, почвах, способные к реакции обмена на др. катионы. Наиболее распространенными являются катионы, характерные для природных вод (Na+, K+, Mg2+, Са2+). Состав К. п. используется для характеристики почв, а в… … Геологическая энциклопедия
КАТИОНЫ ОБМЕННЫЕ — Ca2+, Mg2+, H+, Na+, K+, входят в состав поглощенного комплекса межслоевого пространства глинистых м лов, нейтрализующего заряд октаэдрического слоя; могут заменять друг друга в эквивалентных количествах. Наибольшее количество К. о. содер. м лы… … Геологическая энциклопедия
Катионы межслоевые — К., расположенные в промежутках межслоевых структуры слоистых (глинистых) минералов. Наиболее подвижны и доступны для растений катионы слоистых силикатов. К. м. смешаннослойных образований, смектитов и вермикулитов, являются одной из главных… … Толковый словарь по почвоведению
Катионы обменные — К., удерживаемые твердой фазой п.; могут обмениваться на катионы другого рода из растворов солей … Толковый словарь по почвоведению
Аммоний-катионы — Рис.1.Четвертичный аммониевый катион … Википедия
обменные катионы почвы — Ндп. поглощенные катионы почвы Катионы, поглощенные высокодисперсной частью почвы, способные к обмену. [ГОСТ 20432 83] Недопустимые, нерекомендуемые поглощенные катионы почвы Тематики удобрения Обобщающие термины характеристика почвы в связи с… … Справочник технического переводчика
Обменные катионы — Катионы (Са++, Mg++, K+, Na+, H+ и др.), удерживаемые твердой фазой почвы; могут обмениваться на катионы другого рода из растворов солей Источник … Словарь-справочник терминов нормативно-технической документации
Анализ катионов. Классификация катионов на группы
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Анализ катионов
При систематическом анализе принято деление катионов и анионов на аналитические группы. Наиболее удобная, применяемая и в настоящее время классификация катионов, разработана Н.А. Меншуткиным в 1871 г. Все существующие ныне классификации предусматривают разделение катионов на 5 или 6 аналитических групп на основании следующих их свойств:
1.На различии растворимости хлоридов, карбонатов, сульфатов или гидроксидов.
2. На амфотерных свойствах некоторых гидроксидов.
3. На способности ряда гидроксидов образовывать комплексные аммиакаты.
Классификация катионов на аналитические группы
характеристика
реактив
раствор
Почти все соли калия, натрия, аммония и большинство солей магния хорошо растворимы в воде. Поэтому группового реактива, осаждающего все четыре катиона, нет.
Калий и натрий относятся к 1 группе периодической системы элементов и образуют сильные щелочи. Гидроксид аммония является слабым основанием, но катион аммония близок по свойствам к катиону калия и образует несколько аналогичных малорастворимых солей. Соли аммония разлагаются при нагревании и могут быть удалены прокаливанием. Гидроксид магния – слабое основание, плохо растворимое в воде. Труднорастворимы также фосфат магния и карбонат. Гидроксокарбонат магния растворяется в избытке солей аммония и при действии карбонатом аммония в присутствии хлорида аммония в осадок не выпадает. Поэтому при систематическом анализе ион магния остается в растворе с катионами 1 группы. По этой причине он и отнесен к этой группе.
Ионы калия, магния, аммония необходимы для минерального питания растений. Большое содержание солей натрия указывает на засоленность почв.
Анализ водных вытяжек из почвы на наличие этих катионов используют для определения пригодности почв для возделывания различных культур.
Оценка качества природных вод включает пробы на присутствие ионов аммония. Наличие в воде аммиака и солей аммония служит признаком загрязненности, так как эти соединения образуются при гниении белков.
Продукты детского и диетического питания также подвергаются обязательному исследованию на содержание натрия, калия и магния.
Катионы 2 группы, в отличии от катионов 1 группы, образуют малорастворимые в воде карбонаты. Поэтому их осаждают действием карбоната аммония, который является групповым реактивом.
Сульфиды этих элементов, в отличие от катионов 3,4 и 5 групп, хорошо растворимы в воде.
В водных растворах катионы 2 группы бесцветны.
Соли кальция используют для улучшения почв: в сильно кислые почвы для нейтрализации вводят известняк СаСО3; а в солонцеватые – гипс CaS04•2H2O. Кальций входит в состав минеральных удобрений: фосфоритной муки Са3(РО4)2, суперфосфата Са(Н2РО4)2 + CaS04, кальциевой селитры Са(НСО3)2 и т.д.
Растворимый гидрокарбонат кальция Са(НСО3)2 находится в природных водах, сообщая им временную жесткость. Арсенит и арсенат кальция используют как сельскохозяйственные яды.
Ионы бария ядовиты. Карбонат и хлорид бария используют в сельском хозяйстве как яды. Поэтому обнаружение ионов бария проводят при распознавании ядохимикатов.
Радиоактивный изотоп стронция 90 Sr, образующийся при ядерных реакциях, представляет большую опасность для здоровья и жизни.
Реакции катионов второй группы
| Реактивы | Катионы | ||
| Са 2+ | Ba 2+ | Sr 2+ | |
| (NH4 )2СО3, Nа2СО3, К2СО3 | СаСО3↓ белый | ВаСО3↓ белый | SrСО3↓ белый |
| Na2HP04 | СаНРО4↓ белый | ВаНРО4↓ белый | SrHP04↓ белый |
| (NH4)2C204 | СаС2Н4↓ белый | ВаС2О4↓ белый | SrC204↓ белый |
| H2S04 и растворимые сульфаты | CaS04↓ белый | BaS04↓ белый | SrS04↓ белый |
| К4[Fe(CN)6]+NH4Cl | Ca(NH4)2 [Fe(CN)6] ↓ белый | Ba(NH4)2•Fe(CN)6]↓, белый | ──── |
| CaS04 | BaS04↓ выпадает сразу | SrS04↓ выпадает не сразу | |
| К2Сr207 | ВаСrО4↓ желтый | ───── | |
| Окрашивание пламени | Кирпично- красное | Желто-зеленое | Карминово-красное |
К третьей аналитической группе относят катионы алюминия, железа(II), железа(III), марганца (II), цинка, хрома(III). Они характеризуются большим разнообразием свойств.
Изменение валентности этих элементов осуществляется сравнительно легко, поэтому для них характерны окислительно-восстановительные реакции.
Гидроксиды железа и марганца обладают слабоосновными свойствами, растворяются в кислотах, но не растворяются в щелочах. Гидроксиды всех катионов третьей группы не растворимы в воде, но могут переходить в коллоидное состояние.
Соли большинства элементов этой группы образуют окрашенные растворы.
Окраска растворов солей элементов третьей аналитической группы
зеленая
фиолетовая
Катионы третьей аналитической группы образуют сульфиды, нерастворимые в воде, но растворимые в кислотах. В отличие от них сульфиды первой и второй группы растворимы в воде, а сульфиды четвертой и пятой группы катионов нерастворимы в кислотах. Поэтому в качестве группового реактива используют сульфид аммония. Другие растворимые сульфиды, так же осаждающие катионы третьей группы, не могут быть использованы как групповой реактив, так как с ними в раствор будут введены катионы первой и второй групп. Присутствие катиона аммония в ходе систематического анализа определяется до введения сульфида аммония, а в дальнейшем катион аммония легко удаляется из раствора в виде аммиака. Катионы третьей группы в зависимости от воздействия на них гидр оксида аммония в присутствии хлорида аммония подразделяют на две подгруппы:
катионы аллюминия, хрома(III), железа (III), осаждаемые водным аммиаком в присутствии хлорида аммония.
катионы железа(II), марганца(II), цинка не осаждаемые таким образом.
Катионы третьей группы, подобно катионам второй группы и магния, образуют труднорастворимые карбонаты и гидрофосфаты. Кроме того, они обладают способностью образовывать комплексные соединения.
Обнаружение и количественное определение катионов третьей группы связано главным образом с анализом почв, микроудобрений, растительного и животного материала, продовольственного сырья и продуктов питания (особенно детских и диетических), так как эти катионы имеют важнейшее биологическое значение.
Алюминий в больших количествах содержится в кислых подзолистых почвах, снижая урожайность многих культур. Соли алюминия применяют для очистки природных вод.
Железо содержится в тканях всех растений и животных. Оно входит в состав гемоглобина крови животных, участвует в синтезе хлорофилла зеленых растений. При недостатке железа в почве у растений развивается хлороз, т.е. отсутствие зеленой окраски из-за пониженного содержания хлорофилла. Избыток железа в почве так же вреден для растений. Многие соли железа (лактат, сульфат, глицерофосфат) применяют в ветеринарии как антианемические средства.
Марганец, цинк, хром – микроэлементы, необходимые для нормального течения обменных процессов у растений и животных. Недостаток марганца в почве способствует развитию у них различных заболеваний; в крови – приводит к возникновению „марганцевого рахита”. Нехватка цинка ведет к нарушению синтеза хлорофилла, витаминов, ауксинов у растений, витаминов и ферментов у животных и человека.
Избыток цинка в почвах, продуктах питания, сырье является токсичным для человека, животных и растений. Согласно гигиеническим нормативам качества и безопасности продовольственных продуктов и сырья предельно допускаемое содержание цинка: в мясе- 70,0 мг/кг., в молоке – 5,0 мг/кг., в яйце-50,0 мг/кг.
Реакции катионов третьей группы
| Реактивы | Катионы | |||||
| A1 3+ | Cr 3+ | Fe 3+ | Fe 2+ | Mn 2+ | Zn 2+ | |
| (NH4)2S в щелочной среде | Аl(ОН)3 | Сr(ОН)3↓ | ↓Fе2S3 | ↓FeS | ↓MnS | ↓ZnS |
| NaOH, КОН, NН4ОH | АI(ОН)3 | Сr(ОН)3↓ | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(OН)2 | ↓Zn(ОН)2 |
| NaOH, КОН | Р-р А102 – | Р-р Cr02 – | ↓Fе(ОН)3 | ↓Fе(ОН)2 | ↓Мn(ОН)2 | р-р ZnО2 2- |
| NH4Cl в щел. среде | ↓Аl(ОН)3 | ↓Сr(ОН)3 | ↓Fе(ОН)3 | |||
| Na2HP04 | ↓AlP04 | ↓CrPО4 | ↓FePО4 | ↓Fе3(РО4) | ↓Мn3(РО4) | ↓Zn3(РО4) |
| K4[Fe(CN)6] | ↓Fe4[Fe(CN)6]3 | ↓Fe2[Fe(CN)6] | ↓Мn2[Fе(CN)6] | ↓К2Zn3[Fе(CN)6]2 | ||
| К3[Fе(СN)6] | ↓Fe3[Fe(CN)6] | ↓Мn3[Fе(CN)6]2 | Zn3[Fе(CN)6]2 | |||
| KCNS | Fе(СNS)3 | |||||
| Алюминон | Красный | Красный | Красный | |||
| (NH4)2S208 | Cr207 2- р-р | МnО4 – р-р | ||||
| Дитизон | Красный | |||||
| Cо(NО3)2 | CoZn02 | |||||
| Н2О2 в щелочной среде | Cr204 р-р | Fе(ОН)3 | ||||
Четвертая аналитическая группа объединяет катионы серебра, свинца, и ртути(I). Общим свойством этих катионов является способность осаждаться под действием разбавленной соляной кислоты и ее солей в виде хлоридов-осадков белого цвета. Поэтому соляная кислота является групповым реактивом для катионов этой группы.
Кроме того, катионы четвертой аналитической группы образуют нерастворимые сульфиды черного цвета, которые в отличие от катионов 5 группы, не растворяются в сульфидах натрия, калия, аммония. Мало растворимы в воде также фосфаты и карбонаты катионов четвертой группы. Растворимые соли подвергаются гидролизу и их растворы имеют кислую реакцию. В окислительно-восстановительных реакция катионы четвертой группы выступают в роли окислителей и восстанавливаются до свободных металлов. В водных растворах катионы серебра, свинца и ртути (I) бесцветны.
Соединения катионов четвертой группы имеют важное биологическое значение. Ионы серебра обладают бактерицидным действием. Нитрат серебра применяют в медицине и ветеринарии при эрозиях, язвах, экземах, а также в офтальмологии и стоматологии. Металлическая ртуть и большинство ее соединений очень ядовиты. Наиболее токсичны для животных и человека: хлорид (сулема) и йодид ртути (II) и органические ртутные препараты, применяемые для протравливания семян: гранозан, этилмеркурхлорид, этилмеркурфосфат. Эти соединения нарушают углеводный и кальциевый обмен, функции почек, печени, эндокринных желез, центральной нервной системы вследствие блокады сульфгидрильных групп ферментов. Хлорид ртути (I) или каломель (Hg2CI2) не ядовита и используется в медицине и ветеринарии как слабительное, антисептическое и мочегонное средство.
Соединения свинца также ядовиты. К наиболее токсичным относятся нитрат, ацетат и гидроксохлорид свинца, а так же тетраэтилсвинец. Загрязнение воздуха, почвы и воды соединениями свинца происходит в результате выброса их промышленными предприятиями, выхлопными газами автотранспорта. В соответствии с санитарными нормами содержание свинца в 1 л воды не должно превышать 0.1 мг. В основных сельскохозяйственных продуктах допускается следующее содержание свинца и ртути:
Гигиенические нормативы содержания свинца и ртути в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Свинец | 0,5 | 0,1 | 0.3 |
| Ртуть | 0,03 | 0,005 | 0,02 |
Ацетат свинца и оксид свинца используются в медицине, ветеринарии как вяжущие и противовоспалительные средства в форме примочек, компрессов, мазей и пластырей.
Реакции катионов четвертой группы
| Реактивы | Катионы | |||
| Ag + | Pb 2+ | Нg2 2+ | ||
| HCl и хлориды | AgCl↓ – белый, растворимый в NH4ОH | PbC12↓- белый, растворимый в горячей воде | Hg2C12↓ – белый, чернеющий в NH4ОH | |
| KOH, NaOH | Аg2O↓ – бурый | Pb(OH)2↓- белый, растворимый в кислотах и избытке щелочей. | Hg2О↓- черный | |
| NH40H (избыток) | [Аg(NН3)2] + раствор | Рb(ОН)↓-белый | (NН2Нg)NО3↓- белый + ↓Hg | |
| K2Cr04 | Аg2СrО4↓ кирпично- красный | PbCr04↓ – желтый | Hg2CrО4↓ – красный | |
| H2S04 | ───── | PbS04↓ – белый | ───── | |
| Na2HP04 | Аg3РО4↓ – желтый | ───── | ───── | |
| НI, (KI) | AgI↓- желтый | РbI2↓- желтый, растворимый в горячей воде, NaOH, избытке КI | Hg2I2↓- грязно-зеленый, растворимый в избытке КI | |
| Сu металлич. | ───── | ───── | Hg↓ | |
Катионы пятой группы образуют нерастворимые в воде сульфиды, гидроксиды и основные соли. Гидроксид аммония, который используется как групповой реактив, образует с катионами пятой группы, ярко окрашенные основные соли, которые, кроме солей висмута, растворимы в избытке аммиака. Образующиеся при этом комплексные соли – аммиакаты, также имеют характерную окраску.
Катионы меди, кадмия и висмута, кроме того, образуют комплексные соединения с цианидами и йодидами. В реакциях окисления-восстановления катионы пятой группы ведут себя как окислители и восстанавливаются до свободных металлов.
В водных растворах почти все катионы пятой группы окрашены.
Окраска растворов солей катионов пятой аналитической группы
| Ион | Cu 2+ | Co 2+ | Ni 2+ | Cd 2+ | Bi 3+ |
| Окраска раствора | голубая | розовая | зеленая | бесцветная | бесцветная |
Объектом качественного анализа на присутствие катионов меди, кобальта, никеля, кадмия и висмута являются удобрения, почвы, растения, биологические жидкости, сельскохозяйственное сырье, продовольственные продукты. Медь входит в состав удобрений и сельскохозяйственных ядов, например: медного купороса, парижской зелени Сu(СН3СОО)23Сu(АsО2)2, бордосской жидкости. Медь необходима для нормальной жизнедеятельности растений и животных, так как входит в состав ферментов, влияет на белковый и углеводный обмен. Сульфат и карбонат меди используют в ветеринарии как антгельминтики. Медь отнесена к токсичным элементам. Предельно допустимое содержание меди в некоторых продуктах питания приведено в таблице N29. Кобальт входит в состав витамина В12. Пониженное содержание этого микроэлемента в почвах, растениях, кормах и пищевых продуктах отрицательно сказывается на росте сельскохозяйственных культур, продуктивности животных и развитии человека. Избыточное содержание кобальта, как и меди, и кадмия считается токсичным.
Гигиенические нормативы содержания меди и кадмия в основных продовольственных продуктах, (в мг/кг)
| Мясо | Молоко | Яйца | |
| Медь | 5.0 | 1.0 | 3.0 |
| Кадмий | 0.05 | 0.03 | 0.01 |
Мышьяк /III/, сурьма/III/ и олово /III/ в щелочной среде ведут себя как восстановители. Мышьяк /V/, cурьма /V/ в кислой среде проявляют свойства окислителей.
Характерной реакцией для катионов 6 группы является образование нерастворимых в воде сульфидов при взаимодействии с сероводородом в кислой среде. Сульфиды катионов 6 группы растворяются в сульфидах натрия, калия, аммония, образуя сульфосоли (тиосоли). Например:
Сульфосоли по своему составу подобны кислородосодержащим кислотам тех же элементов с той разницей, что роль кислорода здесь играет элемент, ему аналогичный – сера.
Использование сероводорода в качестве группового реактива сопряжено с многочисленными трудностями.
Бессероводородный метод качественного анализа предусматривает осаждение катионов 6 группы (олова и сурьмы) едкими щелочами. При этом образуются соединения нерастворимые в воде, обладающие способностью растворяться в избытке щелочей.
В ветеринарии соединения мышьяка применяют в качестве противопаразитарных средств и веществ, улучшающих обмен (осарсол, новарсенол, натрия арсенат).
Продовольственные продукты и сельскохозяйственное сырье подлежат обязательному анализу на присутствие мышьяка. Предельно допустимое содержание мышьяка составляет: в мясе- 0.1 мг/кг, в молоке- 0.05 мг/кг, в яйце – 0.1 мг/кг.
Биологическая роль сурьмы и олова выяснена недостаточно. В ветеринарии используют сульфиты сурьмы /III/ и /V/ в качестве отхаркивающих средств, арсенат олова как антгельминтик.