Химия so3 что это
Оксид серы (VI) SO3, серный ангидрид
Взаимодействуя с кислородом, сера образует два оксида:
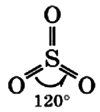
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
В таком виде молекула серного ангидрида может находиться только в газообразном состоянии.
В жидком и твердом состоянии происходит полимеризация молекул:
Физические свойства серного ангидрида:
Химические свойства серного ангидрида
Оксид серы (VI) является типичным кислотным оксидом:
Серный ангидрид очень хорошо растворяется в серной кислоте, образуя раствор, называемый олеумом:
В кислотно-восстановительных реакциях выступает в роли сильного окислителя, восстанавливаясь до сернистого ангидрида:
Получение и применение серного ангидрида
В промышленных целях серный ангидрид получают путем окисления сернистого газа в присутствии катализатора:
Серный ангидрид используют для получения серной кислоты, а также, в качестве сульфирующего и обезвоживающего реагента.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Оксид серы (VI)
Оксид серы (VI)
| Оксид серы(VI) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(VI) |
| Химическая формула | SO3 |
| Отн. молек. масса | 80.06 а. е. м. |
| Молярная масса | 80.06 г/моль |
| Физические свойства | |
| Плотность вещества | 1.92 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | 16,9 °C |
| Температура кипения | 45 °C |
| Энтальпия (ст. усл.) | −397.77 кДж/моль |
| Классификация | |
| номер CAS | [7446-11-9] |
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
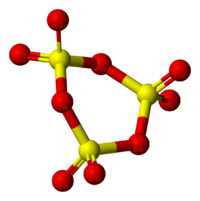
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул тримера. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Содержание
Получение
Можно получить термическим разложением сульфатов:
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (239 Загрузок)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Характеристика оксида серы и его основные свойства
Оксид серы(VI) — что это такое
Оксид серы (VI) — в химии является высшим кислотным оксидом, в обычных условиях представляет собой ядовитую жидкость без цвета.
При контакте с кислородом сера образует два типа оксидов со схожими общими свойствами:
Молекула сернистого газа (оксида серы (IV)) имеет угловую форму и является полярной. Молекулярные связи образуют угол в 119°.
Молекула сернистого ангидрида (оксида серы (VI)) имеет формулу плоского треугольника, валентные углы 120° (см. рисунок)
Такой характер строения молекула серного ангидрида имеет лишь в газообразном состоянии. Для жидкого и твердого агрегатных состояний характерна полимерная структура:
Физические и химические свойства
Серный ангидрид S O 3 – при обычных условиях летучая маслянистая жидкость, обладает характерным удушающим запахом. Особенностью вещества является способность «дымить» в воздушной среде.
Физические свойства оксида серы (VI):
Оксид серы (VI) обладает химическим свойством активно поглощать влагу. В результате реакции с водой образуется серная кислота.
S O 3 + H 2 O → H 2 S O 4
Серный ангидрид представляет собой типичный кислотный оксид. По этой причине вещество взаимодействует со щелочами и основными оксидами.
Взаимодействие оксида серы (VI) с гидроксидом натрия приводит к образованию средних и кислых солей:
S O 3 + 2 N a O H ( и з б ы т о к ) → N a 2 S O 4 + H 2 O S O 3 + N a O H ( и з б ы т о к ) → N a H S O 4
Реакция оксида серы (VI) и оксида магния при нагревании:
S O 3 + M g O → M g S O 4
Серный ангидрид обладает сильными окислительными свойствами. Это связано с тем, что сера в составе вещества находится в высшей степени окисления (+6).
Взаимодействие оксида серы (VI) с восстановителями в виде йодида калия, сероводорода, фосфора:
S O 3 + 2 K I → I 2 + K 2 S O 3
3 S O 3 3 H 2 S → 4 S O 2 + H 2 O
5 S O 3 + 2 P → P 2 O 5 + 5 S O 2
Как реагирует с веществами, взаимодействие с кислородом
Как типичный кислотный оксид, серный ангидрид вступает в реакцию с основаниями и основными оксидами. В результате образуются соли.
S O 3 + 2 N a O H = N a 2 S O 4 + H 2 O S O 3 + C a O = C a S O 4
Сера в оксиде обладает степенью окисления, равной +6. Данное значение является максимальным для серы. По этой причине вещество играет роль окислителя в окислительно-восстановительных реакциях.
Взаимодействие оксида серы (VI) и кислорода сопровождается образованием пероксида сульфурила. Процесс протекает при нулевой температуре под воздействием электричества.
2 S O 3 + O 2 → 2 S O 2 O 2
Получение и применение
2 S O 2 + O 2 ↔ 2 S O 3
Сернистый газ окисляют также с помощью других окислителей, в том числе, озона или оксида азота (IV).
S O 2 + O 3 → S O 3 + O 2 S O 2 + N O 2 → S O 3 + N O
Другим методом получения серного ангидрида является разложение сульфата железа (III).
F e 2 ( S O 4 ) 3 → F e 2 O 3 + 3 S O 3
Чистый серный ангидрид не обладает практическим значением. Вещество используют в качестве промежуточного продукта для производства серной кислоты, а также как сульфирующий и обезвоживающий реагент.
Химия so3 что это
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов.
4. Применение серной кислоты
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Это интересно
История серной кислоты (материал взят с сайта alhimikov.net)
 Джон Робак |
Этот способ использовался в промышленности в течение почти двух столетий. В камерах получали кислоту с концентрацией около 65 %, впоследствии усовершенствовав сам процесс (Это сделали французский химик Гей-Люссак и английский Гловер), концентрацию довели до 78%. Однако этих концентраций для некоторых химических процессов, например, при производстве красителей не хватало.
Лишь в 1831 г. британский торговец уксусной кислотой Перегрин Филипс запатентовал экономичный процесс для производства оксида серы (VI) и концентрированной серной кислоты, который известен нам в настоящее время как контактный способ получения серной кислоты.
В 1864 году стали производить суперфосфат. В восьмидесятые годы XIX века производство серной кислоты достигло в Европе 1 млн. тонн. Основными производителями были Англия и Германия, на долю которых приходилось более 72% от мирового объема производства.
5. Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.

Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
III. Тренажеры
IV. Задания для закрепления
№1. Осуществите превращения по схеме:
№2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
№3. Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.