Хлор для чего используется
Хлор для чего используется
Еще в 2014 году Россия присоединилась к Минаматской конвенции ООН по ртути (The Minamata Convention on Mercury), которая предусматривает поэтапный отказ от использования ртути во всем мире – как в промышленности, так и в быту. Это касается хлорно-щелочного производства. Как говорилось выше, хлор получают в процессе электролиза. Есть три вида технологий. Самый эффективный и экологичный метод получения хлора и каустика – мембранный, он был разработан в 1975 году специалистами японской компании Asahi Kasei Chemicals Corporation. На сегодняшний день мембранный электролиз – доминирующая технология в Европе. По данным Ассоциации «РусХлор», в Европе по ней работают уже 83% мощностей.
В России в основном применяют диафрагменный (около 58% мощностей), три предприятия – «Башкирская содовая компания», «Каустик», «ГалоПолимер Кирово-Чепецк» (примерно 26% мощностей) – до сих пор используют амальгамный (ртутный) электролиз, который был распространен повсеместно в прошлом столетии. Во многом это связано с тем, что при использовании в качестве катода ртуть получают чистую каустическую соду, не содержащую хлоридов. Кроме того, переход на мембранный электролиз процесс технологически сложный и дорогостоящий.
На сегодня мембранная технология в стране внедрена пока только на АО «Саянскхимпласт». Электролизеры по лицензии японской компании были запущены в эксплуатацию в Саянске еще в 2006 году. В том же году на предприятии был остановлен ртутный электролиз, использовавшийся 27 лет. Важно отметить, что объемы выпуска продукции, в том числе ПВХ, были сохранены, а с годами увеличены. О начале перевода имеющейся на предприятии в Кирово-Чепецке ртутной технологии производства хлора и каустика на мембранную заявляла компания «ГалоПолимер».
Переход на безопасную технологию – одно из актуальных направлений развития отечественного хлорного производства.
Хлор элемент. Свойства хлора. Применение хлора
19 граммов на литр. Таково содержание хлора в морской воде. Норма для водопроводной – не более 1,5 грамма на литр. Для обеззараживания этого достаточно. Почему такая разница? Причина в соли, растворенной в океанах.
По химическому составу она является хлоридом натрия. В одном литре морской воды на него приходятся 35 граммов.
Не удивительно, что 19 из них – хлор. В мире его, как видно, немало. Велика и роль. Кто-то элемент боится, а кто-то понимает, что без него никак. Чтобы утвердиться в принятой позиции, или поменять ее, ознакомимся с фактами.
Свойства хлора
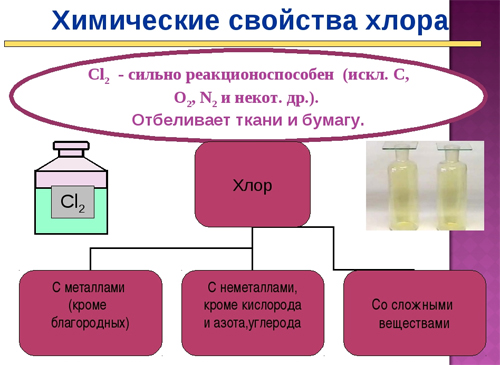
Хлор – элемент газообразный. Цвет у него желто-зеленый. Название 17-го элемента с греческого так и переводиться. Однако, ткани и бумагу вещество отбеливает. Правда, для этого нужна хлорноватистая кислота – итог взаимодействия хлора с водой.
В 18-ом веке, когда 17-е вещество только открыли, говорили «хлорная вода», не зная о том, что имеют дело с кислотой.
В начале 19-го века ей начали ополаскивать свои руки медики. Такая практика была введена, к примеру, в одном из госпиталей Вены. Врачи, конечно, не хотели отбелить руки. Хлорная вода служила обеззараживающим средством.
Способность 17-го элемента убивать болезнетворные бактерии заметили в конце 18-го столетия.
Раствор хлора – одно из примерно 200-от его соединений. В чистом виде элемент не встречается. Причина – высокая химическая активность. Вещество обязательно вступает во взаимодействие с «соседями». Однако, чистый хлор, все же, получен.
Первый удачный опыт проведен в 1774-ом году Карлом Шеелем. Это шведский химик. Он соединил соляную кислоту с пиролюзитом оксида марганца.
Понадобились предосторожности в работе с газом, ведь он токсичен. Если хлор попадает в легкие, то вызывает удушье и ожоги. Поэтому, в дыхательной системе, точнее в ее кровотоках, находят лишь соединения хлора. Общее содержание 17-го вещества в организме человека – 0,25% от массы.
Интересно! Хлор – хим. элемент, обнаруженный в большем количестве в телах профессиональных пловцов. Они, как говорится, не вылезают из бассейнов. Вода в них хлорирована и, видимо, ионы вещества просачиваются в кровоток.
Жидкий хлор – часть соляной кислоты, находящейся в желудке человека. 17-ый элемент в реагенте играет не только обеззараживающую роль, но и расщепляет пищу.
Получается, хлор, опасный в газообразном состоянии, приносит пользу в виде соединений, к примеру, той же поваренной соли.
Как видно, роль хлора весьма относительна. Он может быть благом, а может и ядом. В последнем амплуа элемент использовали немецкие войска.
Применение хлора
Хлор – химический элемент, используемый для производства соляной кислоты, не только в желудке.
Соляную кислоту с помощью 17-го вещества получают и вне организма. Соединение пригождается при дублении и окрашивании кож, на производстве активированного угля, синтетических красителей и органических полупродуктов.
Без хлора не обойтись и в гальванопластике. В составе соляной кислоты элемент нужен при изготовлении различных клеев и гидролизного спирта.
Обеззараживающая характеристика элемента пригождается теперь не в госпиталях, а в обработке водопроводной воды.
Ее хлорирование применяется больше века. Появилась альтернатива – озонирование. Хлор воду обеззараживает, но может негативно влиять на организм. Ресурсоснабжающие организации волнует еще и то, что 17-е вещество разъедает трубы.
Следовательно, сети чаще требуют ремонта и замены. Это убытки. Однако, пока, озонирование – лишь перспектива, а не реалии сегодняшнего дня.
Метод затратнее хлорирования, а результаты обработки воды не столь впечатляющие. В металлургии активный хлор участвует в процессах получения ниобия, титана, тантала. Это редкие и ценные металлы, так что у 17-го элемента важная роль. Уважают вещество и аграрии. Они закупают хлорорганические соединения.
С их помощью борются с сорняками. Чтобы отравление хлором «не заработали» и культурные растения, они должны быть двудольными. Реагент пагубно действует лишь на однодольные побеги. Содержат хлор и инсектициды. Эти соединения направлены уже на вредителей-насекомых.
Инсектициды убивают их избирательно, оставляя нетронутыми растения и полезные микроорганизмы. Потребность человеческого организма – 800 миллиграммов в сутки. Получают их не только из соли.
Продукты содержащие хлор
Помогут морская рыба, а так же, яйца, стручковый горох, гречка и рис. Рыбу заменяют устрицами и морскими огурцами.
Ионы хлора из них поддерживают осмотическое равновесие систем организма и регулируют водно-соляной обмен. Орган, в котором сосредоточенна основная масса 17-го элемента – кожа. Хлор в ней должен постоянно обновляться, поскольку выводится с потом и мочой.
В них переходит почти столько же вещества, сколько потребляется. Поэтому, хлор должен присутствовать в рационе всегда.
Добыча хлора
Методы 18-го века в 21-ом не актуальны. Вместо использованного когда-то Карлом Шееле оксида марганца и соляной кислоты применяют обычные соль и воду. Натрий хлор растворяют и подвергают действию электрического тока.
Не нужно ни специального оборудования, ни тары, ни повышенных температур. Современный метод прост и дешев. Сколько хлора произвести диктует спрос. Так, в 1970-е миру требовались 20 000 000 тонн в год.
Тогда, в производстве основных неорганических продуктов 17-ый элемент занял 5-е место. Позиция осталась прежней, но объем потребления вырос. На 2015-ый год — около 28 000 000 тонн. Это и хлор для бассейна, и хлористый винил, и пестициды, и растворители, и хлор в таблетках.
Последние растворяют в воде и используют, как моющее и обеззараживающее средство.
Половину хлора производят в Соединенных Штатах. Это обосновано потребностью в 17-ом веществе самой Америки.
В год внутренняя промышленность потребляет около 12 000 000 тонн реагента. Весома роль на рынке и у Великобритании. Производят, в основном, соединения 17-го элемента, к примеру, кислоты хлора.
Если говорить не об искусственном получении хлора и его производстве, а о добычи в природе, то она сводится к выработке каменной соли. Получается, месторождения 17-го вещества разрабатывали еще 3000-4000 лет назад. Тогда, добывать соль начали на землях современной Ливии.
Общее количество хлора в земных недрах – всего 0,017%. Получается, при активной добыче есть возможность истощения ресурсов. Так что, в далекой перспективе стоимость 17-го элемента может возрасти. А какова она на данный момент?
Цена хлора
Хлор купить в чистом виде можно канистрами. Как правило, это 30-литровая тара. В нее вмещаются 34 килограмма хлора. Это указывает на тяжесть вещества, даже в газообразном состоянии. Цена канистры со сжиженным хлором 1500-1800 рублей.
Остальная продукция основана на соединениях 17-го элемента, поэтому, стоимость, порой, непредсказуема. Ценник зависит от производителя, разрекламированности товара, его транспортировки, затрат на синтез, или добычу основы.
Так, белизну можно купить и за 13, и за 45 рублей. На отбеливающие порошки, собственно, столь же весомый разброс цен. Речь и о стиральных, и о чистящих составах. Средство для плиты, к примеру, предлагают и за 20, и за 80 рублей. Причем, объем одинаков. Обычно, это 500 граммов.
Интересно! Многие хлорсодержащие средства можно использовать в качестве изоляторов.
Сжиженный элемент №17 проводит электрический ток в миллиард раз хуже дистиллированной воды. Можно поаплодировать сему факту. Но, услышать авиации придется с запозданием. Дело в том, что звук тоже «вязнет» в хлоре, распространяясь в полтора раза медленнее, чем в атмосферном воздухе.
Хлор (Cl, Chlorine)
История хлора
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Общая характеристика хлора
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).
Нахождение в природе
Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Физические и химические свойства
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
Суточная потребность в хлоре
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Продукты питания богатые хлором
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.
Взаимодействие с другими
Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Признаки нехватки хлора
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаки избытка хлора
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Полезные свойства хлора и его влияние на организм
Хлор в организме человека:
Применение хлора в жизни
Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
Хлор для чего используется
ХЛОР, химический элемент VII группы периодической системы, относится к галогенам. Атомный номер 17, относительная атомная масса 35,453. Природный хлор состоит из смеси двух изотопов – хлора-35 (75,77%) и хлора-37 (24,23%).
История получения.
Хлор, вероятно, получали еще алхимики, но его открытие и первое исследование неразрывно связано с именем знаменитого шведского химика Карла Вильгельма Шееле. Шееле открыл пять химических элементов – барий и марганец (совместно с Юханом Ганом), молибден, вольфрам, хлор, а независимо от других химиков (хотя и позже) – еще три: кислород, водород и азот. Это достижение впоследствии не смог повторить ни один химик. При этом Шееле, уже избранный членом Шведской королевской академии наук, был простым аптекарем в Чёпинге, хотя мог занять более почетную и престижную должность. Сам Фридрих II Великий, прусский король, предлагал ему занять пост профессора химии Берлинского университета. Отказываясь от подобных заманчивых предложений, Шееле говорил: «Я не могу есть больше, чем мне нужно, а того, что я зарабатываю здесь в Чёпинге, мне хватает на пропитание».
Многочисленные соединения хлора были известны, конечно, задолго до Шееле. Этот элемент входит в состав многих солей, в том числе и самой известной – поваренной соли. В 1774 Шееле выделил хлор в свободном виде, нагревая черный минерал пиролюзит с концентрированной соляной кислотой: MnO2 + 4HCl ® Cl2 + MnCl2 + 2H2O.
Вначале химики рассматривали хлор не как элемент, а как химическое соединение неизвестного элемента мурия (от латинского muria – рассол) с кислородом. Считалось, что и соляная кислота (ее называли муриевой) содержит химически связанный кислород. Об этом «свидетельствовал», в частности, такой факт: при стоянии раствора хлора на свету из него выделялся кислород, а в растворе оставалась соляная кислота. Однако многочисленные попытки «оторвать» кислород от хлора ни к чему не привели. Так, никому не удалось получить углекислый газ, нагревая хлор с углем (который при высоких температурах «отнимает» кислород от многих содержащих его соединений). В результате подобных опытов, проведенных Гемфри Дэви, Жозеф Луи Гей-Люссаком и Луи Жаком Тенаром, стало ясно, что хлор не содержит кислорода и является простым веществом. К тому же выводу привели и опыты Гей-Люссака, который проанализировал количественное соотношение газов в реакции хлора с водородом.
В 1811 Дэви предложил для нового элемента название «хлорин» – от греч. «хлорос» – желто-зеленый. Именно такой цвет имеет хлор. Этот же корень – в слове «хлорофилл» (от греч. «хлорос» и «филлон» – лист). Спустя год Гей-Люссак «сократил» название до «хлора». Но до сих пор англичане (и американцы) называют этот элемент «хлорином» (chlorine), тогда как французы – хлором (chlore). Приняли сокращенное название и немцы – «законодатели» химии на протяжении почти всего 19 в. (по-немецки хлор – Chlor). В 1811 немецкий физик Иоганн Швейгер предложил для хлора название «галоген» (от греческих «халс» – соль, и «геннао» – рождаю). Впоследствии этот термин закрепился не только за хлором, но и за всеми его аналогами по седьмой группе – фтором, бромом, иодом, астатом.
В 1826 шведский химик Йёнс Якоб Берцелиус, уточнив полученные им же ранее данные, определил для хлора атомную массу 35,41, которая отличается от современной лишь на 0,1%! Это поразительный результат, если учесть качество оборудования, с которым работал знаменитый химик. Основной инструмент для определения атомных масс – весы. Когда-то каждый экземпляр точных аналитических весов изготовлялся мастером вручную, и стоили хорошие весы очень дорого. Поэтому лишь немногие очень богатые химики могли похвастаться такими весами. Сам Берцелиус имел в молодые годы плохо оборудованную лабораторию с довольно грубыми весами, поэтому для получения надежных результатов он был вынужден повторять один и тот же анализ по 20–30 раз! В течение 10 лет Берцелиус опубликовал результаты анализа 2000 соединений, образованных 43 элементами, и труд, затраченный им на эту колоссальную работу, превосходит всякое воображение. Спустя почти столетие другой знаменитый химик, один из первых лауреатов Нобелевской премии по химии Вильгельм Оствальд, увидев в музее оборудование, с которым работал Берцелиус, сказал: «Мне стало совершенно ясно, как мало зависит от прибора и как много от человека, который перед ним сидит».
Хлор в природе.
Хлора в земное коре не очень много – всего 0,017%, причем в свободном состоянии он встречается лишь в небольших количествах в вулканических газах. В списке самых распространенных элементов хлор находится в конце второго десятка. Хлора меньше, чем даже ванадия и циркония (но больше, чем хрома, никеля, цинка, меди и азота). При этом хлор очень сильно распылен: небольшие количества этого элемента входят в состав множества различных минералов и горных пород. Очень высокая химическая активность хлора приводит к тому, что в природе он встречается, как правило, в виде соединений, в сочетании с натрием, калием, магнием, кальцием.
Хлор образует около ста минералов; главным образом это хлориды легких металлов – щелочных и щелочноземельных. Самый распространенный среди них – галит NaCl. Реже встречаются хлориды калия, кальция, магния. Из них наиболее распространены бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O, сильвин KCl, сильвинит NaCl·KCl, каинит KCl·MgSO4·3H2O, тахигидрит CaCl2·2MgCl2·12H2O. В виде таких соединений хлор содержится в соляных пластах, образовавшихся при высыхании древних морей. Особенно мощные залежи образует галит и калийные соли; их запасы оцениваются гигантским числом – более 10 триллионов тонн!
Очень много хлора содержится в морской воде – в среднем 1,9%. Происходит это потому, что хлор вымываемый из пород, нигде не может задержаться (почти все хлориды металлов растворимы) и выносится реками в моря и океаны. Но не следует думать, что попавший в морскую воду хлор уже не может вернуться на материки. В обратной миграции хлора большую роль играет ветер, уносящий соленую пыль с поверхности океанов, морей и соленых озер. Так хлор участвует в круговороте веществ. Но в засушливых и пустынных районах в результате интенсивного испарения воды концентрация хлора в грунтовых водах сильно повышается. Так образуются солончаки, особенно в низинах. Из различных источников ежегодно в мире добывают сотни миллионов тонн хлора.
Растворы хлоридов – обязательная составная часть живых организмов. Содержание хлора в теле человека 0,25%, в плазме крови – 0,35%. В теле взрослого человека содержится более 200 г хлорида натрия, из которых 45 г растворено в крови. В продуктах питания и природной воде часто недостаточно хлора для нормального развития человека, поэтому с древних времен люди подсаливают пищу. Вводят хлор и в подкормку животных. Растения же, в отличие от животных, никогда не испытывают дефицита хлора.
Получение хлора.
Метод Шееле в настоящее время используют редко – разве только во время лекционных демонстраций. В лабораториях для получения хлора используют более сильный окислитель – перманганат калия, который окисляет соляную кислоту уже при комнатной температуре: 2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 8H2O + 5Cl2. Этот способ был предложен немецким химиком Карлом Гребе. Аналогично идет реакция и с дихроматом калия:
K2Cr2O7 + 14HCl ® 2KCl + 2CrCl3 + 3Cl2 + 7H2O. Хлор выделяется также при действии соляной кислоты на хлорную известь: Ca(OCl)Cl + 2HCl ® CaCl2 + Cl2 + H2O. Можно окислить соляную кислоту до свободного хлора и концентрированным раствором пероксида водорода – пергидролем (реакция лучше идет на ярком свету). В 1867 английский технолог Генри Дикон разработал непрерывный способ получения хлора путем каталитического окисления хлороводорода кислородом воздуха над медным катализатором (диконовский процесс): 4HCl + O2 ® 2Cl2 + 2H2O. Сейчас этот метод имеет лишь историческое значение.
После того, как Алессандро Вольта создал в 1799 первый химический источник постоянного тока (вольтов столб), многие ученые начали изучать действие этого источника на различные вещества. Оказалось, что при пропускании тока через раствор поваренной соли можно получить хлор и гидроксид натрия. Однако промышленное значение этот метод приобрел только после 1872, когда для производства дешевой электроэнергии начали использовать изобретенные бельгийским мастером З.Т.Граммом динамо-машины. В настоящее время практически весь хлор получают электролизом водных растворов хлорида натрия: 2NaCl + 2H2O ® Cl2 + 2NaOH + H2. При этом хлор выделяется на аноде, тогда как на катоде также образуются ценные вещества – водород и гидроксид натрия. Путем повышения давления хлор сжижают и заливают в стальные баллоны, где он хранится под давлением около 6 атм. Чтобы выделяющийся при электролизе хлор не разрушал аноды, их делают из титановых сплавов и покрывают оксидами титана и рутения. Производство это энергоемкое – на тонну хлора расходуется в среднем 3000 кВт-ч электроэнергии. В развитых странах на производство хлора затрачивается около 2% всей вырабатываемой электроэнергии! Но одновременно получают и другие ценные продукты – едкий натр и водород. Получают свободный хлор в огромных количествах. Так, к началу 21 в. только в США его ежегодно производили в количестве более 11 млн. тонн!
Свойства хлора.
Хлор – тяжелый (в 2,5 раза тяжелее воздуха) желто-зеленый газ. Молекулы Cl2 легко диссоциируют на атомы при поглощении кванта света, а также при высокой температуре. При 730° С степень диссоциации составляет около 0,02%, а при 1730° С – уже почти 35%. При невысоких давлениях хлор близок к идеальным газам: 1 моль хлора при нормальных условиях занимает объем 22,06 л. При охлаждении до –34° С хлор сжижается, а при –101° С он затвердевает. Температуру сжижения газообразного хлора легко повысить, если увеличить давление; так при давлении 5 атм хлор кипит уже при +10,3° С.
Хлор неплохо растворяется в воде: при 10° С в 1 л воды растворяется 3,15 л хлора, при 20° С – 2,3 л. Образующийся раствор обычно называют хлорной водой. Если насытить хлором при атмосферном давлении холодную (ниже 9,6° С) воду, из раствора выделяются желтоватые кристаллы состава Cl2·6H2O. Такие же кристаллы гидрата хлора образуются при охлаждении влажного газообразного хлора. Нагревая гидрат хлора в одном колене запаянной изогнутой трубки и охлаждая второе колено льдом, Фарадей в 1823 получил жидкий хлор. Хлор хорошо растворяется во многих органических растворителях; так, в 100 г холодного бензола растворяется около 35 г хлора.
Химически хлор очень активен. Он реагирует почти со всеми веществами, даже с платиной (при температурах выше 560° С). А в хлорной воде растворяется и золото. В 1869 профессор химии в Эдинбурге Джемс Альфред Уанклин заметил, что хорошо высушенный хлор не действует на железо и некоторые другие металлы. В результате появилось возможность хранить безводный жидкий хлор в стальных баллонах. Промышленное производство жидкого хлора было налажено в 1888 немецкой фирмой БАСФ.
Высокую химическую активность хлора используют для демонстрации эффектных лекционных опытов. Так, при высыпании в колбу с хлором тонкого порошка металлической сурьмы он вспыхивает на лету красивыми белыми искорками, одновременно образуется белый дым SbCl3. Если в сосуд с хлором внести тонкую оловянную фольгу, она также самовоспламеняется, а на дно падает «огненный дождь»; в этой реакции образуются капли тяжелой дымящейся жидкости – SnCl4. Нагретые железные стружки горят в хлоре красноватым пламенем с образованием рыжего дыма FeCl3. Красный фосфор, внесенный в хлор, горит слабым зеленоватым пламенем. Очень энергично реагирует с хлор с рядом органических соединений. Так, если в цилиндр с хлором бросить комок ваты, смоченной скипидаром, он сразу же загорается, а из цилиндра вырывается пламя и облако сажи. Эффектно горит желтым пламенем в хлоре натрий, образуя на стенках сосуда белый налет соли. Этот опыт в молодости провел будущий академик, лауреат Нобелевской премии по химии Н.Н.Семенов. Собрав со стенок сосуда белый налет, он посыпал им кусок черного хлеба и смело съел; химия не подвела: из ядовитого газа и щелочного металла действительно получилась поваренная соль!
Хлор активно и с выделением значительного количества тепла реагирует с водородом:
Cl2 + H2 ® 2HCl + 184 кДж. Реакция идет по цепному механизму, и если скорость ее инициирования велика (сильное освещение ультрафиолетовым или сине-фиолетовым светом, нагрев до высокой температуры), смесь газов (если хлора в ней содержится более 11,5 и менее 95%) взрывается (см. также ЦЕПНЫЕ РЕАКЦИИ).
Интересна демонстрация горения водорода в атмосфере хлора: иногда во время опыта возникает необычный побочный эффект: раздается гудение. Чаще всего пламя гудит, когда тонкую трубку, по которой подается водород, опускают в заполненный хлором сосуд конической формы; то же справедливо для сферических колб, а вот в цилиндрах пламя обычно не гудит. Это явление назвали «поющим пламенем».
В водном растворе хлор частично и довольно медленно реагирует с водой; при 25° С равновесие: Cl2 + H2O 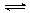
Хлор в своих соединениях может проявлять все степени окисления – от –1 до +7. С кислородом хлор образует ряд оксидов, все они в чистом виде нестабильны и взрывоопасны: Cl2O – желто-оранжевый газ, ClO2 – желтый газ (ниже 9,7 о С – яркокрасная жидкость), перхлорат хлора Cl2O4 (ClO–ClO3, светло-желтая жидкость), Cl2O6 (O2Cl–O–ClO3, ярко-красная жидкость), Cl2O7 – бесцветная очень взрывчатая жидкость. При низких температурах получены нестабильные оксиды Cl2O3 и ClO3. Оксид ClO2 производится в промышленном масштабе и используется вместо хлора для отбеливания целлюлозы и обеззараживания питьевой воды и сточных вод. С другими галогенами хлор образует ряд так называемых межгалогенных соединений, например, ClF, ClF3, ClF5, BrCl, ICl, ICl3.
Хлор и его соединения с положительной степенью окисления – сильные окислители. В 1822 немецкий химик Леопольд Гмелин путем окисления хлором получил из желтой кровяной соли красную: 2K4[Fe(CN)6] + Cl2 ® K3[Fe(CN)6] + 2KCl. Хлор легко окисляет бромиды и хлориды с выделением в свободном виде брома и иода.
Хлор в разных степенях окисления образует ряд кислот: HCl – хлороводородная (соляная, соли – хлориды), HClO – хлорноватистая (соли – гипохлориты), HClO2 – хлористая (соли – хлориты), HClO3 – хлорноватая (соли – хлораты), HClO4 – хлорная (соли – перхлораты). В чистом виде из кислородных кислот устойчива только хлорная. Из солей кислородных кислот практическое применение имеют гипохлориты, хлорит натрия NaClO2 – для отбеливания тканей, для изготовления компактных пиротехнических источников кислорода («кислородные свечи»), хлораты калия (бертолетова соль), кальция и магния (для борьбы с вредителями сельского хозяйства, как компоненты пиротехнических составов и взрывчатых веществ, в производстве спичек), перхлораты – компоненты взрывчатых веществ и пиротехнических составов; перхлорат аммония – компонент твердых ракетных топлив.
Хлор реагирует со многими органическими соединениями. Он быстро присоединяется к непредельным соединениям с двойными и тройными углерод-углеродными связями (реакция с ацетиленом идет со взрывом), а на свету – и к бензолу. При определенных условиях хлор может замещать атомы водорода в органических соединениях: R–H + Cl2 ® RCl + HCl. Эта реакция сыграла значительную роль в истории органической химии. В 1840-х французский химик Жан Батист Дюма обнаружил, что при действии хлора на уксусную кислоту с удивительной легкостью идет реакция
СН3СООН + Cl2 ® CH2ClCOOH + HCl. При избытке хлора образуется трихлоруксусная кислота ССl3СООН. Однако многие химики отнеслись к работе Дюма недоверчиво. Ведь согласно общепринятой тогда теории Берцелиуса положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора. Этого мнения придерживались в то время многие выдающиеся химики, среди которых были Фридрих Вёлер, Юстус Либих и, конечно, сам Берцелиус.
Чтобы высмеять Дюма, Вёлер передал своему другу Либиху статью от имени некоего Ш.Виндлера (Schwindler – по-немецки мошенник) о новом удачном приложении якобы открытой Дюма реакции. В статье Вёлер с явной издёвкой написал о том, как в уксуснокислом марганце Mn(CH3COO)2 удалось все элементы, в соответствии с их валентностью, заместить на хлор, в результате чего получилось желтое кристаллическое вещество, состоящее из одного только хлора. Далее говорилось, что в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные, и что при этом вещи сохраняют свой внешний вид. В сноске было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, так как этот материал очень хорош для ночных колпаков и теплых подштанников.
Либиху шутка понравилась, и он опубликовал ее (на французском языке) от имени Ш.Виндлера всего через несколько страниц после статьи Дюма. Намек получился очень прозрачным. Тем не менее прав оказался все же Дюма.
Реакция хлора с органическими соединениями приводит к образованию множества хлорорганических продуктов, среди которых – широко применяющиеся растворители метиленхлорид CH2Cl2, хлороформ CHCl3, четыреххлористый углерод CCl4, трихлорэтилен CHCl=CCl2, тетрахлорэтилен C2Cl4. В присутствии влаги хлор обесцвечивает зеленые листья растений, многие красители. Этим пользовались еще в XVIII в. для отбеливания тканей.
Хлор как отравляющий газ.
Получивший хлор Шееле отметил его очень неприятный резкий запах, затруднение дыхания и кашель. Как потом выяснили, человек чувствует запах хлора даже в том случае, если в одном литре воздуха содержится лишь 0,005 мг этого газа, и при этом он уже оказывает раздражающее действие на дыхательные пути, разрушая клетки слизистой оболочки дыхательных путей и легких. Концентрация 0,012 мг/л переносится с трудом; если же концентрация хлора превышает 0,1 мг/л, он становится опасным для жизни: дыхание учащается, становится судорожным, а затем – все более редким, и уже через 5–25 минут происходит остановка дыхания. Предельно допустимой в воздухе промышленных предприятий считается концентрация 0,001 мг/л, а в воздухе жилых районов – 0,00003 мг/л.
Петербургский академик Товий Егорович Ловиц, повторяя в 1790 опыт Шееле, случайно выпустил значительное количество хлора в воздух. Вдохнув его, он потерял сознание и упал, потом в течение восьми дней страдал от мучительной боли в груди. К счастью, он выздоровел. Чуть не умер, отравившись хлором, и знаменитый английский химик Дэви. Опыты даже с небольшим количеством хлора опасны, так как могут вызвать сильное поражение легких. Рассказывают, что немецкий химик Эгон Виберг одну из своих лекций о хлоре начал словами: «Хлор – ядовитый газ. Если я отравлюсь во время очередной демонстрации, вынесите меня, пожалуйста, на свежий воздух. Но лекцию при этом придется, к сожалению, прервать». Если же выпустить в воздух много хлора, он становится настоящим бедствием. Это испытали на себе во время Первой мировой войны англо-французские войска. Утром 22 апреля 1915 германское командование решило провести первую в истории войн газовую атаку: когда ветер подул в сторону противника, на небольшом шестикилометровом участке фронта в районе бельгийского городка Ипр были одновременно открыты вентили 5730 баллонов, каждый из которых содержал 30 кг жидкого хлора. В течение 5 минут образовалось огромное желто-зеленое облако, которое медленно уходило от немецких окопов в сторону союзников. Английские и французские солдаты оказались полностью беззащитными. Газ проникал через щели во все укрытия, от него не было спасения: ведь противогаз еще не был изобретен. В результате было отравлено 15 тысяч человек, из них 5 тысяч – насмерть. Через месяц, 31 мая немцы повторили газовую атаку на восточном фронте – против русских войск. Это произошло в Польше у города Болимова. На фронте 12 км из 12 тысяч баллонов было выпущено 264 тонны смеси хлора со значительно более ядовитым фосгеном (хлорангидридом угольной кислоты COCl2). Царское командование знало о том, что произошло при Ипре, и тем не менее русские солдаты не имели никаких средств защиты! В результате газовой атаки потери составили 9146 человек, из них только 108 – в результате ружейного и артиллерийского обстрела, остальные были отравлены. При этом почти сразу же погибло 1183 человека.
Вскоре химики указали, как спасаться от хлора: надо дышать через марлевую повязку, пропитанную раствором тиосульфата натрия (это вещество применяется в фотографии, его часто называют гипосульфитом). Хлор очень быстро реагирует с раствором тиосульфата, окисляя его:
Na2S2O3 + 4Cl2 + 5H2O ® 2H2SO4 + 2NaCl + 6HCl. Конечно, серная кислота тоже не безвредное вещество, но ее разбавленный водный раствор намного менее опасен, чем ядовитый хлор. Поэтому у тиосульфата в те годы появилось еще одно название – «антихлор», но первые тиосульфатные противогазы были мало эффективны.
Применение хлора.
Ежегодно во всем мире получают огромные количества хлора – десятки миллионов тонн. Только в США к концу 20 в. ежегодно путем электролиза получали около 12 млн. тонн хлора (10-е место среди химических производств). Основная его масса (до 50%) расходуется на хлорирование органических соединений – для получения растворителей, синтетического каучука, поливинилхлорида и других пластмасс, хлоропренового каучука, пестицидов, лекарственных средств, многих других нужных и полезных продуктов. Остальное потребляется для синтеза неорганических хлоридов, в целлюлозно-бумажной промышленности для отбеливания древесной пульпы, для очистки воды. В сравнительно небольших количествах хлор используют в металлургической промышленности. С его помощью получают очень чистые металлы – титан, олово, тантал, ниобий. Сжиганием водорода в хлоре получают хлороводород, а из него – соляную кислоту. Хлор применяют также для производства отбеливающих веществ (гипохлоритов, хлорной извести) и обеззараживания воды хлорированием.
Якименко Л.М. Производство хлора, каустической соды и неорганических хлоропродуктов. М., Химия, 1974
Барков С.А. Галогены и подгруппа марганца: Элементы VII группы периодической системы Д.И.Менделеева. М., Просвещение, 1976
Фурман А.А. Неорганические хлориды. М., Химия, 1980