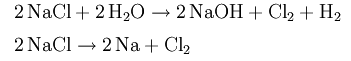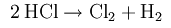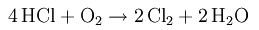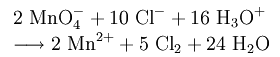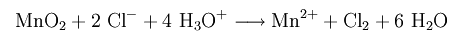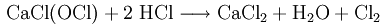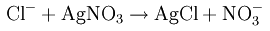Хлора неорганические соединения что это
Соединения хлора
Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
Физические свойства хлороводорода
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
Химические свойства хлорноватистой кислоты:
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
HClO + KOH → KClO + H2O
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
NaClO + 2HCl → NaCl + Cl2 + H2O
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
Химические свойства хлористой кислоты:
Соли хлористой кислоты – хлориты
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
Химические свойства солей хлорной кислоты – перхлоратов:
Оксиды хлора
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
Хлор и его соединения
Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ — оксидов, кислот, солей, бинарных соединений.
В природе — двенадцатый по химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью — в щелочном растворе:
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Реакции с соединениями других галогенов:
Качественная реакция — взаимодействие недостатка СL2 с КI (см. выше) и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
(аналогично с участием других окислителей; подробнее см. реакции для НСl и NaСl).
Хлор относится к продуктам основного химического производства, используется для получения брома и йода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Качественная реакция на ион Сl — — образование белых осадков АgСl и Нg2Сl2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд. Уравнения важнейших реакций:
Получение НСl в промышленности — сжигание Н2 в Сl2 (см.), в лаборатории — вытеснение из хлоридов серной кислотой:
Хлорид натрия NaСl. Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Применяется для получения водорода, натрия и хлора, соды, едкого натра и хлороводорода, как компонент охлаждающих смесей, пищевой продукт и консервирующее средство.
В природе — основная часть залежей каменной соли, или галита, и сильвинита (вместе с КСl),рапы соляных озер, минеральных примесей морской воды (содержание NaСl=2,7%). В промышленности получают выпариванием природных рассолов.
Уравнения важнейших реакций:
Хлорид калия КСl. Бескислородная соль. Белый, негигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, раствор имеет горький вкус, гидролиза нет. Вступает в реакции ионного обмена. Применяется как калийное удобрение, для получения К, КОН и Сl2. В природе основная составная часть (наравне с NаСl) залежей сильвинита.
Уравнения важнейших реакций одинаковы с таковыми для NаСl.
Хлорид кальция СаСl2. Бескислородная соль. Белый, плавится без разложения. Расплывается на воздухе за счет энергичного поглощения влаги. Образует кристаллогидрат СаСl2 6Н2О с температурой обезвоживания 260 °С. Хорошо растворим в воде, гидролиза нет. Вступает в реакции ионного обмена. Применяется для осушения газов и жидкостей, приготовления охлаждающих смесей. Компонент природных вод, составная часть их «постоянной» жесткости.
Уравнения важнейших реакций:
Качественная реакция на ион Аl 3+ — образование осадка АlРO4, который переводится в раствор концентрированной серной кислотой.
Применяется как сырье в производстве алюминия, катализатор в органическом синтезе и при крекинге нефти, переносчик хлора в органических реакциях. Уравнения важнейших реакций:
Получение АlСl в промышленности — хлорирование каолина, глинозёма или боксита в присутствии кокса:
Хлорид железа(II) FеСl2. Бескислородная соль. Белый (гидрат голубовато-зеленый), гигроскопичный. Плавится и кипит без разложения. При сильном нагревании летуч в потоке НСl. Связи Fе — Сl преимущественно ковалентные, пар состоит из мономеров FеСl2 (линейное строение, sр-гибридизация) и димеров Fе2Сl4. Чувствителен к кислороду воздуха (темнеет). Хорошо растворим в воде (с сильным экзо-эффектом), полностью диссоциирует на ионы, слабо гидролизуется по катиону. При кипячении раствора разлагается. Реагирует с кислотами, щелочами, гидратом аммиака. Типичный восстановитель. Вступает в реакции ионного обмена и комплексообразования.
Применяется для синтеза FеСl и Fе2О3, как катализатор в органическом синтезе, компонент лекарственных средств против анемии.
Уравнения важнейших реакций:
FеСl2 + Н2 = 2НСl + Fе (особо чистое,выше 500 °С)
5Fе 2+ + 8Н + + МnО — 4 = 5Fе 3+ + Мn 2+ + 4Н2O
6Fе 2+ + 14Н + + Сr2O7 2- = 6Fе 3+ + 2Сr 3+ +7Н2O
Fе 2+ + S 2- (разб.) = FеS↓
Получение: взаимодействие Fе с соляной кислотой:
(в промышленности используют хлороводород и ведут процесс при 500 °С).
Применяется как хлорагент, катализатор в органическом синтезе, протрава при крашении тканей, коагулянт при очистке питьевой воды, травитель медных пластин в гальванопластике, компонент кровоостанавливающих препаратов.
Уравнения важнейших реакций:
Качественная реакция на ион NН4 + — выделение NН3 при кипячении со щелочами или при нагревании с гашёной известью.
Применяется в неорганическом синтезе, в частности для создания слабокислотной среды, как компонент азотных удобрений, сухих гальванических элементов, при пайке медных и лужении стальных изделий.
Уравнения важнейших реакций:
Получение: взаимодействие NH3 с НСl в газовой фазе или NН3 Н2О с НСl в растворе.
Гипохлорит кальция Са(СlО)2. Соль хлорноватистой кислоты НСlO. Белый, при нагревании разлагается без плавления. Хорошо растворим в холодной воде (образуется бесцветный раствор), гидролизуется по аниону. Реакционноспособный, полностью разлагается горячей водой, кислотами. Сильный окислитель. При стоянии раствор поглощает углекислый газ из воздуха. Является активной составной частью хлорной (белильной) извести — смеси неопределенного состава с СаСl2 и Са(ОН)2. Уравнения важнейших реакций:
Хлорат калия КСlO3. Соль хлорноватой кислоты НСlO3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории — твердый источник кислорода.
Уравнения важнейших реакций:
Получение КСlO3в промышленности — электролиз горячего раствора КСl (продукт КСlO3 выделяется на аноде):
Бромид калия КВr. Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем
Качественная реакция на ион Вr — вытеснение брома из раствора КВr хлором и экстракция брома в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
5Вr — + 6Н + + ВrО3 — = 3Вr 2 + 3Н2O
Иодид калия КI. Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор КI хорошо растворяет I2 за счет комплексообразования.
Качественная реакция на ион I — вытеснение иода из раствора КI недостатком хлора и экстракция иода в органический растворитель, например ССl4 (в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
10I — + 16Н + + 2МnO4 — = 5I2↓ + 2Мn 2+ + 8Н2O
Хлор (Cl)
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название «хлорин», которое вскоре было сокращено до «хлор» с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название «галоген», но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Природный хлор состоит из смеси двух изотопов:
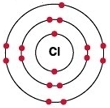
Рис. Строение атома хлора.
Физические свойства хлора:
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
Взаимодействие хлора со сложными веществами:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
Хлор «охотно» вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Хлор (Cl)
Хлор является элементом основной группы VII и получил свое название от цвета газообразного хлора “хлорос” (зеленый). Это зелено-желтый, очень ядовитый газ с резким запахом. Хлор плохо растворяется в воде, 0,5% раствор называется хлорированной водой. Хлор тяжелее воздуха (примерно в 2,5 раза).
Хлор является очень реактивным газом и образует большое количество органических и неорганических соединений. Наиболее важными неорганическими соединениями являются хлористый водород, соляная кислота и встречающиеся в природе хлориды металлов, которые служат сырьем для производства многих химикатов и продуктов, например, каустическая сода, ПВХ, силиконов, моющих средств, пестицидов и средств от сорняков (гербицидов).
История
Хлор был открыт Карлом Вильгельмом Шееле в 1774 году.
Свойства
Желто-зеленый, негорючий, едкий газ, в 2,5 раза тяжелее воздуха. Хлор очень реактивен и вытесняет бром и йод из их водородных и металлических связей. Вступает в реакцию со многими другими элементами с образованием хлоридов. Умеренно растворим в воде, используется для хлорирования воды.
Смеси хлора и водорода (газообразный хлор-кислород) взрываются при воздействии тепла или света.
Нахождение в природе
Хлор не существует в природе в элементарной форме, но главным образом как анион Cl — (хлорид), который является очень реакционноспособным элементом. Но есть и природные органические соединения хлора (соли) с ковалентной связью. Например, хлорид натрия и хлорид калия можно найти во многих крупных солевых отложения. Хлориды составляют примерно 0,05% объема земной коры.
Производство
В промышленном масштабе, хлор получают с помощью так называемого хлорно-щелочного электролиза в виде хлорида натрия — раствора или расплава:
Соляная кислота, которая образуется в ходе реакции хлора с органическими углеводородами, также может быть использована в качестве исходного сырья. Которая может быть преобразована обратно в хлор с помощью электрического тока в водном растворе:
До появления электролитического процесса применялось прямое окисление хлористого водорода с кислородом или воздухом:
Эту равновесную реакцию проводили на катализаторах на основе хлорида меди (II) (CuCl2). Из-за крайне агрессивной реакционной смеси, этот технологический процесс был связан с большими трудностями.
В лабораторных условиях хлор можно получить реакцией перманганата калия с концентрированной соляной кислотой
Реакцией диоксида марганца с концентрированной соляной кислотой
Реакцией хлорной извести с концентрированной соляной кислотой
Физические свойства
При нормальных условиях хлор является газообразным веществом. Обладает едким, резким запахом и классифицируется как токсичный. Хлор относительно растворим в воде: 0,0921 моль растворяется в одном литре при 25 С при нормальном атмосферном давлении.
Этот водный раствор хлора называют хлористый водород и содержит небольшие количества соляной кислоты.
Химические свойства
Хлор не горит в воздухе, но он является одним из наиболее реактивных элементов в периодической таблице. Даже при нормальной температуре он реагирует с многочисленными элементами, многими органическими и неорганическими соединениями.
Реакции хлора
Наряду с фтором хлор является одним из самых реактивных элементов. Это мощный окислитель. Даже при комнатной температуре хлор реагирует со многими элементами, выделяя большое количество тепла (экзотермические реакции). С щелочными, щелочноземельными и другими металлами образует ионные соединения, соли металлов.
Неметаллы, такие как водород и фосфор, полуметаллы, такие как бор и кремний, реагируют с хлором с образованием молекулярных соединений. Поскольку хлор является очень реактивным элементом, он часто встречается в природе. Огромные солевые месторождения в основном содержат минералы каменную соль (NaCl), сильвин (KCl) или сильвинит. Количество хлоридов, растворенных в Мировом океане, почти неизмеримо, если учесть, что морская вода состоит в основном из хлоридных солей.
Изотопы
Природный хлор представляет собой смесь двух стабильных изотопов: 35 Cl и 37 Cl.
Соединения хлора
Хлороводород
Важными неорганическими соединениями хлора являются хлористый водород и хлориды. Хлороводород состоит из одного атома хлора и одного атома водорода, которые связаны полярной атомной связью. Бесцветен, имеет резкий запах, негорюч и хорошо растворяется в воде.
Газообразный хлористый водород менее реактивен, чем его водный раствор соляной кислоты.
Соляная кислота
Соляная кислота является сильной кислотой, потому что молекула HCl полностью диссоциирует на ионы водорода и ионы хлора в водном растворе. Соляная кислота реагирует с основными металлами в окислительно-восстановительной реакции с образованием водорода и хлоридов металлов. Она легко растворяет ряд оксидов и карбонатов металлов и поэтому может использоваться для очистки металлов (травление) и удаления накипи.
Обычными коммерческими формами являются разбавленная соляная кислота (около 7%), концентрированная соляная кислота (около 30%) и дымящая соляная кислота (около 37%). Как сильная неорганическая кислота, соляная кислота используется во многих отраслях промышленности. Помимо обработки металлов, она служит сырьем для производства различных соединений хлора, нейтрализации щелочных сточных вод и для кислотной обработки источников нефти и газа.
Хлориды
Хлориды — это соединения соляной кислоты. Хлориды образуются в результате окислительно-восстановительной реакции соляной кислоты с основными металлами, с оксидами металлов или в результате реакции нейтрализации гидроксидами металлов. Хлориды обычно хорошо растворяются в воде и диссоциируют на положительно заряженные катионы и хлорид-анионы.
Важными ионными хлоридами являются хлорид натрия и хлорид калия. Хлорид натрия из солевых отложений известен как каменная соль. Лишь небольшая часть полученной каменной соли используется как поваренная соль для наших блюд и как консервант для рыбных и мясных продуктов. В химической промышленности хлорид натрия используется в качестве сырья, например производства соляной кислоты, каустической соды, хлора.
Хлорид калия и другие соли калия, полученные из него, такие как сульфат калия, являются важными минеральными удобрениями, содержащими ионы калия. Который является основным сельхозудобрением.
Органические соединения
Помимо неорганических, существует огромное количество органических соединений хлора, например хлорированные углеводороды, хлорангидриды, хлорированные ароматические соединения, такие как хлорбензол. Однако это почти исключительно антропогенные соединения, созданные человеком. В природе же существует лишь несколько органических соединений хлора.
Применение
Крупнейшими потребителями хлора являются компании, производящие этилендихлорид и другие хлорированные растворители, поливинилхлорид (ПВХ), хлорфторуглероды и оксиды пропилена. На бумажных фабриках хлор используется для отбеливания бумаги. Компании водоснабжения и водоотведения используют хлор для дезинфекции воды.
Около 30% хлора используется в химической промышленности, около 25% требуется для производства ПВХ, 20% для очистки воды, 15% используется в растворителях и около 10% в отбеливателях.
Этот элемент также необходим для производства лекарств, силиконов и полимеров. Хлор также входит в состав бытовых отбеливателей, средств для удаления краски, антипиренов и пестицидов.
Другие применения соединений хлора:
Высокая реакционная способность (является активным окислителем) привела к использованию хлора в качестве отбеливателя (например, в бумажной промышленности). Сейчас в этой роли все чаще используют перекись водорода, из-за вредного воздействия хлора на окружающую среду.
Хлор используется в качестве недорогого дезинфицирующего средства для питьевой воды. Получающаяся в результате хлорноватистая кислота убивает практически все вирусы и бактерии. Так называемый хлорный эффект (депо) имеет преимущество перед другими агентами. То есть после добавления хлора в водопровод, он оказывает дезинфицирующее действие на трубопроводную сеть еще в течение длительного времени. Большинство общественных бассейнов используют хлор в качестве дезинфицирующего средства.
Строительство
В прошлом в кирпичную кладку иногда добавляли хлорсодержащий антифриз. Выцветание хлоридов на необработанных кирпичных поверхностях может быть результатом неправильного подкисления. Кладка должна быть тщательно влажной перед подкислением, а после обработки ее следует быстро и обильно промыть.
Цель состоит в том, чтобы преобразовать CaCO3 (нерастворимый в воде раствор), который уже застыл с разбавленной соляной кислотой, в растворимый и моющийся хлорид кальция.
Хлорсодержащие материалы, применяемые в строительстве и быту:
Биологическое значение
Физиологически, хлор имеет большое значение в ионной форме хлорида как минерала. Употребляется в пищу в основном в форме поваренной соли (хлорид натрия). Ежедневно человек потребляет от 3 до 12г соли, которая выводится через почки и пот.
Хлорид натрия необходим для выработки желудочной кислоты, поддержания осмоса в организме, а также для проводимости нервных импульсов.
Обнаружение
Хлор и вода
Среднее содержание хлора в морской воде составляет около 20 000 частей на миллион (2%). Концентрация в речной воде обычно составляет около 8 частей на миллион. Хлор — один из самых реактивных элементов, поэтому он легко вступает в реакцию с водой, образуя соляную кислоту и гипохлорит.
Растворимость газообразного хлора в воде составляет около 6,3 г / л при стандартных условиях. Считается, что соли хлора также легко растворяются в воде.
Как хлор может попасть в воду?
Хлор естественным образом содержится в некоторых минералах, таких как галит, сильвин и карналлит. Он не встречается в природе в свободной форме, а только в соединениях, в основном в виде хлорида натрия (поваренная соль). Поваренную соль получают в основном из галита, но ее также можно извлечь из морской воды.
Использование противообледенительных солей на дорогах и человеческих экскрементов в городских сточных водах быстро приводит к увеличению количества хлоридов в воде и почве.
Какие экологические проблемы может вызвать загрязнение воды хлором?
Концентрация хлоридов в нормальных почвах колеблется в пределах 50-2000 ppm. Самые высокие концентрации соли можно найти в засушливых и полузасушливых районах, а также в районах, расположенных недалеко от моря.
Растения поглощают хлорид через свои корни, а газообразный хлор через надземные части растения. У растения часто наблюдается скопление хлоридов в цитоплазме. Содержание хлора в растениях обычно составляет около 2000-20 000 частей на миллион. Некоторые деревья, такие как чинары или дубы, могут спокойно переносить относительно высокие концентрации солей хлора в почве.
В водных процессах часто происходят взаимодействия между хлоридом и железом, что имеет место, например, в фотохимических процессах. Также интересно, что хлорид натрия в частицах морской соли может реагировать с оксидами азота, образуя атомы хлора, которые могут разрушать озон.
Опасность для здоровья
При попадании на слизистые оболочки, образуются хлорноватистая и соляная кислоты. В зависимости от концентрации, вдыхание приводит к раздражению слизистых оболочек, кашлю и одышке, а также к удушью.
Попадание жидкого хлора может вызвать ожоги как слизистых оболочек, так и кожи.
Газообразный хлор крайне токсичен при вдыхании, раздражает дыхательные пути, глаза, кожу и пищеварительный тракт. Вызывает повреждение легких с тяжелыми хроническими последствиями, различные сердечно-сосудистые заболевания. Концентрация хлора около 0,5% в воздухе смертельна для человека. Концентрация около 0,001% уже может вызывать симптомы отравления.
Одно из научных исследований установило, что хлорированная вода увеличивает риск рака мочевого пузыря на 35 процентов. Плавание в хлорированной воде увеличивает опасность уже на 57 процента. Негативные эффекты зависят от концентрации хлора, продолжительности и частоты приема, а также от состояния здоровья человека.
Техника безопасности
Хранить контейнеры, содержащие хлор, плотно закрытыми в хорошо проветриваемом месте, вдали от открытого огня, тепла и солнечного света, а также влаги. При входе в помещение с газообразным хлором всегда надевать защитные респираторы.
Замена баллона с газообразным хлором возможна только при защите рук (защитные перчатки) и органов дыхания (полнолицевая маска с кислородным фильтром или автономный дыхательный аппарат). После каждой замены баллона необходимо проверять герметичность фитингов и предохранять баллоны от опрокидывания (фиксация на кронштейне).
Первая помощь при отравлении хлором
При попадании в глаза: промыть под проточной водой в течение 10–15 минут с широко открытым веком. Затем немедленно обратиться к офтальмологу.
Экология
Использование многих продуктов, содержащих хлор, экологически сомнительно. С одной стороны, электролитическое производство хлора требует больших затрат энергии. Однако гораздо важнее то, что многие продукты, содержащие хлор, могут нанести вред окружающей среде и здоровью человека.
Причина заключается в том, что из-за недостатка природных органических соединений хлора очень немногие микроорганизмы специализируются на разложении этих соединений в ходе эволюции. Следствием этого является то, что эти неприродные соединения часто остаются в окружающей среде в течение очень долгого времени, поскольку они химически очень стабильны. Если соединения хлора затем попадают в пищевую цепь, то накапливаются в организме в конечных звеньях цепи (биоаккумуляция).
При утилизации хлорорганических соединений и пластиковых отходов из ПВХ образуются очень ядовитые диоксины и другие ядовитые соединения хлора, загрязняющие окружающую среду.