Хлорид аммония что это такое
Хлорид аммония (Е510)

Хлорид аммония хотя и классифицируется как пищевая добавка Е510, но особенной популярностью среди производителей продуктов питания не пользуется, и в пище встречается достаточно редко. Впрочем, это замечание не вполне справедливо для стран Европейского союза – там хлорид аммония можно обнаружить в некоторых популярных продуктах и лакомствах. В химической и пищевой отрасли производства вещество ещё называют солянокислым аммонием или аммонийной солью.
Химическая характеристика, технологии получения вещества
Добавка, хотя и синтезируется искусственным путём для промышленных целей, распространена и в живой природе. Впервые с неё столкнулись ещё жители древних Египта и Греции: египтяне обнаружили белый кристаллический налёт хлорида аммония на стенах пещер в скальных породах, а позже греки начали добывать его из сажи, которая образовывалась внутри печных труб. Топливом на тот момент служил высушенный помёт верблюдов.
И сегодня вещество встречается в виде налёта и корочек на скальных породах, рядом с вулканическими сопками и в расщелинах земной коры. Кроме того, аммониевая соль является одним из продуктов распада экскрементов животных.
На вид добавка представляет собой белый порошок, состоящий из мелких кристалликов. Именно порошковая форма вещества не имеет никакого запаха, на вкус она немного солоновата и оставляет ощущение прохлады во рту. Хлорид аммония обладает высокой растворимостью в жидком аммиаке, этиловом и метиловом спирте, а также в воде, при чём особенно хорошо растворяется в тёплой или горячей воде. Получаемый таким образом водный раствор как раз и имеет тот специфический резкий запах, хорошо знакомый каждому, кто хоть раз терял сознание. Кроме того, вещество подвержено реакциям со щелочами.
Иногда аммониевая соль встречается и в виде крупных кристаллов, но для удобства промышленного пользования её всё равно измельчают в порошок.
Температура плавления добавки Е510 – 337,6 градуса Цельсия, при температуре 338 и выше градусов происходит распад. При возгорании порошкообразная добавка выделяет густой белый дым.
Существует несколько способов синтезирования хлорида аммония. В лабораторных условиях выработка происходит путём проведения реакции аммиака с хлором. Для промышленных целей вещество получают в результате нескольких этапов:
Некоторые “умельцы” получают хлорид аммония в домашних условиях, используя для этого обычные солевые батарейки.
Как пищевая добавка, вещество чаще всего используется в качестве эмульгатора и загустителя: с его помощью можно создавать однородные смеси компонентов, которые не смешиваются в обычных условиях, а также улучшить консистенцию продукта и регулировать её вязкость.
Использование свойств аммониевой соли в промышленности

Скандинавские страны пользуются свойствами добавки для изготовления лакричных конфет (это, кстати, одна из причин, почему ими нельзя увлекаться – при переедании лакрицы могут появиться тошнота и рвота именно из-за хлорида аммония). В Норвегии вещество известно как приправа к различным блюдам.
Различные сферы производства, кроме пищевой, тоже применяют аммониевую соль:
Виноделы пользуются порошковой формой добавки в качестве подкормки для дрожжевой среды зреющих вин. Всего 0,3 грамма раствора на 1 литр напитка вносится не чаще, чем раз в месяц для того, чтобы вино могло перебродить до нужного состояния.
Техническая соль аммония, которая продаётся в аптеках, может быть полезной и в быту: его раствор хорошо выводит загрязнения с одежды, мебели, украшений, посуды и бытовой техники.
Воздействие вещества на человека
Самое известное свойство соли аммония – возбуждающее. При потере сознания вдыхаемые пары раствора вещества способны оказать сильный стимулирующий эффект на дыхательные центры и привести человека в чувство.
Кроме того, добавка обладает мочегонным свойством и может применяться для борьбы с отёчностью и застоями жидкости. В таком случае предписывают принимать слабый раствор вещества в очень маленьких количествах. Добавка всасывается организмом из пищеварительного тракта и выводится почками вместе со всей лишней жидкостью. Для тех, кто имеет в анамнезе заболевания почек, приём вещества категорически запрещён.
Также хлорид аммония оказывает отхаркивающее действие при сильном кашле, вызванном хроническим бронхитом, бронхиальной астмой или пневмонией.
Вдыхание большого количества паров добавки Е510 крайне опасно, так как может спровоцировать ожог дыхательных путей и остановку дыхания. Передозировка раствором аммониевой соли вызывает неприятные симптомы отравления: тошноту, рвоту и потерю аппетита.
В некоторых государствах использование этой пищевой добавки под запретом. В России, Украине и многих странах Европейского союза строгих ограничений по её использованию нет.
Существует неподтверждённая информация о том, что в процессе термообработки хлорид аммония становится токсичным и опасным для человека. Официальных доказательств пока обнародовано не было. Также нет у науки подтверждённых данных о возможной мутагенности или онкогенности вещества.
Хлорид аммония в виде порошка или раствора применяется во многих сферах промышленности. Для человека это вещество не представляет серьёзной опасности при соблюдении некоторых элементарных требований осторожности, оно легко всасывается и выводится из организма, не причиняя ему существенного вреда. Знаменитые лакричные конфеты, а также мучные изделия, макароны, сладости и плодовое вино – в этих продуктах можно столкнуться с пищевой добавкой Е510.
Хлорид аммония
| Хлорид аммония | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия образования (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Классификация | |
| Рег. номер CAS | [12125-02-9] |
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид аммония» в других словарях:
хлорид аммония — хлористый аммоний … Cловарь химических синонимов I
АММОНИЯ ХЛОРИД — (NH4Cl), аммониевая соль соляной кислоты. В прошлом его называли нашатырем. Хлорид аммония твердое тело белого цвета, отличается летучестью, высокой растворимостью; его получают путем реакции между аммиаком и хлоридом водорода. Применяется в… … Научно-технический энциклопедический словарь
АММОНИЯ СОЛИ — хим. соед., содержащие однозарядный катион аммония NН+4, напр. хлорид аммония NH4Cl, нитрат аммония NH4NН3 … Естествознание. Энциклопедический словарь
АММОНИЯ ХЛОРИД — Ammonii chloridum. Синонимы: аммоний хлористый, нашатырь, амохлор, ацидамон и др. Свойства. Белый кристаллический, слегка гигроскопический порошок, без запаха, холодящий, солоноватый на вкус; улетучивается при накаливании (NH4CL). Легко раствори … Отечественные ветеринарные препараты
Хлорид бериллия — Общие Систематическое наименование Хлорид бериллия Химическая формула BeСl2 Эмпирическая формула BeСl2 Физические свойства Состояние ( … Википедия
Хлорид магния — Хлорид магния … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид хрома(IV) — Общие Систематическое наименование Хлорид хрома(IV) Традиционные названия Хлористый хром Химическая формула CrCl4 Физические свойства Состояние … Википедия
Хлористый аммоний
Хлористый аммоний
| Хлорид аммония | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Физические свойства | |
| Плотность вещества | 1,527 г/см³ |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °С) 37,2 г/100 мл |
| Классификация | |
| номер CAS | [12125-02-9] |
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают пропусканием оксида углерода (IV) через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают эффектной реакцией соляной кислоты с раствором аммиака. Эту реакцию проводят в приборе для получения растворимых веществ в твёрдом виде (ПРВ), так как хлорид аммония возгоняется при повышении температуры и не может быть отделён от раствора выпариванием.
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — гидроксидом аммония.
Полезное
Смотреть что такое «Хлористый аммоний» в других словарях:
Хлористый аммоний — или нашатырь см. Аммоний. Хлористый аммоний (сальмиак) минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2 … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ХЛОРИСТЫЙ АММОНИЙ — нашатырь, азотное удобрение второстепенного значения. Получается как побочный продукт при производстве роды. Содержит 24 25% азота. Более применим на черноземных почвах. Содержащийся в X. а. хлор понижает крахмалистость картофеля, ухудшает… … Сельскохозяйственный словарь-справочник
хлористый аммоний — хлорид аммония … Cловарь химических синонимов I
Хлористый аммоний (нашатырь) — см. Аммоний … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Хлористый аммоний (сальмиак) — минерал правильной системы. Кристаллы редки, обыкновенно, в виде коры, в натечных формах, в виде землистого налета. Спайность по (111) несовершенная, излом раковистый, мягок, твердость 1,5 2. Удельный вес 1,5 1,6. Бесцветен или же окрашен в… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH 4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Аммоний, аммониум — Аммоний соединение 1 атома азота с 4 атомами водорода NH4, с несомненностью до сих пор еще не полученное в свободном состоянии; существование его, однако, необходимо принять, так как есть множество тел, строение которых требует допущения… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АММОНИЙ — АММОНИЙ, аммония, мн. нет, муж. (см. аммониак). 1. Соединение азота и водорода, не встречающееся в свободном состоянии, а лишь как составная часть сложных соединений, напр. в нашатыре (хлористый аммоний) и др. (хим.). 2. То же, что углекислый… … Толковый словарь Ушакова
АММОНИЙ — АММОНИЙ, NH4, хим. радикал, не получающийся в свободном состоянии. Впервые Ампер (1817 г.) и затем Берцелиус указали, что соединение аммиака с водой следует рассматривать как водную окись металлоподоб ного соединения, как «сложный… … Большая медицинская энциклопедия
аммоний хлористый — amonio chloridas statusas T sritis chemija formulė NH₄Cl atitikmenys: angl. ammoniac; ammonium chloride; salmiac rus. аммоний хлористый; аммония хлорид … Chemijos terminų aiškinamasis žodynas
Хлорид аммония (нашатырь, Е510): описание, реакции, применение
Хлорид аммония – это неорганическое азотсодержащее вещество, имеющее минеральную природу. Нашатырь, как часто называют хлорид аммония, обладает высокой химической активностью, поэтому используется во многих сферах. В пищевой промышленности хлористому аммонию присвоен статус пищевой добавки Е510, но применение ограничено в связи с неприятным вкусом и запахом. Может вноситься в почву в качестве удобрения, содержащего азот и хлор. Также его применяют в медицине, металлургии и фотографии. Вещество обладает отхаркивающими, мочегонными свойствами, назначается для откашливания мокроты при заболеваниях дыхательных путей, а также в качестве натурального диуретика.
Что такое хлорид аммония, формула
Хлорид аммония – это собой среднюю хлористую соль аммония с химической формулой NH4Cl. В нормальных условиях хлористый аммоний имеет вид белого или желтоватого крупнодисперсного порошка, состоящего из кристаллов прямоугольной формы. Гигроскопичность слабая, не имеет запаха.
Вещество переходит из твёрдого состояния в газообразное при температуре 337,6 °С, в жидком состоянии кипит при очень высокой температуре (520°С). Хорошо растворим в органических растворителях, особенно в спиртах: в метаноле больше, чем в этаноле. Растворяется в воде и жидком аммиаке, при повышении температурного режима растворимость медленно возрастает, наибольшая наблюдается при 100°С.
Насыщенные водные растворы нашатыря имеют меньшую точку кипения (116 °С), проявляют слабокислую реакцию в результате сольволиза водой, поскольку происходит отделение большого количество протонов водорода (H + ).
В природе хлорид аммония встречается в виде минерала нашатыря, имеющего сходную химическую формулу, но с примесями железа (Fe), йода (I) и брома (Br). Обладает жёсткой кубической кристаллической решеткой. Кристалл белого, желтоватого, сероватого или коричневатого цвета, со стеклянным блеском, обладает низкой хрупкостью, режущийся, минимальной твёрдости по шкале Мооса. При раскалывании нашатырь образует раковистый излом.
Минерал формируется в естественных условиях в результате вулканической активности или в районе горячих источников. Имеет вид налётов, корочек, редко образуя массивные скопления. Чаще всего его находят в залежах разложившегося помёта верблюдов, летучих мышей, морских птиц. Нашатырь имеет неприятный резкий горько-солёный вкус, достаточно токсичен, запах едкий, отрезвляющий, в прошлом использовался как компонент нюхательной соли: водным раствором минерала пропитывали углеаммонивые соли.
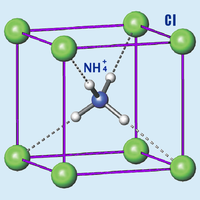
Молекула хлорида аммония
Реакции с хлоридом аммония
Хлористый аммоний проявляет сходные с другими солями аммония химические свойства. При взаимодействии с водой начинается реакция гидролиза – разложение вещества с образованием воды и ионов. При этом разрушается остаток основания (NH4OH), т.е. сольволиз протекает по катиону:
При нагревании образуется аммиак и соляная кислота:
Химическое разложение происходит под воздействием концентрированной серной кислоты:
а также при взаимодействии с щелочами щелочно-земельных металлов:
При этом обязательно выделяется хлороводородная кислота или аммиак.
Хлорид аммония реагирует с металлами с выделением нитрида водорода:
Взаимодействие с оксидами протекает тяжело, требует подогревания или участия катализаторов. Так, при температуре около 300°С идёт реакция с окисью меди:
При этом образуется молекулярный азот и выпадает чистая медь.
При слабом подогревании (60-70°С) или пропускании электрического тока нашатырь взаимодействует с хлором, образуя маслянистую летучую жидкость – трёххлористый азот:
Активно идут реакции с различными нитратами, например, с нитратом серебра:
Формирующийся осадок хлорида серебра белого цвета темнеет на свету.
Хлорид аммония реагирует и с нитритами: нитритом натрия, калия и других металлов:
История использования
Хлорид аммония – это вещество, которое было известно со времен до нашей эры. Впервые его использовали в Египте, получая путём возгонки (перехода из твёрдого состояния в газ). Печи топились верблюжьим навозом, в котором в изобилии был аммиак. В результате образовывалась сажа, из которой добывалось вещество. Нередко минерал находили в пустынях, в местах оазисов, где скапливался кал и моча ездовых животных. Резко пахнущие кристаллы использовали в мистических практиках жрецы бога Амона. Вдыхая едкий запах, люди ощущали рефлекторную стимуляцию дыхательного центра, онемение. Эти эффекты связывались с религиозным общением. Хлориду аммония дали название «нушадир», что в переводе с арабского означает «аммиак».
Спустя столетия, в период Средних веков, алхимики экспериментировали с хлористой солью аммония. Смешивая аммиак с летучий хлористоводородной кислотой, они видели образование густого белого дыма. Активную реакцию нейтрализации аммиака (основания) кислотой (HCl) они объясняли также с точки зрения мистики: считалось, что газы представляют собой богов, в результате сражения которых появляется дым и белый налёт на предметах.
По мере развития науки химики стали использовать кристаллы нашатыря в медицинских целях. Из него готовили водный раствор, в котором смачивали платки или марли для приведения в чувства людей, упавших в обморок. Порошок применялся в качества нюхательной соли при головных болях, в стрессовых ситуациях, при заболеваниях верхних и нижних дыхательных путей, для успокоения при истерических припадках. Безводный хлорид аммония не имеет запаха, однако со временем постепенно разлагается, выделяя аммиак, который и даёт местно-раздражающий эффект.
Сначала нашатырь импортировался в страны Европы и в Россию из Индии и Египта, затем учёные стали синтезировать его самостоятельно. Повсеместное активное применение вещества началось в 1710-1800 годах. В 1710 году в России был построен первый завод по производству хлористого аммония.
Получение и производство
В лабораторных условиях хлорид аммония получают взаимодействием аммиака с хлором:
Первые производственные методы получения хлористого аммония были основаны на нейтрализации водного раствора аммиаком соляной кислоты.
Сегодня большое количество Е510 производится как побочный продукт при выпуске пищевой соды. Общее уравнение реакции:
Производство проходит в несколько этапов:
Так поступают заводы, специализирующиеся на производстве двууглекислого натрия. Для них наиболее экономически выгодно совмещать выпуск двух продуктов, поскольку в наличии изначально есть все необходимые реактивы.
Иногда получение хлорида аммония может быть не связано с пищевой содой. Для этого используют самую первую технологию – взаимодействие раствора аммиака и хлористоводородной кислоты. При этом производство идёт с участием крупного и дорогостоящего оборудования.
Исходный метод был усовершенствован, т.к. имел некоторые недостатки: выпаривание водного раствора для выделения нужного соединения происходило с затратами тепла, сопровождалось сильной коррозией выпарных устройств, в результате производитель нёс убытки. Поэтому было решено заменить водный раствор аммиака насыщенным растворов – таким, в котором концентрация вещества наибольшая, а содержание воды – наименьшее. Последовательность стадий производства:
Выход вещества при таком способе довольно большой. Однако производитель сталкивается с токсичными и опасными реактивами, во время синтеза есть вероятность образования взрывоопасного трихлорида азота (Cl3N). Поэтому чаще всего вещество, поступающее в продажу, производится вместе с пищевой содой.
Воздействие на организм
При правильном применении хлорид аммония не оказывает негативного воздействия на организм. Нужно строго следовать рекомендациям лечащего врача, если вещество было назначено в качестве мочегонного, отхаркивающего средства.
Вред для организма, противопоказания, побочные эффекты
Частое или интенсивное вдыхание паров нашатыря может привести к ожогу слизистой, головным болям. Злоупотребление пищевыми продуктами, в состав которых входит Е510, может привести к отравлению, тошноте и болям в животе, аллергии.
Главное противопоказание к применению хлористого аммония – индивидуальная непереносимость. Она может выражаться в отёках, развитии тяжёлых аллергических реакций. Вещество противопоказано следующим группам лиц:
Среди побочных эффектов после использования нашатыря головокружение, головная боль, тошнота, временная потеря или притупление вкусовой чувствительности, обоняния, а также сыпи, кашель.
Полезные свойства
Хлористый аммоний обладает выраженной фармакологической активностью. Воздействуя через рецепторы носа на дыхательный центр, он производит мощный раздражающий эффект. При этом активизируются базовые защитные рефлексы: кашель и чихание. Средство улучшает отхождение мокроты из нижних дыхательных путей при бронхите, пневмонии, способствует сужению сосудов полости носа (избавляет от насморка).
Хлорид аммония проявляет мочегонные свойства. При этом его принимают перорально в виде слабого раствора, который быстро всасывается в желудочно-кишечном тракте. Он вызывает отток жидкостей из тканей в кровь, а затем усиливает выделение и формирование мочи в почках, ускоряет процесс перехода первичной мочи во вторичную, вывод её из организма. Благодаря диуретикоподобному действию хлористый аммоний способствует устранению отёков и нормализации водно-щелочного баланса.
Допустимые нормы потребления хлорида аммония
Предельно допустимая доза хлористого аммония в сутки составляет 12 г в сутки для взрослых людей и 2,5 г в день для детей. Вещество разрешено к применению во многих странах мира, в том числе в США, Канаде, России.
Применение хлорида аммония
Хлорид аммония используется во многих сферах. Сегодня его значение в некоторых областях несколько уменьшилось (сельское хозяйство, пищевая промышленность), поскольку его заменили более совершенные вещества.
Применение хлорида аммония в пищевой промышленности
Пищевая добавка Е510 действует как эмульгатор. Добавка позволяет смешивать исходно трудно растворимые друг в друге соединения, стабилизирует и улучшает их структуру. При производстве хлебобулочной продукции хлористый аммоний добавляется как улучшитель муки. Пищевую добавку Е510 можно встретить в составе и других продуктов:
Применение хлористого аммония в пищевой промышленности ограничивается, поскольку иногда он даёт неприятный вкус и запах. Ему предпочитают безвкусные стабилизаторы. Однако в лакричной карамели аммиачный привкус пищевой добавки Е510 ценится.
Применение хлорида аммония в медицине
Хлорид аммония выпускается в виде желатиновых капсул, а также дозированного порошка для приготовления растворов. Препараты на основе этого вещества назначаются при следующих патологических состояниях:
Благодаря мягкому мочегонному действию хлористый аммоний может назначаться как индивидуально, так и в составе комплексной терапии для усиления других диуретиков. Важно не превышать предельно допустимую дозировку и обязательно консультироваться о возможности приёма средства с врачом.
Применение хлорида аммония в сельском хозяйстве
Иногда хлористый аммоний может использоваться в качестве прикорневого удобрения сельскохозяйственных культур. Для этого необходим порошок, содержащий не менее 25% азота. Внесение в почву данного вещества улучшает рост и развитие растений, плодоношение, повышает их продуктивность. В качестве подкормки используют водный раствор.
Недостаток удобрения в том, что более 65% в составе занимает хлор. Этот элемент токсичен для многих видов растений. Поэтому хлорид аммония чаще всего используют для подкормки малочувствительных к хлору культур:
При применении данного удобрения нужно стараться вносить его при перекопке грунта осенью, тогда есть вероятность, что большинство хлора вымоется осадками. В связи с этими трудностями в использовании, хлористый аммоний чаще всего заменяют более безопасными для сельскохозяйственных растений азотными удобрениями.
Применение хлорида аммония в других сферах
При перепайке различных устройств хлорид аммония удаляет оксиды с поверхности металлов, что улучшает эффективность спаивания.
За счёт высокой способности к сольволизу водой нашатырь используется как источник электрического тока в гальванических элементах. Также может быть источником обильного дымообразования, что необходимо в пиротехнических составах.
В лабораториях хлористый аммоний используется для исследования состава крови. Соединение приводит к гемолизу эритроцитов, в результате чего их оболочка разрывается, и гемоглобин выходит наружу, становится доступным для изучения.
Хлорид аммоний раньше применялся в фотографии как компонент фиксирующей жидкости.
Где купить и сколько стоит хлорид аммония
Хлористый аммоний продаётся оптом заводами-производителями. Цена варьирует от 25 до 28 рублей за 1 кг. Удобрение на основе этого вещества продаётся в магазинах, ориентированных на товары для сада и огорода. Стоимость пакета, содержащего 500 грамм порошка, около 95-100 рублей. Хлорид аммония продаётся в аптеках, стоимость порошкообразного препарата от 95 до 200 рублей.
Заключение
Хлорид аммония – это неорганическое вещество, насыщенное азотом и хлором, которое издревле применяется в медицинских целях. Оно обладает мочегонным и отхаркивающим действием. Вещество используют как пищевую добавку Е510 для эмульгирования и стабилизации состава ряда продуктов. Хлористым аммонием можно удобрять почву, улучшая азотное питание растений. Он высоко химически активен, образует устойчивые водные растворы, способные проводить электричество, которые применяются также в промышленности, фотографии, пиротехнике.


