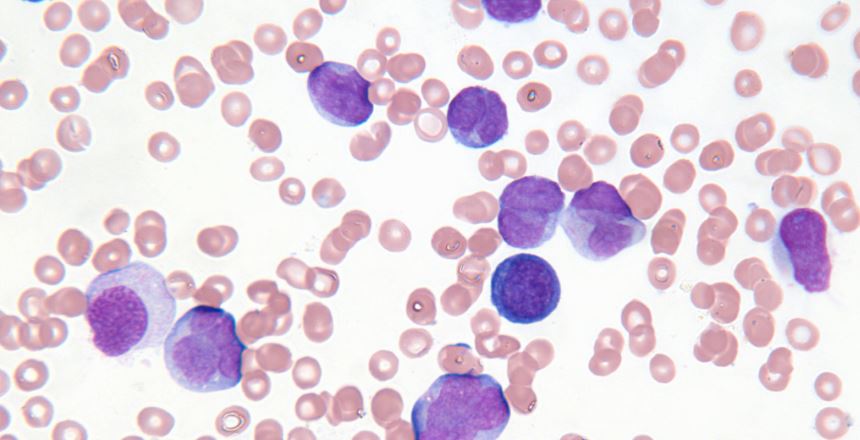
Хлпз что это диагноз
Диагностика и мониторинг лимфопролиферативных заболеваний
Лейкопения – это снижение количества лейкоцитов в единице объема крови.
Лейкопения может появиться как следствие различных заболеваний, в том числе и онкологических.
Лейкоциты – это клетки, имеющие важное значение для иммунной системы человека; белые кровяные тельца выполняют защитную функцию для организма от вирусов, бактерий и прочих агентов, способных причинить вред человеку и вызвать заболевания.
Норма содержания лейкоцитов в крови: от 4 до 9 х 109 клеток/ 1л. Если выявлено их снижение, то это может быть сигналом о подозрении на лейкопению.
ФОРМЫ ЛИМФОПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ:
Существуют различные виды лейкоцитов, обычно происходит снижение не всех, а только нескольких видов.
Причины возникновения лейкопении
ОСНОВНЫМИ ПРИЧИНАМИ ДАННОГО ЗАБОЛЕВАНИЯ ЯВЛЯЮТСЯ:
Опасность, которую несет лейкопения
Лейкоциты – это часть иммунной системы. Белые кровяные тельца атакуют чужеродные агенты, попадающие в организм, но при снижении лейкоцитов, иммунитет человека падает, защитные силы ослабевают. Организм становится более подвержен инфекционным заболеваниям.
Диагностика лимфопролиферативных заболеваний
Заболевание определяется с помощью общего анализа крови.Происходит подсчет содержания количества лейкоцитов в крови и соотношение различных видов лейкоцитов (лимфоциты, эозинофилы, базофилы, нейтрофилы, моноциты) в процентах.
Симптоматика при лейкопении может отсутствовать, особенно легкой степени заболевания. Первым симптомом может быть возникновение различных инфекций. У некоторых онкобольных наблюдается лихорадка, вызванная либо инфицированием, либо как реакция организма на прием химиопрепаратов, либо лихорадка имеет опухолевую причину.
ПОСКОЛЬКУ ЛЕЙКОПЕНИЯ ВЫЗЫВАЕТ НАРУШЕНИЕ ПРОЦЕССА КРОВЕТВОРЕНИЯ, ТО ВОЗМОЖНЫ СЛЕДУЮЩИЕ СИМПТОМЫ:
Лечение лимфопролиферативных заболеваний
Пациент, проходящий курс химиотерапии, должен находиться под постоянным наблюдением онколога, контролирующего уровень лейкоцитов в крови.
ПАЦИЕНТУ, КОТОРОМУ ДИАГНОСТИРОВАНО ДАННОЕ ЗАБОЛЕВАНИЕ СЛЕДУЕТ:
Пациент, у которого наблюдается ярко выраженная симптоматика заболевания помещается в изолированную палату, а медицинский персонал, с которым больной имеет контакт, обязательно должен соблюдать все санитарные правила антисептики. Пациент может быть направлен в гематологическую клинику, специализирующуюся только на заболеваниях крови.
Больному вводят лекарственные препараты, стимулирующие образование лейкоцитов, дополнительно могут быть назначены витаминно-минеральные комплексы для поддержания организма.
Хронические лимфопролиферативные заболевания: когортное исследование выживаемости 310 пациентов (результат одноцентрового исследования и анализ литературных данных)
Полный текст:
Аннотация
Введение. Хронические лимфопролиферативные заболевания (ХЛПЗ) являются распространенными онкогематологическими заболеваниями, сопровождающимися высоковариабельным клиническим течением, неодинаковым прогнозом и недостаточно изученной выживаемостью как одним из основных критериев длительной эффективности противоопухолевой терапии больных, особенно вне рамок клинических исследований.
Материалы и методы. В исследование включена когорта больных ХЛПЗ (n = 310), проходивших обследование и лечение в гематологическом центре ФГКУ «ГВКГ им. академика Н. Н. Бурденко» МО РФ за период с июня 2003 по сентябрь 2014 г. Диагноз конкретной нозологической формы верифицировали в соответствии с национальными и международными рекомендациями. Изучение исходов лечения проводилось на основе анализа общей выживаемости (ОВ) пациентов по методу Каплана–Майера.
Результаты и обсуждение. Большинство пациентов (в основном с неходжкинскими лимфомами (НХЛ) – 75 %, или множественной миеломой (ММ) – 80,6 %) имели распространенную стадию заболевания (III–IV), а 20,3 % госпитализированных поступали в тяжелом состоянии (соматический статус по ECOG – 3–4). Значительная часть больных НХЛ и лимфомой Ходжкина (ЛХ) (38,3 %) имела большую опухолевую массу. При анализе выживаемости пациентов с ХЛПЗ медиана ОВ составила 81,1 мес. Вероятность 5-летней выживаемости всей группы пациентов от момента диагностики составила 62 %, а вероятность 10-летней выживаемости – 37 %. Самая короткая медиана ОВ была у больных ММ – 39 мес, а самая продолжительная – у пациентов с хроническим лимфолейкозом – 117,8 мес. При НХЛ медиана ОВ составила 68,1 мес, а при ЛХ – 99,3 мес. Сравнение выживаемости за 2 временных интервала (2003–2009 гг. и 2009–2014 гг.) выявило тенденцию в увеличении выживаемости для отдельных групп больных ХЛПЗ, что могло быть связано с применением таргетных препаратов и новых лечебных подходов.
Заключение. Выраженная эффективность новых препаратов при отдельных нозологических формах привела к возобновлению интереса к результатам терапии ХЛПЗ. В нашем исследовании большинство пациентов с ХЛПЗ имеют долгосрочную ОВ, однако влияние последующих линий терапии на ОВ требует дополнительного изучения. Эти результаты будут способствовать новым разработкам в области организации и планирования терапии, изменения терапевтической практики и индивидуализации лечения.
Ключевые слова
Об авторах
Список литературы
1. Fowler N., Davis E. Targeting B-cell receptor signaling: changing the paradigm. Hematology Am Soc Hematol Educ Program 2013;2013:553.60.
2. Статистика злокачественных новообразований в России и странах СНГ в 2009 г. Под ред. М.И. Давыдова, Е.М. Аксель. Вестник РОНЦ им. Н.Н. Блохина РАМН 2011;22(3) (прил. 1). [Malignancies statistics in Russia and CIS countries in 2009. Eds.: Davydov M.I., Aksel E.M. Vestnik RONC RAMN = Bulletin of N.N. Blokhin Russian Cancer Research Center 2011;22(3) (Suppl.1). (In Russ.)].
3. Siegel R., Ma J., Zou Z., Jemal A. Cancer Statistics, 2014. CA Cancer J Clin 2014;64(1):9.29.
4. Hallek M. Signaling the end of chronic lymphocytic leukemia: new frontline treatment strategies. Blood 2013;122(23):3723.34.
5. Mikhael J.R., Dingli D., Roy V. et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo Stratification of Myeloma and Risk-Adapted Therapy (mSMART). Consensus Guidelines 2013. Mayo Clin Proc 2013;88:360.76.
6. Rajkumar S.V., Dimopoulos M.A., Palumbo A. et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014;15(12):e538.48.
7. Zhou Z., Sehn L.H., Rademaker A.W. et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the ituximab era. Blood 2014;123(6):837.42.
8. Ludwig H., Miguel J.S., Dimopoulos M.A. et al. International Myeloma Working Group recommendations for global myeloma care. Leukemia 2014;28(5):981.92.
9. Hallek M., Cheson B.D., Catovsky D. et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop n Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008;111(12):5446.56.
10. Abramson J.S., Zelenetz A.D. Recent advances in the treatment of non-Hodgkin’s lymphomas. J Natl Compr Canc Netw 2013;11(5 Suppl):671.5.
11. Cheson B.D., Fisher R.I., Barrington S.F. et al. Recommendations for Initial Evaluation, Staging, and Response Assessment of Hodgkin and Non-Hodgkin Lymphoma: The Lugano Classification. JCO 2014;32(27):3059.67.
12. Diefenbach C., Steidl C. New strategies in Hodgkin lymphoma: better risk profiling and novel treatments. Clin Cancer Res 2013;19(11):2797.803.
13. Eichenauer D.A., Engert A., Andre M. et al. Hodgkin’s Lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014;25 Suppl 3:iii70.5.
14. Гринхальх Т. Основы доказательной медицины. Пер. с англ. М.: ГЭОТАР-Медиа, 2004. 240 с. [Greenhalgh T. The Basics of Evidence Based Medicine. Trans. rom English. M.: GEOTAR-MED, 2004. 240 pp. (In Russ.)].
15. Власов В.В. Введение в доказательную медицину. М.: Медиа Сфера, 2001. 392 с. [Vlasov V.V. Introduction to evidence-based medicine. M.: Media Sfera, 2001. 392 pp. (In Russ.)].
16. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиа Сфера, 2002. 312 с. Rebrova O.Yu. Statistical analysis of medical data. Application of software package STATISTICA. M.: Media Sfera, 2002. 312 pp. (In Russ).].
17. Swerdlow S.H., Campo E., Harris N.L. et al. (eds.). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, IARC, Lyon, 2008. 439 p.
18. Criteria or the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. International Myeloma Working Group. Br J Haematol 2003;121(5):749.57.
19. Kyle R.A., Rajkumar S.V. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009;23(1):3.9.
20. Greipp P.R., San Miguel J., Durie B.G. et al. International staging system for multiple myeloma. J Clin Oncol 2005;23(15):3412.20.
21. Rai K.R., Savitsky A., Cronkite E.P. et al. Clinical staging of chronic lymphocytic leukemia. Blood 1975;46(2):219.34.
22. Cheson B.D., Pfistner B., Juweid M.E. et al.; International Harmonization Project on Lymphoma. Revised response criteria for malignant lymphoma. J Clin Oncol 2007;25(5):579.86.
23. Durie B.G., Harousseau J.L., Miguel J.S. et al.; International Myeloma Working Group. International uniform response criteria for multiple myeloma. Leukemia 2006;20(9):1467.73.
24. Rajkumar S.V., Harousseau J.L., Durie B. et al.; International Myeloma Workshop Consensus Panel 1. Consensus recommendations for the uniform reporting of linical trials: report of the International Myeloma Workshop Consensus Panel 1. Blood 2011;117(18):4691.5.
25. «О совершенствовании системы Государственного ракового регистра». Приказ МЗ РФ № 135 от 19 апреля 1999 г. 172 с. [“On Improving of the State ancer Registry”. Order of the Ministry of Health of Russian Federation № 135; 19 April 1999. 172 pp. (In Russ.)].
26. Kaplan E.L., Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958;53:457.81.
27. A predictive model for aggressive non-Hodgkin’s lymphoma. The International Non- Hodgkin’s Lymphoma Prognostic Factors Project. N Engl J Med 993;329(14):987.94.
29. Oliva S., Caltagirone S., Passera R. et al. Revised international staging system (R-ISS): a new and simple prognostic assessment for multiple myeloma. EHA 2014 ongress Milan, abstr. S1289.
31. Kumar S.K., Dispenzieri A., Lacy M.Q. et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia 2014;28(5):1122–8.
32. Pflug N., Bahlo J., Shanafelt T.D. et al. Development of a comprehensive prognostic index for patients with chronic lymphocytic leukemia. Blood 014;124(1):49– 2.
33. Eichhorst B., Fink A., Busch R. et al. Chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) versus bendamustine and ituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): Results of a planned interim analysis of the LL10 trial, an international, randomized study of The German CLL Study Group (GCLLSG). rogram and abstracts of the 55th American Society of Hematology Annual eeting and Exposition; December 7–10, 2013; New Orleans, Louisiana. Abstr. 526.
34. Goede V., Fischer K., Busch R. et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014;370(12):1101–10. 35. urger J.A., Keating M.J., Wierda W.G. et al. Safety and activity of ibrutinib plus rituximab for patients with high-risk chronic lymphocytic leukaemia: a single-arm, hase 2 study. Lancet Oncol 2014;15(10):1090–9.
35. Furman R.R., Sharman J.P., Coutre S.E. et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370(11):997–1007.
36. http://seer.cancer.gov/statfacts/html/hodg. html.
37. Younes A., Gopal A.K., Smith S.E. et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol 2012;30(18):2183–9.
38. Niraula S., Seruga B., Ocana A. et al. The price we pay for progress: a meta-analysis of harms of newly approved anticancer drugs. J Clin Oncol 2012;30(24):3012–9
39. Поп В.П., Кучма Ю.М. Резистентность к индукционной терапии ухудшает общую выживаемость больных с хроническими лимфопролиферативными або- леваниями. Актуальные проблемы оказания специализированной медицинской помощи в условиях стационара и применение стационарозамещающих технологий. Тезисы докладов научно-практической конференции. М.: ГВКГ им. Н.Н. Бурденко, 2009. С. 204. [Pop V.P., Kuchma u.M. esistance to induction therapy worsens the overall survival of patients with chronic lymphoproliferative disorders. Abstracts book of Russian Conference “Actual problems of specialized medical care in a hospital and use of hospital-replacing echnologies”. M.: Burdenko Main Military Clinical Hospital, 2009, p. 204 (In Russ.)].
40. Wildes T.M., Goede V., Hamlin P. Personalizing therapy for older adults with lymphoid malignancies: options and obstacles. Am Soc Clin Oncol Educ Book 2014:e240–8.
41. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством профессора И.В. оддубной, профессора В.Г. Савченко. М.: ММА МедиаМедика, 2014. 128 с. [Russian clinical guidelines for diagnosis and treatment of lymphoproliferative iseases. Eds.: prof. Poddubnaya I.V., prof. Savchenko V.G. M.: MMA MediaMedica, 2014. 128 pp. (In Russ.)].
42. Национальное руководство по гематологии. Под ред. О.А. Рукавицына (в печати). [Hematology National Guidance. Ed.: Rukavitsyn O.A. (in press). (In uss)].
Для цитирования:
Поп В.П., Рукавицын О.А. Хронические лимфопролиферативные заболевания: когортное исследование выживаемости 310 пациентов (результат одноцентрового исследования и анализ литературных данных). Онкогематология. 2014;9(4):15-23. https://doi.org/10.17650/1818-8346-2014-9-4-15-23
For citation:
Pop V.P., Rukavitsyn O.A. Chronic lymphoproliferative diseases: survival in cohort study of 310 patients (single-center study results and literature data). Oncohematology. 2014;9(4):15-23. (In Russ.) https://doi.org/10.17650/1818-8346-2014-9-4-15-23
Хронические лимфопролиферативные болезни (ХЛПЗ)
С 1.07.2017г в МЛ Дела внедрено инновационное исследование «Иммунофенотипирование лимфопролиферативных заболеваний (проточная цитометрия). Это комплексное исследование включает 22 показателя и общий анализ крови (ОАК).
Важно: ХЛЛ всегда протекает с привлечением периферической крови, поэтому материалом для первичного исследования может быть венозная кровь. Для выявления подвариантов ХЛЛ используется экспрессия моноклональных антител, рекомендованных Британской комиссией по стандартизации в гематологии **: CD5, CD19, CD20, CD10, CD23, CD22, CD16, CD56, CD3, CD4, CD8, FMC7, CD103, CD25, CD11с, CD7 и CD79b.
Показаниями для проведения исследования являются:
Обнаружение в периферической крови абсолютного и относительного лимфоцитоза
Иммунофенотипирование методом проточной цитометрии позволяет:
Иммунофенотипирование методом проточной цитометрии используется:
для разграничения реактивных и опухолевых состояний, постановки точного диагноза при различных лимфопролиферативных состояниях, в диагностике таких заболеваний, как:
I периферической В-клеточной лимфоме:
a. В-клеточный хронический лимфолейкоз / лимфома из малых лимфоцитов.
б Лимфома из мантийных клеток.
с Фолликулярная лимфома.
д. В-клеточная лимфома маргинальной зоны.
е Волосатоклеточный лейкоз
II Периферические Т / NК-клеточные лимфомы.
III Реактивный / неопухолевой лимфаденит
IV Лейкемоидные Реакции
А также для мониторинга эффективности терапии данных заболеваний.
Интерпретация результата:
Аутоиммунный лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме.
Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки.
При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС.
Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку.
Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
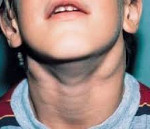
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза.
Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия.
Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие.
При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.