Холестаз что это такое симптомы у женщин лечение и причины
Застой желчи
Застой желчи (холестаз) – состояние, при котором нарушено поступление желчи в двенадцатиперстную кишку. При этом развиваются выраженные нарушения расщепления и усвоения жиров, что приводит к увеличению их концентрации в кровеносном русле. Это влечет за собой изменения трансформации глюкозы в гликоген, а также повышение количества холестерина в крови. Таким образом, застой желчи, оставленный без лечения, может привести к развитию сахарного диабета, атеросклероза и их осложнений. Холестаз может развиться в желчных протоках (внутрипеченочный застой) и в желчном пузыре (внепеченочный), а также бывает острым и хроническим.
Причины застоя желчи
Холестаз может развиться по множеству причин, среди которых самыми распространенными являются:
Для застоя желчи характерно изменение цвета склер и кожи (пожелтение), а также жалобы на кожный зуд, неустойчивый стул (чередование запоров и поноса), обесцвеченный кал и темную мочу. При наличии даже нескольких таких симптомов у врача есть основание назначить биохимический анализ крови (исследуется уровень билирубина, желчных кислот, печеночных ферментов и пр.), анализ мочи на уробилин, УЗИ печени и желчного пузыря, фиброгастродуоденоскопию и пр. При диагностике холестаза важно отличать это состояние от вирусных, паразитарных и других заболеваний печени, которые имеют схожую клиническую картину.
Лечение
Тактика лечения формируется на основании результатов обследования, но всегда подразумевает устранение причины этого состояния. Если застой желчи вызван обструкцией желчного пузыря или желчных протоков, показано хирургическое вмешательство с восстановлением проходимости протоков. В остальных случаях лечение проводится с помощью комплекса лекарственных препаратов с желчегонным, холеретическим, гепатопротекторным или другим действием. Курс лечения формируется индивидуально для каждого больного.
Внутрипеченочный холестаз при болезнях печени: от диагноза до лечения
При длительно существующем холестазе нарушается липидный обмен, в результате чего на коже образуются ксантомы и ксантелазмы Внутрипеченочный холестаз (ВХ) может развиваться на уровне гепатоцитов или внутрипеченочных желчных протоков. С
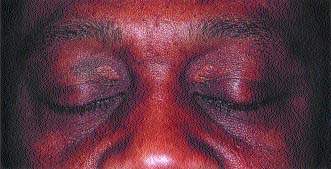 |
| При длительно существующем холестазе нарушается липидный обмен, в результате чего на коже образуются ксантомы и ксантелазмы |
Внутрипеченочный холестаз (ВХ) может развиваться на уровне гепатоцитов или внутрипеченочных желчных протоков. Соответственно этому выделяют ВХ, обусловленный поражением гепатоцитов и каналикул, и ВХ, связанный с поражением протоков.
Этиология и патогенез ВХ многообразны. Гепатоцеллюлярный и каналикулярный холестазы могут быть обусловлены вирусным, алкогольным, лекарственным, токсическим поражением печени, застойной сердечной недостаточностью, эндогенными метаболическими нарушениями (холестаз беременных, при муковисцидозе, при альфа-1-антитрипсиновой недостаточности и др.). Экстралобулярный (дуктулярный) холестаз характерен для первичного билиарного цирроза печени и первичного склерозирующего холангита, этиология которых неизвестна, а также для некоторых других заболеваний с известными причинами, например, для вторичного склерозирующего холангита.
При гепатоцеллюлярном и каналикулярном холестазах преимущественно поражаются транспортные системы мембран, а для экстралобулярного холестаза характерно повреждение эпителия желчных протоков. Для ВХ характерно поступление в кровь, а следовательно, и в ткани, различных компонентов желчи, преимущественно желчных кислот, и их дефицит или отсутствие в просвете двенадцатиперстной кишки и других отделах кишечника. При холестазе избыточная концентрация компонентов желчи в печени и тканях организма вызывает печеночные и системные патологические процессы, обусловливающие соответствующие клинические и лабораторные проявления болезни.
В основе формирования клинических симптомов лежат три фактора:
— избыточное поступление желчи в кровь и ткани;
— уменьшение количества или отсутствие желчи в кишечнике;
— воздействие компонентов желчи и ее токсических метаболитов на печеночные клетки и канальцы.
Характерными симптомами холестаза, в том числе ВХ, являются: кожный зуд, желтуха, ксантомы, ксантелазмы, ахоличный стул, моча темно-коричневого цвета. Выраженность симптомов ВХ зависит от основного заболевания, нарушения экскреторной функции гепатоцитов и печеночно-клеточной недостаточности.
Кожный зуд обычно предшествует появлению желтухи.
При ВХ присоединяются симптомы, связанные с недостатком желчи в просвете кишечника и нарушением всасывания жиров (стеаторея, похудение, дефицит жирорастворимых витаминов).
При длительно существующем холестазе закономерно выявляются: дефицит витамина Д (оссалгии, проксимальная миопатия, остеопороз, иногда остеомаляция), витамина Е (мышечная слабость, мозжечковая атаксия), витамина К(геморрагический синдром, гипопротромбинемия), витамина А (“куриная слепота”, гиперкератоз кожи, ксерофтальмия, кератомаляция). При формировании билиарного цирроза печени присоединяются признаки билиарной гипертензии (упорный метеоризм, асцит, спленомегалия) и печеночно-клеточной недостаточности (потеря массы тела, атрофия мышц, гипоальбуминемия и др.). К характерным лабораторным признакам ВХ относят: увеличение в крови щелочной фосфатазы (ЩФ) и гамма-глютаминтранспептидазы (ГГТП) до трех и более норм, а также повышение в крови холестерина (свыше полутора норм), желчных кислот (до полутора норм и выше) и некоторых других маркеров (лейцинаминопептидазы и др.), имеющих определенное диагностическое значение.
Уровень трансаминаз обычно повышен, но, как правило, он ниже уровней ферментов холестаза и только при быстро прогрессирующем холестазе уровень АсАТ и АлАТ резко возрастает, особенно при внепеченочном обструктивном синдроме.
Важным, но необязательным лабораторным признаком ВХ является повышение уровня конъюгированного билирубина, холестерина и его производных.
К симптомам, связанным с задержкой липидов в организме, относят ксантомы на коже, во внутренних органах, в том числе на оболочках нервных стволов с проявлениями полинейропатии.
Прежде чем диагностировать болезни, при которых проявляются ВХ, необходимо исключить внепеченочный холестаз, который также может длительно протекать под маской ВХ.
Внепеченочный холестаз имеет следующие характерные признаки: надстенотическое расширение протоков, выявляемое на УЗИ, и блокада протоков (холедохолитиаз, стриктура и др.), выявляемая при эндоскопической ретроградной холангиографии (ЭРХГ).
| Внутрипеченочный холестаз (ВХ) характеризуется уменьшением тока желчи и ее поступления в двенадцатиперстную кишку при отсутствии механического повреждения и обструкции внепеченочного билиарного тракта. ВХ обусловлен либо нарушением механизмов образования и транспорта желчи на уровне гепатоцитов, либо повреждением внутрипеченочных протоков, либо их сочетанием |
ВХ на уровне гепатоцитов, каналикулов и даже экстралобулярных желчных протоков, по существу, клинически неразличимы, поскольку внутрипеченочный билиарный тракт представляет собой непрерывную систему, и поэтому любой патологический процесс на уровне печени, в том числе поражающий гепатоциты, может сопровождаться холестазом. Гепатоцеллюлярный холестаз развивается как при острых, так и при хронических гепатитах вирусной, алкогольной, лекарственной и токсической этиологии, при циррозе печени, а также при невоспалительных заболеваниях печени (амилоидоз, саркоидоз и др.).
Таблица 1. Патогенетические подходы к медикаментозной терапии ВХ
Независимо от этиологии и нозологии ВХ, постоянное присутствие в избыточном количестве желчи в гепатоцитах и каналикулах приводит к некрозу гепатоцитов и развитию печеночно-клеточной недостаточности. Если холестаз наблюдается в течение трех–пяти лет, то формируется цирроз печени с развитием асцита, отеков и печеночной энцефалопатии. Тяжесть и выраженность клинических симптомов и при ВХ чрезвычайно вариабельны. Но почти всегда процесс прогрессирует, если не устраняется причина, обусловившая его развитие, — например, лекарство, алкоголь, вирус, бактерии и т. д.
В лечении используются любые лекарственные средства, влияющие на этиологию и патогенез болезни, если это возможно; также предпринимаются попытки оказать медикаментозное влияние на отдельные симптомы, например, устранить дефицит витаминов, улучшить процессы пищеварения и всасывания и т. д. Однако у каждого конкретного больного надо применять только патогенетически обоснованную лекарственную терапию.
1. Адеметионин-1,4-бутандисульфонат (S-адеметионин, гептал) — биологическое вещество, входящее в состав тканей и жидких сред организма и участвующее в реакциях трансметилирования. Обладает антидепрессивной и гепатопротективной активностью.
В течение двух-трех недель целесообразно применять ежедневно внутривенно или внутримышечно по 5-10 мл (400-800 мг), а в дальнейшем принимать внутрь по 400 мг (одна таблетка) два–четыре раза в день натощак.
Курс лечения. При остром ВХ полтора — два месяца, при хроническом — с учетом эффективности.
2. Урсодезоксихолевая кислота (УДХК) — обладает разносторонним позитивным действием на гепатобилиарную систему при ВХ и желчекаменной болезни. УДХК абсорбируется в прямой кишке. При систематическом приеме внутрь (10 мг/кг в сутки) она включается в энтерогепатическую циркуляцию, обеспечивая нормализацию желчеобразовательной и выделительной функций печени. Чаще применяется препарат урсофальк, назначаемый при ВХ внутрь по 250 мг два-три раза в день на длительный период. Возможно сочетание с гепталом.
3. Рифампицин (рифадин, рифарен и др.) — в основе его позитивного действия при ВХ лежит индукция микросомальных ферментов печени. Препарат вызывает ряд побочных эффектов (тошнота, рвота, диарея, головная боль и др.)
Эффект от применения препаратов, используемых при ВХ, как правило, больными оценивается по тому, как они влияют на зуд (его выраженность обычно уменьшается через несколько дней, но исчезает зуд лишь через один-два месяца от начала лечения. Врачами эффект оценивается, кроме того, по клиническим и лабораторным показателям (уровни ЩФ, ГГТП, холестерина и др.).
О патофизиологии холестаза
Как известно, желчь представляет собой изоосмотическую жидкость, состоящую из воды, электролитов, органических веществ (желчных кислот и солей, холестерина, коньюгированного билирубина, цитокинов, эйкозаноидов и других веществ) и металлов, в частности меди. Общее количество выделяемой печенью желчи в сутки составляет в среднем 600 мл. Основными же органическими компонентами желчи являются желчные кислоты, которые поступают из двух источников:
Формирование желчи проходит в три этапа: 1) захват из крови ее компонентов на уровне базолатеральной мембраны; 2) метаболизм, а также синтез новых составляющих и их транспорт в цитоплазме гепатоцитов; 3) выделение их через каналикулярную (билиарную) мембрану в желчные каналикулы.
В физиологических условиях транспорт желчных кислот из плазмы в гепатоцит осуществляется благодаря наличию в составе базолатеральных мембран K+-Na+-АТФазы. Внутриклеточный транспорт желчных кислот от базолатеральной мембраны до каналикулярной мембраны гепатоцита осуществляется цитозольными протеинами.
Выделение компонентов желчи из цитоплазмы гепатоцитов в просвет каналикулов против градиента концентрации осуществляют АТФ-зависимые транспортные белки, которые синтезируются в гепатоцитах наряду со щелочной фосфатазой (ЩФ). В результате функционирования этих транспортных систем в каналикулы поступают желчные кислоты и их соли, а также ряд осмотически активных веществ (глютатион, бикарбонаты), обеспечивающих поступление воды в каналикулы по осмотическому градиенту из синусоидов. Ток желчи во всей системе протоков зависит от темпов образования желчи. Из каналикулов желчь через вставочные канальцы Геринга поступает в желчные протоки, которые, соединяясь между собой, образуют интралобулярные, а затем и общий желчный проток. Эпителий протоков секретирует бикарбонаты и воду, формируя тем самым окончательный состав желчи, поступающей по внепеченочному желчному протоку (холедоху) в двенадцатиперстную кишку.
Холестаз при беременности — что это такое?
Гестационный холестаз — заболевание, которое может появиться ближе к концу беременности. Обычно это проявляется желтухой и стойким зудом. Заболевание проходит после родов, но часто повторяется при последующих беременностях. Требует симптоматического лечения и частого наблюдения за плодом.
Холестаз при беременности — что это такое?
Холестаз, представляет собой набор биохимических нарушений и клинических симптомов, которые проявляются при нарушении секреции желчных кислот в печени или затруднении оттока желчи по желчным путям. Обычными причинами холестаза являются отложения желчных камней или наличие опухолей в брюшной полости, таких как опухоли поджелудочной железы. У некоторых беременных холестаз может возникнуть спонтанно.
Основными причинами гестационного холестаза являются высокий уровень эстрогена в конце беременности и повышенная чувствительность клеток печени к этому гормону. Заболевание обычно проявляется в третьем триместре. Очень редко симптомы проявляются на ранних сроках беременности. Генетические факторы играют важную роль в случае холестаза во время беременности. Появление холестаза при первой беременности несет в себе высокий риск возникновения при второй и последующих беременностях.
Холестаз при беременности и последствия для ребенка
Первым симптомом обычно является кожный зуд. Он может быть очень стойким и значительно снижает качество жизни. Кожный зуд часто усиливается вечером и ночью. Через несколько недель появляются другие симптомы гестационного холестаза, такие, как пожелтение кожи и слизистых оболочек, а также более темная моча и изменение цвета стула. Иногда возникает жировая диарея. Эти симптомы, хотя и могут беспокоить, обычно не представляют значительной угрозы для здоровья матери.
Однако холестаз может быть опасен для ребенка. Наиболее частым осложнением являются преждевременные роды, влекущие, например, риск гипоксии.
К менее частым осложнениям относятся: снижение частоты сердечных сокращений плода и синдром аспирации мекония. В самых тяжелых случаях плод может погибнуть.
Холестаз при беременности — диагностика
Заподозрить холестаз беременной следует при появлении кожного зуда между 25 и 32 неделями беременности. О застое желчи свидетельствуют в основном биохимические нарушения. Лабораторные анализы крови показывают повышенные уровни желчных кислот и билирубина, а также повышенные уровни ферментов печени, в основном АЛТ, АСТ и щелочной фосфатазы (ЩФ). Эти показатели могут быть повышены при многих других заболеваниях печени и желчевыводящих путей.
Правильная интерпретация результатов важна. Холе стаз при беременности подтверждается повышенной концентрацией конъюгированного билирубина и превышением верхнего предела активности щелочной фосфатазы как минимум в два раза. Дифференциальный диагноз должен включать холестаз при вирусном гепатите и желчекаменной болезни. Эти заболевания следует особенно учитывать при появлении дополнительных симптомов или желтухе на ранних сроках беременности или в послеродовом периоде.
Холестаз при беременности — как лечить?
Урсодезоксихолевая кислота является основным препаратом, применяемым при лечении холестаза беременных. Этот препарат считается наиболее эффективным в борьбе с зудом. Также используются холестирамин и стероиды, в основном дексаметазон. Стероидные препараты также ускоряют созревание легких малыша, что важно в случае преждевременных родов.
Холестаз беременных требует частого наблюдения за беременностью, включая частоту сердечных сокращений и движений плода. При тяжелом холестазе с повышенным уровнем билирубина в крови некоторые врачи рекомендуют индукцию родов после того, как легкие ребенка достигают зрелости. Как правило, такая попытка делается на 36 неделе беременности.
Диета при холестазе при беременности
Желчь участвует в переваривании жиров. Нарушение секреции желчи также означает ухудшение всасывания жиров, в том числе незаменимых жирных кислот и жирорастворимых витаминов. Лучшие источники витаминов A и D — жирные молочные продукты, жирная морская рыба и печень. В случае тяжелых симптомов непереносимости жирной пищи может потребоваться соблюдение печеночной диеты с пониженным содержанием жира при холестазе.
В природе витамин A и D содержится в моркови, помидорах, тыкве и зеленом горошке. Листовые овощи, такие как шпинат, салат и петрушка, являются естественным источником витаминов Е и К. Несмотря на повышенное количество этих витаминов в рационе, может потребоваться их добавление. Добавки витамина К особенно важны, так как они необходимы для правильного свертывания крови. Использование любых витаминов в виде БАД или лекарств необходимо согласовывать с врачом.
Холестаз при беременности — последствия
Холестаз: симптомы и лечение холестатического синдрома
Холестаз – клинико-лабораторный синдром, при котором нарушена выработка желчи или полностью либо частично блокирован ее отток в двенадцатиперстную кишку.
Состояние может быть вызвано различными заболеваниями. Оно характеризуется накоплением в крови выводимых с желчью веществ, что сопровождается кожным зудом, слабостью, желтухой и другими проявлениями.
Диагностика патологии основана преимущественно на данных анализов, а также инструментальных методов исследования.
Лечение холестатического синдрома включает прием медикаментов, диету и в ряде случаев хирургическое вмешательство на органах печени и желчевыводящих путей.
Распространенность и особенности холестаза
По данным статистики, этой патологией страдает 1 человек на 10 тысяч населения планеты в год. При этом около 50-70% людей с заболеваниями печени и желчных путей (даже пролеченных ранее) может столкнуться в той или иной степени с холестазом в разные периоды жизни.
Большая часть заболевших мужского пола, в возрасте старше 40 лет. Среди беременных женщин состояние выявляется от 0,2 до 27% среди обследованных, в зависимости от региона и дополнительных заболеваний и состояний.
Причины и виды холестатического синдрома
Существует две основные формы патологии – внепеченочная и внутрипеченочная. Первая развивается в случае полной или частичной закупорки желчных протоков, чаще всего камнями при желчнокаменной болезни и холедохолитиазе, а также при опухоли органов гепатобилиарной системы, дисфункции сфинктера Одди, описторхоза, врожденных аномалий желчевыводящих путей.
Внутрипеченочный холестаз – следствие заболеваний гепатоцеллюлярной системы, таких как гепатиты вирусного, алкогольного и медикаментозного происхождения, жировая болезнь печени (довольно частая патология современного человека, поражающая до 20% людей и более, в зависимости от возраста и массы тела) и ее аутоиммунные поражения, дефекты внутрипеченочных протоков.
Среди частых причин патологии также врожденные метаболические нарушения (галактоземия, муковисцидоз и другие), саркоидоз, изменения гормонального фона, например, при беременности.
Проявления застоя желчи
Холестаз у беременных женщин и детей
Отдельного внимания заслуживают такие формы патологии, как холестаз во время вынашивания плода и в детском возрасте. В этих случаях механизм развития нарушений и симптомы имеют свои особенности.
Проявления холестаза у беременных наблюдаются в третьем триместре. Кожный зуд может быть ярко выраженным или практически не доставлять дискомфорта. Расчесы чаще отмечаются на руках, голенях, предплечьях. Желтуха встречается лишь у одной из десяти женщин и, как правило, проходит самостоятельно через две недели после родов. Однако при выраженной желтухе и раннем начале (до 25-27-й недели беременности) может повышать риск осложнений в родах.
Детский холестаз может наблюдаться как с первых месяцев жизни, так и появиться в более старшем возрасте. В младенчестве чаще встречаются внутрипеченочный холестатический синдром, вызванный врожденными метаболическими нарушениями, идиопатический неонатальный гепатит и пороки развития желчных протоков. Причинами холестаза могут быть также инфекции, токсические поражения органов, цирроз печени, сердечно-сосудистая недостаточность, опухоли поджелудочной железы, паразитарные поражения, склерозирующий холангит.
Опасность холестаза в том, что он развивается у детей в скрытой форме. Симптоматика зависит от возраста, в котором проявилось заболевание, и особенностей организма.
Диагностика патологии
Диагностику и лечение синдрома холестаза проводит врач-гастроэнтеролог. Некоторые пациенты ошибочно консультируются с дерматологом, акцентируя внимание только на кожном зуде и не принимая во внимание прочие симптомы.
Заподозрить патологию врачу позволяют беседа с больным, внешний осмотр кожи и слизистых пациента. Пальпация и перкуссия часто позволяют выявить увеличение печени в размерах, болезненные области. Нередко холестатический синдром протекает почти бессимптомно, и на его наличие указывают только лабораторные анализы. Они заключаются в определении уровня билирубина, холестерина, щелочной фосфатазы, ферментов и желчных кислот в крови, желчных пигментов в моче.
Для общего анализа крови при холестазе характерны анемия, лейкоцитоз, завышенные значения СОЭ. В биохимическом анализе крови выявляются гипербилирубинемия (за счет прямого (конъюгированного) билирубина), гиперлипидемия, повышение активности ферментов, таких как аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), гаммаглутамилтранспептидаза (ГГТП). Обнаружение антимитохондриальных, антинуклеарных антител и антител к гладкомышечным клеткам позволяет заподозрить аутоиммунное поражение печени как возможную причину холестаза.
Инструментальная диагностика холестаза предполагает ультразвуковое и рентгеновское исследования органов брюшной полости, гастро- и дуоденоскопию, магнитно-резонансную или эндоскопическую ретроградную холангиопанкреатографию, чрескожную чреспеченочную холангиографию. Диагноз может быть установлен на любом этапе, даже просто после выполнения лабораторных анализов и УЗИ, не все вышеперечисленные исследования обязательно потребуются для диагностики.
Если результаты проведенных обследований сомнительны, то прибегают к биопсии печени (которая также может быть назначена на любом этапе диагностического поиска).
Лечение холестаза
Первая мера при выявлении холестаза или подозрении на него – коррекция питания. Особенностью такой диеты является замена животных жиров на растительные. Рекомендуется употреблять больше овощей и фруктов, выбирать нежирные сорта мяса и виды молочных продуктов. Полезны также каши на основе злаковых культур. Нужно ограничить жареные, копченые и острые продукты. Следует полностью отказаться от спиртного, крепкого кофе и чая.
Лечение беременных осложняется рисками для плода при применении лекарств, потому для уменьшения симптоматики прибегают в первую очередь к простым и безопасным средствам – маски из овсяных хлопьев, отвар ромашки, использованию детского крема.
Холодная вода и сон в прохладном помещении облегчают кожный зуд. Однако при его усилении врачом могут быть назначены препараты желчных кислот, разрешенные к применению у беременных (в частности – урсодезоксихолевая кислота). Эти препараты определены американской Food and Drug Administration (FDA) на основании проведенных клинических исследований. Препараты, по которым накоплено достаточно данных о применении их у беременных, отнесены данной организацией к соответствующей группе (категории действия на плод).
Для успешного лечения холестаза у детей важно своевременно установить причину данного синдрома. Часто одними лекарствами патологию у этой группы больных не вылечить, тогда проводят хирургическую операцию.
Внутрипеченочный холестаз: от патогенеза до лечения
Резюме. Внутрипеченочный холестаз характеризуется уменьшением тока желчи и ее поступления в двенадцатиперстную кишку при отсутствии механического повреждения и обструкции внепеченочного билиарного тракта. Внутрипеченочный холестаз обусловлен либо нарушением механизмов образования и транспорта желчи на уровне гепатоцитов, либо повреждением внутрипеченочных протоков, либо сочетанием указанных факторов.
Нарушения пассажа желчи от гепатоцита к двенадцатиперстной кишке могут быть обусловлены многочисленными причинами, врожденными и приобретенными, обратимыми и необратимыми.
При холестазе наблюдают уменьшение канальцевого тока желчи, печеночной экскреции воды и/или органических анионов (билирубина, желчных кислот — ЖК), накопление желчи в гепатоцитах и желчевыводящих путях, задержку компонентов желчи в крови (ЖК, липидов, билирубина). Длительно сохраняющийся холестаз приводит к развитию билиарного цирроза.
Холестаз оказывает повреждающее действие как на канальцевый эпителий, так и на гепатоциты. Накопление компонентов желчи внутри гепатоцита может быть связано с дефектом транспортера или с торможением его функции при внепеченочном холестазе по принципу отрицательной обратной связи. Компоненты желчи (гидрофобные ЖК, билирубин, холестерин) оказывают токсическое действие на гепатоцит, в частности на его митохондрии, прямо или опосредованно блокируя дыхательный цикл и окисление жирных кислот. Результатом является не только дальнейшее нарушение функции гепатоцита, но и стимуляция процессов перекисного окисления липидов, что ведет к повреждению клетки.
Последствия холестаза для желчевыводящих путей обусловлены, с одной стороны, повышением давления в просвете канальцев, а с другой — повреждающим детергентным действием гидрофобных ЖК. Застой желчи в протоках на всех уровнях приводит к их пролиферации. В результате этих процессов локально повышается продукция факторов роста (в том числе трансформирующего фактора роста β1) и ряда провоспалительных цитокинов, которые стимулируют мезенхимальные клетки, синтезирующие компоненты внеклеточного матрикса, что в конечном итоге приводит к фиброзу.
Механизмы развития синдрома внутрипеченочного холестаза многофакторны: в основном преобладают гепатоцеллюлярный и каналикулярный холестаз, которые могут быть обусловлены вирусным, алкогольным, лекарственным, токсическим поражениями, метаболическими нарушениями (доброкачественный возвратный внутрипеченочный холестаз, холестаз беременных, муковисцидоз, α1— недостаточность), хромосомными нарушениями (трисомия по 13-й, 17/18-й хромосоме). Генетическая предрасположенность к холестазу проявляется особенностями биотрансформации ксенобиотиков в печени при изменениях со стороны гена АВСВ4, кодирующего каналикулярный выводной насос. Мутации и полиморфизм генов часто являются предпосылкой манифестации холестаза при действии экзогенных ксенобиотиков.
В основе формирования клинических проявлений холестаза лежат три фактора: избыточное поступление элементов желчи в кровь, уменьшение или отсутствие желчи в кишечнике, воздействие компонентов желчи на печеночные клетки и канальцы.
Различают внутри- и внепеченочный холестаз. При внутрипеченочном холестазе выделяют внутриклеточную, внутриканальцевую и смешанную формы. Кроме того, различают острый и хронический холестаз, а также желтушную и безжелтушную его формы.
Существует несколько форм холестаза. Парциальный характеризуется уменьшением объема секретируемой желчи, диссоциированный связан с задержкой только отдельных компонентов желчи (на ранних стадиях первичного недеструктивного холангита в сыворотке крови повышается содержание только ЖК и активности щелочной фосфатазы (ЩФ), в то время как уровень билирубина, холестерина, фосфолипидов остается в норме); тотальный связан с нарушением поступления желчи в двенадцатиперстную кишку.
Этиопатогенез холестаза
Этиология и патогенез внутрипеченочного холестаза довольно многообразны. В патогенезе развития холестаза наибольшее значение придают повреждению секреторного аппарата печеночных клеток и желчных канальцев, при котором происходяит нарушенияе секреции желчи, реабсорбции и секреции жидкости и электролитов в желчных канальцах.
Причинами холестаза могут быть нарушения функции транспортных систем гепатоцита. ЖК поступают в гепатоцит через базолатеральную мембрану с помощью специализированных транспортных систем. Конъюгированные ЖК проникают в гепатоцит при участии Na- зависимого трансмембранного котранспортера (Na-Taurocholate Cotransporting Protein — NTCP), а неконъюгированные — преимущественно при участии транспортера органических анионов (Organic Anion Transport Protein — OATP). В просвет желчного капилляра ЖК секретируются при участии аденозинтрифосфат (АТФ)-зависимого механизма, транспортера BSEP (Bile Salt Exporter Pump). Ряд транспортеров, объединенных в так называемую АТФ- зависимую «кассету» (ABC — ATP-Binding Cassette), обеспечивает активный транспорт других компонентов желчи. Важно, что работа транспортеров регулируется по принципу отрицательной обратной связи, а потому при повышении концентрации ЖК в протоках их экскреция из гепатоцита замедляется или прекращается.
Нарушение функции такого индивидуального переносчика ЖК, как BSEP, может служить причиной развития холестаза. В то же время относительная сохранность экспрессии данного транспортера при холестазе, возможно, защищает печень от повреждения, вызванного задержкой ЖК в организме (Frezza M., 1993; Nei S. et al., 2002; Харченко Н.В. и соавт., 2010).
В развитии холестаза важная роль отводится ЖК, обладающим выраженными поверхностноактивными свойствами. ЖК вызывают повреждение клеток печени и усиливают холестаз. Их токсичность зависит от степени липофильности (и, соответственно, гидрофобности). К гепатотоксичным ЖК относят хенодезоксихолевую (первичную ЖК, синтезирующуюся в печени), а также литохолевую и дезоксихолевую кислоты (вторичные кислоты, образующиеся в кишечнике из первичных под действием бактерий).
Состав и текучесть плазматических мембран гепатоцитов также оказывают влияние на активность ферментов и рецепторов гепатобилиарной транспортной системы. Сниженная текучесть мембраны обычно связана с повышенным содержанием холестерина, что характерно при лекарственном холестазе (при воздействии эстрогенов, анаболических стероидов).
Многие холестатические заболевания печени связаны с глубокими нарушениями цитоскелета гепатоцитов, в том числе с разрушением микротрубочек, увеличением числа промежуточных филаментов, разрушением микрофиламентов в периканаликулярной зоне гепатоцитов. Разрушение цитоскелета гепатоцитов под воздействием вирусов, цитокинов приводит к исчезновению микроворсинок на апикальной поверхности гепатоцитов, снижению сократимости каналикулярной мембраны, а также может служить причиной повышенной проницаемости межклеточных плотных контактов и приводить к обратному току желчи в синусоиды.
Другим механизмом развития интралобулярного холестаза является нарушение внутриклеточного транспорта везикул, зависящего от состояния микротрубочек. Подавление движения везикул ведет к сокращению количества функционирующих транспортеров на каналикулярной мембране, способствуя развитию холестаза.
Морфологически холестаз представляет собой накопление компонентов желчи, холестерина, фосфолипидов, меди, металлопротеинов в гепатоцитах, желчных протоках. Персистирующий холестаз с сопутствующим воспалением и соответствующей реакцией соединительной ткани ведет к необратимому холестазу, а в дальнейшем (через несколько месяцев или лет) — к развитию билиарного фиброза и первичного или вторичного билиарного цирроза.
Клинические проявления внутрипеченочного холестаза
В основе формирования клинических симптомов лежат три фактора: избыточное поступление желчи в кровь и ткани; уменьшение количества или отсутствие желчи в кишечнике; воздействие компонентов желчи и ее токсических метаболитов на печеночные клетки и канальцы.
Выраженность клинических симптомов внутрипеченочного холестаза зависит от тяжести основного заболевания, нарушения экскреторной функции гепатоцитов, печеночно-клеточной недостаточности.
Ведущими клиническими проявлениями холестаза являются кожный зуд и нарушение всасывания. Зуд долгое время остается единственным признаком болезни, часто нераспознанным. Зуд усиливается ночью, более выражен в холодное время года, носит мучительный характер, на теле пациента появляются множественные следы расчесов. Кожный зуд обусловлен избыточной концентрацией пруритогенов в крови, усилением нейротрансмиссии, дисбалансом эндогенных опиоидных пептидов, в меньшей степени — холемией. Желтуха — более поздний синдром холестаза, не всегда сопутствующий ему. Желтуха может быть следствием рефлюкса билирубина из канальцев в кровь или транспорта билирубина через синусоидальную мембрану, а также в ряде случаев возникает в результате метаболической дисфункции гепатоцитов.
Дефицит желчи приводит к нарушению пищеварения и абсорбции пищевых жиров. У больного развиваются метеоризм, снижение аппетита, непереносимость жирной пищи, тошнота и рвота, обесцвечивание кала. Стеаторея обусловлена недостаточным содержанием в просвете кишечника солей ЖК, необходимых для всасывания жиров и жирорастворимых витаминов А, D, К, Е, и соответствует выраженности желтухи. Отсутствует адекватное мицеллярное растворение липидов, при этом стул становится жидким, слабоокрашенным, объемным, зловонным. По цвету кала можно судить о динамике обструкции желчных путей (полной, интермиттирующей, разрешающейся) (Подымова С.Д., 2010; Голованова Е.В., Петраков А.В., 2011).
Билиарная стеаторея характеризуется значительным скоплением каловых масс (>200 г) и увеличением экскреции жира (>7 г/сут). Это состояние коррелирует с тяжестью холестаза. Стеаторея сопровождается диареей, потерей жидкости, электролитов, жирорастворимых витаминов. Стеаторея и диарея приводят к развитию синдрома мальабсорбции и последующему снижению массы тела. Развивается дефицит витаминов A, D, E и К. У 50% больных выявляют признаки остеопороза или остеомаляции.
При холестазе нарушена элиминация эндотоксинов, вследствие чего нарушается функция почек. В отличие от больных с гепатоцеллюлярным заболеванием, слабость и утомляемость при этом нехарактерны.
При объективном исследовании печень, как правило, увеличена, с гладким краем, уплотнена, безболезненна, спленомегалия нехарактерна, если нет билиарного цирроза и портальной гипертензии, кал обесцвечен.
При длительном холестазе снижается уровень витамина А в сыворотке крови вследствие нарушения всасывания; процесс накопления витамина в печени не нарушен. При истощении печеночных запасов витамина А наступает нарушение адаптации глаза к темноте («куриная слепота»). Может развиться также дефицит витамина D, приводящий к остеомаляции. В большей части случаев печеночная остеодистрофия представлена остеопорозом. Также при холестазе наблюдается нарушение обмена меди, способствующее процессам коллагеногенеза. У здорового человека около 80% всасываемой меди в кишечнике экскретируется с желчью и выводится с калом.
Печеночно-клеточная недостаточность развивается медленно, функция печени при холестазе долгое время остается сохранной. Печеночная недостаточность присоединяется при длительности желтухи 3–5 лет; об этом свидетельствуют быстрое нарастание желтухи, появление асцита, отеков, снижение уровня альбумина в сыворотке крови. Кожный зуд уменьшается, кровоточивость не поддается лечению парентеральным введением витамина К. В терминальной стадии развивается печеночная энцефалопатия.
В крови отмечают повышение содержания прямого билирубина, холестерина, конъюгированных ЖК, гамма-глутамилтранспептидазы (ГГТП), активности (ЩФ). ЩФ, ГГТП, 5-нуклеотидаза, лейцинаминопептидаза (ЛАП) рассматриваются как ферменты холестаза, если повышение их уровня значительно превосходит активность трансаминаз (аланинаминотрансфераза — АлАТ, аспарагинаминотрансфераза — АсАТ). Повышение уровней ЩФ и ГГТП связано с их высвобождением из каналикулярной мембраны под действием ЖК и с повышением их последующего синтеза.
Также в сыворотке крови повышается уровень всех компонентов желчи в результате нарушения ее экскреции. Повышен уровень сывороточных липопротеинов (ЛП) в основном за счет ЛП низкой плотности. Концентрация ЛП высокой плотности снижена. Уровень альбумина и глобулинов при остром холестазе не меняется. С развитием билиарного цирроза уровень альбумина сыворотки крови может снижаться.
Алгоритм диагностического обследования
При внутрипеченочном холестазе выполняется ультразвуковое исследование (УЗИ) в реальном времени, позволяющее разграничить холестаз с расширенными и нерасширенными протоками. При УЗИ в случае внутрипеченочного холестаза возможно повышение эхогенности стенок внутрипеченочных желчных протоков, сужение их просвета. При выявлении расширения протоков необходимо проведение холангиографии. При отсутствии ультразвуковых признаков расширения желчных протоков ход дальнейшего обследования определяется клиническими данными. При подозрении на поражение протоков (камни или первичный склерозирующий холангит) выполняют эндоскопическую ретроградную холангиопанкреатографию (ЭРХПГ). Если при холангиографии патологические изменения отсутствуют, следует обсудить возможность биопсии печени.
При невозможности ретроградного заполнения желчных путей используется чрескожная чреспеченочная холангиография (ЧЧХГ). Оба метода (ЭРХПГ и ЧЧХГ) позволяют дренировать желчные пути при их обструкции, однако при эндоскопическом подходе отмечают меньшую частоту осложнений. Кроме того, при ЭРХПГ возможно проведение эндоскопической папиллосфинктеротомии для удаления камней.
Компьютерная томография обладает чувствительностью 74–96% и специфичностью 90–94% в диагностике холестаза. В сложных случаях выполняется магнитно-резонансная холангиография (МРХ). Если данные МРХ не позволяют идентифицировать причину холестаза, необходимо провести ЭРХПГ, а если это технически невозможно — позитронно-эмиссионную томографию (ПЭТ). Если результаты предшествующего диагностического поиска неоднозначны, выполняют биопсию печени; однако гистологическое исследование не всегда позволяет надежно отличить внутри- и внепеченочный холестаз.
Терапия внутрипеченочного холестаза
Диетические рекомендации при внутрипеченочном холестазе включают адекватный прием белка, уменьшение потребления нейтрального жира с пищей 40 г/сут, восполнение дефицита жирорастворимых витаминов перорально: А (25 000 МЕ/сут), D (400–4000 ME/сут), Е (200 мг/сут) и К (10 мг/сут), кальция (1 г/сут), а также электролитов и цинка.
Патогенетически обоснованным при внутрипеченочном холестазе является назначение адеметионина (препарата Гептрал ® (Heptral ® ) производства компании «Абботт Лабораториз С.А.» (Abbott Lab), США), обладающего широким спектром терапевтического действия на организм.
Адеметионин (S-аденозилметионин) — природное вещество, производное серосодержащей незаменимой аминокислоты метионина и АТФ. Ежесуточно из аденозина и метионина с участием фермента S-аденозилметилсинтетазы синтезируется 8 г эндогенного адеметионина (Юрьев К.Л., 2011). Необходимость метионина как незаменимой аминокислоты для животных и человека обусловлена прежде всего его уникальным свойством донатора лабильных метильных групп. Однако фактическим донатором метильных групп в реакциях трансметилирования является не свободный метионин, а его производное — адеметионин, который поэтому еще называют активным метионином. Адеметионин есть во всех живых тканях организма, его химическое строение впервые было представлено G.L. Cantoni в 1952 г. Десятилетия интенсивных исследований биохимической и молекулярной роли адеметионина в клеточном метаболизме создали мощную научную базу для дальнейших клинических исследований.
На сегодня наиболее изученными областями терапевтического применения адеметионина являются заболевания печени, депрессия и остеоартроз (Hardy M. et al., 2002).
Возможность терапевтического применения адеметионина при болезнях печени обосновывают две базовые концепции (Lieber C.S., 2002; Lieber C.S., Packer L., 2002). Во-первых, это давно установленное и хорошо известное положение о том, что ряд питательных веществ (нутриентов) являются эссенциальными (незаменимыми) по той причине, что не синтезируются эндогенно в организме человека и поэтому должны поступать извне с пищей. Классический тому пример — 9 незаменимых аминокислот, которые должны быть обязательным компонентом рациона любого человека. Незаменимой аминокислотой является и метионин, которым богаты молочные продукты (твердый сыр, творог), мясо, рыба, яйца, бобовые, гречневая крупа, пшено. При заболеваниях печени необходимо дополнительно использовать ряд эссенциальных нутриентов, в частности метионин, который прежде чем выполнять свои биологические функции, должен быть активирован и преобразован в адеметионин. Этот процесс часто нарушается при различных заболеваниях печени (вследствие нарушения функции ферментов, задействованных в процессе активации метионина) и, как оказалось, не может быть компенсирован просто путем дополнительного приема метионина с пищей. В экспериментальном исследовании J.D. Finkelstein, J.J. Martin (1986) показано, что даже 7-кратное повышение содержания метионина в рационе не оказывает существенного влияния на содержание внутрипеченочного адеметионина. Таким образом, увеличение количества метионина в рационе может не принести желаемого терапевтического результата, а в ряде случаев даже стать причиной интоксикации (Lieber C.S., 2002).
В таких случаях адеметионин приобретает ключевую роль в нормальном функционировании клетки в патологических условиях и становится эссенциальным нутриентом (вместо метионина), или так называемым супернутриентом, то есть активированным нутриентом, способным обеспечить запросы организма в случаях, когда его эндогенный синтез из поступающего с пищей предшественника (метионина) становится недостаточным из-за нарушения активации вследствие патологического процесса (в том числе и внутрипеченочного холестаза).
Гепатопротекторное действие адеметионина
В основе гепатопротекторного действия адеметионина лежит его незаменимое участие в жизненно важных биохимических реакциях трансметилирования, транссульфирования, аминопропилирования, а также влияние на обмен оксида азота и цитокиновый баланс (Кузнецова Е.Л., Широкова Е.Н., 2007; Ивашкин В.Т., Буеверов А.О., 2010; Юрьев К.Л., 2011).
Адеметионин, являясь донором метильной группы, принимает непосредственное участие в синтезе фосфатидилхолина. Для понимания механизма его защитного действия следует учитывать, что все клеточные мембраны имеют типичное строение и в среднем на ⅔ (мембрана митохондрий — на 92%) состоят из фосфолипидов, 80–90% которых представлены фосфатидилхолином. Помимо структурной функции, фосфолипиды участвуют в процессах молекулярного транспорта, деления и дифференцировки клетки, стимулируют активность различных ферментных систем.
Нарушение транссульфирования приводит к дефициту глутатиона — важнейшего клеточного антиоксиданта. Недостаток глутатиона, характерный для хронических заболеваний печени, снижает устойчивость гепатоцитов к повреждающему действию свободных радикалов, постоянно образующихся вследствие метаболизма экзогенных и эндогенных ксенобиотиков. Кроме того, адеметионин служит предшественником других тиоловых соединений, таких как цистеин, таурин, коэнзим А. Такой метаболит адеметионина, как таурин, также играет важную роль в детоксицирующей функции печени, будучи вовлечен в конъюгацию ЖК. Поскольку конъюгирование таурина с ЖК способствует повышению растворимости последних, снижение содержания таурина ведет к накоплению токсичных ЖК в клетках печени. Повышенная концентрация гидрофобных ЖК запускает цепь биохимических процессов, конечным итогом которых является гибель гепатоцитов и холангиоцитов посредством апоптоза (Hardy M. et al., 2002; Голованова Е.В., Петраков А.В., 2011).
Детоксикация ЖК происходит также путем их непосредственного сульфурирования. Сульфурированные ЖК способны защитить мембраны клеток от разрушительного действия несульфурированных ЖК, которые в высоких концентрациях присутствуют в гепатоцитах при внутрипеченочном холестазе.
Реакции аминопропилирования являются третьим адеметионинзависимым биохимическим путем: аминопропильная группа переносится к полиаминам типа путресцина, спермина и спермидина, которые играют важную роль в структурах рибосом, пролиферации и регенерации гепатоцитов, обладают противовоспалительными и анельгезирующими свойствами (Hardy M. et al., 2002; Подымова С.Д., 2010; Голованова Е.В., Петраков А.В., 2011; Юрьев К.Л., 2011).
Помимо этого, адеметионин, влияя на обмен оксида азота (NO), уменьшает выработку индуцибельной NO-синтетазы, снижает продукцию фактора некроза опухолей (ФНО)-α, стимулированную бактериальным липополисахаридом, а также усиливает синтез физиологического антагониста ФНО-α — интерлейкина-10, обладает антиапоптозным действием на нормальные гепатоциты и проапоптозным — на поврежденные (Кузнецова Е.Л., Широкова Е.Н., 2007; Ивашкин В.Т., Буеверов А.О., 2010).
Основные метаболические пути адеметионина представлены на рисунке (Юрьев К.Л., 2012).
Согласно современным представлениям Гептрал ® следует назначать в адекватных дозах — не менее 1600 мг/сут. При внутрипеченочном холестазе препарат назначается в дозе 800 мг первые 14 сут внутривенно, затем в дозе 1600 мг перорально на протяжении 1 мес, при необходимости — 2 мес.
Экспериментальные и клинические данные свидетельствуют об антиоксидантном и детоксицирующем действии адеметионина, а также об ускорении под его влиянием регенерации печеночной ткани и замедлении развития фиброза и апоптоза гепатоцитов (Boyer J.L., 2001; Elferink R., 2003; Подымова С.Д., 2010; Харченко Н.В. и соавт., 2010).
Почти за 4 десятилетия терапевтического применения адеметионина накопилось достаточно большое количество результатов плацебо-контролируемых мультицентровых клинических исследований его эффективности при патологии печени, выполненных в соответствии с принципами доказательной медицины. В самый первый метаанализ были включены результаты 6 контролируемых испытаний адеметионина при внутрипеченочном холестазе у пациентов с различными заболеваниями печени и у беременных (Finkelstein J.D., Martin J.J., 1986; Frezza M., 1993; Fiorelli G., 1999).
Терапевтический эффект адеметионина через 15–30 дней лечения статистически значимо превышал таковой плацебо в отношении следующих исходов: полное прекращение кожного зуда (77,6% против 27,8%, p ® у больных с внутрипеченочным холестазом вне зависимости от его этиологии (Юрьев К.Л., 2011). При лечении препаратом отмечается быстрая и клинически значимая редукция синдромов холестаза, цитолиза, астении, повышается уровень эндогенной антиоксидантной защиты, нормализуется липидный спектр, достоверно уменьшается выраженность гиперхолестеринемии, что способствует повышению качества жизни пациентов и их социальной адаптации.
Гептрал ® обладает высоким уровнем безопасности, практически не имеет побочных действий, эффекта кумуляции в организме и нежелательных взаимодействий с другими средствами. Средняя частота возникновения побочных эффектов при внутривенном и внутримышечном введении составила 2,7 и 5,6% соответственно. Пероральный прием препарата вызывал побочные эффекты у 13,8% больных, что почти не отличалось от группы плацебо (10,8%). К ним относились тошнота, преходящая бессонница, изжога, диарея, головная боль; при этом перечисленные симптомы не стали причиной прекращения лечения (Frezza M. et al., 1987; Звягинцева Т.Д., 2009).
G. Manzillo и соавторы (1992), анализируя результаты лечения 420 пациентов с острыми и хроническими заболеваниями печени с синдромом внутрипеченочного холестаза из 12 итальянских медицинских центров в двойном слепом плацебо-контролируемом исследовании, пришли к следующим выводам. Применение адеметионина в дозе 800 мг внутривенно в течение 2 нед и затем в дозе 1600 мг перорально в течение 8 нед привело к ответу на терапию у 60% больных, получавших препарат, и у 34% больных, принимавших плацебо. Кожный зуд уменьшился у 77,6% больных, лечившихся адеметионином, по сравнению c 27,8% в группе плацебо. Важно подчеркнуть, что в исследование не включали больных, злоупотреблявших алкоголем, получавших противовирусную или гормональную терапию или другие препараты для лечения заболеваний печени.
В контролируемом открытом испытании (Fiorelli G., 1999) 640 пациентов с внутрипеченочным холестазом как осложнением хронических заболеваний печени (цирроз — 309 больных, хронический вирусный гепатит — 190, первичный билиарный цирроз — 16, первичный склерозирующий холангит — 14) получали адеметионин по одной из двух схем: по 500 мг ежедневно внутримышечно или по 800 мг/сут внутривенно в течение 15 сут. После 7 сут лечения ответная реакция со стороны уровня билирубина и активности ЩФ была выявлена у 39% пациентов, получавших препарат внутримышечно, и у 43% больных, которым препарат вводили внутривенно. В конце лечения ответная реакция выявлена соответственно у 61 и 62% больных. Зуд уменьшился или исчез у 74% пациентов при внутримышечном введении препарата и у 69% больных при внутривенном введении; уменьшилась или исчезла усталость соответственно у 72 и 69% больных. Полученные результаты свидетельствуют об эффективности краткосрочного лечения адеметионином больных с внутрипеченочным холестазом на фоне хронических заболеваний печени, причем обе схемы введения препарата давали хорошую ответную реакцию.
Применение адеметионина целесообразно для купирования синдрома внутрипеченочного холестаза, развивающегося у больных хроническим гепатитом С на фоне терапии рофероном А. Устранение холестаза у этих пациентов позволяет провести полноценный курс интерферонотерапии (Adachi Y. et al., 1986). В другом контролируемом рандомизированном исследовании сравнительной эффективности урсодезоксихолевой кислоты и адеметионина у 46 пациенток пришли к выводу об одинаковой эффективности обоих препаратов в отношении кожного зуда (Roncaglia N. et al., 2004).
Эффективность препарата при внутрипеченочном холестазе беременных была подтверждена результатами метаанализа 8 исследований. Эффективность внутривенного введения адеметионина по сравнению с плацебо при холестазе беременных изучена в двух плацебо-контролируемых исследованиях, включавших соответственно 18 и 30 женщин. Дозы адеметионина составляли 200 и 800 мг/сут на протяжении 20 сут. В группе, где применяли более высокую дозу препарата, отмечали значительную редукцию зуда, уровней сывороточного конъюгированного билирубина, желчных солей, щелочной фосфатазы и трансаминаз. В другой группе показатели были относительно стабильными, в то время как в группе плацебо все вышеозначенные параметры ухудшались. Открытое исследование внутривенного введения адеметионина в дозе 800 мг у 55 женщин с холестазом беременных также продемонстрировало положительную динамику во всех случаях: редукция кожного зуда достигнута у 15 пациенток, полное исчезновение — у 40. Клиническое улучшение сопровождалось нормализацией биохимических показателей (Ribalta J. et al., 1991; Kondrackiene J., Kupcinskas L., 2008). У большинства больных с внутрипеченочным холестазом уменьшается степень выраженности кожного зуда и биохимических критериев внутрипеченочного холестаза — уровня прямого билирубина, активности ГГТП и ЩФ, что связано с антихолестатическим эффектом Гептрала. На фоне лечения выявлена также положительная динамика в выраженности синдрома цитолиза (Подымова С.Д., 2010).
Таким образом, многолетний опыт успешного применения препарата Гептрал ® в лечении внутрипеченочного холестаза различного генеза подтверждает целесообразность введения препарата в широкую клиническую практику.
Выводы
1. Адеметионин является производным незаменимой аминокислоты метионина и играет ключевую роль во всех метаболических процессах, протекающих в организме.
2. Многочисленные клинические исследования и собственные наблюдения свидетельствуют о патогенетической обоснованности и терапевтической эффективности Гептрала в лечении пациентов с внутрипеченочным холестазом.
4. При применении препарата Гептрал ® отмечают быструю и клинически значимую редукцию синдромов холестаза, цитолиза, астении, повышение уровня эндогенной антиоксидантной защиты, нормализацию липидного спектра, достоверное уменьшение выраженности гиперхолестеринемии, что способствует повышению качества жизни пациентов и их социальной адаптации.
5. Гептрал ® обладает высоким уровнем безопасности, практически не имеет побочных действий, эффекта кумуляции в организме и нежелательных взаимодействий с другими лекарственными средствами.
6. Гептрал ® следует назначать в адекватных дозах — не менее 1600 мг/сут.
7. Эффективность препарата не снижается при проведении повторных курсов лечения.
