Холинергические побочные реакции что это такое
Современный опыт применения антихолинэстеразных препаратов в неврологии
Антихолинэстеразные средства в неврологической практике применяются для активации процессов регенерации и реиннервации при заболеваниях периферической и центральной нервной системы
Антихолинэстеразные средства в неврологической практике применяются для активации процессов регенерации и реиннервации при заболеваниях периферической и центральной нервной системы.
Долгие годы в лечебной практике широко используется препарат «Прозерин», обладающий выраженным действием на периферические холинергические синапсы.
В конце 80-х гг. 20 века было синтезировано лекарственное средство «Амиридин» с комбинированным антихолинэстеразным эффектом. С 2002 г. препарат выпускается под торговым наименованием «Нейромидин».
Фармакологические эффекты антихолинэстеразных препаратов приводят к усилению действия ацетилхолина. Выбор препарата из группы антихолинэстеразных средств определяется его фармакологическими свойствами, длительностью действия, активностью, способностью проникать через тканевые барьеры, а также побочными эффектами.
Прозерин — N-(мета-диметилкарбамоилоксифенил)-триметиламмонийметил-сульфат обладает сильной обратимой антихолинэстеразной активностью. Основой механизма его действия является ингибирование ацетилхолинэстеразы — фермента, гидролизующего медиатор ацетилхолин, которое сопровождается замедлением скорости его разрушения, накоплением и усилением действия в области холинергических синапсов с восстановлением нервно-мышечной проводимости.
В связи с наличием в молекуле Прозерина четвертичной аммониевой группы, препарат плохо проникает через гематоэнцефалический барьер и оказывает в основном влияние на периферические холинергические структуры.
Существенным отличием Нейромидина (ипидакрина) от Прозерина является способность Нейромидина блокировать калиевую проницаемость мембраны, что приводит к продлению реполяризационной фазы потенциала ее действия и повышению активности пресинаптического аксона. Этот процесс сопровождается увеличением входа ионов кальция в пресинаптическую терминаль и, как следствие, усилением выброса медиатора ацетилхолина в синаптическую щель во всех синапсах, способствуя усилению стимуляции постсинаптической клетки.
Кроме того, Нейромидин обладает эффектом обратимого ингибирования холинэстеразы в холинергических синапсах, что дополнительно увеличивает накопление нейромедиатора в синаптической щели и соответственно усиливает функциональную активность постсинаптической клетки. Однако торможение действия ацетилхолинэстеразы у Нейромидина менее выражено по сравнению с Прозерином.
Таким образом, Нейромидин стимулирует пресинаптическое нервное волокно, увеличивает выброс нейромедиатора в синаптическую щель, уменьшает разрушение медиатора ацетилхолина ферментом, повышает активность постсинаптической клетки прямым мембранным и опосредованным медиаторным воздействием, то есть действует на все звенья проведения возбуждения, в отличие от Прозерина, который уменьшает метаболизм медиатора только в холинергических синапсах.
М-холиномиметические эффекты Прозерина и Нейромидина схожи, однако активность воздействия на М-холинорецепторы у Прозерина выше.
Нейромидин обладает следующими фармакологическими эффектами: восстанавливает и стимулирует нервно-мышечную передачу, проводит импульс в периферической нервной системе, нарушенный вследствие воздействия различных факторов. Нейромидин увеличивает сократительную активность мышц под влиянием ацетилхолина и других медиаторов: адреналина, серотонина, гистамина и окситоцина, оказывая прямое воздействие на миофибриллы, в то время как Прозерин таким свойством не обладает.
Нейромидин, в отличие от Прозерина, стимулирует проведение нервного импульса не только в нервно-мышечном синапсе, но и в ЦНС, что объясняет положительное влияние этого препарата на мнестические процессы.
Следует обратить внимание на чрезвычайно важное, хотя и умеренно выраженное свойство Нейромидина — способность блокировать натриевую проницаемость мембраны. С этим эффектом связаны его седативные и анальгетические свойства. Кроме того, препарат обладает антиаритмическим эффектом.
Прозерин и Нейромидин метаболизируются в печени, а выводятся в основном за счет почечных механизмов. В неизмененном виде выделяется 50% Прозерина и 3,7% Нейромидина, что свидетельствует об ускоренном метаболизме Нейромидина. Начальный эффект от введения Прозерина отмечается, в среднем, через 10–15 минут, а от введения Нейромидина — через 15–20 минут. Продолжительность действия Нейромидина — 3–5 часов, что связано с длительной блокадой калиевой проницаемости мембраны, а Прозерин заканчивает свое действие через 2–3 часа после его введения.
Прозерин в результате воздействия на Н-холинорецепторы приводит к значительному повышению силы сокращения скелетных мышц и благодаря этому показан к применению в первую очередь у больных с миастенией и миастеническим кризом. Также препарат используется в неврологической практике при параличах, парезах, возникающих после механических травм, остаточных явлениях перенесенного менингита, полиомиелита, энцефалита и при невропатиях.
Благодаря мускариноподобным эффектам Прозерин используется для устранения послеоперационной атонии кишечника и мочевого пузыря, изредка при слабости родовой деятельности, иногда в офтальмологической практике при открытоугольной форме глаукомы.
В связи с тем что Прозерин облегчает передачу возбуждения в вегетативных ганглиях, он показан при отравлениях ганглиоблокаторами. Кроме того, Прозерин эффективен при передозировке миорелаксантов антидеполяризующего действия (мышечная слабость, угнетение дыхания).
Показания к применению Нейромидина шире, так как в его основе лежит биологически выгодная комбинация двух молекулярных эффектов (блокада калиевой проницаемости мембраны и ингибирование холинэстеразы) и он стимулирует структурные образования ЦНС. Это не только поражения периферической нервной системы: нейропатии, полинейропатии, миелополирадикулоневриты, миастения и миастенический синдром, рассеянный склероз и другие формы демиелинизирующих заболеваний нервной системы (в комплексной терапии), но и бульбарные параличи и парезы при органических поражениях ЦНС в восстановительном периоде, а также нарушения памяти, внимания, мотивации и инициативы различного генеза, дезориентация, эмоциональная лабильность при сенильной деменции, болезнь Альцгеймера и другие формы слабоумия позднего возраста, энцефалопатии травматического, сосудистого и другого генеза, сопровождающиеся не только нарушением памяти, но и двигательных функций.
Нейромидин, также как и Прозерин, используется при атонии кишечника и интоксикации антихолинергическими средствами.
Сопоставление клинического эффекта Нейромидина и Прозерина при миастении показало, что Прозерин по своему антихолинэстеразному действию значительно превосходит Нейромидин. Добиться полной компенсации двигательных расстройств у пациентов с миастенией можно, только используя Прозерин. Однако его применение ограничивает большое число побочных эффектов.
Вместе с тем отмечена эффективность Нейромидина в комплексном лечении больных миастенией и миастеническими синдромами, так как он дополняет действие Прозерина. Оба препарата улучшают передачу возбуждения в нервно-мышечном синапсе, и хотя Нейромидин слабее по антихолестеразной активности, но выигрывает в длительности действия.
Нейромидин приводит к урежению миастенических кризов, более быстрому наступлению и увеличению длительности ремиссий, повышению сократительной активности мышц, улучшению общего состояния больных.
По данным Российского миастенического центра Нейромидин продемонстрировал максимальную эффективность у пациентов с миастеническим синдромом Ламберта–Итона в отличие от Прозерина, при этом отмечено относительное снижение выраженности вегетативно-трофических нарушений.
И все же достоверным дифференциально-диагностическим тестом в диагностике острых состояний при миастении, а именно миастенических и холинергических кризах, является введение Прозерина. Проба с Прозерином при миастеническом кризе позитивная и проявляется в увеличении силы мышцы или ее полном восстановлении, а при холинергическом кризе — негативная.
Клинические исследования показали преимущества Нейромидина по сравнению с Прозерином в комплексной терапии нейропатии лицевого нерва, травматических невропатий и плексопатий. Лечение Нейромидином можно начать в дебюте заболевания, а Прозерин назначается спустя 10 дней, учитывая риск постпаралитической контрактуры. Восстановление функции мышц происходит быстрее при использовании Нейромидина. Отчетливый положительный эффект достигнут у 89,5% больных с поражением лицевой мускулатуры, у 80% пациентов с травматическими невропатиями и плексопатиями. Полное восстановление утраченной функции конечностей зарегистрировано у 40% больных. Причем активизация реиннервации больных подтверждается положительной динамикой показателей электромиографии (ЭМГ). Следует подчеркнуть, что признаков контрактуры конечностей или мимической мускулатуры ни у одного из наблюдаемых пациентов не отмечено. Несмотря на позднее назначение Прозерина, у нескольких пациентов все же наблюдалось появление патологических синкинезий на 16–22 день заболевания.
Нейромидин в лечении больных демиелинизирующими заболеваниями нервной системы (рассеянный склероз, боковой амиотрофический склероз) продемонстрировал положительный эффект на ранних стадиях заболевания у 40% больных. Конечно, лечебный эффект Нейромидина менее выражен, но он более длительный, чем у Прозерина. Под влиянием Нейромидина происходит восстановление проведения возбуждения в спинном мозге и периферической нервной системе, что проявляется уменьшением выраженности парезов и параличей, расстройств чувствительности, повышением силы в пораженных группах мышц.
Эффективное лечение сенсорных симптомов не зависимо от патогенеза поражения периферических нервов, обусловлено блокированием ионных каналов аксолеммы и нейрональных мембран, в основном калиевых и частично натриевых, что выгодно отличает Нейромидин от Прозерина.
Анальгетическое действие Нейромидина, блокирующего ионные каналы, достигается торможением эктопических разрядов и эфаптической передачи возбуждения в поврежденном нерве, в регенерирующих аксональных ветвлениях в результате коллатерального спраутинга, а также снижением возбудимости центральных нейронов.
Нейромидин входит в группу препаратов, используемых в качестве патогенетического лечения диабетической хронической дистальной симметричной сенсомоторной полинейропатии. Патогенетические механизмы диабетической полинейропатии приводят к прогрессивной потере миелинизированных волокон, в результате чего проведение нервного импульса замедляется, а во вновь образующихся в результате регенеративного спраутинга «новых» синапсах нервно-мышечная передача не эффективна. Исследование Нейромидина в лечении диабетической полинейропатии продемонстрировало уменьшение выраженности сенсорных симптомов, особенно парестезий, крампи, стреляющей боли с подтверждением результатами ЭМГ (увеличение амплитуды М-ответа).
Нейромидин в отличие от Прозерина, который фактически не проникает через гематоэнцефалический барьер, имеет способность стимулировать структурные образования ЦНС, в частности когнитивные процессы.
Когнитивные расстройства являются ведущими клиническими проявлениями хронической недостаточности мозгового кровообращения. Существует мнение, что мнестические расстройства связаны с центральным холинергическим дефицитом, а глютаматная экзайтотоксичность, возникающая при этом, является вторичной.
У пожилых людей нарушаются как пресинаптический, так и постсинаптический компоненты центральных холинергических синапсов, расположенных в коре больших полушарий и в гиппокампе, в результате чего уменьшается высвобождение ацетилхолина и снижается чувствительность к нему в пожилом возрасте.
После курса Нейромидина у пациентов с прогрессирующей сосудистой лейкоэнцефалопатией улучшалась кратковременная память, уменьшались проявления астенического синдрома, улучшались показатели когнитивных функций.
У больных сенильной деменцией альцгеймеровского типа и мультиинфарктной деменции, получавших Нейромидин, было выявлено уменьшение поведенческих нарушений, улучшение когнитивных функций, речи и социальной адаптации.
Независимым фактором нарушения когнитивных функций и развития деменций является сахарный диабет. Проведенные клинические исследования позволяют рассматривать Нейромидин как препарат первой линии лечения больных сахарным диабетом с умеренными когнитивными нарушениями и деменцией.
У больных с последствиями умеренного или легкого мозгового инсульта на фоне лечения Нейромидином возрастала физическая активность, интеллектуальные функции, увеличивался объем памяти. В восстановительном периоде ишемического инсульта средней тяжести у пациентов наблюдалось значительное уменьшение степени пареза конечностей без нарастания мышечного тонуса, бульбарных параличей и парезов, регресс расстройств чувствительности, вегетативно-трофических нарушений. У 70–80% больных с сосудистыми и другими органическими поражениями головного мозга в остром и отдаленном периодах отмечался быстрый регресс нарушений памяти, внимания, праксиса, шаткости при ходьбе, уменьшение астенических явлений, улучшение сна, повышение интеллектуальных возможностей больного и его работоспособности. Почти у всех больных с афазией отмечено улучшение речевых функций.
Оба препарата производятся в таблетированной (Прозерин по 15 мг, Нейромидин по 20 мг) и ампулированной форме по 1 мл (Прозерин 0,05%, в глазной практике используется 0,5% раствор, Нейромидин 1,5% и 0,5% раствор). Прозерин выпускается также в форме порошка, гранулах (для детей). Его применяют внутрь и подкожно. Взрослым Прозерин назначают внутрь за 30 мин до еды в порошках или таблетках по 10–15 мг 2–3 раза в день, подкожно вводят по 0,5 мг (1 мл 0,05% раствора) 1–2 раза в день, в глаза по 1–2 капли 0,5 % раствора 1–4 раза в сутки.
При развитии миастенического криза у взрослых Прозерин вводят внутривенно — 0,5–1 мл 0,05% раствора, затем подкожно в дозе 1,5–2,5 мл в зависимости от веса больного. Лечение миастении Прозерином проводят длительно. При других заболеваниях курс лечения продолжается 25–30 дней; при необходимости его повторяют после 3–4-недельного перерыва.
Нейромидин используют внутрь независимо от приема пищи, подкожно и внутримышечно. При поражениях периферической нервной системы — по 20 мг 2–3 раза в день в течение 30–40 дней. Курсы лечения повторяют с перерывом 1–2 месяца. При острых невритах используют по 10–20 мг в день в течение 10–15 дней, при хронических невропатиях длительность лечения увеличивают до 20–30 дней. При необходимости курсы повторяют 2–3 раза с интервалом 2–4 недели до достижения максимального эффекта.
При миастении, миастенических синдромах, демиелинизирующих поражениях нервной системы дозу Нейромидина можно увеличить до 20–40 мг 5–6 раз в сутки. Максимальная суточная доза — 180–200 мг. Купирование миастенического криза — по 5–15 мг 1–2 раза в сутки подкожно или внутримышечно.
Наибольший эффект для стимулирования когнитивных процессов получен при использовании средних (50–60 мг/сут) и высоких доз (80–120 мг/сут) Нейромидина.
При болезни Альцгеймера и других формах слабоумия требуется индивидуальный подбор режима дозирования Нейромидина. Максимальная суточная доза может достигать 200 мг; длительность курса терапии — от 4 месяцев до 1 года. При необходимости применения высоких доз целесообразно применение 4–5 раз в сутки с интервалом 2–3 ч.
В восстановительном периоде ишемического инсульта легкой и средней тяжести используют 1,5% раствор Нейромидина внутримышечно в течение 14 дней по 1 мл в день.
При черепно-мозговой травме Нейромидин назначают от 40 мг до 120–160 мг в сутки. Курс лечения составляет 30–40 дней, 4 раза в год с интервалом месяц.
Для лечения и профилактики атонии кишечника — по 15–20 мг 2–3 раза в сутки в течение 1–2 нед.
Противопоказаниями к применению Прозерина и Нейромидина являются: гиперчувствительность, эпилепсия, экстрапирамидные нарушения с гиперкинезами, бронхиальная астма, стенокардия, выраженная брадикардия, беременность и период лактации.
Число противопоказаний и побочных эффектов у Прозерина больше по сравнению с Нейромидином, что связано с его сильной антихолинэстеразной активностью. Прозерин нельзя использовать при выраженном атеросклерозе, органических заболеваниях сердца и сосудов, тиреотоксикозе, язвенной болезни желудка и двенадцатиперстной кишки, перитоните, воспалительных процессах в брюшной полости, механической обструкции желудочно-кишечного тракта и мочевыводящих путей, аденоме предстательной железы, периоде острого заболевания, интоксикации.
Следует соблюдать осторожность при использовании нейромидина у пациентов с заболеваниями сердечно-сосудистой системы, тиреотоксикозом, язвенной болезнью желудка, однако эти состояния не являются противопоказаниями к его применению.
При применении Прозерина возможно появление гиперсаливации, обильного потоотделения, спастического сокращения и усиления перистальтики кишечника, тошноты, рвоты, метеоризма, диареи, учащенного мочеиспускания. Кроме того, могут развиться головная боль, головокружение, слабость, потеря сознания, сонливость, миоз, нарушения зрения, артралгии, аллергические реакции вплоть до анафилаксии. Со стороны сердечно-сосудистой системы: замедление сердечного ритма, аритмии, AV-блокада, неспецифические изменения на ЭКГ, снижение артериального давления, остановка сердца. Со стороны дыхательной системы: одышка, бронхоспазм, угнетение дыхания до остановки. Благодаря никотиноподобным эффектам Прозерин может вызвать тремор, спазмы и подергивание скелетной мускулатуры, включая фасцикуляции мышц языка, дизартрию, судороги.
Для снятия побочных явлений уменьшают дозу Прозерина или прекращают его прием, при необходимости вводят холинолитические препараты.
При парентеральном введении больших доз Прозерина необходимо предварительное или одновременное назначение атропина для нивелирования побочных мускариновых эффектов. При развившихся судорогах используют Сибазон.
Нейромидин, в сравнении с Прозерином, хорошо переносим, побочные эффекты возникают редко, слабо выражены и, как правило, не требуют отмены препарата, в связи со слабой антихолестеразной активностью и быстрым выведением, что препятствует кумуляции и возникновению побочных эффектов.
Кроме того, при приеме Нейромидина, в отличие от Прозерина, не наблюдается побочных эффектов, обусловленных действием на Н-холинергические синапсы, — фасцикуляции, крампи. Побочные эффекты Нейромидина связаны с активацией М-холинергических синапсов. В основном это диспептические явления (тошнота, усиление перистальтики, учащение частоты стула без диареи), которые самостоятельно регрессируют и не требуют прекращения лечения.
Появление других побочных явлений, таких как головокружение, гиперсаливация и брадикардия, кожно-аллергические реакции, требует коррекции дозы или короткого 1–2-дневного перерыва в лечении.
Для предотвращения побочных нежелательных явлений необходимо титровать препарат до лечебной дозы, чтобы организм адаптировался к усилению холинергической активности.
В связи с тем что Нейромидин может оказывать седативное действие, во время лечения необходимо воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенной концентрации внимания, в том числе и вождения автотранспорта. На время лечения следует исключить прием этанола, так как возможно усиление неблагоприятных побочных действий.
Нейромидин и прозерин, несмотря на общее антихолинэстеразное действие, являются препаратами, обладающими неоднородными фармакологическими свойствами, что обуславливает их круг применения. В связи с высокой антихолинэстеразной активностью, Прозерин обладает рядом выраженных побочных эффектов и остается препаратом выбора при миастении, миастенических кризах и демиелинизирующих заболеваниях. Нейромидин обладает более широким спектром фармакологической активности, в том числе и стимулирующим действием на структурные образования ЦНС, поэтому с успехом применяется как при лечении заболеваний периферической нервной системы, так и при органических поражениях ЦНС. Несомненным достоинством является хорошая переносимость и отсутствие выраженных побочных эффектов, что позволяет его длительно применять у пожилого контингента пациентов, страдающих многочисленными сопутствующими заболеваниями.
По вопросам литературы обращайтесь в редакцию.
З. А. Суслина, доктор медицинских наук, профессор, академик РАМН
М. Н. Шаров, доктор медицинских наук, профессор
О. А. Степанченко, кандидат медицинских наук
МГМСУ, Москва
КРАПИВНИЦА
Рисунок 1. Классификация аллергических заболеваний. Европейская ассоциация аллергологии и клинической иммунологии (2001) Крапивница — одно из часто встречающихся заболеваний кожи, характеризующихся возникновением кожной сыпи, перви
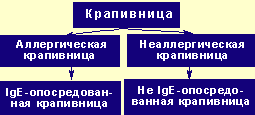 |
| Рисунок 1. Классификация аллергических заболеваний. Европейская ассоциация аллергологии и клинической иммунологии (2001) |
Крапивница — одно из часто встречающихся заболеваний кожи, характеризующихся возникновением кожной сыпи, первичным элементом которой является волдырь (см. рисунок 1).
По данным эпидемиологических исследований, выполненных в США, хотя бы один раз на протяжении жизни крапивница наблюдается у 15—25% населения, а хронический характер крапивница принимает в 25% случаев. Эпидемиологические исследования, проведенные в разных странах, показали, что распространенность хронической крапивницы в общей популяции составляет 0,1–3% (см. таблицу 1). Так, популяционные исследования, выполненные в Германии, свидетельствуют о том, что хронической крапивницей страдают около 1,3% населения [7], причем аллергическая форма хронической крапивницы встречается менее чем у 5% больных.
Кроме того, если острой крапивницей чаще страдают дети и подростки, то хроническая крапивница более характерна для людей от 20 до 40 лет.
Традиционно выделяют острую и хроническую формы крапивницы. Диагноз острой крапивницы предполагает продолжительность заболевания менее шести недель. Хроническая крапивница характеризуется возникновением ежедневно (или почти ежедневно) на протяжении более шести недель зудящих волдырей.
Согласно новой номенклатуре аллергических болезней, предложенной Европейской академией аллергологии и клинической иммунологии (2001) [6], крапивницу, обусловленную иммунологическими механизмами, обозначают термином «аллергическая крапивница», причем если заболевание вызвано IgE-антителами, то предлагается использовать термин «IgE-опосредованная крапивница». Хроническую крапивницу следует рассматривать как неаллергическую, пока не будет доказано участие иммунологических механизмов (см. рисунок 2).
Аллергические реакции лежат в основе патогенеза у большинства больных острой крапивницей и, напротив, крайне редко обусловливают возникновение ежедневных симптомов при хроническом течении заболевания.
Острая крапивница
Острая крапивница развивается вследствие аллергической реакции на пищевые продукты (орехи, яйца, рыба, морепродукты) или медикаменты (пенициллин, аспирин и другие нестероидные противовоспалительные препараты). У детей острая крапивница может быть связана с вирусной инфекцией (см. таблицу 2).
Хроническая крапивница
У подавляющего большинства больных хронической крапивницей причина заболевания так и остается неизвестной, т. е. крапивница является идиопатической [4]. В настоящее время выделяют следующие формы хронической крапивницы (см. таблицу 3).
Крапивницы, вызванные физическими факторами
Причинами возникновения физических крапивниц являются: воздействие высоких и низких температур, солнечного света, давления, вибрации, контакт с водой, физические нагрузки.
К физическим крапивницам относятся: холинергическая, холодовая, солнечная, аквагенная, вибрационная, замедленная крапивница, вызванная давлением, и дермографизм.
Аутоиммунная крапивница
В настоящее время активно внедряется относительно новая концепция, согласно которой хроническая крапивница имеет аутоиммунную природу.
Давно известна высокая распространенность аутоиммунного тиреоидита у больных хронической крапивницей (преимущественно у женщин) [1, 4].
По данным американских исследователей, функции щитовидной железы (увеличение или снижение Т3, ТТГ) нарушены у 19% пациентов хронической крапивницей. Уровень антител к тиреоглобулину повышен у 8% больных хронической крапивницей, уровень антител к тиреоидной пероксидазе — у 5%, а повышение уровня и тех, и других антител отмечено у 14% больных. В целом, повышенный уровень антитиреоидных антител встречается у 27% больных хронической крапивницей [1, 4].
В настоящее время установлено, что у 30—52% больных хронической крапивницей определяются функциональные аутоантитела к высокоаффинному IgE-рецептору и к иммуноглобулинам класса IgE. При этом антитела к высокоаффинному IgE-рецептору являются причинным фактором хронической крапивницы примерно у 25—40% больных, а анти-IgE-антитела приблизительно еще у 5—10% больных.
В сыворотке больных хронической крапивницей аутоантитела к высокоаффинному IgE-рецептору путем связывания с рецептором активируют базофилы или тучные клетки, что приводит к гистаминолиберации и обусловливает клинические проявления крапивницы. Способность функциональных аутоантител активировать тучные клетки кожи и базофилы доказана в ходе экспериментов in vivo и in vitro. In vivo показано развитие волдыря и гиперемии вследствие внутрикожной инъекции аутологичной сыворотки, а in vitro — высвобождение гистамина из базофилов здоровых доноров под действием сыворотки больных хронической идиопатической крапивницы (ХИК).
Эти факты легли в основу новой концепции, возникшей в последнее десятилетие, согласно которой у определенной категории больных хроническая крапивница является аутоиммунным заболеванием [4].
Крапивница может быть самостоятельной нозологической формой, а может выступать и как симптом целого ряда заболеваний (см. таблицу 4).
Ключевое значение в патогенезе крапивницы принадлежит дегрануляции тучных клеток. Известно, что тучные клетки больных хронической крапивницей обладают повышенной способностью к дегрануляции. Причем гиперреактивность тучных клеток кожи у больных хронической крапивницей может рассматриваться как преходящий феномен, поскольку состояние тучных клеток возвращается к норме при ремиссии заболевания.
Механизмы активации тучных клеток
Активацию тучных клеток кожи при крапивнице могут вызывать иммунологические и неиммунологические факторы.
Иммунологические механизмы опосредуются специфическими рецепторами на мембране клеток. На поверхности тучных клеток представлены следующие специфические рецепторы, участвующие в активации мастоцитов: высокоаффинный рецептор к IgE-антителам, С3а- и С5а-рецепторы, рецепторы к цитокинам и др. Активация тучных клеток через эти рецепторы влечет за собой немедленное высвобождение преформированных медиаторов тучных клеток («ранняя фаза» воспалительного ответа), что, в свою очередь, через несколько часов обусловливает привлечение различных клеток воспаления, включая эозинофилы, нейтрофилы и базофилы. Данный воспалительный ответ определяется как ответ «поздней фазы».
Вместе с тем, активация тучных клеток кожи может происходить и без участия иммунологических механизмов (см. таблицу 5). Некоторые вещества (например, кодеин) вызывают дегрануляцию тучных клеток кожи, приводя к развитию крапивницы.
При острой крапивнице, как правило, доминируют иммунологические IgE-опосредованные механизмы активации тучных клеток. При хронической крапивнице также возможны иммунологические механизмы активации тучных клеток (при аутоиммунной форме заболевания). Вместе с тем, действие хорошо известных неспецифических триггеров хронической крапивницы (эмоциональные стрессы, предменструальный период, алкоголь, лекарственные вещества, физические факторы и т. д.) реализуется посредством неиммунологической активации тучных клеток.
Активация тучных клеток кожи при крапивнице сопровождается высвобождением медиаторов из них и образованием волдырей. Фармакологические медиаторы, высвобождаемые из тучных клеток кожи, вызывают гиперемию, зуд, повышение проницаемости сосудов кожи, что обусловливает в конечном итоге формирование уртикарных высыпаний.
В патогенезе крапивницы основная роль принадлежит гистамину, который содержится в гранулах тучных клеток и секретируется в результате их дегрануляции. Гипотеза о центральной медиаторной роли гистамина при крапивнице подтверждается следующими клиническими и экспериментальными наблюдениями. Во-первых, при внутрикожном введении гистамина формируется кожная реакция, аналогичная высыпаниям, наблюдаемым при крапивнице. Во-вторых, при крапивнице усилена местная кожная гистаминолиберация. В конечном итоге клиническая эффективность антигистаминных препаратов у больных крапивницей также свидетельствует о патогенетической значимости гистамина.
В начале прошлого века Tomas Lewis описал кожную реакцию при внутрикожном введении гистамина, протекающую в три этапа:
Экспериментальное моделирование волдырной реакции путем внутрикожного введения гистамина показало, что волдыри чаще исчезают спустя несколько минут и лишь в редких случаях держатся несколько часов. В то же время уртикарные высыпания у ряда больных хронической крапивницей персистируют 12 ч и более. Это явление обусловлено действием дополнительных медиаторов, и источником некоторых из них, возможно, также являются тучные клетки. Наблюдается определенное сходство между гистологическим профилем уртикарных волдырей и высыпаний поздней фазы. Очевидно, другие медиаторы (простагландины, лейкотриены, брадикинин, фактор активации тромбоцитов, нейропептиды), кроме гистамина, также играют определенную роль в патогенезе хронической крапивницы.
Клинические проявления
Уртикарные высыпания сопровождаются зудом, бледнеют при надавливании и представляют собой ограниченный отек сосочкового слоя дермы. Особенностью крапивницы является быстрое возникновение и быстрое разрешение волдырей (в течение 24 ч) без формирования вторичных элементов.
Высыпания при крапивнице могут иметь любую локализацию, включая волосистую часть головы, ладони и подошвы. В области головы и шеи число тучных клеток кожи на единицу площади повышено по сравнению с другими участками кожи, поэтому крапивница и зуд этой локализации характеризуются большей интенсивностью.
Хроническая крапивница в 50% случаев сопровождается отеком Квинке. Крапивница и отеки Квинке характеризуются отеком ткани, при этом поверхностный отек приводит к клиническим проявлениям крапивницы, а более глубокий отек кожи и подкожной клетчатки — к отеку Квинке. Кроме того, при отеке Квинке возможно поражение слизистых оболочек различных органов и систем (дыхательной, пищеварительной, мочевыделительной, нервной и др.). Отеки Квинке могут приводить к обезображиванию лица (отек губ, век, ушных раковин) и вызывать опасное поражение гортани.
Различные формы хронической крапивницы имеют свои отличительные особенности. Клинические симптомы у больных хронической крапивницей, вне зависимости от участия аутоиммунных механизмов, одинаковы. Тем не менее некоторые авторы отмечают более тяжелое течение заболевания у больных аутоиммунной хронической крапивницей [1]. У этих пациентов выше индексы зуда и высыпаний, наблюдается тенденция к генерализации высыпаний. Для физических крапивниц (кроме замедленной крапивницы, вызванной давлением) свойственно быстрое развитие высыпаний, которые возникают после воздействия физического стимула и держатся не более 2 ч.
Следует подчеркнуть, что продолжительность острой крапивницы составляет несколько дней, в то время как для хронической крапивницы характерно длительное рецидивирующее течение с периодическими обострениями. Продолжительность заболевания может быть различной. Несмотря на симптоматическое облегчение вследствие медикаментозной терапии, некоторые больные страдают от этого заболевания годами.
В настоящее время накоплен значительный клинический материал по естественному течению хронической крапивницы. Так, по данным английского исследователя R. Сhampion, у 20% больных хронической крапивницей заболевание длится до 10 лет. Также установлено, что 50% больных, у которых в течение трех месяцев наблюдалась хроническая крапивница, страдают этим заболеванием еще не менее трех лет. А у 40% больных хронической крапивницей при анамнезе заболевания более шести месяцев высока вероятность сохранения симптомов крапивницы на протяжении последующих 10 лет.
Спонтанная ремиссия хронической крапивницы (при лечении или без него) наступает:
Причем у каждого второго больного хронической крапивницей со спонтанной ремиссией в дальнейшем развивается по меньшей мере один рецидив заболевания.
Обследование больных хронической крапивницей проводится на основании международного консенсуса по определению, классификации и диагностике крапивницы, принятого в 2001 г. [1].
Первичное обследование больных хронической крапивницей включает подробный сбор анамнеза, физикальное обследование и скрининговые лабораторные исследования.
В ходе сбора анамнеза необходимо изучить особенности и локализацию уртикарных высыпаний у данного больного, уточнить триггеры, суточный паттерн высыпаний и время существования отдельного волдыря.
Диагностика крапивницы при физикальном обследовании обычно не представляет трудностей для клинициста. При этом особое внимание необходимо обратить на визуальные характеристики уртикарных высыпаний, на присутствие общих симптомов, таких, как лихорадка, лимфаденопатия, гепато- и спленомегалия, отек в области суставов.
Поскольку IgE-опосредованные реакции участвуют преимущественно в патогенезе острой крапивницы, всем больным острой крапивницей необходимо проводить аллергологическое обследование. Однако многие исследователи считают его нецелесообразным и используют в качестве рутинного скринингового диагностического метода у больных хронической крапивницей при отсутствии соответствующего анамнеза [2, 3]. При этом они ссылаются на тот факт, что распространенность атопии среди пациентов с хронической крапивницей не превышает таковой в общей популяции [3, 4, 5]. Таким образом, аллергологическое обследование больным хронической крапивницей необходимо назначать по показаниям.
Диагностика и поиск потенциальных причин развития хронической крапивницы представляют немалую сложность для клинициста (см. таблицу 6). Важность детального обследования больных хронической крапивницей объясняется необходимостью исключить серьезные заболевания, симптомом которых может быть крапивница (например, гепатиты, лимфома, системная красная волчанка, опухоли прямой кишки, почек, желудочно-кишечного тракта и др.).
Дальнейшее обследование больных хронической крапивницей определяется результатами первичного обследования больного. Специфические лабораторные тесты должны быть выбраны на основании диагностических гипотез: например, проведение радиоаллергосорбентного теста с латексом для выявления специфических IgE-антител к латексу у лаборанта, предъявляющего жалобы на симптомы ринита и крапивницы, возникающие во время работы. При увеличении скорости оседания эритроцитов и анамнестических данных, свидетельствующих об артрите, может потребоваться определение антинуклеарных антител. У пожилых пациентов со снижением веса и лимфаденопатией необходимо исключить лимфому. Указания в анамнезе на содержание домашних животных или на путешествия в страны Азии и Африки, а также наличие эозинофилии периферической крови обусловливают целесообразность поиска паразитарной инвазии. При подозрении на гиперреактивность на пищевые добавки должны выполняться плацебо-контролируемые пероральные провокационные тесты с пищевыми добавками. Кроме того, необходимо помнить, что больным хронической крапивницей, у которых высыпания сохраняются более 24 ч, показана биопсия кожи для исключения уртикарного васкулита.
По мнению Warren Heymann, скрининговое исследование уровня антитиреоидных антител (антитела к тиреоидной пероксидазе и тиреоглобулину) при хронической крапивнице следует проводить у женщин и пациентов с семейным анамнезом аутоиммунных заболеваний и патологий щитовидной железы.
Диагностика аутоиммунной хронической крапивницы принципиально важна для последующего патогенетического лечения. Стандартизированная внутрикожная проба с аутологичной сывороткой рекомендуется в качестве скринингового метода диагностики аутоиммунной хронической крапивницы (см. рисунок 2). В настоящее время тест гистаминолиберации базофилов доноров под действием сыворотки больных хронической крапивницей считается «золотым» стандартом для определения функциональных антител при аутоиммунной хронической крапивнице.
Физические крапивницы диагностируются на основании анамнестических данных и соответствующих провокационных тестов (см. таблицу 7). Больным с изолированными физическими крапивницами дальнейшее обследование не требуется.
| Таблица 7. Диагностика физических крапивниц. | |
| Физические крапивницы | Провокационные тесты |
| Дермографизм | Механическое раздражение кожи |
| Холинергическая крапивница | Тест с физической нагрузкой, велоэргометрия, горячая ванна |
| Холодовая крапивница | Дункан-тест с кубиком льда |
| Солнечная крапивница | Фототестирование |
| Замедленная крапивница вследствие давления | Тест с подвешиванием груза |
| Аквагенная крапивница | Водный компресс (+25°С) |
Следует отметить, что у большинства больных хронической крапивницей инструментальное и лабораторное обследование не приводит к выявлению причины заболевания, в этих случаях хроническая крапивница считается идиопатической.
Дифференциальный диагноз
Необходимо помнить, что при некоторых кожных заболеваниях, сопровождающихся гистаминолиберацией, уртикарные высыпания могут присутствовать как компонент клинической картины, что может приводить к ошибкам в диагностике (см. таблицу 8).
Основное заболевание при дифференциальном диагнозе — это уртикарный васкулит. Действительно, уртикарный васкулит может проявляться уртикарными высыпаниями, которые иногда неправильно диагностируются как обычная крапивница. Тогда как уртикарный васкулит часто является клиническим проявлением серьезных заболеваний (например, коллагенозов, вирусных гепатитов и др.). Клинические особенности уртикарного васкулита указаны в таблице 9.
Высыпания при уртикарном васкулите обычно сопровождаются общими симптомами (артралгии, субфебрильная температура, абдоминальные боли и др.). Другие системные проявления представлены гломерулонефритом, увеитом, эписклеритом, легочными и неврологическими расстройствами. Кроме того, возможно сочетание ангионевротического отека и уртикарного васкулита (до 42% больных), поэтому такой набор симптомов не может служить критерием дифференциальной диагностики.
У больных хронической крапивницей с особыми характеристиками уртикарных высыпаний (см. таблицу 9) при подозрении на коллагенозы или при нарушениях в системе комплемента показана биопсия кожи с целью проведения дифференциального диагноза с уртикарным васкулитом, поскольку окончательный диагноз уртикарного васкулита устанавливается исключительно гистологически. Уртикарный васкулит отличается от обычной крапивницы развитием воспаления и некроза кровеносных сосудов. При биопсии наблюдается следующая гистологическая картина: в стенках посткапиллярных венул определяются фрагментация лейкоцитов (лейкоцитоклазия) и фибриноидные отложения, что указывает на лейкоцитокластический васкулит.
Подтверждение диагноза с помощью биопсии кожи путем определения гистологических признаков васкулита представляется крайне важным, поскольку этим больным требуется обследование с целью выявления системной красной волчанки или других аутоиммунных заболеваний, степени вовлечения почек или других внутренних органов.
Основным отличительным признаком многоформной эритемы является полиморфность высыпаний (макулезные, папулезные, элементы-«мишени», явно буллезные элементы и иногда уртикарные высыпания). Заболевание возникает после переохлаждения, простуды, катаральных явлений весной или осенью и характеризуется продромальным периодом (лихорадка, боли в суставах, мышцах и др.). Для дифференциальной диагностики представляется важным, что отдельные элементы при многоформной эритеме периодически не исчезают, а остаются фиксированными. Кроме того, для высыпаний характерно распределение преимущественно в области конечностей. Высыпания чаще сопровождаются жжением, в то время как типичные уртикарные высыпания — зудом. Для постановки диагноза может понадобиться биопсия кожи.
Буллезный пемфигоид представляет собой аутоиммунный пузырный дерматоз, при котором формируются иммунные комплексы к антигенам базальной мембраны. Для буллезного пемфигоида характерны генерализованные буллезные высыпания. Вместе с тем, ранние высыпания при буллезном пемфигоиде часто сопровождаются зудом и могут иметь явный уртикарный компонент. При ограниченной форме заболевания эволюция уртикарных в буллезные элементы может отсутствовать. В таких ситуациях диагностическое значение имеет биопсия кожи вокруг элементов с последующим иммунофлюоресцентным окрашиванием для выявления отложений IgG-антител и комплемента на базальной мембране.
Герпетиформный дерматит является буллезным дерматозом, при котором ранние высыпания также имеют уртикарный компонент. Высыпания характеризуются полиморфизмом, выраженным зудом, сгруппированным (герпетиформным), симметричным расположением. Характерна эволюция высыпаний с образованием из уртикарных высыпаний везикул и пустул, а затем появлением и вторичных элементов. При иммунофлюоресцентной диагностике определяют отложения IgA-антител в базальной мембране пораженных участков кожи.
Принятие международного соглашения по лечению хронической крапивницы в 2001 г. способствовало выработке единых подходов к терапии хронической крапивницы (см. таблицу 10) [2].
Ведение больных с хронической крапивницей и отеками Квинке включает образовательные программы для пациентов, проведение нефармакологических мероприятий (элиминация и т. д.) и фармакологическое лечение [2].
Больной хронической крапивницей должен быть полностью осведомлен о своем заболевании. При идиопатической форме заболевания пациента следует информировать о том, что необходимости в дальнейшем обследовании нет.
Все больные крапивницей и отеком Квинке должны избегать приема ацетилсалициловой кислоты и других нестероидных противовоспалительных препаратов, так как эти средства вызывают обострение уже имеющейся крапивницы в 50% случаев.
У таких больных также необходимо исключить прием ингибиторов ангиотензин-превращающего фермента, так как побочным эффектом этих препаратов может стать развитие отека Квинке.
Прежде всего при лечении крапивницы необходимо исключить причинный фактор и неспецифические триггеры, что, к сожалению, не всегда возможно, так как у большинства пациентов причинный фактор остается неизвестным. Часто причиной развития крапивницы считают употребление тех или иных пищевых продуктов. Однако доказательства того, что хроническая крапивница действительно обусловлена аллергией на пищевые продукты, удается получить достаточно редко. Гораздо чаще при хронической крапивнице наблюдаются псевдоаллергические реакции на естественные ингредиенты, входящие в состав продуктов, а в некоторых случаях — на пищевые добавки. В этих случаях показана диета с низким содержанием естественных и искусственных гистаминолибераторов. Примечательно, что при острой крапивнице в случае IgE-опосредованных реакций исключение причинно-значимых аллергенов приводит к разрешению симптомов крапивницы в течение 24—48 ч, тогда как для улучшения состояния при псевдоаллергических реакциях у больных хронической крапивницы требуются две-три недели. Кроме того, необходимо избегать действия неспецифических триггеров (например, горячая ванна или прием алкоголя).
Базисная терапия хронической крапивницы проводится антигистаминными препаратами. Лечить крапивницу достаточно сложно, поскольку антигистаминные препараты эффективны не у всех больных из-за участия в патогенезе хронической крапивницы, наряду с гистамином, других медиаторов.
Прежде всего необходимо объяснить пациенту, что полное устранение крапивницы не всегда осуществимо. Терапия должна быть направлена на достижение такой степени контроля над зудом, которая позволяла бы пациенту относительно комфортно жить, работать и сохранять социальную активность, несмотря на единичные уртикарные высыпания.
Примечательно, что клиническая эффективность антигистаминных препаратов гораздо выше, когда они назначаются в качестве профилактического средства, нежели при приеме в момент интенсивных высыпаний. Поэтому необходимо адаптировать время приема антигистаминных препаратов к суточному паттерну высыпаний при хронической крапивнице у каждого больного.
Применение классических антигистаминных препаратов ограничено нежелательными побочными действиями этих препаратов. Классические седативные антигистаминные препараты могут не только вызывать сонливость, но и изменять время рефлекторной реакции центральной нервной системы, вызывать общее угнетение центральной нервной системы, сравнимое с действием алкоголя. Другие побочные действия классических антигистаминных препаратов включают головокружение, нарушение координации, нечеткость зрения, диплопию и симптомы парадоксальной стимуляции ЦНС. Все эти нежелательные эффекты наблюдаются чаще у молодых и пожилых пациентов. Эпилептическая активность может возникать у больных, предрасположенных к эпилепсии, так как антигистаминные препараты легко проникают через гематоэнцефалический барьер, связываются с Н1-гистаминными рецепторами в головном мозге (с высокой аффинностью) и снижают порог эпиактивности. Антихолинергические эффекты, такие, как сухость слизистых оболочек, задержка мочи, сердцебиение, тревога и повышение внутриглазного давления, определяются атропиноподобным антагонистическим действием Н1-блокаторов на мускариновые рецепторы. Кроме того, безопасность классических антигистаминных препаратов у беременных не доказана, потому что эти средства легко проходят через плаценту. Следовательно, большинство классических антигистаминных препаратов, отнесенных FDA к категории С, могут применяться у беременных, только если ожидаемая польза превышает предполагаемый риск для плода.
В настоящее время новые неседативные антигистаминные препараты по-прежнему рассматриваются как препараты первого выбора при лечении крапивницы. Эти лекарственные средства (лоратадин, цетиризин, эбастин, фексофенадин, дезлоратадин) имеют значительные преимущества по сравнению с классическими, так как они, в отличие от последних, не оказывают нежелательного воздействия на центральную нервную систему. Поскольку новые антигистаминные препараты не обладают множеством побочных эффектов, характерных для препаратов первого поколения, они могут применяться в более высоких дозах (за исключением препаратов, метаболизирующихся печеночными ферментами P450).
Применение системных кортикостероидов при хронической крапивнице показано:
Точный механизм действия кортикостероидов при хронической крапивнице не выяснен. Известно, что молекулы кортикостероидов попадают в клетку и, образуя комплексы с глюкокортикоидными рецепторами, проникают в ядро. Затем, подавляя экспрессию генов и кодирование м-РНК синтеза провоспалительных интерлейкинов и цитокинов, купируют кожные высыпания при хронической крапивнице. Вместе с тем, кортикостероиды предотвращают привлечение воспалительных клеток, способных потенциировать уртикарные высыпания вследствие вторичного высвобождения факторов гистаминолиберации и цитокинов.
В случае необходимости назначения системных кортикостероидов допустимы только короткие курсы преднизолона в суточных дозах более 40 мг (1-2 мг/кг в сутки) в течение пяти—семи дней до достижения ремиссии с постепенным снижением дозы [4]. Длительное применение системных кортикостероидов при хронической крапивнице не рекомендуется, так как, несмотря на очевидный и быстрый клинический эффект, существует опасность развития серьезных побочных эффектов. Кроме того, возможно обострение хронической крапивницы при попытке отмены системных кортикостероидов. Таким образом, применение системных кортикостероидов при хронической крапивнице ограничивается лишь тяжелым и торпидным к обычной терапии течением заболевания.
Наибольшие трудности для клиницистов возникают при ведении пациентов с аутоиммунной хронической крапивницей в связи с возможным отсутствием клинической эффективности антигистаминных препаратов. Вне зависимости от участия аутоиммунных механизмов, терапия хронической крапивницы начинается с применения антигистаминных препаратов. Однако у пациентов с аутоиммунной крапивницей возможны более тяжелое течение заболевания и низкая эффективность антигистаминных препаратов. В клинической практике в таких случаях назначают системные глюкокортикостероиды.
Хорошо известно, что отличительной особенностью иммунологической активации тучных клеток при аутоиммунной хронической крапивнице является формирование ответа «поздней фазы». Важность этого этапа подтверждается эффективностью кортикостероидов, поскольку последние не оказывают действия на иммунологическую активацию тучных клеток, но предупреждают образование клеточного инфильтрата. В этом отношении лечение хронической крапивницы напоминает терапию аллергического ринита и астмы, при которых важно воздействие на реакцию «поздней фазы». Итак, назначая терапию при аутоиммунной хронической крапивнице, ее прежде всего не следует рассматривать как аллергическую реакцию, тогда становится понятно, почему при тяжелом течении этой формы хронической крапивницы лечение только антигистаминными препаратами является недостаточным. Терапевтической мишенью при хронической аутоиммунной крапивнице должно быть воспаление, развивающееся вследствие не аллергических, а аутоиммунных процессов.
При тяжелом течении аутоиммунной хронической крапивницы требуется специальное лечение (плазмаферез, в/в иммуноглобулин, циклоспорин), которое должно проводиться в условиях специализированных центров. Применение плазмафереза является эффективным и патогенетически обоснованным при аутоиммунной хронической крапивнице. Механизм действия плазмафереза связан с механическим удалением из циркуляции функциональных антител к высокоаффинному IgE-рецептору или к иммуноглобулинам класса Е. При тяжелом течении аутоиммунной хронической крапивницы и резистентности к традиционной терапии также представляется оправданным применение методов неспецифической иммунотерапии, включая циклоспорин А и внутривенный иммуноглобулин. Эффективность внутривенного применения иммуноглобулина при лечении аутоиммунной хронической крапивницы связывают с его способностью активизировать Т-супрессоры и стимулировать продукцию антиидиотипических антител, направленных против функциональных антител, активизирующих тучные клетки.
Целесообразность использования циклоспорина при хронической крапивнице обусловлено его способностью подавлять дегрануляцию тучных клеток и базофилов и продукцию цитокинов, что особенно важно для предотвращения реакции «поздней фазы».
По вопросам литературы обращайтесь в редакцию
Л. А. Горячкина, доктор медицинских наук, профессор
Н. М. Ненашева, кандидат медицинских наук, доцент
Е. Ю. Борзова
РМАПО, Москва