Хумира или далибра что лучше
Голикова на российской «Хумире»
ЗАО «Биокад» смогла получить российское регистрационное удостоверение для препарата «Далибра», являющегося аналогом американского лекарства «Хумира», — сообщает The Moscow Post.
Это может стать причиной для иска от американской AbbVie, продающей оригинальный препарат. В прошлом году объем продаж «Хумиры» оценили почти в 20 млрд. долларов. В России американское лекарство упаковывали на мощностях «Р-Фарм» Алексея Репика. Но компания «Биокад», связанная с Виктором Харитониным оказалась «ближе к телу» Татьяны Голиковой?
Адалимумаб «Биокаду» или легким мановением Голиковой?
Адалимумаб — это не заклинание из нового блокбастера про юных волшебников. Это действующее вещество американского препарата Хумира, которым можно лечить псориаз, болезнь Бехтерева, ревматоидный артрит и прочие, крайне неприятные и плохо излечимые недуги.
Родственники страдающих ревматоидным артритом прекрасно знают насколько эта болезнь может быть мучительной. Любые деньги за спасение выложишь. Это и обеспечило AbbVie 20 миллиардов долларов продаж только в 2018 году.
Само собой, разумеется, лекарство не дешево. Американская AbbVie полагает, что может себе позволить получать прибыль. А для того, чтобы в России получать прибыль было сподручнее, компания привлекла для сотрудничества Алексея Репика и его «Р-Фарм».
Казалось бы, у Репика, которому это сулило баснословную прибыль (только в 2017 году продажи препарата достигли в России 3,2 млрд. рублей), все «на мази». У него отличные отношения с вице-премьером по соцполитике Татьяной Голиковой, устойчивое положение в Соединенных Штатах. Что могло пойти не так?
Регистрация первого в России отечественного препарата-заменителя «Хумиры» под названием «Далибра» на данный момент выглядит весьма неоднозначно с точки зрения патентного права.
Вероятнее всего, AbbVie пойдет в суд. Причем, опять-таки, вероятнее всего ничего там не добьется. Ведь речь идет о компании «Биокад», связанной с Виктором Харитониным и его знакомыми. А знакомые у Виктора Харитонина — загляденье. Даже Алексей Репик позавидует.
А вот эту «Хумиру» мы отдадим Биокаду, как бы говорит Татьяна Голикова
По данным издания «Коммерсант», Виктору Харитонину и его компании «Фармстандарт» в «Биокаде» принадлежит 20% акций. Харитонин владеет ими через кипрский офшор Biocad Holding.
Госзакупки у компаний, связанных с Харитониным проводились незаконно?
И «Фармстандарт» и «Биокад» являются системными поставщиками для нужд структур Минздрава РФ. Портфель госзаказов «Биокада» приближается к 30 млрд. рублей, а «Фармстандарт» выиграл тендеров почти на 180 млрд. рублей.
При этом, до недавнего времени «Фармстандарт» и «Биокад» каким-то совершенно непостижимым образом умудрялись принимать участие в одних и тех же госзакупках. Более того, в некоторых из них они были единственными реальными претендентами на победу.
С тем, что Харитонин, пытающий одолеть Харитонина в нервной борьбе за выгодный тендер — это не нормальная ситуация были вынуждены согласиться даже в Федеральной Антимонопольной Службе (ФАС).
В 2017 году ФАС выявила признаки картельного сговора в проведении 3 тысяч аукционов с участием этих компаний. При этом, сотрудникам ФАС, проводящим проверки откровенно препятствовали вплоть до отключения сетевых дисков под видом технической ошибки.
Судя по всему, сотрудники компании Харитонина могли чувствовать себя уверенно не в последнюю очередь благодаря своему коллеге, Владимиру Христенко. О том, что этот молодой человек является сотрудником «Фармстандарта» и сыном бывшего главы Минпромторга РФ Виктора Христенко писал портал «Состав. Ру».
Если уж арбидол сумели продать, любую Хумиру сможем, считает Виктор Харитонин?
Супругой уважаемого Виктора Христенко является вице-премьер Татьяна Голикова. Злые языки утверждают, что Харитонин является другом семьи Татьяны Голиковой и, учитывая ее некоторые лекарственные пристрастия, в это можно поверить.
Именно Татьяна Голикова аж несколько раз умудрялась открыто рекомендовать препарат арбидол производства «Фармстандарта». Якобы, он прекраснейшим образом помогает от простудных недугов.
Правда впоследствии эффективность препарата доказать не удалось. В отличие от угрозы для здоровья. Препарат, который рекомендовала россиянам Голикова, оказался высоко токсичным.
Вкупе с недоказанной эффективностью это должно было положить конец не только продажам арбидола, но и репутации «Фармстандарта». Разумеется, Харитонин отделался легким испугом, а арбидол все еще можно купить.
Разве что Голикову за глаза все еще нет-нет да назовут «мадам арбидол». В скором времени она еще и «мадам Хумира» может стать? Сомнительный титул, да и звучит «не очень».
Токсичный «Биокад»?
Судя по всему, никто не может дать гарантию, что дженерик (препарат-заменитель) от компании «Биокад» не окажется впоследствии недостаточно эффективным. Так бывает с любыми препаратами-заменителями.
В данном же случае речь идет о компании, связанной со знаменитым торговцем арбидолом Харитониным. А это может означать, что регистрационное удостоверение новому препарату-заменителю от «Биокад» могло быть выдано без должного рвения проверяющих.
При этом, отзывы на этот препарат в обязательном порядке будут отслеживаться юристами держателя оригинального патента из Соединенных Штатов. Он вполне может заказать не одну, а где-то десяток независимых экспертиз в самых авторитетных лабораториях мира.
Сложно даже представить что может начаться, если и российский аналог «Хумиры» окажется недостаточно эффективным или высоко токсичным. Будет уничтожена не только репутация «Фармстандрта», под угрозой будет вся программа по созданию препаратов-заменителей в России.
Но Татьяне Голиковой все равно, она готова лишить россиян качественных и дешевых лекарств, в очередной раз поставив на друга семьи и работодателя пасынка Виктора Харитонина? Только очередного «арбидола» россиянам сейчас для «полного счастья» и не хватало. Пора бы перестать наступать на те же грабли.
Тема: Далибра наш аналог Хумиры, есть ли те кто его применял?
Опции темы
Отображение
В Москве вместо Хумиры выдают препарат Далибра производства Биокад, отдала неделю назад рецепт, сегодня позвонили и сказали, чтоб приезжала забирала эту Далибру. Может кто-то ее колол? Как ощущение? Нет ли ухудшений? Про инфликсимаб того же Биокада плохие отзывы.
Тоже сегодня съездил на Новогиреевскую улицу а аптеку, где выдавали «Хумиру». Отказали в ней (сказали, теперь не будут давать. ), предложили по этому же рецепту «Далибра».
Кстати, статья на эту тему, см. ссылку:
Оптимизма при прочтении не добавляет. Людям из этой правящей шайки жуликов и воров я бы ржавого гвоздя не доверил, не то, что своё здоровье.
Со слов лечащего врача, пока закуплена Далибра на квартал, в аптеке не знают появится ли снова Хумира. Возможен индивидуальный заказ, но для этого должна быть непереносимость этой Далибры.
Да я лично, что-то не горю желанием проверять на себе «отрицательную реакцию».
Конечно, я по жизни пофигист и порезан с более чем 12-тью операциями уже вдоль и поперёк за эти десять прошедших лет.
Но вводить в себя всякую бодягу от каких-то проходимцев я боюсь. Лекарство само по себе сложное, опасное, БИОЛОГИЧЕСКОЕ. Там от одного прочтения инструкции волосы во всех местах дыбом встают. Даже от нормального импортного.
А раз лекарство биологическое, то любое изменение его состава в организме по сравнению с ранее вводимым повлечёт фиг знает какие последствия. Может, они будет ощущаться не сразу, а с отложенным эффектом! Оно нам надо?
P.S. Женщина в очереди, кстати, тоже не стала брать «далибру» (в своём сообщении выше я забыл упомянуть!).
Константин, как вообще ваше самочувствие? После обследования в 2017 как развивалась ваша история?
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 5. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 8. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
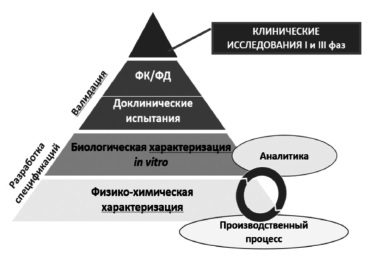
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 18 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.

 Конечно, я по жизни пофигист и порезан с более чем 12-тью операциями уже вдоль и поперёк за эти десять прошедших лет.
Конечно, я по жизни пофигист и порезан с более чем 12-тью операциями уже вдоль и поперёк за эти десять прошедших лет.