Клиника hormone life
Клиника hormone life
SMART-диагностика дефицита железа
Пройти комплекс лабораторных исследований, которые позволяют выявить дефицит железа и получить индивидуальный план лечения от лучших специалистов нашей клиники
О КЛИНИКЕ
Клиника Hormone Life — Первая в России клиника спортивной эндокринологии для людей, придерживающихся ЗОЖ, бодибилдеров, профессиональных спортсменов и спортсменок.
Не секрет, что у спортсменов организм работает на износ, большинство показателей необходимо контролировать для сохранения здоровья и для того, чтобы достигать высоких показателей в спорте. Но редко эти показатели могут динамически наблюдаться другими специалистами.
Кроме этого, обычный человек не задумывается о гормонально-метаболических процессах в организме. Ни одно заболевание не протекает без участия гормональной системы. Гормонально-метаболическими процессами должен заниматься специалист.
В нашей стране с осторожностью относятся к эндокринологи в связи с нехваткой с узких специалистов.
Мы открыли клинику которая занимается спортивной, репродуктивной и antiage эндокринологией и специализируется в области на гормонально-метаболических процессов.
ОСНОВАТЕЛЬ КЛИНИКИ
Евгений Греков
Спортивный эндокринолог | Уролог | Андролог
Евгений Александрович занимается вопросами нормализации гормонального фона, мужского здоровья, бесплодия, повышения качества жизни и подготовкой спортсменов к соревнованиям. За каждого пациента он переживает всей душой и по праву гордится результатами работы – на его счету сотни спасенных семей и родившихся детей, а его подопечные спортсмены завоевывают первые места и золотые медали.
Также доктор Греков – соавтор более 25 научных статей в сфере эндокринологии, гинекологии, урологии, андрологии. Благодаря его научным изысканиям, мужчины расстаются с самыми страшными диагнозами, а основанная им ассоциация по спортивной эндокринологии и спортивной нутрициологии успешно помогает любителям и профессиональным спортсменам.
Окончил Ярославскую государственную медицинскую академию ФАЗСР «Педиатрический факультет».
В 2009 году закончил ординатуру по урологии.
С 2019 года обучается в ординатуре по эндокринологии на базе РУДН с целью подтверждения своих научно-практических навыков и умений.
С 2010 года работает на кафедре эндокринологии РУДН под руководством Калинченко С.Ю.
Был заведующим отделением урологии в “Клинике профессора Калинченко” в Москве.
Параллельно врач ведет подкаст на медицинском интернет-радио.
Клиника «Гормон Лайф»
Клиника «Гормон Лайф» в Москве: официальный сайт, 8 врачей, 20 отзывов пациентов о клинике и врачах, цены, запись на приём по телефону +7 (903) 258-84-55.
Клиника Hormone Life — Первая в России клиника спортивной эндокринологии для людей, придерживающихся ЗОЖ, бодибилдеров, профессиональных спортсменов и спортсменок.
Не секрет, что у спортсменов организм работает на износ, большинство показателей необходимо контролировать для сохранения здоровья и для того, чтобы достигать высоких показателей в спорте. Но редко эти показатели могут динамически наблюдаться другими специалистами.
Кроме этого, обычный человек не задумывается о гормонально-метаболических процессах в организме. Ни одно заболевание не протекает без участия гормональной системы. Гормонально-метаболическими процессами должен заниматься специалист.
В нашей стране с осторожностью относятся к эндокринологи в связи с нехваткой с узких специалистов.
Мы открыли клинику которая занимается спортивной, репродуктивной и antiage эндокринологией и специализируется в области на гормонально-метаболических процессов.
Наши специалисты
Греков Евгений Александрович
Российский врач-уролог, андролог, эндокринолог, основатель и главный врач Клиники Hormone Life — Первой в России клиники спортивной, репродуктивной AntiAge эндокринологии.
Рогунова Любовь Ивановна
Врач гинеколог-эндокринолог высшей квалификационной категории с экспертным уровнем в вопросах эндокринологии с высокой квалификацией в нюансах «классического» акушерства и гинекологии с общим стажем профессиональной деятельности более 35 лет.
Соловьев Денис Олегович
Врач эндокринолог — андролог, врач ультразвуковой диагностики.
Специализируется на проблемах мужского и женского здоровья, ожирении, патологии щитовидной железы, бесплодии.
Жуйков Александр Владимирович
Врач эндокринолог первой квалификационной категории.
Мясоедов Антон Александрович
врач ультразвуковой диагностики.
2002 — 2008 гг. — Московский Медицинский Стоматологический институт им. Н.А.Семашко, специальность «Лечебное дело».
2009 — 2010 гг. — Клиническая ординатура по специальности «Ультразвуковая диагностика» в ФГБУ «Центральная клиническая больница с поликлиникой» Управления делами Президента Российской Федерации
Проводит все виды ультразвуковых исследований органов брюшной полости, забрюшинного пространства, органов малого таза, щитовидной железы, грудных желез, молочных желез, органов мошонки, мягких тканей, лимфатических узлов
Член Российской ассоциации врачей ультразвуковой диагностики.
Гришина Наталья Ивановна
Кандидат медицинских наук, врач гастроэнтеролог, диетолог. Ведет пациентов с различными заболеваниями желудочно-кишечного тракта: гастритом, холециститом, гепатитом; колитом; панкреатитом, язвенной болезнью желудка и двенадцатиперстной кишки, синдромом раздраженного кишечника, пациентов с алиментарным, гормональным и психогенным ожирением (диетическая и лекарственная коррекция). Занимается разработкой диетического питания при различных видах патологии.
Макшанова Елена Владимировна
Врач эндокринолог, врач ультразвуковой диагностики
Клиника hormone life
Коррекция андрогенного дефицита при хроническом инфекционном простатите как патогенетический метод преодоления неэффективности стандартной антибактериальной терапии на фоне растущей антибиотикорезистентности СКАЧАТЬ
Андрогены и симптомы нарушения функций нижних мочевых путей.
Андрогены и симптомы нарушения функций нижних мочевых путей: исключительно мужская гендерность или нерешенная проблема обоих полов? Калинченко С.Ю., Тюзиков И.А., Греков Е.А., Апетов С.С., Ворслов Л.О., Тишова Ю.А. Термин «симптомы нижних мочевых путей» (СНМП) традиционно подразумевает многообразные клинические проявления нарушений мочеиспускания вследствие различных заболеваний мочевого пузыря и уретры, а у мужчин – еще и предстательной…
Урология в офтальмологии: от невероятного к реальному
Поговорим о том, какова роль офтальмолога в диагностике урологических заболеваний. Почему именно офтальмологическое обследование даст ответы на многие вопросы уролога? В чем общая ряда инфекционных заболеваний этих двух специальностей и почему лечить их нужно совместно? К. Чинёнова: В эфире наша постоянная программа «Взгляд доктора Куренкова. Сегодня у нас в гостях Евгений Александрович Греков, врач-уролог, андролог….
Евгений Греков отвечает на интимные вопросы читательниц.
Советы эксперта Евгения Грекова (сексолог-уролог, заведующий урологическим отделением Клиники профессора Калинченко) Что такое мультиоргазм? Это несколько оргазмов за один половой акт или за ночь? Два оргазма подряд – это уже мультиоргазм? Это череда оргазмов, сменяющих друг друга, их количество может достигать 5-10 за один стандартный по времени половой акт. «Стандартный» – это примерно 10 минут (ну, плюс-минус). Если же на пятидесятой…
Влияние женской андрогенной недостаточности и ее коррекции на нарушение мочеиспускания у женщин в постменопаузе
Влияние женской андрогенной недостаточности и ее коррекции на нарушение мочеиспускания у женщин в постменопаузе Изучение влияния женского возрастного андрогенного дефицита и андрогенотерапии на нарушение мочеиспускания у женщин. Применение тестостерона у женщин в постменопаузе может быть эффективным средством терапии ноктурии и гиперактивного мочевого пузыря. Андрогенная недостаточность, Дефицит андрогенов, Женщина, Нарушение мочеиспускания, Недержание мочи, Половые гормоны, Постменопауза, Урогенитальные расстройства, Цистоуретральная атрофия, Эндокринная система, Эндокринология, Androgenic insufficiency, Cyst uretral atrophy, Endocrine…
Клиника hormone life
Спортивная генетика для молодежи и действующих спортсменов
Риски нарушений костно-суставной системы у спортсменов (6 SNP)
СТОИМОСТЬ 14 000 ₽
Риски дефицита витаминов и микроэлементов у спортсменов
(6 SNP)
СТОИМОСТЬ 15 000 ₽
Риски гормональных нарушений у спортсменов (8 SNP)
СТОИМОСТЬ 17 000 ₽
Полиморфизмы, связанные с особенностями метаболизма у спортсменов (9 SNP)
СТОИМОСТЬ 18 000 ₽
записаться на анализ можно по телефону:
+7(903) 258 — 84 — 55
ДОКТОР В СЕТИ
НАШ АДРЕС


ПН- СБ: 10:00 — 20:00
ВС: 10:00 — 19:00
ВНИМАНИЕ! ПАРКОВКИ НЕТ! Работает эвакуатор
Клиника hormone life
ЛАБОРАТОРНЫЕ МЕДИЦИНСКИЕ АНАЛИЗЫ
1 Клинический анализ крови 700,00 руб.
2 Общий анализ мочи 230,00 руб.
3 Анализ мочи по Нечипоренко 230,00 руб.
3 Фибриноген — 230,00 руб.
4 АЧТВ (активированное частичное тромбопластиновое время) — 180,00 руб.
5 Тромбиновое время — 330,00 руб.
6 Протромбин (МНО) — 530,00 руб.
7 Тромбоэластограмма — 280,00 руб.
8 РФМК — 280,00 руб.
9 Антитромбин III — 980,00 руб.
10 Коагулограмма (12 показателей) — 3000,00 руб.
1 Группа крови — 1080,00 руб.
2 Резус фактор — 355,00 руб.
3 Антитела к резус-фактору — 520,00 руб.
1 Гепатит A: anti-HAV IgG — 830,00 руб.
2 anti-HAV IgM — 830,00 руб.
3 Гепатит B: HBsAg — 380,00 руб.
4 HBeAg — 380,00 руб.
5 Гепатит C: anti-HCV общ — 480,00 руб.
6 Anti-HCVcorIgM — 830,00 руб.
7 Гепатит E: anti-HEV IgM — 830,00 руб.
8 anti-HEV IgG — 830,00 руб.
9 ВИЧ Anti-HIV 1/2 — 380,00 руб.
10 Сифилис-TPHA — 310,00 руб.
11 Сифилис-RPR — 310,00 руб.
12 Chlamydia trachomatis IgG — 630,00 руб.
13 Chlamydia trachomatis IgA — 630,00 руб.
14 Chlamydia trachomatis IgM — 630,00 руб.
15 Chlamydia pneumoniae IgG — 680,00 руб.
16 Chlamydia pneumoniae IgM — 680,00 руб.
17 Mycoplasma pneumoniae IgG — 680,00 руб.
18 Mycoplasma pneumoniae IgM — 680,00 руб.
19 Toxoplasma gondii IgG — 580,00 руб.
20 Toxoplasma gondii IgM — 580,00 руб.
21 Rubella IgG — 480,00 руб.
22 Rubella IgM — 480,00 руб.
23 Cytomegalovirus IgG — 350,00 руб.
24 Cytomegalovirus IgM — 350,00 руб.
25 Herpes simplex 1 IgG — 350,00 руб.
26 Herpes simplex 1 IgM — 350,00 руб.
27 Herpes simplex 2 IgG — 350,00 руб.
28 Herpes simplex 2 IgM — 350,00 руб.
29 Epstein Barr virus IgG — 350,00 руб.
30 Epstein Barr virus IgM — 350,00 руб.
31 Helicobacter Pylori IgG — 880,00 руб.
32 Helicobacter Pylori IgA — 1030,00 руб.
33 Candida albicans IgG — 350,00 руб.
34 Candida albicans IgM — 350,00 руб.
35 Лямблии IgG/IgM — 120,00 руб.
36 Лямблии IgM — 550,00 руб.
1 Токсокароз IgG — 600,00 руб.
2 Токсокароз IgM — 600,00 руб.
3 Описторхоз IgG — 600,00 руб.
4 Описторхоз IgM — 600,00 руб.
5 Эхинококк IgG — 600,00 руб.
6 Эхинококк IgM — 600,00 руб.
Клиника hormone life
Греков Евгений Александрович
Российский врач-уролог, андролог, эндокринолог, основатель и главный врач Клиники Hormone Life — Первой в России клиники спортивной, репродуктивной AntiAge эндокринологии.
Высшее медицинское образование (специальность «Педиатрия») Евгений Александрович приобрел в Ярославской Государственной Медицинской Академии в 2007 году.
В 2009 году окончил клиническую ординатуру по специальности «Урология» в Ярославской Государственной Медицинской Академии.
С 2010 года работает на кафедре эндокринологии РУДН под руководством Калинченко С.Ю.
В 2019 году окончил курс дополнительной профессиональной переподготовки по специальности «Урлогия» в ФГБОУ дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования Министерства здравоохранения Российской Федерации»
В 2021 окончил клиническую ординатуру по специальности «Эндокринология» на базе Федерального государственного образовательного учреждения высшего образования «Российский университет дружбы народов»
Является соавтором более 35 научных статей в сфере эндокринологии, гинекологии, урологии, андрологии. Благодаря его научным изысканиям, мужчины расстаются с самыми страшными диагнозами, а основанная им ассоциация по спортивной эндокринологии и спортивной нутрициологии успешно помогает любителям и профессиональным спортсменам.
Кроме того, Евгений — ведущий авторской передачи «Спортивная жизнь с доктором Грековым», «Вопрос андрологу» на Радио Медиаметрикс.
В апреле 2019 доктор Греков дебютировал в качестве телевизионного ведущего в программе «Я стесняюсь своего тела В популярном блоге в Instagram ведет просветительскую работу, дает советы о здоровье и делится с подписчиками историями из жизни. На блог подписано более 35 тысяч пользователей соцсети.
К доктору могут обращаться и мужчины и женщины с проблемами связанными с гормональным дефицитом, дефицитом минералов и витаминов.
Ятрогенный гипогонадизм у мужчин
На онлайн-заседании дискуссионного андрологического клуба «Гипогонадизм у мужчин» уролог, андролог, эксперт в сфере спортивной медицины Евгений Александрович Греков рассказал о применении анаболитических стероидов и ятрогенном гипогонадизме у мужчин.
Е.А. Греков
уролог, андролог, эндокринолог, генеральный директор клиники Hormone Life. (г. Москва)
Прежде всего, Евгений Александрович напомнил о присутствии в МКБ 10 пункта F55 — «Злоупотребление веществами, не вызывающими зависимость», к которому можно отнести в том числе применение анаболитических стероидов. Со своей стороны доктор отметил, что некоторым пациентам — скажем, тренерам в спортзалах или профессиональным бодибилдерам — употребление таких веществ может приносить социальную или экономическую выгоду, однако во многих видах спорта — например боях UFC — их применение запрещено под угрозой дисквалификации.
Вместе с тем употребление анаболиков, особенно бесконтрольное, чревато серьезными последствиями для здоровья вплоть до фатальных. Проблема соревнований по бодибилдингу в том, что на них зачастую никак не оцениваются показатели силы, выносливости и функциональности — лишь параметры внешнего вида спортсменов. Прием анаболитических стероидов без медицинского контроля может ввести к дилатационной кардиомиопатии, стероидным гепатитам, полиорганной недостаточности и смерти.
В российском поликлиническом звене, как подчеркнул Евгений Александрович, сегодня практически нет специалистов, которые могли бы вести пациента, страдающего от недостатка мышечной массы при гипогонадизме. В частности, по этой причине молодые люди часто прибегают к изучению источников в интернете и самоназначениям
Сегодня в распоряжении российских спортивных врачей остается все меньше официально доступных препаратов. В частности, из их числа не так давно исключен ретаболил — анаболитический стероид, применяемый при саркопении. Некоторые фармацевтические компании, в частности молдавская «Балканфарма», продолжают официально выпускать стероидные препараты. Российский «Дальхимфарм» производит тестостерона пропионат — правда, в небольшой дозировке — 50 мг/мл, что, впрочем, подходит для лечения гипогонадизма.
Большую проблему, как подчеркнул Евгений Александрович, представляет распространенная ситуация, когда тренер, человек без медицинского образования, назначает анализы, а также «на глаз» диагностирует и лечит людей. Очень часто таким образом назначаются тамоксифен, клостилбегит, препараты, блокирующие ароматазу, и многие другие средства. При этом антиэстрогены, например, при постоянном приеме негативно влияют на костную ткань, и многие из молодых людей, принимающих их в спортивных целых, позже попадают к врачам с переломами. Часто тренеры и «коллеги» в залах советуют прием препаратов Т3 и Т4, а также глюкокортикоидов без каких-либо опасений
Как отметил Евгений Александрович, нередко проблемой становится даже не сам ятрогенный гипогонадизм, а то, как его пытаются откорректировать. К примеру, после приема хорионического гонадотропина уровни ЛГ и ФСГ могут держаться на нуле некоторое время, однако впоследствии благополучно восстанавливаются самостоятельно. Несмотря на это, для корректировки такой ситуации многие тренеры и спортивные блогеры назначают комбинации тамоксифена с кломифеном плюс витамины, омега 3 и трибестан. Все вместе это вызывает лекарственный гепатит с резким повышением показателей АЛТ и АСТ из-за неприспособленности печени к переработке высоких доз антиэстрогенов.
Помимо этого, некоторые лаборатории, включая сетевые, измеряют уровень тестостерона методом иммунофеоментного анализа (ИФА), который сейчас не должен применяться для гормонов. Таким образом, пациентов вводят в заблуждение, хотя можно было бы воспользоваться более достоверным методом масс-спектрометрии.
В числе жалоб пациентов, которые обращаются к спортивным врачам, обычно недостаток мышечной массы и дряблость кожи, несмотря на регулярное посещение спортзала. Распространенный диагноз — нормогонадотропный гипогонадизм. Грамотно выстроенный режим терапии у них дает обычно очень хорошие визуальные результаты без изменения режима нагрузок.
Наконец, блогеры и самоназванные эксперты в сфере спортивной медицины, как правило, не знают о необходимости генетических исследований, рассматривающих рецепторы, полиморфизм генов и т. д. К примеру, как напомнил Евгений Александрович, такие исследования помогают выяснить причины повышения уровня глобулина, связывающего половые гормоны (ГСПГ), а не корректировать его стероидами. В заключение доктор поделился планами по созданию Ассоциации экспертов стран СНГ по спортивной эндокринологии и нутрициологии — все необходимые действия для этого уже предприняты, осталось лишь начать регулярную работу.
Гормональные нарушения у женщин: а она и не знала, что гормон бывает жестоким
» data-image-caption=»» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?fit=825%2C550&ssl=1″ />
Гормональный фон — это совокупность гормонов, биологически активных веществ, которые вырабатываются железами внутренней секреции. Задача гормонов — нормализация всех жизненных процессов.
Гормональные нарушения у женщин
» data-image-caption=»» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?resize=900%2C600″ alt=»Гормональные нарушения у женщин» width=»900″ height=»600″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?resize=825%2C550&ssl=1 825w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2017/12/Gormonalnyie-narusheniya-u-zhenshhin.png?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ />
Гормональные вещества вступают в клетках организма в различные биохимические и физиологические реакции. При гормональном сбое происходит разбалансировка в работе желез внутренней секреции, и гормоны начинают вырабатываться недостаточно или избыточно. Следовательно скорость всех реакций в организме, зависящих от данного гормона, повышается или снижается.
Какие гормоны участвуют в работе желез внутренней секреции: вот откуда все наши беды
Многие пациентки, обратившиеся к гинекологу — эндокринологу удивляются, когда им предлагают пройти сразу несколько анализов на гормоны. Они почему-то думают, что их здоровье зависит только от пары-тройки половых гормонов и инсулина. На самом деле эндокринными железами женщины вырабатывается около 70 гормонов. И каждый из них очень важен для организма.
По химическому составу гормональные вещества относят к 3 группам:
Белково-пептидные гормоны воздействуют на корки надпочечников, щитовидной железы, половых желез, стимулируя их работу. Сбой в выработке белково-пептидных гормонов приводит к нарушению в работе различных внутренних органов.
Производные аминокислот продуцируют гормоны, регулирующие деятельность щитовидной железы. L-триптофан синтезирует жизненно важные гормоны, отвечающие за настроение и жизненный тонус человека — гормон сна мелатонин и гормон радости серотонина. Аминокислоты отвечают за тягу к алкоголю и курению, ПМС у женщин, нормальный сон.
Они имеют следующие функции:
Как и когда происходит гормональный сбой: хочется плакать — сходи к гинекологу
Гормональный сбой происходит вне зависимости от возраста женщины. Он характерен как для очень молодых девушек, так и для женщин, достигших определённого возрастного рубежа.
Эндокринная система работает благодаря сигналам, поступающим из подкорки головного мозга, а именно, из гипоталамуса. От него сигнал поступает к гипофизу, одной из эндокринных желез.
Для женщины, если рассматривать только репродуктивную функцию, наибольшее значение имеют три гормона, отвечающих за работу женской половой системы.
Все гормоны взаимодействуют между собой. При переизбытке эстрогена уменьшается количество ФСГ. При недостатке прогестерона увеличивается производство лютеинизирующего гормона. Точно по такому же принципу взаимодействуют гипофиз и гипоталамус.
Гормональный сбой имеет как незначительные (выпадение волос, плаксивость), так и серьёзные последствия (поликистоз яичников, миома матки, бесплодие). Независимо от возраста сбой в работе желез внутренней секреции сопровождается повышением веса, нервозностью, тревожными расстройствами и даже депрессией.
Почему происходят гормональные нарушения у женщин
Среди самых распространённых причин, приводящих к гормональным нарушениям, отмечают хронический стресс, напряжённые отношения в семье и на работе. Во время стресса в организме в повышенных объемах вырабатывается гормон надпочечников кортизол. В обычном состоянии он нужен для поддержания стабильного ритма сердца и тонуса сосудов.
При опасности, реальной или мнимой, кортизол попадает в кровь и подготавливает организм к атаке. Это своеобразный рудимент, доставшийся человечеству от далёких предков. Кортизол помогал пещерным людям моментально реагировать на приближающегося саблезубого тигра. В ходе эволюции такая реакция сохранилась, только теперь опасность представляют не дикие животные, а жизненные обстоятельства.
Любая опасность, физическая или психологическая, вызывают повышение выработки кортизола. Но чаще всего к повышению гормона приводят:
Хронический стресс на протяжении длительного времени. К симптомам переизбытка кортизола относится следующее:
Также при повышении кортизола снижаются силы иммунитета, человек подвержен частым ОРВИ, у него проявляется ВПЧ и другие вирусные заболевания.
Возрастные особенности. Риск гормональных сбоев возрастает в подростковом возрасте, в период беременности и менопаузы.
Наиболее часто встречающиеся разновидности гормональных сбоев
Существуют определённые виды гормональных сбоев, характерных для женщин разного возраста. К наиболее часто встречающимся относятся:
Также к гормональным нарушениям относят избыток или недостаток какого-либо гормона:
Как лечится гормональный сбой
| Проблема | В чём риск | Препараты, средства | Как воздействует |
| Понижен эстроген | Увеличивается хрупкость костей, кожа становится морщинистой и сухой, риск инфаркта и инсульта увеличивается | Премарин Прогинова Красная щётка | Борется с остеопорозом, риском развития сердечнососудистых заболеваний. Курс лечения не должен превышать 2 лет, чтобы не вызвать онкологию |
| Повышен эстроген | Разрастание эндометрия и риск развития злокачественных опухолей груди, матки и яичников | Тамоксифен Кломифен | Препараты блокируют эстрогеновые рецепторы, тестостерон прекращает превращаться в эстрадиол. Соответственно, выработка эстрогена останавливается |
| Повышен тестостерон | Нарушается работа яичников, увеличивается секреция сальных желез, появляются прыщи и угри | Леупролид Спиронолактон Гозерелин | Снижают выработку тестостерона, уменьшают выработку кожного жира, лечат угревую сыпь, борются с излишней волосатостью |
| Понижен тестостерон | Нарушается выработка эстрогена, теряется объём мышц, они становятся дряблыми, набирается лишняя масса тела | Небидо Сустанон 250 Estratest Андрогель | Способствует выработке гормона тестостерона естественным путём |
| Низкий прогестерон | Сильные менструальные кровотечения, невозможность зачатия | Дюфастон Утрожестан Кринон гель | Нормализует менструальный цикл, снимает угрозу выкидыша |
| Повышен прогестерон | Опухоль или киста яичника, возникновение хорионэпителиомы — злокачественной опухоли у плода в период беременности | Тамоксифен Кломифен Мифепристон | Используется как средство медикаментозного аборта, снижает выработку прогестерона, борется с новообразованиями |
| Снижен инсулин | Свидетельствует о развитии сахарного диабета 1 типа | Инъекции инсулина | Восполняет недостающий в организме гормон, расщепляет сахар в крови |
| Инсулинорезистентность | Глюкоза не поступает внутрь клетки, развивается диабет 2 типа | Глюкофаж Сиофор | Глюкоза поступает в клетку в виде энергии, снижается уровень сахара в крови |
| Повышен кортизол | Снижается процент мышечной массы при увеличении количества жировой ткани, повышается уровень глюкозы в крови, развивается остеопороз | Медикаментов не существует, кортизол снижается диетой, спортом и лечением последствий стресса | Организм не находится в состоянии стресса, нормализуется работа ЦНС и надпочечников |
| Понижен кортизол | Тёмные пятна на коже, потеря веса, снижение жизненного тонуса, раздражительность, низкое давление | Инъекции кортизола (только при критическом минимуме гормона в организме) | Нормализуется работа надпочечников, снимаются раздражительность и апатия |
Зачем и куда идти к гинекологу — эндокринологу при гормональных нарушениях
Даже пройдя анализы и выяснив, какие гормоны стали причиной гормонального нарушения, принимать самостоятельно никакие таблетки нельзя. Гинеколог рассматривает не только анализы, а все состояние организма женщины, опираясь на свой опыт и знания.
Также очень важно рассчитать дозировки и дополнить базовые препараты сопутствующими. Ведь повышение или снижение нормы гормональных веществ, даже до нормальных показателей, опять-таки влияет на интенсивность выработки других гормонов — этот процесс должен быть контролируемым.
Сдать анализы на гормоны и получить эффективное лечение гормональных сбоев, вы можете в клинике Диана в Санкт-Петербурге. Цены в нашей клинике одни из самых низких. На комплексное обследование предоставляется скидка.
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
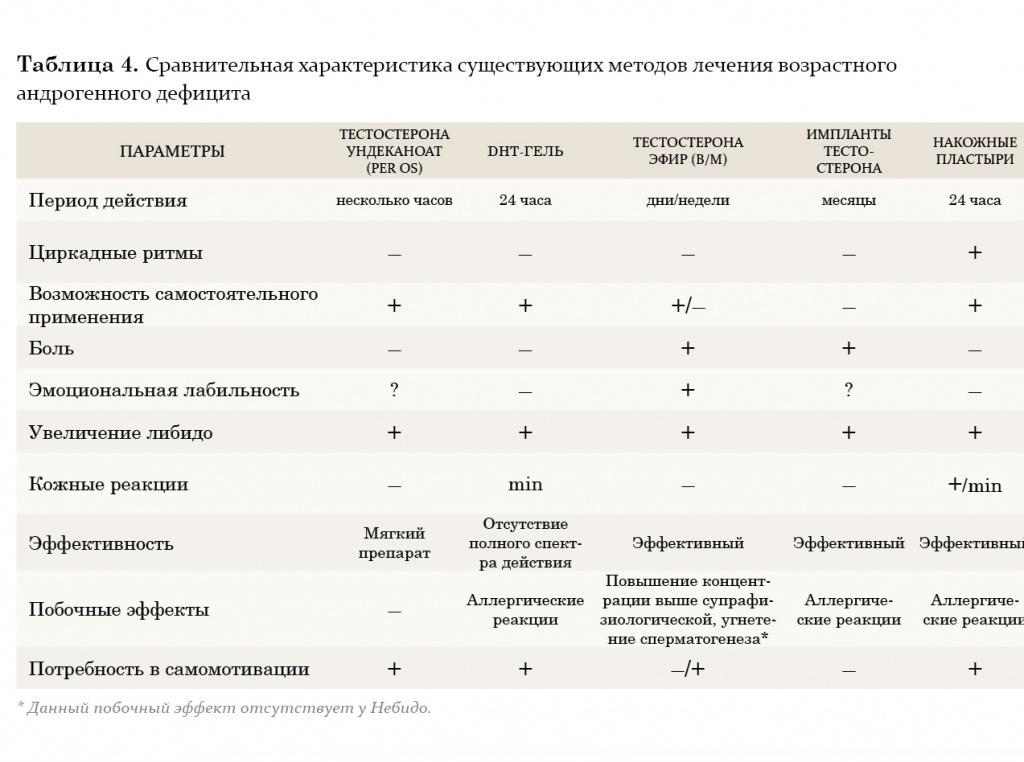
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
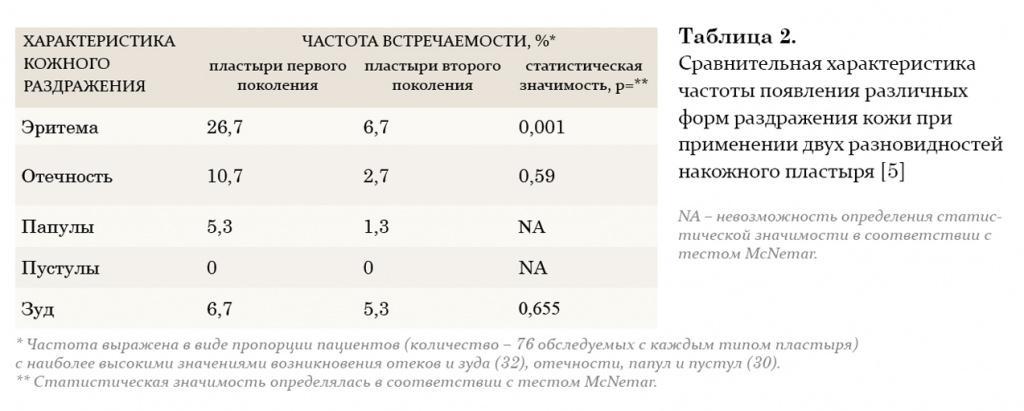
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Возможности медикаментозной коррекции недостатка гормона роста у взрослых
Каковы основные причины соматотропной недостаточности у взрослых? Каковы ее клинические проявления? Какие методы лабораторно подтверждают диагноз? Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с
Каковы основные причины соматотропной недостаточности у взрослых?
Каковы ее клинические проявления?
Какие методы лабораторно подтверждают диагноз?
Как известно, гормон роста (ГР) был последним из классических гормонов, который начали применять с целью заместительной гормональной терапии у взрослых. У детей история медикаментозной коррекции низкорослости насчитывает около тридцати лет, ко взрослым же лечение с использованием биосинтетических препаратов ГР впервые было применено около десяти лет назад. В течение многих лет с целью терапии использовался ГР, получаемый из гипофизарных экстрактов, однако в 1985 году, когда были описаны четыре случая болезни Крейтцфельдта — Якоба у реципиентов гипофизарного ГР, использование последнего было запрещено. Это послужило отправной точкой для начала работ по производству биосинтетического ГР [2].
Использование ГР у детей и произошедший параллельно научный прорыв в отношении диагностирования дефицита гормона роста у взрослых привели к появлению в клинической эндокринологии новой нозологии и, соответственно, новых методов обследования и лечения. Ни один конгресс или симпозиум, проходящий в настоящее время, не обходится без докладов, посвященных проблемам диагностики дефицита ГР (ДГР) у взрослых, выявлению нарушений, сопровождающих заболевание, и принципам подбора терапии.
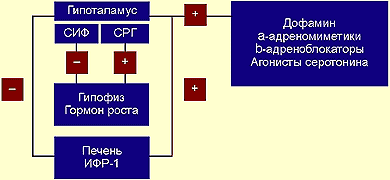
Для того чтобы создать более точное представление о спектре нарушений, развивающихся на фоне соматотропной недостаточности, необходимо кратко напомнить о структуре ГР, механизмах его секреции и влиянии на органы и системы. ГР, синтезируемый соматотрофами передней доли гипофиза, относится к особому семейству пептидных гормонов, в состав которого кроме ГР входят пролактин (ПРЛ) и плацентарный соматомаммотропин человека (СМЧ). Секреция ГР находится под контролем двух гипоталамических гормонов: соматостатина или соматотропин-ингибирующего фактора (СИФ), который оказывает блокирующее действие на синтез и секрецию соматотрофами ГР. Соматотропин — рилизинг гормон (СРГ) — оказывает стимулирующее действие на соматотрофы, что проявляется увеличением продукции ГР.
Как многие гормоны, ГР синтезируется в определенном импульсном режиме, пики секреции приходятся на 22.00 и 4.00 часа.
Несмотря на существование специфических рецепторов ГР, его действие осуществляется посредством специфических факторов, аналогичных по своей структуре инсулину: инсулиноподобного ростового фактора I (ИФР-I) и инсулиноподобного ростового фактора II (ИФР-II). ИФР-I, действуя через собственные рецепторы, оказывает ростовые эффекты преимущественно в постэмбриональном онтогенезе организма. Действие ИФР-II проявляется преимущественно в процессе эмбриогенеза.
Многочисленные исследования, результаты которых публикуются в современных медицинских изданиях, красноречиво свидетельствуют о наличии серьезных нарушений в соматическом и психологическом статусе пациентов с декомпенсированной недостаточностью гормона роста. Эти нарушения характеризуются изменением соотношения жировая/мышечная ткань в сторону снижения удельного веса последней, увеличения удельного веса жировой ткани и сопровождаются висцеральным отложением последней. При проведении денситометрии обнаруживается снижение плотности костной ткани (МПК). Scacchi at al отметили обратно пропорциональную зависимость между индексом массы тела (ИМТ) и периодом полужизни ГР, а также амплитудой секреции ГР. Процент содержания жировой ткани находился в обратной зависимости от интегрального показателя концентрации ГР, определяемого в течение 24 часов.
Со стороны метаболических нарушений необходимо выделить снижение толерантности к углеводам при проведении инсулинтолерантного теста, увеличение продукции инсулина, проинсулина, повышение содержания триглицеридов плазмы крови, липопротеидов низкой и очень низкой плотности [3].
Не до конца изучено влияние недостаточности ГР на увеличение риска развития сердечно-сосудистых заболеваний, однако при ретроспективном исследовании 333 пациентов с гипопитуитаризмом выявлено, что в течение 22 лет случаи кардиоваскулярной смерти встречались в два раза чаще по сравнению с группой контроля. При проведении эхокардиографии исследователи обнаруживали снижение массы левого желудочка, уменьшение толщины перегородки и задней стенки желудочков, а также снижение фракции выброса левого желудочка.
Еще сравнительно недавно проблема дефицита ГР у взрослых не находила отражения в исследованиях эндокринологов, хотя вопросы, связанные с недостаточностью секреторной функции гипофиза, возникали с того времени, когда были впервые описаны пациентки с синдромом Шиена (Шихана). Данная патология обусловлена развитием инфарктов и кровоизлияний в раннем послеродовом периоде и характеризуется развитием пангипопитуитаризма. Долгие годы пациентки получали заместительную гормональную терапию глюкокортикоидами, тиреоидными гормонами, половыми стероидами, однако при этом продолжали предъявлять неспецифические жалобы на повышенную утомляемость, слабость, немотивированное увеличение массы тела. При попытке исследовать уровень гормонов сыворотки крови с целью выяснения степени компенсации имеющихся нарушений патологических отклонений обнаружено не было, а сниженному уровню ГР не придавали значения. В дальнейшем многочисленные клинические и лабораторные исследования продемонстрировали, что снижение секреции ГР в организме взрослого человека приводит к целому ряду нарушений, которые остаются незамеченными и не имеют такой яркой клинической окраски, как, например, гиперсекреция ГР и развивающаяся вследствие этого акромегалия.
Перечислим причины развития соматотропной недостаточности у взрослых
Количество пациентов, подвергшихся тем или иным вмешательствам на селлярной области, растет год от года, и связано это с повышением разрешающей способности диагностических методов, используемых при обследовании больных, и расширением лечебных возможностей современной медицины. Исходя из этого можно прогнозировать, что количество пациентов, нуждающихся в проведении скринингового обследования ДГР, будет увеличиваться год от года. Современная фармакология, в свою очередь, располагает целым спектром препаратов, призванных компенсировать соматотропную недостаточность; ниже приводится перечень средств, имеющихся на сегодняшний день в отечественной аптечной сети.
«Золотым стандартом» в диагностике ДГР у взрослых справедливо считается инсулинотолерантный тест. Необходимо оговориться, что его проведение возможно только после компенсации вторичного гипотиреоза и вторичного гипокортицизма, в противном случае результаты теста могут быть недостоверными.
В рамках исследования, проведенного в клинике эндокринологии ММА им. И. М. Сеченова и посвященного изучению целесообразности назначения препарата генноинженерного гормона роста взрослым, была обследована группа больных с подозрением на наличие соматотропной недостаточности.
В группу вошли 15 человек в возрасте от 15 до 45 лет: 12 женщин (80%) и трое мужчин (20%). Девять женщин (60%) были прооперированы по поводу макропролактином гипофиза, трое мужчин (20%) и трое женщин (20%) подверглись оперативному вмешательству по поводу краниофарингиомы гипофиза, у одного мужчины (6,7%) при проведении МРТ выявлена агенезия гипофиза. Среди всех обследованных пациентов задержка роста зафиксирована у троих мужчин (20%) в возрасте 16, 21 и 27 лет, оценка роста у них проводилась с использованием таблицы «Перцентильный график роста для мальчиков». У первого пациента рост был равен 148 см, при оценке перцентильных значений величина стандартного отклонения (SDS) составила –3,5. Рост второго и третьего пациентов был равен 145 и 152 см соответственно, но в связи с невозможностью оценить величину SDS исходя из паспортного возраста последняя была рассчитана исходя из костного. В первом случае паспортный возраст ровнялся 13-14 годам и SDS –2, во втором случае костный возраст соответствовал 16 годам и SDS –3. Структура эндокринных заболеваний, выявленных у пациентов с подозрением на соматотропную недостаточность, отражена в табл. 2.
 |
| Регуляция секреции гормона роста |
Перед проведением провокационных тестов, направленных на диагностику соматотропной недостаточности, всем пациентам был проведен комплекс лабораторно-диагностических мероприятий для уточнения соматического и гормонального статуса пациентов.
Большинство пациентов получали заместительную гормональную терапию по поводу вторичного гипотиреоза, вторичной надпочечниковой недостаточности, несахарного диабета; у всех было проведено скрининговое исследование концентрации свободного Т4, пролактина, ЛГ, ФСГ, эстрадиола с целью коррекции доз получаемых препаратов.
Исследование соматического статуса предусматривало определение следующих показателей: расчет индекса массы тела (ИМТ), вычисление отношения объем талии/объем бедер (ОТ/ОБ), определение уровня глюкозы, холестерина, триглицеридов, ЛПНП, ЛНВП, АЛТ, АСТ. Проводилось ЭКГ и измерение артериального давления с целью исключения патологии со стороны сердечно-сосудистой системы.
Для оценки качества жизни пациентов с рассматриваемой патологией использовался опросник, разработанный специально для пациентов с дефицитом ГР — QoL-AGHDA (Quality of Life — Assessment of Growth Hormone — Deficiency in Adults) и содержащий 25 вопросов, на которые необходимо было ответить «да» или «нет». Каждый положительный ответ оценивался в один балл; чем больше оказывалась полученная в результате сумма, тем ниже показатель качества жизни.
В ходе обследования были получены следующие результаты.
Нормальные показатели ИМТ (18 30) диагностировано у четырех человек (26,7%). У одного пациента наряду с задержкой роста был выявлен дефицит массы тела, ИМТ составил 15,9 (6,7%). У одной пациентки (6,7%) обнаружен сахарный диабет II типа. Признаки висцерального ожирения выявлены у четырех пациенток (26,7%).
При обследовании у шести пациенток обнаружено повышение гликемии натощак, которое составило 7,025 ± 0,12 ммоль/л; показатели гликемии у 11 пациентов были в пределах нормы и варьировали от 3,6 до 5,5 ммоль/л. Для исключения возможных нарушений углеводного обмена: тощаковой гипергликемии, нарушения толерантности к углеводам, сахарного диабета, гиперинсулинемии всем пациентам был проведен оральный глюкозотолерантный тест с 75 г глюкозы. При определении гликемии через 2 часа после приема 75 г глюкозы последняя составила 6,6 ± 0,14 ммоль/л. Сахарный диабет был выявлен у одной пациентки (гликемия 11,9 ммоль/л), еще у двоих пациентов определено нарушение толерантности к углеводам (гликемия 8,3 и 9,0 ммоль/л). При исследовании уровня С-пептида сыворотки крови были получены следующие результаты: базальная гиперинсулинемия (>2,5 нг/мл) обнаружена у пяти пациентов (3,33%) и составила 3,89 ± 0,1 нг/мл. Более чем двукратное увеличение концентрации С-пептида через 120 минут после стимуляции отмечено у девяти пациентов (60%) и составило 10,5 ± 0,4 нг/мл. При оценке липидного обмена гиперхолестеринемия выявлена у десяти пациентов (66,6%), гипертриглицеридемия обнаружена у семи пациентов (46,6%).
Всем пациентам был проведен инсулинотолерантный тест с целью подтверждения дефицита гормона роста. В условиях стационара пациентам внутривенно вводился инсулин короткого действия: Humulin R или Actrapid HM, из расчета 0,1 ЕД/кг [1]. Исходно через каждые 15 минут в дальнейшем пациентам проводилось определение гликемии в капиллярной крови и забор крови для последующего выявления уровня гормона роста в сыворотке крови.
В ответ на инсулин-индуцированную гипогликемию у 12 обследованных (80%) концентрация ГР не превысила 5 нг/мл, а составила в среднем 0,76 ± 0,013 нг/мл. У троих на фоне гипогликемии было зарегистрировано повышение уровня ГР до 30,78 ± 0,45 нг/мл.
По результатам проведенного теста девяти пациентам была назначена терапия генотропином (Pharmacia&Upjohn). Двое пациентов с задержкой роста получают препарат в настоящее время, у семи человек завершился шестимесячный курс терапии. При расчете дозы препарата использовались рекомендации Janssen и соавт., дозировка генотропина определялась из расчета 0,018 МЕ/кг для шести пациентов, а для трех пациентов с задержкой роста доза была вычислена из расчета 0,1 МЕ/кг [2].
Спустя 6 месяцев после начала терапии все пациенты прошли повторное обследование. Сколько-нибудь значимых изменений ИМТ отмечено не было, показатель ОТ/ОБ снизился у пяти человек, у двоих он остался на прежнем уровне. У троих пациентов выявлено некоторое снижение концентрации холестерина, составившее 8,4, 9,7 и 26,6% от первоначального уровня. У троих пациентов не определено каких-либо изменений, у одного пациента выявлено повышение концентрации холестерина на 17% от исходного. По показателям содержания триглицеридов выявлены следующие данные: у четверых пациентов снижение ТГ составило 56,4, 47,2, 3,7 и 6,3% от исходного. В одном случае динамики отмечено не было, а у двоих человек зафиксировано повышение концентрации ТГ, составившее 68 и 92% от исходного уровня. Снижение уровня ТГ и холестерина на фоне терапии генотропином подтверждается данными зарубежных исследователей, демонстрирующих нормализацию показателей липидного обмена на фоне заместительной терапии.
Перед началом терапии средний показатель качества жизни составил 12,5 балла, а на последней неделе терапии он снизился до 8,9 балла (необходимо отметить, что, по данным Holmes и соавт., у здоровых пациентов, обследованных в Швеции, он составляет 3,7).
Пациент с задержкой роста за 6 месяцев лечения вырос на 5 см, и его рост на момент окончания терапии составил 157 см.
Среди зафиксированных пациентами побочных эффектов чаще всего встречались: отеки, артралгии и миалгии, которые развивались на 3-6-й неделе терапии; о них сообщили четверо пациентов. Аналогичные данные демонстрируют и зарубежные исследователи, проводившие наблюдения за более многочисленными группами пациентов, получавших ГР.
По результатам проведенного исследования можно сделать следующие выводы.
Литература
1. Алгоритмы диагностики и лечения болезней эндокринной системы/ Под ред. И. И. Дедова, 1997.
2. Дедов И. И., Тюльпаков А. Н., Петеркова В. А. Соматотропная недостаточность, 1998.
3. Monson J. P. Growth Hormone Therapy. Oxf, 1999. Р. 93-103.
Зачем нужна заместительная гормональная терапия женщине после 50 лет — риски и эффекты
Зачем нужна заместительная гормональная терапия женщине после 50 лет — риски и эффекты
С увеличением продолжительности жизни увеличивается и количество пожилых людей. По данным Всемирной организации здравоохранения, средняя продолжительность жизни женщин к 2031 году достигнет 85 лет. Таким образом, женщина проживет почти треть своей жизни после менопаузы. Поэтому важно понимать, что менопауза является еще одним естественным и качественным этапом в жизни.
Что такое менопауза? Это не болезнь?
Менопауза — это физиологический период жизни для всех женщин, который наступает в среднем в возрасте 51,3 года. Это серьезное потрясение в организме, где снижение выработки эстрогена и прогестерона может привести к появлению множества симптомов, которые ухудшают качество жизни.
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фазы-менопаузы.jpg?fit=450%2C267&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фазы-менопаузы.jpg?fit=800%2C475&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%A4%D0%B0%D0%B7%D1%8B-%D0%BC%D0%B5%D0%BD%D0%BE%D0%BF%D0%B0%D1%83%D0%B7%D1%8B.jpg?resize=800%2C475&ssl=1″ alt=»Фазы менопаузы» width=»800″ height=»475″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фазы-менопаузы.jpg?w=800&ssl=1 800w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фазы-менопаузы.jpg?resize=450%2C267&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фазы-менопаузы.jpg?resize=768%2C456&ssl=1 768w» sizes=»(max-width: 800px) 100vw, 800px» data-recalc-dims=»1″ /> Фазы менопаузы
Женские половые гормоны, эстрогены и прогестерон в основном вырабатываются фолликулами яичников. Максимальное количество фолликулов находится в яичниках плода, еще в утробе матери. При рождении их число уже меньше, и впоследствии постоянно сокращается.
Примерно к 50 годам функция яичников постепенно прекращается, а баланс и синтез секретируемых гормонов нарушается. Овуляция в яичниках происходит реже или полностью исчезает, что означает, что желтое тело, вырабатывающее прогестерон, больше не формируется, что снижает его уровень в организме. Эстрогены все еще производятся, это приводит к относительному избытку эстрогенов. Следствием процесса становится нерегулярный менструальный цикл и дисфункциональные кровотечения.
Симптомы ранней менопаузы часто возникают еще в предменопаузе. Это вазомоторные симптомы, такие как:
» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Головная-боль.jpg?fit=450%2C253&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Головная-боль.jpg?fit=900%2C506&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%93%D0%BE%D0%BB%D0%BE%D0%B2%D0%BD%D0%B0%D1%8F-%D0%B1%D0%BE%D0%BB%D1%8C.jpg?resize=900%2C506&ssl=1″ alt=»Головная боль» width=»900″ height=»506″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Головная-боль.jpg?w=900&ssl=1 900w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Головная-боль.jpg?resize=450%2C253&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Головная-боль.jpg?resize=768%2C432&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Головная боль
Также возможны психологические симптомы:
В этот период женщина часто не связывает вышеуказанные психологические жалобы с надвигающейся менопаузой и поэтому обращается не к гинекологу, а к терапевту. Врач назначает седативные средства или антидепрессанты. Это не правильно: при симптомах менопаузы нужно идти в гинекологическую клинику и лечить гормональные проблемы, а не их последствия.
В 2013 году Британское общество менопаузы (англ. British Menopause Society) рекомендовало врачам консультировать по вопросам здоровья и здорового образа жизни всех женщин около 50 лет. А также для каждой пациентки составлять индивидуальный план лечения в период менопаузы и в последующий период, таким образом обеспечивая более долгую и здоровую жизнь. Подчеркивается, что наибольшая возможность профилактики негативных симптомов — это ранняя менопауза.
Рекомендации Британского общества менопаузы гласят, что даже кратковременное использование гормонов методом ЗГТ в начале менопаузы улучшает настроение и снимает депрессию. В этом случае срабатывает так называемый эффект домино из-за исчезновения вегетативных симптомов и прямого антидепрессивного эффекта. Психиатрическое консультирование рекомендуется женщинам, страдающим жесткой депрессией или когда нет улучшения после лечения гормонами.
С годами запасы фолликулов истощаются, и вырабатывается все меньше и меньше эстрогена, поэтому на основе обратной связи гипофиз выделяет еще больше фолликулостимулирующих (ФСГ) и лютеинизирующих (ЛГ) гормонов. Даже стимулированный яичник перестает выделять половые гормоны (эстроген и прогестерон) — наступает менопауза.
В среднем через 3-5 лет после наступления менопаузы промежуточные симптомы включают урогенитальные расстройства:
Частое и болезненное мочеиспускание
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?fit=401%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?fit=734%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%A7%D0%B0%D1%81%D1%82%D0%BE%D0%B5-%D0%B8-%D0%B1%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D0%B5%D0%BD%D0%BD%D0%BE%D0%B5-%D0%BC%D0%BE%D1%87%D0%B5%D0%B8%D1%81%D0%BF%D1%83%D1%81%D0%BA%D0%B0%D0%BD%D0%B8%D0%B5.jpg?resize=900%2C674&ssl=1″ alt=»Частое и болезненное мочеиспускание» width=»900″ height=»674″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?resize=401%2C300&ssl=1 401w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?resize=734%2C550&ssl=1 734w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Частое-и-болезненное-мочеиспускание.jpg?resize=768%2C575&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Частое и болезненное мочеиспускание
Атрофия соединительной ткани и нарушение синтеза коллагена приводят к выпадению волос, переломам ногтей, истончению и сухости кожи, болям в костях и суставах. Эти признаки относятся к симптомам позднего климакса, остеопорозу, сердечно-сосудистым заболеваниям, старческой деменции (слабоумию).
Этот период каждая женщина переносит индивидуально. Поскольку основной причиной этих симптомов является недостаток половых гормонов, наиболее эффективным лечением для улучшения качества жизни женщины будет лечение гормонами. В гинекологии для уменьшения симптомов дефицита эстрогена применяется комбинация эстрогена (E) и эстрогена / прогестина (E / P).
Современный подход к гормональному лечению женщин в менопаузе
В 2002 г. в рамках Инициативы по охране здоровья женщин было проведено исследование, изучающее эффективность лечения гормонами в постменопаузе. Были выделены две группы пациенток: для первой назначили комбинацию конъюгированных эстрогенов (KE) и ацетата медроксипрогестерона (MPA), другой давали только KE.
После публикации первых результатов некоторые гинекологи перестали назначать гормонотерапию, заменив лечение различными БАДами, фитоэстрогенами и даже препаратами сои, считая, что они будут подавлять постменопаузальные симптомы. Естественно, что такое лечение не может быть эффективным.
Повторный анализ результатов исследования выявил причины, приведшие к отрицательным результатам:
Тогда как у женщин, находившихся в постменопаузе менее 10 лет и получавших грамотно подобранную комбинацию KE / MPA, была зафиксирован более низкая частота сердечно-сосудистых заболеваний, чем у женщин, получавших плацебо. А в группе пациенток 50-59 лет, принимающих только KE, было отмечено снижение риска ССЗ сразу на 50% по сравнению группы с плацебо.
Мета-анализ 24-х клинических испытаний подтвердил кардиозащитное действие эстрогенов. Поэтому в рекомендациях Североамериканского общества менопаузы уже в 2012 году говорится, что женщины, начинающие лечение эстрогенами во время менопаузы, снижают риск рака груди и заболеваний сосудов и сердца.
Тромбоз глубоких вен
Тромбоз глубоких вен
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?fit=822%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%A2%D1%80%D0%BE%D0%BC%D0%B1%D0%BE%D0%B7-%D0%B3%D0%BB%D1%83%D0%B1%D0%BE%D0%BA%D0%B8%D1%85-%D0%B2%D0%B5%D0%BD.jpg?resize=900%2C602&ssl=1″ alt=»Тромбоз глубоких вен» width=»900″ height=»602″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?resize=822%2C550&ssl=1 822w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Тромбоз-глубоких-вен.jpg?resize=768%2C514&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Тромбоз глубоких вен
Окончательный вывод ученых: риск рака груди, связанный с гормональным лечением, низкий. В заявлении Международного общества менопаузы упоминается менее 1 случая на 1000 женщин в течение года использования. Риск возрастает при постменопаузальном ожирении, низкой физической активности или повышенном потреблении алкоголя.
Здоровым женщинам до 60 лет (10-летний период постменопаузы) не следует беспокоиться о рисках гормонотерапии, поскольку риск рака груди не увеличивается в течение первых 5-7 лет лечения. При этом доказано, что с лучшим профилем риска рака груди связаны микронизированный прогестерон или дидрогестерон при использовании с эстрадиолом, чем синтетические прогестагены. Общество эндокринологов США пришло к выводу, что ЗГТ не увеличивает риск рака груди при приеме гормонов в течение 5 лет или меньше.
В настоящее время исследований, однозначно и четко показывающих влияние ЗГТ на развитие или риск рака яичников нет. Но следует отметить важные преимущества ЗГТ в снижении риска рака толстой кишки.
Осложнения тромботической эмболии повышают риски перорального приема гормонов. Наибольший риск возникает в первый год использования. Поэтому перед назначением лекарств важно оценить медицинский и семейный анамнез венозной тромбоэмболии, ожирения и запланированного хирургического лечения. Если выявлен повышенный риск, выбираются трансдермальные препараты эстрогена, а микронизированный прогестерон или дидрогестерон выбираются из более безопасных прогестинов.
Гормоны не используются для первичной или вторичной профилактики инсульта, поскольку они увеличивает риск инсульта у женщин старше 60 лет.
Режим приема гормонов при менопаузе
Если последняя менструация была менее чем за год до начала ЗГТ, терапия является циклической, т. е. эстрогены вводятся непрерывно, а прогестагены — в течение 12–14 дней, после чего следует кровотечение. Следует иметь в виду, что лечение, проводимое циклически более 5 лет, незначительно увеличивает риск рака эндометрия.
Гормоны используются на постоянной основе, если последняя менструация была более года назад или, если женщина принимает циклическую гормональную терапию более года и хотела бы перейти лечение без ежемесячных кровотечений. Постоянное использование гормонов имеет более низкий риск рака эндометрия.
Фемостон — один из вариантов лечения симптомов у женщин в менопаузе
Чтобы понять, как работает ЗГТ, можно рассмотреть действие препарата, часто назначаемого в Европе. Фемостон — это лекарство, содержащее гормоны — микронизированный 17β-эстрадиол и дидрогестерон.
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?fit=406%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?fit=744%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%A4%D0%B5%D0%BC%D0%BE%D1%81%D1%82%D0%BE%D0%BD.jpg?resize=900%2C665&ssl=1″ alt=»Фемостон» width=»900″ height=»665″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?resize=406%2C300&ssl=1 406w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?resize=744%2C550&ssl=1 744w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Фемостон.jpg?resize=768%2C567&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Фемостон
Существует 3 различных фармацевтических формы препарата с различной дозировкой, подбираемой гинекологом индивидуально.
Например, Фемостон 1 мг / 10 мг представляет собой циклическое лечение в низких дозах, т.е. эстрогены вводятся непрерывно, а гестагены — в течение 14 дней. После их приема у пациентки возникает кровотечение. В пачках содержится 28 таблеток, принимаемых по 1 таблетке без перерыва. Каждая таблетка содержит 1 мг 17β-эстрадиола, а последние 14 таблеток содержат 10 мг дидрогестерона. Препарат применяют, если последняя менструация была менее года до начала лечения. Такое сочетание гормонов обычно хорошо переносится. Побочные реакции возникают редко. Среди них распространены: головная боль, боль в спине, животе или груди, гиперчувствительность молочных желез.
Непрерывный режим гормонотерапии используется, если последняя менструация была более чем за год у женщин в менопаузе или более чем за 2 года до наступления преждевременной недостаточности яичников. В этом случае лекарство содержит 28 таблеток. Каждая таблетка содержит одинаковое соотношение 17β-эстрадиола и дидрогестерона. Препарат принимают ежедневно по 1 таблетке без перерыва.
Такой вариант лечения показан для женщин, страдающих от симптомов дефицита эстрогена, или для профилактики остеопороза у женщин с повышенным риском переломов, которые не переносят или которым запрещено принимать другие лекарства для профилактики остеопороза. Защитный эффект на кости зависит от дозы эстрогена. Исследования показали, что гормоны, вводимые во время перименопаузы, оказывают длительное защитное действие на кости в течение многих лет даже после отмены.
Какую дозу препаратов для ЗГТ выбрать? Общее правило состоит в том, что оптимальная доза и продолжительность лечения подбираются индивидуально с учетом тяжести симптомов и реакции на назначенное лечение.
Часто лечение начинают с самой низкой, но эффективной дозы эстрогена, т.е. препарата, содержащего 1 мг эстрадиола 17-β. Если симптомы сохраняются в течение примерно 2–3 месяцев, дозу увеличивают. Большинству женщин достаточно низких доз эстрогена в 1 мг, чтобы облегчить симптомы. Очень низкие дозы эстрадиола 0,5 мг эффективны для контроля субъективных симптомов и поддержания минеральной плотности костей у женщин в постменопаузе.
Согласно заявлению Международного общества менопаузы, дидрогестерон, входящий в состав препаратов для ЗГТ, связан с лучшим профилем риска рака груди, чем синтетические гестагены. Но ЗГТ в любом случае не следует применять женщинам с диагнозом:
» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Рак-груди.jpg?fit=450%2C253&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Рак-груди.jpg?fit=900%2C506&ssl=1″ loading=»lazy» src=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/%D0%A0%D0%B0%D0%BA-%D0%B3%D1%80%D1%83%D0%B4%D0%B8.jpg?resize=900%2C506&ssl=1″ alt=»Рак груди» width=»900″ height=»506″ srcset=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Рак-груди.jpg?w=900&ssl=1 900w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Рак-груди.jpg?resize=450%2C253&ssl=1 450w, https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/01/Рак-груди.jpg?resize=768%2C432&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Рак груди
Ключевые моменты заместительной терапии гормонами
Баланс риска и пользы от гормонозаместительного лечения:
Важно ежегодно оценивать соотношение польза и риски. Если симптомы сохраняются после 5 лет приема гормонов, преимущества продолжения лечения перевешивают риски.
Добавить комментарий Отменить ответ
Вы должны быть авторизованы, чтобы оставить комментарий.
Гормон роста
Дата публикации: 6 апреля 2022 г.
Время прочтения: 5 минут
Ни один человек не может нормально жить без нормального уровня соматотропного гормона. Чаще всего его называют гормоном роста. Это активный белок, который занимает в организме важное место по части обмена вещества и выработки новых клеток. Синтез его происходит в гипофизе, благодаря чему воздействуют на процессы непосредственно из мозга.
О гормоне
В организме человек формируется огромное количество химических соединений, которые управляют процессами развития организма, регулируют работу важных для жизнедеятельности желёз, контролируют обмен веществ. Соматотропный гормон роста формируется в гипофизе под непосредственным контролем гипоталамуса. Он отвечает за рост организма, регулирование обменных процессов, в том числе расщеплении белков, жиров и углеводов, а также работу желез внутренней секреции.
Самые большие концентрации соматотропина наблюдаются в детском возрасте, когда малыш активно растёт. Дефицит гормона роста влечёт за собой отставание ребёнка в процессе роста от сверстников. В запущенных случаях это может повлечь задержки общего развития, что чревато опасными последствиями.
Важно отметить, что переизбыток соматотропина также приводит к нежелательным последствиям. В данном случае ребёнок обгоняет сверстников по всем параметрам и рост не прекращается даже после завершения периода полового созревания. Это может перерасти в гигантизм или акромегалию.
Максимальные дозы синтеза гормона роста происходят в период с рождения малыша до окончания пубертатного возраста. Однако за его концентрацией важно следить и во взрослом периоде. Он отвечает за многие важные процессы в организме, в том числе выработку клеток, формирование тканей и правильный обмен веществ.
Функции
Соматотропин выполняет ряд важных функций для поддержания здоровья человека. Это процессы, без которых невозможна нормальная жизнедеятельность человека, а также восстановление после стрессов, физических нагрузок и других неприятных последствий.
Расщепление жиров
Гормон роста вырабатывается в ночное время, когда организм отдыхает. Происходит так потому, что в дневные часы человеку хватает потребляемых с пищей углеводов. Они дают энергию. В ночные часы активно вырабатывается соматотропин, расщепляя отложения жиров. Именно поэтому после пробуждения мы выглядим несколько худее, чем в течение дня.
Но данные процессы не работают, если человек предпочитает плотно поесть перед сном или лечь спать позже обычного. Чтобы соматотропин вырабатывался в соответствии с природной функцией, важно соблюдать ряд правил:
Расщепляя жиры, гормон вырабатывает нужную нам энергию. При этом в переработку идут даже отложившиеся давно жиры, застоявшиеся в организме. Человек «худеет» не прилагая к этому особых усилий.
Поддержание упругости кожи
Участие в регенерации тканей, а также усиленная выработка белка помогает поддерживать кожу в тонусе и активно поддерживать кожу в тонусе. Она подтягивается, становится более упругой и ровной, замедляется процесс появления морщин.
Увеличение силы мышц и прочности костей
Под воздействием гормона роста и при достаточном количестве его выработки гипофизом происходит укрепление мышц и костей, они становятся более упругими и эластичными, дольше сохраняют «молодость». Существенно уменьшается риск развития остеопороза, в результате которого минеральные вещества вымываются из костей. Также сокращается риск переломов.
Благодаря спортивным тренировкам можно усилить процесс укрепления, так как при физических нагрузках соматотропин вырабатывается сильнее и быстрее.
Чтобы походить с помощью выработки гормона роста и занятий в фитнес-центре, обязательно отказаться от употребления перед тренировкой шоколада, а также сладких напитков, кофе и чая. Они являются источниками поступления в организм углеводов, которых будет достаточно на взятие нагрузок. Выработка соматотропина будет приостановлена.
Регулировка жирового обмена
Гормон роста регулирует и снижает выработку вредного холестерина, который способен оседать на стенках сосудов и провоцировать развитие атеросклероза, инфарктов, инсультов, нарушений сосудистой системы.
Функции гормона роста достаточно обширны. Он расщепляет поступающие в организм вещества и энергетически подпитывает органы и ткани. В результате нормальной работы синтеза гормонов происходит укрепление организма в целом, появляется упругость костей, тканей, нормализация метаболизма.
Нормативные показатели
Пациенты любого возраста могут быть исследованы на количественное содержание гормона в сыворотке крови. Для этого достаточно посетить ближайшую лабораторию для забора биоматериала. Анализ назначается в следующих случаях:
Чтобы показатели секреции гормона роста были качественными, важно правильно подготовиться к посещению лаборатории. Для этого соблюдают режим голодания от 8 до 12 часов, без употребления кофе, чая, сладких соков и газировки. Можно пить только чистую питьевую воду без газа.
Обязательно воздержаться от физических и эмоциональных перегрузов хотя бы за сутки до исследования, а также от курения не менее чем за три часа до сдачи крови. Перед забором венозной крови рекомендуется посидеть в состоянии покоя не менее получаса перед кабинетом лаборантов.
Существуют таблицы, которые определяют референсные значения гормона роста. Стоит ориентироваться на них при оценке результата, но заниматься самолечением категорически запрещено. Диагностику и назначение соответствующей терапии проводит только врач.
Уровень инсулиносвязанного гормона изменяется в зависимости от пола и возраста пациента. Здесь даются подробные таблицы с усреднёнными значениями:
| Возраст и пол пациента | Концентрация (нг/мл) |
| женщины от 16 до 19 лет | 176–249 |
| мужчины от 16 до 19 лет | 57–425 |
| пациенты в возрасте от 19 до 22 лет | 105–345 |
| граждане в возрасте от 23 до 25 лет | 107–367 |
| люди от 26 до 30 лет | 88–537 |
| пациенты от 31 до 35 лет | 41–246 |
| пациенты 36 – 40 лет | 57–241 |
| пациенты 41 – 45 лет | 43–210 |
| граждане от 46 до 50 лет | 75–196 |
| от 51 до 55 лет | 55–250 |
| пациенты от 56 до 60 лет | 35–200 |
| пациенты от 61 до 65 лет | 50–187 |
| пациенты от 66 до 70 лет | 37–220 |
| пожилые люди от 71 до 80 лет | 25–200 |
| люди старше 80 лет | 17–325 |
В целом у взрослого населения показатель выработки соматотропина у женщин должен быть ниже 8 мкг/л, у мужчин – до 3 мкг/л.
Повышенные и пониженные значения: как с ними бороться
Если гормон роста вырабатывается некорректно, в этом случае идёт речь о понижении или повышении количественных значений. Увеличение показателей соматотропина наблюдается в случае алкоголизма или соблюдения диеты пациентом. Показатели меняются также при активных физических нагрузках.
Речь может идти о гигантизме и акромегалии, если количественные значения сильно превышают норму выработки гормона. Чрезмерный синтез соматотропного гормона приводит к усиленному росту в детском и подростковом возрасте. При этом пропорции тела сохраняются.
Акромегалия представляет собой рост, но только уже не костей и тканей, как у подростков, а внутренних органов, так как наблюдается у взрослых пациентов. Увеличивается их размеры и вес, что создаёт существенные проблемы для нормальной жизнедеятельности. Всё это указывает на то, что гормон роста в крови повышен.
Также повышение уровня вырабатываемого железой гормона роста происходит после перенесённых травм и операций. В этот момент организму нужна активная стимуляция клеток и рост новых для поддержания здоровья организма и его восстановления. Самототропин вырабатывается в усиленном режиме, наблюдается избыток гормона роста.
Недостаток вещества характеризуется задержкой в росте и общем развитии. Нужна срочная помощь, чтобы не спровоцировать отклонения у ребёнка. У взрослых сниженные показатели также опасны, так как могут спровоцировать развитие различных заболеваний, к примеру, остеопороз.
Чтобы восполнить недостаток гормона роста, следует наладить режим сна и отдыха. Действительность такова, что наибольшая концентрация соматотропина наблюдается в ночной период. Поэтому ложиться спать нужно не позднее 22 часов, предварительно подготовившись и отложив гаджеты.
Важно правильно и сбалансированно питаться. Нельзя отказывать себе в потреблении белка, содержащегося в мясе и рыбе. Повысить уровень гормона можно также за счёт умеренных физических перегрузов.
После консультации с доктором можно перейти на приём лекарственных препаратов и аминокислот. Важно не заниматься самостоятельным, бесконтрольным приёмом, чтобы не навредить организму.
Советы от врачей
Железа, вырабатывающая гормон роста, должна работать как часы, в противном случае качество жизни будет существенно снижено. Чтобы этого не произошло, обязательно наладить режим дня. Следует вовремя ложиться спать и высыпаться положенное время, качественно отдыхать и заниматься спортом. Умеренные физические нагрузки способствуют питанию мышц и формированию правильного мышечного каркаса.
Режим питания и сбалансированность продуктов – один из ключевых моментов. В организм пациента должно поступать достаточное количество белков, жиров и углеводов. Не стоит есть перед сном или переедать в течение дня, рекомендуется придерживаться «правильного» питания с полезными продуктами.
При подозрении на отклонения в нормативах содержания соматотропного гормона рекомендуется незамедлительно обратиться к доктору и получить назначение на анализ крови. Лабораторное исследование покажет, необходима ли человеку восстановительная терапия.
Справиться с патологическим недостатком или переизбытком соматотропина можно только с помощью отслеживания лечащего доктора. Самостоятельное лечение или бесконтрольный приём аминокислот способен привести к обратному результату. Не стоит заниматься самолечением, даже если уже сданы все анализы и по протоколу исследования видны нарушения нормативного содержания гормона роста.
«Квартет здоровья» — новая концепция современной профилактической медицины
Изложена концепция «Квартета здоровья» как важной составляющей современной профилактической медицины, направленной на увеличение продолжительности и качества жизни. Концепция основывается на понимании патогенетических механизмов клеточного старения и пред
There is a concept of the «Health quartet» as an important component of modern preventive medicine, aimed at increasing the duration and quality of life reported in this article. The concept is a complex metabolic therapy based on an understanding of thepathogenic mechanisms of cellular aging.
В последнее десятилетие особенно возрос интерес к антивозрастной медицине. И это вполне понятно, так как ожидаемая продолжительность жизни населения Земли неуклонно растет и в целом ряде стран уже превышает 80 лет. Соответственно, неуклонно растет и количество возраст-ассоциированных болезней (так называемых болезней цивилизации), а также желание людей как можно дольше оставаться здоровыми, активными и красивыми. Крепкое здоровье, высокая стрессоустойчивость и работоспособность, внешняя привлекательность и свежесть — именно ради этих составляющих биологической молодости люди тратят немалые ресурсы на борьбу со старением.
Сегодня человечество пришло к пониманию, что красота и молодость зависят не только от косметических средств, которые мы используем наружно, ученые доказали — красота идет изнутри. Регулярная физическая активность, рациональное питание с высоким содержанием пищевых волокон и витаминов, отказ от вредных привычек — основа хорошего самочувствия и долголетия. Однако в современном постоянно меняющемся мире этого оказывается недостаточно.
Определение концепции «Kвартет здоровья»
Основываясь на понимании патогенетических механизмов клеточного старения и развития основных болезней цивилизации: ожирения, атеросклероза, артериальной гипертонии и сахарного диабета 2-го типа, мы сформулировали концепцию «Квартета здоровья» — комплексной метаболической терапии. Понятие «метаболическая терапия» подразумевает лечение, направленное в первую очередь на поддержание или восстановление клетки как наименьшей единицы живого, ее физиологических функций, структуры тканей и организма в целом. Термин «метаболическая» подчеркивает характер терапии, направленной на восстановление гормонально-биохимического фона, соответствующего 30–35-летнему возрасту пациента.
Компонентами «Квартета здоровья» являются:
1) половые гормоны (поддержание их физиологического уровня; заместительная гормональная терапия при дефиците половых гормонов);
2) витамин D (поддержание его физиологического уровня, прием препаратов витамина D при выявлении его дефицита);
3) омега-3 полиненасыщенные жирные кислоты (ПНЖК) (постоянный прием);
4) тиоктовая или альфа-липоевая кислота (АЛК) (постоянный прием).
Каждый компонент «Квартета здоровья» обоснован и одинаково важен.
Половые гормоны: источник молодости, красоты и энергии
В современной медицинской литературе часто можно встретить неверное традиционное представление о половых гормонах, согласно которому якобы существуют только «мужские» (андрогены) или только «женские» (эстрогены, прогестерон) половые гормоны, применение которых нецелесообразно, недопустимо и даже опасно у представителей противоположного пола. Мы не согласны с такой постановкой вопроса в принципе! Дело в том, что все половые гормоны (а также витамин D) являются представителями одного гормонального семейства — стероидных гормонов, которые синтезируются, во-первых, из одного биохимического предшественника (7-дигидрохолестерола), во-вторых, имеют общего гормонального «прародителя-прогормона» — прогестерон, а в-третьих, синтезируются по практически одинаковой схеме как у мужчин, так и у женщин, что объединяет все эти гормоны в своеобразную гормональную систему половых стероидных гормонов. В этой связи традиционное деление половых гормонов на «женские» и «мужские» нужно считать ошибочным и некорректным. В организме и мужчин, и женщин происходит природный синтез всех половых стероидных гормонов (прогестерона, андрогенов, эстрогенов), которые крайне необходимы для качественной жизни во все периоды.
Так, эстрогены у обоих полов являются основными регуляторами костного метаболизма, обеспечивая прочность костной ткани и защиту от остеопении/остеопороза. Кроме того, эстрогены у обоих полов являются активными гормонами, отвечающими за познание, память, когнитивность и другие функции центральной нервной системы. У мужчин подавляющее большинство эстрогенов образуется из тестостерона за счет ароматизации, и без этого биохимического процесса тестостерон не оказывает полноценные физиологические эффекты в организме мужчины. Эстрогены у мужчин моделируют либидо и поведение, за которые тоже отвечает тестостерон. Часто можно слышать фразу, что тестостерон — король гормонов и гормон королей! Это так, но у каждого короля должна быть преданная свита, которая поддержит в трудную минуту, обеспечит безопасность короля и не даст королю сделать нечто неподобающее. Так вот именно эстрогены являются такой своеобразной свитой для короля-тестостерона. Кроме того, как и у женщин, эстрогены у мужчин отвечают за процессы гидратации и поддержание тургора кожи, регулируют образование кожного коллагена (эластичность кожи), рост волос, процессы сперматогенеза и т. д. [1, 2].
Известно, что с возрастом уровень половых гормонов (эстрогенов, андрогенов, прогестерона) снижается, проявляясь в конечном итоге состоянием менопаузы у женщин и возрастного дефицита тестостерона (андропаузы) у мужчин (рис. 1). Примерно с 30 лет и далее до конца жизни ежегодно мужчина в среднем теряет около 1,5–2,0% свободного наиболее активного тестостерона. Считается, что мужчины, обладающие изначально более высоким уровнем тестостерона в молодости, имеют больше шансов как можно дольше не испытать проявлений возрастного андрогенного дефицита (ВАД) (рис. 2). Таким образом, в отличие от женщин, у подавляющего большинства которых менопауза возникает в довольно узком временном интервале (45–55 лет), у мужчин такого временного ограничения с физиологической точки зрения нет, поэтому мы говорим об индивидуальных для каждого мужчины потенциальных сроках наступления ВАД [3–5].
Снижение уровня половых гормонов является одним из ключевых моментов запуска и развития процессов старения и возраст-ассоциированных заболеваний. Современные врачи знают, что диагностировать дефицит половых гормонов нужно как можно раньше, не дожидаясь основных проявлений менопаузы или андропаузы. Так, первыми признаками дефицита эстрогенов и прогестерона у женщин являются истончение и сухость кожи и слизистых, появление морщин, ухудшение роста и качества волос и ногтей, «приливы», набор веса, раздражительность, эпизоды депрессивного настроения, появление общей слабости и апатии, болевой синдром. Первыми признаками дефицита андрогенов и у мужчин, и у женщин являются снижение полового влечения, ухудшение половой функции, мышечная слабость, нарушения мочеиспускания.
Заместительная терапия половыми гормонами сегодня хорошо изучена. Обычно терапию симптомов менопаузы у женщин начинают с комбинированных (эстрогены в сочетании с прогестероном) препаратов заместительной терапии. Очень важно подобрать правильный препарат и его дозу. Имеет значение не только количество эстрогенов, но и количество и форма препарата прогестерона, который должен быть максимально метаболически нейтральным и не оказывать иных, кроме прогестагенных, эффектов [5]. На сегодняшний день наиболее безопасной формой препаратов менопаузальной гормональной терапии являются комбинированные препараты, содержащие 17-β-эстрадиол (биоидентичный натуральному эстрадиолу) и дидрогестерон (наиболее метаболически нейтральный гестаген).
Для коррекции андрогенного дефицита используются препараты тестостерона. Cегодня во всем мире лицензировано большое количество лекарственных форм тестостерона для внутримышечного, субдермального (подкожного), трансдермального (накожного), перорального и буккального применения, которые являются одинаково безопасными и эффективными (уровень 1b, степень А) [4].
Правильно подобранная заместительная терапия половыми гормонами должна быть частью общей стратегии поддержания здоровья мужчин с ВАД и женщин в пери- и постменопаузе, включающей также рекомендации относительно образа жизни, диеты, физических упражнений, отказа от курения, когнитивной тренировки и безопасных уровней потребления алкоголя [4, 5].
Витамин D: фундамент антивозрастной метаболической терапии
Традиционные представления о витамине D связаны прежде всего с его ключевой ролью в кальциево-фосфорном обмене и влиянии на минеральную плотность костной ткани [6]. В последнее время произошло обогащение существующих представлений, и сегодня известно, что витамин D является по сути стероидным гормоном, обладающим целым рядом важных эффектов на различные органы и ткани, которые крайне необходимы для обеспечения широкого спектра физиологических процессов и оптимального состояния здоровья человека.
В последние десятилетия было подтверждено участие витамина D и ассоциированных с ним механизмов в профилактике развития раковых трансформаций в различных органах, аутоиммунных состояний и инфекционных заболеваний [7, 8]. Накоплен значительный материал о взаимосвязи дефицита витамина D с ожирением, инсулинорезистентностью, неблагоприятным влиянием на толерантность к глюкозе и развитием сахарного диабета [9, 10].
По сути, достаточный уровень витамина D необходим человеку на протяжении всей жизни: от периода новорожденности до самой глубокой старости, поскольку он регулирует активность крайне важных генов (свыше 1000 генов, локализованных в разных хромосомах, что составляет около 3% всего генома человека), нарушение функции которых закономерно сопровождается низкой продолжительностью и качеством жизни и ускоренным старением человека [11].
Витамин D синтезируется в организме человека самостоятельно из 7-дегидрохолестерола (производного холестерина, 7-DHT) под действием ультрафиолетовых В-лучей (УФ-В) солнечного света или поступает в организм с некоторыми продуктами питания, такими как рыбий жир, масло, яйца, молоко. Витамин D, получаемый из продуктов питания и в виде пищевых добавок, а также образующийся при пребывании на солнце, биологически инертен. Для активации и превращения в активную форму D-гормона [1,25(ОН)2D] в организме должны пройти два процесса гидроксилирования. Таким образом, под термином «витамин D» мы понимаем целую группу биологически активных веществ, куда входят инертный витамин D, получаемый из пищи и синтезированный в коже, промежуточная (транспортная или депо) форма и активный метаболит витамина D (табл. 1).
По данным разных исследований, от 50% до 75% населения Земли страдает от недостатка витамина D разной степени выраженности [12]. Более того, с возрастом происходит снижение уровня витамина D даже у людей, проживающих в регионах с достаточным уровнем инсоляции. Поэтому проблема дефицита витамина D в организме человека носит глобальный характер и приковывает к себе внимание огромного количества специалистов различных направлений.
В группе риска по развитию дефицита витамина D находятся грудные младенцы, пожилые люди, люди с ограниченным пребыванием на солнце (менее двух часов в день), темнокожие, люди с ожирением, с заболеваниями, сопровождающимися нарушением всасывания жиров, а также население стран, расположенных севернее 35-й параллели в северном полушарии (т. е. вся территория России) [13, 14].
Как показали исследования последних лет, для сохранения здоровья необходимо поддерживать в крови уровень витамина D (в виде транспортной 25(ОН)D3 формы) не менее 40 нг/мл. Только достижение такой концентрации 25(OH)D3 позволяет в несколько раз снизить риск развития возраст-ассоциированных заболеваний, таких как остеопороз, сахарный диабет (СД) 2-го типа, различные виды онкологических и аутоиммунных заболеваний, и увеличить продолжительность жизни по сравнению с теми, у кого уровень 25(OH)D3 в крови составляет 25 нг/мл и ниже [15, 16].
Для лечения недостаточности и дефицита витамина D традиционно используются препараты холекальциферола (витамина D3). Схема подбора дозы препарата витамина D3 в зависимости от исходной концентрации 25(OH)D3 приведена на рис. 3. Следует отметить, что применение препаратов витамина D3 является абсолютно безопасным, так как данная форма витамина D является неактивной и подвергается дальнейшему метаболизму в организме до гормона D в зависимости от индивидуальной потребности.
Омега-3: почему у эскимосов нет инфарктов?
В 1956 году профессор Хью Синклер, заинтересовавшийся, почему у гренландских эскимосов практически не бывает сердечно-сосудистых заболеваний, доложил в Оксфорде данные проведенных им исследований и наблюдений, свидетельствующих о том, что причиной столь удивительного парадокса является рацион эскимосов, который состоял исключительно из рыбы и тюленьего жира — натуральных источников омега-3 ПНЖК. Работы Х. Синклера не получили должного признания в свое время, однако проведенные в дальнейшем исследования подтвердили существование «эскимосской легенды» и выявили причину, обуславливающую ее существование.
Действительно, у гренландских эскимосов статистика фиксировала небывало низкую заболеваемость инфарктом миокарда — 2:100 000 населения (для сравнения, в Калифорнии на сегодняшний день этот показатель составляет 280:100 000!), очень редкие случаи возникновения бронхиальной астмы и практически полное отсутствие заболеваемости сахарным диабетом 2-го типа! Проведенный мультифакторный анализ полученных за четверть века данных показал, что причина парадокса заключается в высоком содержании в пищевом рационе омега-3 полиненасыщенных жирных кислот, а именно эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК) [17, 18].
Так началась эра накопления данных о незаменимых омега-3 ПНЖК (ЭПК и ДГК) как основе рациональной терапии, направленной прежде всего на профилактику сердечно-сосудистых заболеваний, а в целом — на профилактику и лечение возраст-ассоциированных заболеваний.
На сегодняшний день существует необходимая доказательная база, достаточная для утверждения, что каждый человек, проживающий в регионе с обедненным содержанием омега-3 ПНЖК в рационе (вся территория России), должен дополнительно к пище принимать препараты, содержащие ЭПК и ДГК для профилактики возраст-ассоциированных заболеваний, неинфекционных хронических заболеваний, увеличения продолжительности и качества жизни в целом [19].
Актуальной дозой для взрослого россиянина является дополнительный к пище постоянный ежедневный прием от 2000 мг омега-3 ПНЖК в расчете на сумму ЭПК и ДГК. Диапазон оптимальных доз для достижения терапевтических целей находится от 3 до 4 г/сут. Максимальной терапевтической дозой является 8 г/сут.
Как можно охарактеризовать показания к назначению препаратов омега-3 ПНЖК? По сути, показанием необходимо считать весь жизненный цикл человека. Действительно, все незаменимые компоненты мы должны получать либо с пищей, либо в виде лекарственных препаратов. Другой альтернативы нет.
Являясь субстратом для производства цитокинов, некоторых гормонов, омега-3 ПНЖК служат сигнальными регуляторными молекулами, участвующими в построении миелиновых оболочек, клеточных мембран, обеспечении их функциональности, регуляции проницаемости, текучести, эластичности, являются активаторами нормального деления стволовых клеток, активаторами синтеза регуляторных белков, отвечают за когнитивные функции и еще десятки разнообразных других.
Показанием для назначения омега-3 ПНЖК являются [19]:
Учитывая, что ЭПК и ДГК относятся к незаменимым жирным кислотам и период полувыведения составляет около 8 часов, мы рекомендуем ежедневный прием суточной дозы в течение дня.
Важными критериями выбора конкретного препарата для назначения и приема являются, кроме стоимости лечения, количество ЭПК и ДПК в капсуле, концентрация этих кислот в капсуле. Согласно нашим наблюдениям и теоретическим обоснованиям целесообразно использовать препараты, концентрация ЭПК + ДГК в которых составляет не менее 50%.
Альфа-липоевая (тиоктовая) кислота: защита от окислительного стресса
Окислительный стресс — это несостоятельность антиоксидантной системы организма, при которой клетки подвергаются воздействию чрезмерных уровней или молекулярного кислорода или его активных форм (АФК) — свободных радикалов. Свободные радикалы — нестабильные атомы и соединения, действующие как агрессивные окислители и в результате повреждающие жизненно важные структуры организма. Свободные радикалы образуются при воздействии неблагоприятных факторов окружающей среды (плохая экология, курение, хроническая интоксикация, УФ-облучение). Кроме того, выработка свободных радикалов может увеличиваться при сахарном диабете и инсулинорезистентности, ожирении, артериальной гипертонии, возрастном снижении половых гормонов как у мужчин, так и у женщин. Также выработка свободных радикалов является неотъемлемой составляющей частью процесса старения [20, 21].
Альфа-липоевая кислота (АЛК) и промежуточный продукт ее обмена — дигидролипоевая кислота — являются одними из самых эффективных эндогенных антиоксидантов [22]. АЛК была впервые выделена в 1951 году L. J. Reed и его сотрудниками из бычьей печени и изначально носила название «витамин N», что подчеркивало ее незаменимость и важность для функции нервной ткани (витамины — незаменимые вещества, поступающие с пищей, N — «невро»). Однако витамином она не является по химической структуре, к тому же в небольшом количестве образуется в организме, что не позволяет отнести ее к абсолютно незаменимым жирным кислотам. Тем не менее, стоит отметить крайне низкое ее содержание в продуктах питания, в то время как в условиях окислительного стресса отмечается повышенный расход АЛК, и ее суточная потребность для взрослого человека достигает около 300 мг в сутки [23].
К сожалению, ее терапевтическая ценность недооценена, а показания к назначению необоснованно сужены. Между тем, исходя из представлений о биохимических свойствах АЛК (табл. 2), истории ее изучения и доказанной эффективности в лечении, в том числе невропатии любой этиологии, показания к ее применению должны быть значительно расширены [24]. Кроме того, АЛК является не только универсальным антиоксидантом, но и повышает эффективность любой другой терапии.
Альфа-липоевая кислота — уникальный полноценный компонент «Квартета здоровья», крайне необходимый при наличии проявлений окислительного стресса. В отсутствии выраженных проявлений окислительного стресса альфа-липоевая кислота также необходима каждому человеку, начиная с 35–40-летнего возраста, поскольку примерно с этого возраста естественная антиоксидантная защита организма начинает ослабевать. Средняя суточная терапевтическая доза АЛК, на наш взгляд, должна составлять 300–600 мг. В терапевтической практике традиционно используются таблетированные препараты АЛК, капсулы с АЛК и в/в инъекции.
Необходимость применения «Квартета здоровья» в качестве основы профилактической и антивозрастной терапии не вызывает сомнений, и основная его задача — не только профилактика и лечение возраст-ассоциированных заболеваний, но и увеличение продолжительности и качества жизни.
Литература
* ФГБОУ ВПО РУДН, Москва
** Клиника профессора Калинченко, Москва
*** ФГБУ НМИРЦ МЗ РФ, Москва
Альтернативные (негормональные) методы лечения менопаузальных расстройств. В помощь врачу-интернисту
Климактерический синдром (КС) — патологическое состояние, возникающее у значительной части женщин в климактерическом периоде. Менопаузальная гормональная терапия (МГТ) признана самым эффективным средством лечения климактерических расстройств. Однако в реа
Climacteric syndrome (CS) is a pathological condition that occurs in a significant part of women in the menopause. Menopausal hormone therapy (MHT) is recognized as the most effective treatment for menopausal disorders. However, in real clinical practice, not all women in the transition due to various reasons can use MHT. Alternative (non-hormonal) treatment methods can be used to alleviate the symptoms of CS. The article describes the main alternative methods of treating CS. It is indicated that a positive effect of these methods on the course of CS to a certain extent may be associated with the placebo effect.
Климактерический синдром (КС) — патологическое состояние, возникающее у значительной части женщин (до 80%) в климактерическом периоде и характеризующееся нервно-психическими, вегетативно-сосудистыми и обменно-трофическими расстройствами [1]. Менопаузальная гормональная терапия (МГТ) является действенной мерой сохранения здоровья женщин в этот сложный период ее жизни. При своевременном назначении МГТ эффективно снижает не только вазомоторные проявления КС, но и риск атеросклероза, ишемической болезни сердца, остеопороза и связанных с ним переломов, улучшает сон, настроение и повышает качество жизни женщины в целом [2, 3].
Однако, несмотря на столь очевидные положительные эффекты МГТ, отношение к этому лечению все еще остается достаточно сдержанным. Причем не только со стороны женщин, имеющих показания для МГТ, но и врачей-интернистов, к которым зачастую в первую очередь обращаются женщины с «терапевтическими» проявлениями КС [4]. Как показал наш анкетный опрос, только 12,5% женщин переходного возраста и 19,6% врачей-интернистов не испытывают сомнений в безопасности МГТ. Причем как у первых, так и у вторых в той или иной мере (с разными акцентами) лидируют одни и те же опасения перед МГТ. Это — увеличение массы тела, рост онкологических рисков, сосудистых осложнений [5].
При непереносимости МГТ, наличии противопоказаний и опасений в отношении безопасности применения гормональных средств остается возможность прибегнуть к методам так называемой альтернативной медицины, которые используются в первую очередь для облегчения симптоматики КС. Чаще всего речь идет о нейровегативных расстройствах – приливах и ночной потливости, которые особенно беспокоят женщину и значительно ухудшают качество ее жизни.
Все существующие на сегодняшний день альтернативные методы лечения по своей эффективности уступают МГТ и, несмотря на многочисленные сообщения об успешном применении отдельных из них, все еще не имеют убедительной доказательной базы, демонстрирующей целесообразность их безусловного внедрения в клиническую практику. Именно поэтому необходимо объяснять женщинам, что альтернативные методы лечения имеют ограниченные доказательства эффективности и безопасности и, как правило, не контролируются медицинскими надзорными органами [3].
Тем не менее отказ от МГТ никак не должен служить поводом для отказа от поиска других — альтернативных (негормональных) — средств, направленных на облегчение симптоматики КС. На наш взгляд, в этих случаях роль врача-интерниста даже может возрасти, так как подбор альтернативных средств лечения предполагает более регулярный и многоплановый мониторинг соматического здоровья, особенно на начальных этапах лечения КС.
Общепринятой классификации альтернативных лекарственных средств, используемых при лечении КС, не существует. Условно среди них мы выделяем [4]:
Фитоэстрогены
Фитоэстрогены — вещества растительного происхождения, функционально (но не структурно) близкие эстрогенам и поэтому способные связываться с теми же рецепторами, что и эстрогены, с той лишь разницей, что действие фитоэстрогенов значительно слабее, но вполне достаточное для того, чтобы облегчить состояние женщины. К основным классам фитоэстрогенов относят [6]:
Наиболее популярными из фитоэстрогенов являются изофлавоны. Лучше других изучены изофлавоны, содержащиеся в красном клевере, который является единственным в природе источником сразу четырех изофлавонов: биоканина A, формононетина, дайдзеина, генистеина. При снижении выработки эстрогенов в перименопаузе изофлавоны в определенной степени компенсируют их дефицит посредством своего эстрогенного действия [7]. Этим эффектом объясняют способность экстрактов красного клевера (Феминал®) одновременно достоверно снижать частоту симптомов КС и улучшать показатели деятельности сердечно-сосудистой системы [8].
И тем не менее, несмотря на большое количество проведенных в течение последних 15–20 лет исследований, опубликованных систематизированных обзоров и результатов метаанализов, указывающих на способность фитоэстрогенов снижать выраженность климактерических проявлений, отношение к ним как к эффективным средствам лечения КС остается неоднозначным [9].
Фитогормоны
Фитогормоны — разнородная группа природных нестероидных растительных соединений, которые не оказывают прямого воздействия на эстрогенные рецепторы, но обладают эстрогеноподобным эффектом и положительно влияют на симптомы менопаузы. Есть основания считать, что эти вещества реализуют свой эффект за счет влияния на соотношение нейротрансмиттеров в гипоталамусе, гиппокампе, коре головного мозга и других структурах центральной нервной системы (ЦНС). Это, в частности, способствует стабилизации центров терморегуляции и вегетативной нервной системы. В настоящее время особый интерес вызывают препараты, являющиеся экстрактами из корневища цимицифуги кистевидной (клопогон кистевидный, Cimicifuga racemosa, Black cohosh), обладающие положительными клиническими эффектами в отношении вазомоторных и психоэмоциональных симптомов, костного метаболизма и не оказывающие негативного воздействия на сердечно-сосудистую систему, эндометрий и молочные железы [10]. Полагают, что основной терапевтический эффект экстрактов корневища цимицифуги обусловлен наличием в нем достаточных количеств тритерпеновых гликозидов [11], обладающих, по-видимому, определенным тропизмом к структурам ЦНС, которые задействованы в реализации нейровегативных проявлений КС. В частности, есть основания считать, что активные компоненты экстракта цимицифуги кистевидной связываются с рецепторами серотонина. Полагается [9], что такое взаимодействие объясняет положительное влияние препаратов на основе цимицифуги на психосоматические и вазомоторные проблемы, обнаруженные в плацебо-контролируемых рандомизированных исследованиях.
Учитывая отдельные сообщения о гепатотоксическом эффекте препаратов, содержащих цимицифугу, у пациенток с заболеваниями печени, такие препараты следует использовать с осторожностью. Рекомендуется использовать стандартизованные и уже изученные препараты, например, экстракт цимицифуги кистевидной BNO1055, который входит в состав препарата Климадинон® [10].
Нейротропные аминокислоты, мелатонин и препараты с мелатониноподобным действием
Аминокислоты и продукты их метаболизма могут выполнять роль нейромедиаторов в нервной системе, воздействовать на различные процессы, контролируемые ЦНС: определение величины болевого порога, настроение, структура сна [12]. К нейротропным аминокислотам можно отнести глицин, глутаминовую кислоту, триптофан, аланин и ряд других.
Особенно часто в качестве аминокислоты, способной заметно улучшить симптоматику при КС, упоминается аминокислота аланин, а именно β-аланин, в которой аминогруппа находится в β-положении. Эта аминокислота используется или в качестве самостоятельного лекарственного средства Клималанин® [13] или в составе мультикомплексных биологически активных добавок МЕНСЕ® [14]. Один из механизмов действия β-аланина реализуется посредством
взаимодействия с глициновыми рецепторами, что способствует быстрой нормализации активности терморегуляторной зоны гипоталамуса. Оказывая более длительное воздействие на глициновые рецепторы, чем сам глицин, данная аминокислота обладает и дополнительными свойствами — способствует улучшению когнитивных функций (памяти и концентрации внимания). Аминокислота β-аланин входит в состав естественных белков карнозина и ансерина, а также является частью пантотеновой кислоты (витамин В5), которая входит в состав кофермента А. Прием β-аланина постепенно увеличивает уровень карнозина в мышцах, что приводит к повышению ресурсов мышечной системы и уменьшению общей утомляемости. В итоге долговременная обеспеченность карнозином нормализует работу гладкой мускулатуры сосудов и тем самым способствует нормализации терморегуляции организма [11].
Важную роль в процессах, связанных с климактерическими проявлениями, играет аминокислота триптофан, которая является основным источником серотонина и мелатонина [14, 15], оказывающих многогранное действие на эмоциональный и нейровегетативный компоненты ранних менопаузальных расстройств.
Последние годы ознаменовались целым рядом открытий в области биоритмологии, к числу которых относится установление связи между репродуктивной функцией и состоянием эпифиза, секретирующего мелатонин. Доказано, что женщины в постменопаузе имеют более низкие концентрации мелатонина в крови, чем женщины в перименопаузе. Чем позже наступает пик секреции мелатонина в перименопаузе, тем выше уровень тревожности, а чем длительнее секреция мелатонина, тем лучше качество жизни женщины [16]. Дефицит эндогенного мелатонина приводит к нехватке гонадоингибина, что запускает через сложную систему нейронов возникновение приливов [17]. Применение мелатонина (Мелаксен®) в течение 3 мес при КС у женщин в пери- и постменопаузе обеспечивает существенное улучшение их самочувствия (снижается частота приливов, восстанавливается качество сна, уменьшается чувство усталости) [18]. Некоторые авторы рекомендуют использовать мелатонин как первую ступень лечения климактерических расстройств еще до начала МГТ [19].
Подобными мелатонину эффектами, судя по всему, обладает комплекс полипептидов эпифиза, синтезированный отечественными учеными и успешно апробированный при лечении 450 женщин с КС. Преимуществами данного препарата (Пинеамин®) являются быстрое купирование нейровегетативных симптомов КС, а также отсутствие какой-либо токсичности [20]. Считается, что комплекс полипептидов эпифиза активирует синтез мелатонина и серотонина и через особую систему нейронов приводит к снижению интенсивности вегетативных проявлений КС [17].
Нейроактивные фармакологические средства
В большинстве рекомендаций последних лет указывается на возможность применения для лечения вазомоторных симптомов таких средств, как селективные ингибиторы обратного захвата серотонина (СИОЗС) (циталопрам, флуоксетин и пароксетин), селективные ингибиторы обратного захвата серотонина и норадреналина — СИОЗСН (венлафаксин), гипотензивный препарат клонидин (α2-адреномиметик) и антиконвульсант габапентин [1, 2, 10].
В целом при использовании нейроактивных средств нужно помнить об их потенциальных побочных эффектах (тошнота, чрезмерная седация, сонливость), необходимости подбора дозы (титрования) и постепенного ее снижения при отмене терапии, за исключением современных СИОЗС, которые, как правило, применяются по одной таблетке в сутки [10].
Из всех перечисленных нейроактивных средств только СИОЗС пароксетин одобрен FDA для лечения вазомоторных симптомов. По данным В. Е. Радзинского, А. А. Костроминой (2017), пароксетин (Паксил®) в дозе 10 мг/сут особенно эффективен при облегчении психологических и вазомоторных симптомов КС (на 57% снижает проявления тревоги и депрессии, на 61% уменьшает вазомоторную симптоматику), в меньшей степени улучшает физическое состояние (на 33%) и не влияет на сексуальную дисфункцию [21].
В последние годы стали появляться сведения, демонстрирующие целесообразность использования при лечении КС комбинаций нейроактивных средств с препаратами из других групп альтернативной терапии. В частности, есть указания на эффективность комбинации атипичного бензодиазепина тофизопама (Грандаксин®) с препаратом (Феминал®) на основе сухого экстракта красного клевера. Суммация эффектов препаратов этой комбинации способствует снижению частоты, выраженности приливов и других нарушений со стороны ЦНС при одновременном улучшении состояния слизистых оболочек влагалища, мочевыводящих путей и обменных процессов в целом [22].
Прочие средства
Кроме вышеупомянутых существует еще множество других средств, используемых для облегчения симптоматики КС. Не у всех из них в полной мере известны механизмы действия, или они носят предполагаемый характер. Некоторые биологически активные добавки состоят из нескольких компонентов (например, Эстровэл®, Климактоплан® Н), каждый из которых в той или иной мере сам по себе может быть полезен при КС [23, 24]. К этой группе можно отнести различные витаминно-минеральные комплексы, многокомпонентные биологически активные добавки, гидролизат плаценты, биорегулирующие средства и некоторые другие [9, 21, 23, 25, 26].
Потенциальную пользу при КС могут оказать такие нелекарственные средства, как йога, дыхательные техники, иглоукалывание и ряд других. Хоть они и не продемонстрировали достоверную эффективность, но способны улучшить качество жизни пациенток [27].
Есть указания на благотворное влияние на проявления КС различных естественных и преформированных физических факторов [28, 29].
Однако эти и другие, ранее перечисленные, альтернативные методы лечения КС при всей их кажущейся клинической эффективности имеют один общий недостаток — отсутствие надежной доказательной базы [30, 31]. Что, безусловно, связано со сложностью организации соответствующих исследований. В том числе направленных на сопоставление эффектов при КС предлагаемых методов альтернативной терапии с результатами МГТ, целесообразность применения которой у женщин в климактерическом периоде считается доказанной [2, 3, 10].
Эффект плацебо при использовании альтернативных методов лечения КС
Нельзя исключить, что популярность и «живучесть» тех или иных альтернативных методов лечения климактерических расстройств в определенной мере обусловлена эффектом плацебо, к которому женщин с КС, судя по всему, весьма чувствительны. На такой вывод ориентируют результаты наблюдения исследователей из США за 544 женщинами, страдающих КС [32]. Было установлено, что имитация лечения КС позволяет более чем вдвое снизить частоту приливов. Причем эффекту плацебо в большей мере были подвержены женщины с исходно более выраженной симптоматикой. При этом исследователи также обнаружили, что прием плацебо после терапевтического курса приема препаратов, снижающих частоту и интенсивность климактерических симптомов, позволяет дольше сохранять достигнутый эффект лечения от этих препаратов. В этой связи отметим, что при использовании тех же, уже упомянутых, нейротропных средств (СИОЗС и СИОЗСН) 25% «успеха» в плане снижения интенсивности приливов связывают исключительно с эффектом плацебо, тогда как сами препараты привносят лишь дополнительные 15–25% в общую сумму положительных результатов [31].
Как показывает наш опыт, нельзя исключить, что на выраженность эффекта плацебо при лечении КС в определенной мере оказывают влияние два фактора — ценовой (стоимость лечения) и временной (когда и на какой срок назначено лечение). Поиск альтернативных средств лечения КС обычно начинается с относительно дешевых средств, при их неэффективности прибегают к более дорогостоящим средствам. При увеличении стоимости альтернативных средств мы предполагаем усиление эффекта плацебо. В свою очередь на последовательный подбор эффективного средства для КС уходит определенное время (месяцы, а то и год), которое для фазы нейровегетативных (вазомоторных) расстройств, безусловно, имеет значение [33]. Ведь очевидно, что и в естественных условиях, без медикаментозного вмешательства, выраженность вазомоторных расстройств с течением времени снижается. Поэтому не удивительно, что нередко самым эффективным средством лечения климактерических расстройств оказывается то, что явилось самым дорогим и последним из использованных женщиной препаратов альтернативной терапии.
Таким образом, эффект плацебо при применении альтернативных средств лечения КС играет если не определяющую, то весьма существенную роль.
Заключение
На сегодняшний день МГТ признана самым эффективным средством лечения климактерических расстройств. Однако в реальной клинической практике не все женщины переходного возраста в силу различных причин могут ее использовать. В этих случаях для облегчения симптомов КС можно прибегнуть к альтернативным (негормональным) методам лечения. Существует большой перечень этих методов, в том числе основанных на использовании природных (преимущественно растительных) и синтетических лекарственных средств, а также естественных и преформированных физических факторов. В литературе можно встретить немало указаний в пользу эффективности отдельных методов альтернативной терапии КС. Немало и в то же время недостаточно, чтобы делать вывод об их безусловной эффективности.
И тем не менее наблюдаемые, пусть и не всегда очевидные, позитивные эффекты альтернативной терапии могут иметь благотворное влияние на общее самочувствие женщины. В столь непростое для нее время зачастую сам факт медицинского вмешательства, заинтересованное участие со стороны врачей в преодолении климактерических расстройств, в том числе путем привлечения методов альтернативной терапии, способны значительно облегчить состояние женщины. По всей видимости, этим методам лечения в особой мере свойственен эффект плацебо, что, в принципе, не умаляет их достоинств.
Таким образом, альтернативные (негормональные) методы лечения менопаузальных расстройств должны рассматриваться в качестве дополнительного инструмента, способного улучшить состояние женщины, страдающей КС и по тем или иным причинам не использующей МГТ.
Литература
* ГАУ ДПО ИУВ Минздрава ЧР, Чебоксары
** ООО МЦ «Айболит М», Чебоксары
Альтернативные (негормональные) методы лечения менопаузальных расстройств. В помощь врачу-интернисту/ И. В. Мадянов, Т. С. Мадянова
Для цитирования: Лечащий врач № 3/2020; Номера страниц в выпуске: 26-29
Теги: женщины, фитоэстрогены, фитогормоны, мелатонин, аминокислоты
Менопаузальная гормональная терапия при отдельных заболеваниях терапевтического профиля
В статье представлены современные подходы к применению менопаузальной гормональной терапии (МГТ) при отдельных заболеваниях терапевтического профиля. Показано, что при рациональном подборе МГТ она может успешно использоваться практически при всех заболева
The article presents modern approaches to the use of menopausal hormone therapy (MHT) in certain diseases of therapeutic profile. It is shown that, in rational choice of MHT, it can be successfully used almost in all diseases of therapeutic profile.
Менопаузальная гормональная терапия (МГТ) является действенной мерой сохранения здоровья женщин зрелого возраста [1, 2]. Решение о проведении МГТ должно приниматься хорошо информированной женщиной при участии гинеколога и других специалистов, среди которых важная роль отводится терапевту [3].
К моменту начала перименопаузы женщина может иметь хронические заболевания, и возрастная гормональная перестройка способна отразиться на их течении, а также спровоцировать манифестацию новых патологий. Сведения относительно влияния МГТ на течение внутренних болезней носят разрозненный характер и не всегда доступны терапевтам и врачам общей практики. Для того чтобы в какой-то мере восполнить этот пробел, мы сочли целесообразным осветить данные литературы касательно применения МГТ при отдельных заболеваниях терапевтического профиля.
МГТ и остеопороз
Постменопаузальный остеопороз (ОП) — одно из немногих заболеваний, при котором благотворное влияние МГТ неоспоримо [3]. В возрасте 50–60 лет, или в течение 10 лет после наступления менопаузы («терапевтическое окно»), преимущества МГТ с наибольшей вероятностью перевешивают какой-либо риск, а потому МГТ в этих временных рамках может рассматриваться в качестве терапии первой линии ОП [4]. МГТ снижает частоту всех видов переломов, включая переломы позвонков и бедра, причем даже у женщин, не имеющих высокого риска переломов [5]. Несмотря на то, что эффективность МГТ тем выше, чем ближе ее старт к срокам начала менопаузы, она способна предотвращать переломы в любом возрасте, то есть и в более старших группах [6]. Однако в возрасте 60–70 лет серьезно возрастают риски, связанные с МГТ [7].
МГТ и остеоартроз
В менопаузальном периоде существеннее возрастает частота развития остеоартроза (ОА), а само заболевание характеризуется менее благоприятным клиническим течением [8]. Экспериментальные [9] и клинические [10] данные указывают на наличие у эстрогенов четкого и многопланового хондропротективного эффекта [11]. Назначение эстроген-гестагенной МГТ женщинам с ОА приводит к купированию или снижению болевого синдрома, замедлению прогрессирования заболевания [11, 12]. Причем этот эффект более отчетлив для коленных суставов, чем тазобедренных [12]. Убедительным свидетельством позитивного влияния МГТ на течение ОА являются данные крупного эпидемиологического исследования, показавшие снижение на 45% операций на суставах у женщин, принимавших МГТ [13].
МГТ и ревматоидный артрит
Распространенность ревматоидного артрита (РА), также как и ОА, повышается в постменопаузе, однако влияние МГТ на его течение не столь однозначно [14, 15]. Несмотря на то, что пока не получено достоверных сведений о позитивном влиянии МГТ на течение РА, существует устойчивое мнение, что применение этого лечения при данном заболевании вполне оправдано. Указывается, что МГТ не только предотвращает снижение минеральной плотности костей, но и улучшает при РА трофику мышц, связочного аппарата, деятельность центральной нервной системы, что приводит к повышению скорости психомоторных реакций, нормализации центральной интеграции поступающих извне сенсорных импульсов (улучшается координация движений, снижается риск падений) и нормализации общего самочувствия пациенток [15].
МГТ и системная красная волчанка
Системная красная волчанка (СКВ) и средства, используемые для ее терапии (глюкокортикоиды, циклофосфамид и др.), могут обусловить раннюю менопаузу [16], что в сочетании с множеством других факторов делает женщину с СКВ особо подверженной ОП [16, 17]. В этих условиях назначение МГТ выглядит, казалось бы, оправданным [18]. Однако следует учитывать, что МГТ при СКВ может увеличить сердечно-сосудистые риски и вероятность венозных тромбоэмболических осложнений. Поэтому МГТ, особенно пероральные эстрогены, не следует назначать женщинам с активной стадией болезни и при наличии антифосфолипидных антител. МГТ рекомендуется использовать только у пациенток вне активной стадии болезни, а чтобы снизить ее влияние на свертываемость крови, эстрогенный компонент МГТ рекомендуется вводить трансдермально [14].
МГТ и хроническая обструктивная болезнь легких
Указывается, что у женщин с хронической обструктивной болезнью легких (ХОБЛ) в пре- и менопаузальном периодах обострение заболевания длится дольше и протекает тяжелее, чем у женщин вне менопаузы. С менопаузой связано ухудшение мукоцилиарного клиренса, мукостаз в бронхах, угнетение клеточного и гуморального иммунитета, способствующее колонизации дыхательных путей микроорганизмами [19]. МГТ в этих случаях обеспечивает улучшение течения ХОБЛ. Показано, что комбинированная МГТ, включающая эстрадиол-17β (Э17β) 2 мг и дидрогестерон 10 мг, у женщин с ХОБЛ в сочетании с сахарным диабетом (СД) снижает содержание провоспалительных цитокинов в бронхоальвеолярной лаважной жидкости и в сыворотке крови. МГТ оказывает благоприятное влияние на адаптивный иммунитет за счет нормализации иммуноглобулинов разных классов [20].
МГТ и бронхиальная астма
Несмотря на большое количество исследований, не совсем ясно, почему бронхиальная астма (БА) возникает чаще у женщин и в чем причина такого феномена, как «поздняя БА» [21]. Менопаузальная БА часто характеризуется более тяжелым течением и плохим ответом на лечение [22, 23].
Считается, что эстрогены (особенно синтетические) способны ухудшить течение БА [24, 25], тогда как комбинированная МГТ с включением в схему прогестагенов риск БА не повышает [26]. Поэтому при БА рекомендуется применять натуральные эстрогены с обязательной комбинацией их с прогестагенами. Как показано на примере использования у женщин с БА комбинации Э17β + дидрогестерон, такой подход вполне оправдан. МГТ в этом режиме не только хорошо переносится, но и способствует предупреждению обострений БА, уменьшению дозы ингаляционных и системных глюкокортикостероидов [27].
МГТ и патология печени
К абсолютным противопоказаниям МГТ относятся острые гепатиты и опухоли печени [1]. Что касается хронических заболеваний печени, то под контролем показателей ее функции МГТ при них считается вполне допустимой [28].
Из всех патогенетических типов повреждений печени (цитолитический, холестатических, фибротический и сосудистый) для МГТ более характерен холестатический. Считают, что холестаз в большей мере провоцирует эстрогенный компонент МГТ, принимаемый перорально [29]. С другой стороны, при вирусном гепатите С тот же эстрогенный компонент оказывает антифибротическое действие, а потому применение МГТ при этой патологии может оказать позитивный эффект [30, 31].
Холестаз возникает не у всех женщин, и его можно избежать. В частности, путем параллельного назначения с МГТ препаратов урсодезоксихолевой кислоты (УДХК). Показано, что «подключение» к циклической МГТ препарата УДХК (в дозе 8 мг/кг массы тела) не только предотвращает отрицательное влияние гормональных средств на печень, но и дает женщинам, получавшим такую схему лечения в течение года, дополнительные преимущества. Комбинированное применение МГТ и УДХК приводило к выраженной положительной динамике в липидном спектре, нормализации печеночных показателей, включая УЗИ-параметры, обеспечивало устойчивую тенденцию к снижению массы тела и, как результат, значимое улучшение основных шкал, характеризующих качество жизни [32].
При прочих равных условиях назначение парентеральных форм препаратов (особенно эстрогенного компонента), несомненно, более предпочтительно для печени, чем пероральный прием [33]. В этих случаях удается избежать эффекта «первичного прохождения» через печень [14] и, следовательно, уменьшить эстрогенную «нагрузку» на гепатоциты [34].
МГТ и желчекаменная болезнь
При назначении МГТ врачи должны помнить об увеличении риска развития у женщин желчекаменной болезни (ЖКБ) [35, 36]. Согласно данным ведущих отечественных гастроэнтерологов, ее применение увеличивает риск развития ЖКБ в 3,7 раза [37]. Важно подчеркнуть, что риск ЖКБ ощутимо ниже при трансдермальном способе использования эстрогенного компонента МГТ [14].
В настоящее время показания к медикаментозной или хирургической профилактике камнеобразования в период МГТ отсутствуют [35], а сама ЖКБ является относительным, а не абсолютным противопоказанием для ее проведения [1].
МГТ и заболевания кишечника
Биодоступность компонентов МГТ при пероральном приеме во многом зависит от их абсорбции в тонкой кишке и первичного метаболизма в слизистой оболочке кишечника [28]. При заболеваниях кишечника возможно неполное всасывание препарата, а потому для достижения клинического эффекта могут потребоваться более высокие дозы. Пациентки иногда могут не отвечать на пероральную МГТ [38]. В таких случаях более предпочтительным считается трансдермальный путь введения препаратов МГТ, в частности при болезни Крона [14].
МГТ и артериальная гипертензия
Эстрогены вызывают вазодилатацию и снижение артериального давления (АД) посредством влияния на синтез оксида азота, а также стимулируя открытие кальциевых каналов в клеточных мембранах гладкомышечных клеток сосудов [39, 40]. Кроме того, эстрогены являются естественными ингибиторами ангиотензинпревращающего фермента [41], их снижение способствует повышению тонуса симпатической нервной системы [42].
Дефицит эндогенного прогестерона также вносит свой вклад в формирование артериальной гипертензии (АГ). Прогестерон обладает свойством снижать тонус артериол, уменьшать реабсорбцию ионов натрия в почках, блокировать медленные кальциевые каналы [41]. Прогестерон рассматривают в качестве естественного антагониста альдостерона, который обладает высоким сродством к минералокортикоидным рецепторам, широко представленным в жировой ткани [43].
Имеется положительный опыт использования при АГ комбинации Э17β 1 мг и дидрогестерона 10 мг в циклическом режиме [44] и комбинации Э17β 1 мг и дроспиренона 2 мг в непрерывном режиме [42, 45, 46].
Учитывая, что пероральный прием эстрогенов иногда способен за счет первичного пассажа через печень активировать ренин-ангиотензивную систему, этот способ доставки эстрогенов не рекомендуется использовать у женщин с АД выше 170/100 мм рт. ст. В таких случаях отдается предпочтение трансдермальным формам эстрогенов [1]. Этот способ более безопасен и весьма при этом эффективен. В частности, результаты суточного мониторирования АД в рандомизированном двойном слепом исследовании убедительно показали, что трансдермальный эстрадиол снижает уровень систолического и диастолического АД и способствует восстановлению нормальной амплитуды циркадного ритма АД у женщин с умеренной АГ [47].
МГТ и ишемическая болезнь сердца
МГТ способна устранять возникающие в менопаузальном переходе обменные и вегетативные сдвиги и корректировать начинающиеся изменения со стороны сердечно-сосудистой системы [48]. С помощью сцинтиграфических методик показано, что МГТ улучшает микроциркуляцию и метаболизм миокарда [49].
Доказано, что терапия эстрогенами может оказывать кардиопротективное действие, если она начата в период, близкий ко времени наступления менопаузы [50], и может причинять вред, если она начата более чем через 10 лет после менопаузы [51]. Поэтому не рекомендуется с целью первичной профилактики ишемической болезни сердца начинать МГТ в возрасте старше 60 лет [2]. При комбинированной терапии (эстрогены + прогестагены) в сравнении с монотерапией эстрогенами кардиопротективные эффекты выглядят скромнее, но демонстрируют сходную тенденцию [1].
Считается, что вклад МГТ в снижение смертности у женщин существенно выше, чем применение гиполипидемических средств и ацетилсалициловой кислоты [43].
МГТ и инфекции мочевых путей
Одной из причин инфекций мочевых путей (ИМП) у женщин в пре- и постменопаузе является дефицит эстрогенов и связанная с ним урогенитальная атрофия [52], проявления которой принято объединять в генитоуринарный менопаузальный синдром (ГУМС) [1]. ГУМС такой же характерный признак климакса, как и приливы жара [53]. Разница состоит в том, что приливы со временем могут постепенно исчезнуть, тогда как проявления ГУМС без лечения неуклонно прогрессируют [54].
Применению локальных эстрогенов отводят ведущую роль в профилактике рецидивирующей ИМП у женщин в постменопаузе [55]. Эстрогены обеспечивают снижение рН влагалища, тем самым способствуя нормализации микрофлоры, и предотвращают рецидивы ИМП [56]. Рекомендуется использовать вагинальные эстрогены столь продолжительно, сколько это будет необходимо для снижения симптомов, поскольку они крайне редко вызывают неблагоприятные эффекты [55]. Причем препараты эстриола можно назначать и в возрасте старше 60 лет [1].
МГТ и патология щитовидной железы
Патология щитовидной железы (ЩЖ) — одна из самых частых у женщин в пери- и постменопаузе [57], и нарушение ее функции ассоциировано с клинически менее благоприятным течением климакса [58–60].
Однако ни нарушения функции, ни наличие узлов в ЩЖ не являются противопоказанием к назначению МГТ. Все определяется конкретной клинической ситуацией.
При гипотиреозе необходимо учитывать, что терапия эстрогенами способствует увеличению содержания тироксинсвязывающего глобулина и уменьшению концентрации свободных фракций тиреоидных гормонов, а потому МГТ может привести к декомпенсации гипотиреоза и потребовать коррекции дозы L-тироксина в сторону увеличения [14]. При тиреотоксикозе МГТ может проводиться при легкой и средней тяжести заболевания, но после достижения эутиреоза. При хирургическом лечении тиреотоксических зобов МГТ может назначаться после операции [60].
Имеющиеся данные литературы дают основания считать, что у женщин с эутиреоидным узловым зобом ни монотерапия эстрогенами [61], ни комбинированная МГТ (Э17β 1 мг + дроспиренон 2 мг) [62] не оказывают отрицательного влияние на ЩЖ. Вместе с тем МГТ в этих случаях может способствовать повышению минеральной плотности костной ткани как в трабекулярных, так и в кортикальных костных структурах [63], что весьма актуально для женщин с патологией ЩЖ.
МГТ и сахарный диабет
В настоящее время СД не является противопоказанием к МГТ, а общие рекомендации к использованию МГТ у данной категории женщин не отличаются от таковых для здоровых сверстниц [64]. Перед началом МГТ необходимо добиваться достижения компенсации СД, в противном случае можно нивелировать положительное влияние этой терапии, в том числе эстрогенов, на сердечно-сосудистую систему [65].
При СД чаще, чем обычно, возникает необходимость прибегать вместо перорального к трансдермальному способу доставки эстрогенов (для минимизации рисков), а также к более активному использованию местных (интравагинальных) форм эстрогенов [60].
Другой особенностью МГТ у больных СД является необходимость тщательного выбора прогестагенного компонента. Предпочтение отдается метаболически нейтральным прогестагенам — микронизированному прогестерону, дидрогестерону, дроспиренону, тогда как другие прогестагены, обладая остаточными андрогенными и/или глюкортикоидными эффектами, могут противодействовать повышению холестерина липопротеидов высокой плотности и усугублять инсулинорезистентность [1].
МГТ и ожирение
В последние годы получены доказательства того, что МГТ не только не провоцирует дополнительный набор массы тела, но даже способна его предотвращать [66]. Накопление абдоминальной жировой массы в менопаузальном периоде ослабляется на фоне терапии эстрогенами, при этом уменьшается общая жировая масса, улучшается чувствительность к инсулину и снижается частота развития СД 2 типа [2]. Как и у больных СД 2 типа, при ожирении (ОЖ) предпочтение отдается трансдермальным формам эстрогенов [67]. Этот способ введения эстрогенов предотвращает повышение уровней в крови триглицеридов и С-реактивного белка, а также способствует снижению инсулинорезистентности [68].
При ОЖ нежелательно назначать препараты с остаточной андрогенной и глюкокортикоидной активностью [64], предпочтение также, как и при СД 2 типа, отдается метаболически нейтральным прогестагенам — дидрогестерону, микронизированному прогестерону и дроспиренону [64, 65]. Включение последнего в комбинированную МГТ при ОЖ выглядит особенно привлекательным из-за наличия у дроспиренона четкого антиминералокортикоидного эффекта [1], способствующего снижению АД и выраженности абдоминального ОЖ [69]. Длительное (от 4,8 до 5,7 года) включение этого прогестагена в непрерывную комбинированную (Э17β 1 мг + дроспиренон 2 мг) МГТ у женщин с ранней постменопаузой наряду с уменьшением выраженности абдоминального ОЖ способствовало улучшению углеводного обмена, снижению инсулинорезистентности и вероятности новых случаев СД 2 типа [70].
МГТ пациенткам с индексом массы тела более 40 кг/м 2 не проводится до тех пор, пока масса тела не будет снижена на 10% от исходной [64]. Однако, как показывает наш клинический опыт, эта категория женщин далеко не всегда проявляет достаточных усилий по соблюдению диеты и других рекомендаций врача и, в большей части, относится к категории так называемых «едоков-демагогов» [143], что ограничивает применение у них МГТ.
Заключение
Таким образом, при рациональном подборе МГТ может успешно использоваться практически при всех заболеваниях терапевтического профиля. При этом важно придерживаться международных [2] и отечественных [1] ключевых документов, регламентирующих проведение МГТ у женщин зрелого возраста.
Литература
* ГАУ ДПО ИУВ МЗ ЧР, Чебоксары
** ООО МЦ «Айболит М», Чебоксары
Менопаузальная гормональная терапия при отдельных заболеваниях терапевтического профиля/ И. В. Мадянов, Т. С. Мадянова
Для цитирования: Лечащий врач № 3/2018; Номера страниц в выпуске: 50-54
Теги: женщины, менопауза, эстрогены, остеопороз, ревматоидный артрит
Лечение гормональных нарушений
В нашем организме более 60 гормонов, все из них выполняют определенную функцию. И каждый месяц происходят циклические гормональные изменения, которые влияют на работу репродуктивной системы и всего организма в целом.
Прием акушера-гинеколога (врач высшей категории) 2 500 руб.
Прием врача-гемостазиолога 2 600 руб.
Бывают случаи, когда баланс гормонов нарушается, тогда речь идет о гормональном сбое. Несмотря на кажущуюся безобидность, подобные нарушения могут серьезно повлиять на самочувствие пациента, а также спровоцировать развитие различных заболеваний, в том числе, и онкологии.
Причины гормональных нарушений
Существует огромное множество причин, которые могут объяснить сбои в организме. Среди наиболее распространенных:
Симптомы нарушения гормонального баланса
Сбои имеют следующие признаки:
У женщин о наличии гормональных нарушений дополнительно могут свидетельствовать следующие симптомы:
Диагностика и лечение
Диагностика патологии заключается в консультации у гинеколога и эндокринолога, сборе анамнеза и прохождении ряда процедур. Чаще всего пациенту назначают сдачу крови на определенные гормоны. Исследуют следующие показатели:
После обследования назначается лечение гормональных нарушений, направленное на корректировку количественных показателей. Чаще всего используются следующие методы:
Обращение в нашу клинику
Наша Международная клиника Гемостаза занимается лечением гормонального нарушения у женщин и мужчин. Врачи медцентра – кандидаты и доктора медицинских наук, специалисты более с чем 10-летним опытом в терапии различных эндокринных и репродуктивных проблем.
Мы гарантируем грамотную диагностику и эффективное устранение вашей проблемы. Обратившись к нам, вы сможете избавиться от самых тяжелых гормональных сбоев и наладить свою жизнь в максимально короткие сроки.
Будем ждать вас в нашей клинике по адресу: г. Москва, м. Арбатская / Кропоткинская, Большой Афанасьевский пер., 22. Для записи воспользуйтесь онлайн-формой на сайте или позвоните нам по номеру: +7 (495) 106-91-83.
Медицинский центр «XXI век» был основан в 1999 году
В настоящее время в группе компаний «Медицинский центр «XXI век» работают детские и взрослые врачи: педиатры, терапевты, кардиологи, аллергологи, гастроэнтерологи, гинекологи, дерматологи, логопеды, неврологи, нефрологи, ортопеды, отоларингологи (ЛОР-врачи), офтальмологи, психотерапевты, реабилитологи, стоматологи, травматологи, урологи, хирурги, эндокринологи: всего более 600 врачей разных специальностей.
На дому и амбулаторно нашими специалистами оказывается полный комплекс медицинских услуг: диагностика, все виды анализов, вакцинация, реабилитация, сестринский уход, капельницы на дому, массаж, физиотерапия, стоматология. Работает цифровой рентген. В Стационарзамещающем операционном комплексе (СОК) выполняется широкий спектр хирургических, урологических, гинекологических, травматологических операций из разряда day case surgery (хирургия одного дня).
Амбулаторные отделения открыты для пациентов каждый день с 8:00 до 22:00, включая выходные и праздники.
Для удобства пациентов, все возможные медицинские услуги могут быть оказаны на дому, наши специалисты выезжают во все районы Санкт-Петербурга и Ленинградской области.
Щитовидная железа: гормоны, симптомы заболевания у женщин и мужчин
В статье мы расcкажем:
Щитовидная железа занимается активной выработкой гормонов в организме человека. Вся ее работа является основой обмена веществ. Без выделяемых тироидных гормонов человек не мог бы нормально развиваться и расти. Щитовидная железа оказывает огромное влияние на иммунитет. Именно поэтому важно поддерживать этот орган в нормальном состоянии.
Подробная информация
«Щитовидка» оказывает влияние на работу всех органов. По внешнему виду железа представляет собой 2 доли, которые соединены специальным перешейком. Орган размещается на уровне 3 кольца трахеи, спереди. Его форма отчетливо напоминает бабочку.
Ученые дали такое название не просто так. Железа по внешнему виду и своим защитным характеристикам напомнила им щит. Орган очень мал, поэтому в здоровом состоянии практически незаметен для человеческого глаза.

В чем важность щитовидной железы
«Щитовидка» — один из самых важных органов в эндокринной системе. Она вырабатывает тиреоидные гормоны, которые активно участвуют во всей жизнедеятельности организма. Например, регулируют артериальное давление, частоту сердечных сокращений и уровень дыхания. Железа участвует в процессе замены сосудов и клеток на новые. Можно сделать вывод, что орган является главным в метаболизме организма.
Основные гормоны щитовидной железы
Для нормального функционирования щитовидной железе нужен тирозин и йод. Они поступают в организм человека вместе с пищей.
Железа активно вырабатывает следующие йодсодержащие гормоны:
Также стоит упомянуть кальцитонин, который задействован в процессе обмена кальцием. От него зависит уровень скорости обмена веществ в костях.
Самые распространенные болезни «щитовидки»
Все заболевания условно подразделяются на следующие виды:
Заподозрить нарушение в органе можно при сдаче анализов на гормоны щитовидной железы. Если есть подозрения на опасное заболевание, то дополнительно делают УЗИ и биопсию тканей на пораженном участке.
Характерные симптомы заболеваний
Гипотиреоз
Данный недуг возникает при снижении уровня гормонов. У человека начинаются проблемы с обменом веществ, а жизненная энергия стремительно иссекает.
Гипотиреоз выделяется следующими симптомами:
Лечение происходит с помощью медикаментов, восполняющих уровень недостающих гормонов. Чем быстрее человек обследуется у врача, тем плодотворнее пройдет терапия.
Гипертиреоз
Если гормонов вырабатывается слишком много, то происходит обратное заболевание, которое принято называть гипертиреозом. Организм получает слишком большой запас энергии.
Симптомы заболевания щитовидной железы выглядят следующим образом:
Медикаментозное лечение направлено на купирование выработки излишних тиреоидных гормонов. Недуг начинается у каждого человека индивидуально, поэтому симптоматика зависит от пола и возраста. Важно начать своевременное и правильное лечение, чтобы избежать возможных проблем со здоровьем.

Список симптомов у женщин
У каждой женщины после наступления климакса развивается гипотиреоз. Симптомы щитовидной железы при нем менее выражены, но прийти на прием к врачу все равно нужно.
Список симптомов у мужчин
Данное заболевание щитовидной железы у женщин встречается реже, чем у мужчин. Эмоциональный фон при гипотиреозе находится в норме, но запас сил для работоспособности заметно снижается.
Симптомы у детей
Гипотиреоз у младенцев:
Гипотиреоз у школьников:
Самое главное – вовремя обратиться к врачу. Если не сделать этого, то у ребенка могут развиться проблемы с сердечно-сосудистой системой. Железа играет большую роль в развитии молодого организма. Крайне важно вовремя выявить патологию и начать ее лечение.
Зоб – это стремительное увеличение щитовидной железы. Недуг никак не беспокоит человека до тех пор, пока не разрастется до больших размеров.
Для заболевания характерны следующие симптомы:
Чаще всего зоб приводит к образованию избыточных гормонов.
Описания различных видов зоба и их симптомы
Если не лечить узловой зоб, то он со временем может перерасти в кистозный. В некоторых случаях встречается диффузно-узловой зоб.
Чаще всего назначается лечение медикаментами. Если оно не помогает, то человеку требуется оперативное вмешательство.
Опухоли
Данный тип заболеваний делится на два вида: доброкачественные и злокачественные.
К доброкачественным относятся все аденомы. Они не изменяют структуру тканей и не переходят на другие органы. Аденома со временем начинает немного разрастаться, что приводит к ощущению затрудненного дыхания и глотания. Избавиться от доброкачественной опухоли можно только с помощью операции.
Рак щитовидной железы: описание
Из-за активных мутаций клеток начинают образовываться злокачественные опухоли – рак. Мутированная клетка начинает активно разрастаться, захватывая здоровые участки органа.
Признаки развития онкологии:
Лечение назначается в зависимости от вида рака и его стадии. На начальных этапах применяются медикаменты, помогающие сохранить орган. В более запущенных случаях щитовидная железа полностью удаляется. В этом случае человек всю оставшуюся жизнь будет пить гормональные таблетки.
Лечение самых распространенных недугов
Самым распространенным способом является медикаментозное лечение щитовидной железы. Оно позволяет скорректировать уровень гормоном, из-за чего больно начинает быстро поправляться.
Если медикаменты не дали должного результата, а недуг продолжает разрастаться, то назначается хирургическое вмешательство. При нем может быть удалена вся железа или небольшая часть. При удалении маленького участка гормональные функции органа нарушены не будут.
Если пациенту назначали полное удаление «щитовидке», то до конца жизни ему придется пропивать курс гормональных препаратов. Без них организм не сможет нормально функционировать, а у пациента появятся еще большие проблемы со здоровьем.
При обнаружении заболевания щитовидной железы требуется сразу посетить эндокринолога. Также не будет лишним сходить на обследование к кардиологу, неврологу и прочим специалистам, потому что «щитовидка» влияет на работу всех органов.
Депрессия: как в мозге отключается радость?
С депрессией связано множество мифов и заблуждений, которые могут быть опасны для тех, кто потерял радость к жизни и действительно страдает от тяжелых мыслей. К врачам-психиатрам, которые специализируются на лечении этой болезни, обращаются мало, а если и приходят, то как правило далеко не в первую очередь.
Врач-психиатр, психотерапевт Центра изучения расстройств пищевого поведения Владислав Чупеев в интервью проекту «Лаба» развеял мифы о депрессии и антидепрессантах, рассказал о необходимости обращения к специалистам и методах лечения.
1. Депрессию все любят обсуждать, например, за выпивкой. Но что мы действительно о ней знаем?
По всему миру сегодня от депрессии страдает более 300 млн человек. Это одно их самых распространенных психических заболеваний и главная причина потери работоспособности в мире, по данным Всемирной организации здравоохранения (ВОЗ).
2. Получается, это не просто плохое настроение?
Нет, это вполне реальное заболевание. Причем серьезное. Большинство научных теорий говорят о том, что депрессия возникает из-за нехватки нейромедиаторов – универсальных «веществ-посредников», – которые передают сигналы в мозге от одной нервной клетки к другой. Поэтому люди, страдающие депрессией, видят мир в темных тонах – причем буквально. Нейромедиаторы участвуют в работе органов зрения, слуха, формировании тактильных и температурных ощущений.
Без этих веществ информация, которая доходит до мозга, искажается, любимые занятия перестают радовать, музыка слышится иначе. Кроме того, снижается концентрация и функция памяти: в депрессивном состоянии становится труднее вспомнить что-то хорошее.
У теории связи депрессии и нейромедиаторов есть множество косвенных подтверждений, но пока у нее нет бесспорного доказательства. Все потому, что нейромедиаторы очень маленькие. Отследить их в организме и хорошенько исследовать – дорого и сложно.
3.Так что происходит при депрессии?
Депрессию составляет множество симптомов среди которых основные: апатия – стойкое снижение мотивации, ангедония – отсутствие удовольствия от того, что приносило его раньше, а также упадок сил (астения).
Еще один сигнал депрессии – это тревога. Это универсальный «флажок» организма, который дает понять: что-то идет не так. Каждый из этих симптомов – результат дисбаланса нейромедиаторов в клетках головного мозга, в первую очередь – серотонина. Если симптомы сохраняются 3-5 недель, точно пора обратиться к психиатру.
4. Может быть, надо просто отдохнуть и депрессия пройдет?
Нет. При слабой или умеренно выраженной депрессии лучшее средство лечения противоположное. Нужно вставать из постели, общаться с людьми и заниматься спортом. Проблема в том, что делать это при депрессии абсолютно не хочется.
Для сильных эпизодов депрессии характерно развитие апатии. Иногда – это последний способ организма защититься от попытки суицида: сил нет вообще ни на что.
5. Звучит страшно! А как не доводить до такого состояния?
Перемены происходят постепенно, поэтому на них сложно обратить внимание. При депрессии характерно снижении концентрации внимания, слабая память, но за этими факторами наблюдать сложнее всего: в депрессивном состоянии трудно адекватно оценивать себя.
Важнее всего изменения качества жизни. К ним относятся расстройства сна (вы спите не так хорошо, как полгода назад), изменение аппетита в любую сторону, перемены в личной гигиене, отсутствие желания заботиться о себе, навязчивое чувство вины и грусти, равнодушие к любимому хобби, книгам, фильмам, музыке. Эти перемены – признак биохимической «поломки», той самой нехватки нейромедиаторов.
Если речь идет о чувстве беспомощности, отвращении к себе и желании нанести себе вред, обратиться к врачу нужно как можно скорее. Когда такие мысли сохраняются 2 недели – ждать больше нечего, дальше будет хуже.
6. Обращаться к врачу при депрессии? Вы смеетесь? Если пришел к психиатру, сразу упекут в психушку!
Нет, не сразу. В психиатрические больницы недобровольно могут госпитализировать только тех, кто представляет реальную опасность для себя или окружающих. Т.е. если вас сняли с окна при попытке суицида, или вы пытались порезать окружающих ножом, или довели себя до истощения (индекс массы тела менее 17), то основания для госпитализации существуют.
В любом другом случае окончательное решение остается за пациентом. Главное, чтобы тяжелые мысли не сформировались в конкретный и мрачный план, который человек готов выполнять уже сейчас. Если от таких мыслей удается отвлечься в течение суток, в больницу такого пациента класть не будут.
7. Не верю! В психушку легко попасть просто так!
В России любое попадание в больницу связано с ворохом бумаг, поэтому оказаться там «просто так» невозможно. Для госпитализации в психиатрический стационар существуют строгие критерии: риск для окружающих или для себя, или приведение к такому риску без оказания помощи. При депрессии к таким рискам относят навязчивые мысли о самоубийстве или попытки суицида в последние несколько месяцев.
Если пациент находится в таком состоянии, госпитализация в стационар – это выход. Там под наблюдением врачей человек за несколько недель сможет справиться с тяжелым состоянием.
Иногда врачи действительно могут недобровольно госпитализировать пациента – если он входит в группы высокого риска. Например, недавно пытался покончить с собой и не демонстрирует положительной динамики, то есть его состояние ухудшается.
Но даже в таком случае пациенту предоставлен выбор: он может отказаться от госпитализации. Без письменного согласия отвезти человека в больницу можно только на 72 часа, затем собирается врачебная комиссия и ее решение уходит в суд.
Такая процедура требует от врачей больших трудозатрат, поэтому к ней прибегают только в случае реальной угрозы жизни.
Конечно, психиатрическая больница – не самое веселое место на планете, особенно для человека в тяжелой депрессии. Но, к счастью, реальность далека от фантазии голливудских сценаристов. Врачи не разгуливают по отделению с шокером или заготовленным шприцом.
Они стараются максимально снизить риски пациента, помогают справиться с кризисом и стабилизируют состояние так, что человек может постепенно вернуться в привычный ритм и снова радоваться жизни.

8. Вы говорите, что пациенты психиатрических больниц опасны?
Пациенты психиатрических больниц преимущественно представляют опасность только для себя. Местный персонал внимательно следит за их состоянием.
В среднем по популяции психиатрический диагноз имеет 1 человек из 100 – эта цифра не меняется в зависимости от пола, региона и национальности (исключение составляют пожилые мужчины – у них выше риск суицида).
9. Может, все-таки достаточно поговорить с психологом?
Безусловно, можно не обращаться в хирургию, если вы сломали ногу. Организм сам может заживить перелом. Но лучше все-таки наложить гипс. Вот и помощь психиатра нужна для того, чтобы справится с проблемой быстрее: так меньше рисков для здоровья и жизни.
Психиатр – специалист с медицинским образованием. Только он может поставить диагноз «депрессия» и назначить схему лечения. Психолог таким не занимается. При клинической депрессии и компульсивном переедании психолог и помогает решить проблему системно.
Кстати, в список назначений психиатра входят не только антидепрессанты, но и та же работа с психологом. При их совмещении достигаются лучшие результаты: антидепрессанты помогают набраться сил, а психотерапия – найти причину депрессии.
10. Хорошо, а как тогда выбрать адекватного психиатра?
Точно так же, как вы выбираете любого другого врача. Хорошую рекомендацию могут дать друзья, которые уже бывали у такого специалиста и вы видели, что им стало лучше.
Единственный четко очерченный критерий – готовность врача быть на связи и отвечать на вопросы. Важно, чтобы специалист мог поддержать, если проявятся побочные эффекты лекарства. В них нет угрозы, но внезапное головокружение, сонливость, тошнота действительно могут напугать.
К тому же, не всегда удается подобрать антидепрессант, который подойдет именно вам, с первого раза. В критический момент специалист сможет предпринять необходимые меры: успокоить, изменить лекарственную терапию, объяснить, что происходит.
11. Расскажите тогда про таблетки. Если психиатр назначит лекарства, я стану «овощем»?
Прием лекарственного средства никогда не приводит к переходу из царства животных в царство растений. Миф об «овоще» отчасти происходит от побочных эффектов нейролептиков, разработанных почти полвека назад. Но в гораздо большей степени это состояние вызвано течением шизофрении, оставленной без лечения. То есть речь в этом контексте вовсе не о депрессии.
Ряд тяжелых психических болезней, если их не лечить, год за годом забирают уникальные черты личности человека, оставляя глубокий след на психике. Лекарства, наоборот, способствуют замедлению этого процесса, помогая поддерживать высокий уровень качества жизни как можно дольше.
12. Тогда объясните, как работают антидепрессанты!
Работа нервной системы осуществляется передачей нервных импульсов от одной клетки головного или спинного мозга (нейрона) другой при помощи нейромедиаторов. Эти вещества-посредники выбрасываются в пространство между нейронами, что запускает каскад передачи сигнала следующим клеткам. Затем нейромедиаторы захватываются обратно, разрушаются на составные блоки и собираются вновь для повторной передачи импульсов.
Передача нервного импульса при депрессии меняется, так как количество нейромедиаторов снижено. Это препятствует созданию законченного нервного импульса. Отсюда возникает тревога. Восстановить естественную работу нервной системы возможно с помощью антидепрессантов.
Лекарства от депрессии работают по-разному. Препараты предыдущих поколений, например, ингибиторы моноаминоксидазы (иМАО), блокируют разрушение нейромедиаторов в нервных клетках. Сейчас их используют достаточно редко из-за выраженных побочных эффектов и высокой токсичности.
Им на смену пришли более современные лекарства – селективные ингибиторы обратного захвата серотонина (СИОЗС), то есть препараты, которые препятствуют захвату конкретного нейромедиатора.
СИОЗС помогают сформировать законченный нервный импульс. Постепенное увеличение дозировки помогает нервной системе вернуться на «докризисный уровень».
13. Все антидепрессанты – ужасные наркотики?
За время лечения депрессии человек привыкает разве что к хорошему настроению, нормальному сну и отсутствию тревоги. Так что не все психотропные препараты наркотики, хотя такое мнение чрезвычайно распространено.
Миф о зависимости связан с наличием у психиатрических лекарств синдрома отмены: набора побочных эффектов, возникающих при несвоевременном, чаще всего самовольном, прекращении курса лечения синдрома руминации синдрома руминации и РПП в целом.
Но это не означает, что антидепрессанты придется пить до конца жизни. Первичная стабилизация состояния наступает примерно через месяц.
За это время дозировка лекарств наращивается до лечебной, она всегда выше. Небольшие дозы в первое время нужны для того, чтобы снизить количество побочных эффектов. Полный курс лекарственной терапии длится от полугода до 1,5 лет. В большинстве случаев лечение занимает от 7 до 10 месяцев.
14. А вот у меня есть подруга, которая пила антидепрессанты, но потом депрессия вернулась, и стало еще хуже. Такое же может произойти?
Так может быть по нескольким причинам. Самая распространенная – досрочное прекращение лечения без консультации с врачом. Важно пройти курс до конца: несвоевременный отказ от лекарств вызывают синдром отмены и приводят к повторному возникновению депрессии. Симптомы болезни в таком случае нередко бывают более тяжелыми, чем в самом начале.
Однако стать хуже может и после полностью пройденного курса лечения антидепрессантами. Лекарства – не единственный компонент выздоровления. Они помогают справиться с текущим депрессивным состоянием, но никак не исключают возможности рецидива. Залогом стабильного эмоционального фона может быть только поведенческая психотерапия. На это нужно потратить время.
15. Что делать, если в помощи психиатра нуждается близкий человек?
Если вы чувствуете, что человек нуждается в помощи, но не считает возможным или нужным обратиться к специалисту, можно предложить собственную помощь и пойти к врачу вместе, буквально «взять за руку и отвести». Если вы встречаете сильное сопротивление – высока вероятность, что с вами говорит не человек, а его болезнь.
Людям в депрессии часто может быть страшно признаться самим себе, что ситуация выходит из-под контроля.
Лучший вариант – не вступать в противостояние, а задавать вопросы. Считает ли человек происходящее с ним здоровым? Можете ли вы чем-то помочь? Действительно, поход к специалисту может не решить всех проблем, но попытаться все же стоит.
Современная психиатрия, в отличие от того, чем она располагала 30 лет назад, обладает большим набором фармакологических инструментов даже для тяжелых заболеваний, таких как шизофрения или биполярное-аффективное расстройство.
Так что с помощью лекарственной терапии депрессию вполне можно побороть. Главное, не бояться идти к врачу и не бросать лечение на полпути.
Для кого тиболон?
Тиболон — синтетический стероид, тканеселективный регулятор эстрогенной активности. В организме человека он метаболизируется в три изомера: 3 альфа-гидрокситиболон, 3 бета-гидрокситиболон и 4 дельта-метаболит, обладаюшие тканеселективным сродством к эстро
Tibolon is synthetic steroid, tissue-selective regulator of estrogenic activity. In the human organism, it is metabolized into three isomers: 3alfa-gidroksitibolon, 3beta-gidroksitibolon and 4 delta-metabolite, which have tissue-selective affinity for the estrogenic receptors.
Изменение демографической структуры общества в последние десятилетия привело к увеличению в популяции доли женщин старшей возрастной группы. В настоящее время развитые страны мира стоят перед серьезной социальной и медицинской проблемой — инверсией возрастной «пирамиды», что связано с увеличением продолжительности жизни. Более трети своей жизни современная женщина проводит в состоянии дефицита женских половых гормонов. По данным ВОЗ с каждым годом возрастает число женщин, вступающих в период постменопаузы (к 2030 г. их количество достигнет 1,2 млрд человек). Менопауза, не являясь заболеванием, приводит к нарушению эндокринного равновесия в организме женщины, вызывая приливы, раздражительность, бессонницу, а в последующем — возможные урогенитальные расстройства, повышение риска развития остеопороза и сердечно-сосудистых заболеваний. Все эти данные свидетельствуют о необходимости разработки целого ряда медицинских и социальных мер по защите здоровья, сохранению работоспособности и достойного качества жизни женщин пери- и постменопаузального периода.
Новым этапом в развитии менопаузальной гормональной терапии (МГТ) стали данные о возможности эффективного использования особых групп препаратов как альтернативы традиционной эстрадиолсодержащей заместительной гормональной терапии (ЗГТ) [1]. Одним из таких препаратов является тиболон, относящийся к категории G3H — другие половые гормоны и препараты, применяющиеся для лечения менопаузальных нарушений. Тиболон — синтетический стероид, тканеселективный регулятор эстрогенной активности. В организме человека он метаболизируется в три изомера: 3 альфа-гидрокситиболон, 3 бета-гидрокситиболон и 4 дельта-метаболит, обладающие тканеселективным сродством к эстрогенным рецепторам. Гидроксиметаболиты циркулируют в плазме крови в связанном неактивном состоянии в виде сульфатированных форм. Попадая в ткани-мишени (кости, центральная нервная система, мочеполовые органы, сердечно-сосудистая система), метаболиты тиболона реактивируются под воздействием сульфатазы, что обеспечивает их эстрогеноподобный эффект. В молочной железе и эндометрии 4 дельта-изомер блокирует сульфатазу, препятствуя формированию активных метаболитов, способных взаимодействовать с эстрогенными рецепторами. Этот изомер обладает также гестагенными и слабыми андрогенными свойствами. В результате достигаются благоприятные эстрогенные эффекты в центральной нервной системе, костях и мочеполовом тракте при отсутствии нежелательных влияний в эндометрии и молочных железах.
Тиболон появился на фармацевтическом рынке с 1988 г. Зарегистрирован в 89 странах для лечения климактерического синдрома, в 45 странах — для профилактики остеопороза. В РФ зарегистрирован препарат Ледибон — тиболон 2,5 мг, который применяется один раз в сутки, желательно в одно и то же время. Показания к применению: лечение симптомов эстрогенной недостаточности у женщин спустя 1 год после последней естественной менструации; профилактика остеопороза у женщин в постменопаузе, имеющих высокий риск возникновения переломов, и при непереносимости других препаратов, применяемых для профилактики остеопороза. Начало лечения: естественная менопауза — лечение можно начать через 12 месяцев после последней естественной менструации; хирургическая менопауза — лечение начинают немедленно. Пропуск приема таблетки: менее 12 часов — принять немедленно; более 12 часов — пропустить прием таблетки, следующую таблетку принять в обычное время. Общая переносимость: Ледибон хорошо переносится, нет существенного влияния на массу тела.
В рандомизированных плацебо-контролируемых исследованиях было показано, что тиболон позволяет контролировать приливы жара, потливость и другие типичные симптомы, такие как бессонница, головная боль и утомляемость. В плане облегчения климактерических симптомов он оказался настолько же эффективным, как и многочисленные схемы эстроген-прогестагенной комбинированной и только эстрогенной терапии (ЭПТ/ЭТ) [8–10], хотя, возможно, он и характеризуется несколько более медленным началом действия, но может также использоваться в качестве «терапии прикрытия» для облегчения симптомов дефицита эстрогенов у женщин, получающих лечение агонистами гонадотропин-рилизинг-гормона (аГнРГ) по поводу миомы матки и эндометриоза [11, 12].
Показано, что тиболон способствует обратному развитию атрофии влагалища (увеличивает кариопикнотический индекс и индекс созревания клеток) и улучшает качество цервикальной слизи [13]. Женщины, получающие лечение тиболоном, отмечают значительное уменьшение сухости во влагалище, выраженности диспареунии и мочевых симптомов.
Эффекты тиболона в отношении циркулирующих андрогенов отличаются от действия стандартных пероральных схем МГТ (ЭПТ/ЭТ). При использовании тиболона уровень глобулина, связывающего половые стероиды (ГСПС), снижается, а не увеличивается, в связи с этим концентрация свободного тестостерона повышается, в то время как при стандартной МГТ (ЭПТ/ЭТ) наблюдается ее снижение. Показано, что увеличивается также концентрация дегидроэпиандростеронсульфата (ДЭАС) [14]. Кроме этого, 4 дельта-изомер тиболона также оказывает некоторое андрогенное действие. Эти свойства тиболона способствуют его благоприятному влиянию на сексуальное благополучие, которое заключается в повышении сексуального влечения, возбуждения, стимуляции сексуальных фантазий и повышении увлажненности влагалища [15–17]. В сравнении со стандартными схемами ЭПТ, тиболон в значительно большей степени способствует увеличению частоты коитусов, повышает степень наслаждения и удовлетворенности половым актом [18]. Что касается частоты оргазма и сексуальной чувствительности, то при применении тиболона или комбинации эстрогенов и андрогенов наблюдается более выраженный эффект, нежели при использовании ЭТ или в контрольной группе [19].
Предполагается, что существенное благоприятное воздействие тиболона на уровень настроения обусловлен нормализацией уровня эндорфинов и его андрогенными свойствами [15, 20]. В сравнительном исследовании с использованием ЭПТ тиболон оказался более эффективным в плане уменьшения выраженности расстройств настроения [21]. Кроме того, его эффект может осуществляться синергистически с эффектами психоактивных препаратов, что сопровождается более быстрым достижением улучшения у женщин, страдающих депрессией и психозами. Поскольку применение антидепрессантов часто ассоциируется с сексуальной дисфункцией, влияние тиболона на сексуальность у таких женщин сопровождается дополнительными преимуществами.
В рандомизированных контролируемых исследованиях показано, что тиболон вызывает увеличение минеральной плотности костной ткани (МПК) и предотвращает потерю костного вещества [23, 24]. Благоприятные эффекты тиболона наблюдались как в шейке бедра, так и в позвоночнике. Эти благоприятные эффекты отмечались при длительном (10-летнем) лечении [25] как в ранней, так и в поздней постменопаузе у женщин с установленным диагнозом остеопороза и у женщин, получавших лечение агонистами ГнРГ [11, 12, 26–28].
Терапия тиболоном значительно реже вызывает болезненность молочных желез и масталгию, нежели ЭПТ; эта причина гораздо реже, чем в случае ЭПТ, приводит к прекращению лечения тиболоном [8, 9, 23, 29]. Женщины с болезненностью молочных желез или масталгией на фоне ЭПТ, по-видимому, могут воспользоваться благоприятным эффектом при переходе на тиболон [30].
Тиболон не вызывает увеличения плотности ткани на маммограмме [29, 31]. Самопроизвольно возникшая повышенная рентгенографическая плотность молочных желез рассматривается как независимый фактор риска рака молочной железы. В настоящее время неясно, является ли индуцированная ЭПТ плотность молочных желез суррогатным маркером повышенного риска рака молочной железы, однако повышенная маммографическая плотность может маскировать опухоли молочных желез при скрининговой маммографии, что приводит к поздней диагностике [32]. Кроме того, повышенная маммографическая плотность приводит к увеличению частоты повторных вызовов пациенток, что вызывает страх женщин [33, 34]. Действие тиболона на молочные железы отличается от эффектов ЭПТ. В отличие от ЭПТ, тиболон не повышает риск пролиферации ткани молочной железы, но стимулирует апоптоз [31, 35]. Согласно объединенным данным всех исследований тиболона III/IV фазы, тиболон не вызывал увеличения риска рака молочной железы, в сравнении с плацебо (относительный риск (ОР) 0,50; 95% доверительный интервал 0,11–2,54) [36]. Исследование «Миллион женщин» (MWS) сообщает о повышении ОР рака молочной железы на фоне лечения тиболоном (ОР 1,45; 95% доверительный интервал 1,25–1,67), хотя это увеличение и достоверно (p
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Хронический простатит/синдром хронической тазовой боли: современные тренды и перспективы лечения с позиций доказательной медицины
Тюзиков И.А., Греков Е.А.
Сведения об авторах:
ВВЕДЕНИЕ
Современные клинические исследования хронического простатита/синдрома хронической тазовой боли (ХП/СХТБ) начались с фундаментальных работ T.A. Stamey и E.M. Meares, разработавших основные принципы диагностики заболевания, которыми мы до сих пор пользуемся в рутинной клинической практике [1]. Именно они разработали бактериологический метод исследования сегментированной культуры для уточнения локализации инфекций у мужчин (мочеиспускательный канал, мочевой пузырь или предстательная железа) с целью дифференциации основных категорий простатита, известный как четырехстаканная проба Meares –Stamey [2]. Выявляемые при проведении данного лабораторного теста ключевые категории ХП (инфекционный и не–инфекционный, или абактериальный) с некоторыми модификациями до сих пор используются в соответствии с классификацией Chronic Prostatitis Symptom Index, разработанной еще в 90–х годах XX века Национальным институтом здоровья США (NIH) (СPSI–NIH) [3]. Данная классификация, основанная на использовании микробиологического теста локализации инфекции в виде четырехстаканной пробы Meares –Stamey или упрощенного теста (двухстаканная проба Nickel), в настоящее время общепринята во всем мире [4]. Однако по мере расширения наших представлений о многообразии и взаимодействии различных факторов в патогенезе ХП/СХТБ на основе современных исследований стало очевидным, что классификация CPSI–NIH в рутинной урологической практике все чаще «дает сбой», не позволяя точно идентифицировать выявляемые лабораторные находки у пациентов с конкретной формой заболевания, которые «не вписываются» в предлагаемые критерии диагноза, что, безусловно, не позволяет назначить обоснованную патогенетическую терапию. Кроме того, известно, что у каждого пациента существуют индивидуальные механизмы патогенеза ХП/СХТБ, отличные от механизмов развития заболевания у другого пациента, более того, они находятся в теснейших взаимодействиях между собой, которые в реальной клинической практике порой бывает крайне сложно изучить и сопоставить между собой [5].
Для преодоления выше указанных методологических трудностей и обеспечения персонализированного подхода к диагностике и лечению ХП/СХТБ в каждом конкретном случае D.A. Shoskes и соавт. предложили фенотипический комплексный подход к оценке симптомов заболевания, который лег в основу предложенной ими новой классификации ХП/СХТБ, известной как UPOINT [6]. В данной классификации авторы предусмотрели оценку нескольких доменов с целью более детальной характеристики определенных клинических фенотипов заболевания (U – мочевой домен; Р – психосоциальный домен; О – органоспецифический домен; I – инфекционный домен; N – неврологический домен; T – болевой домен) [6]. По мнению авторов, количество выявленных клинических фенотипов у конкретного пациента, с одной стороны, хорошо коррелирует с тяжестью симптомов ХП/СХТБ, а, с другой стороны, позволяет подобрать каждому пациенту таргетную мультимодальную персонализированную терапию с использованием наиболее эффективных с точки зрения доказательной медицины методов в рамках конкретного домена [6]. В 2010 году V. Magri и соавт. предложили добавление еще одного домена к данной классификации – S (сексуальные дисфункции) [7]. Вместе с тем, к настоящему времени ни в одном исследовании не проводилось проспективной оценки использования системы UPOINT «S» в лечении СХТБ/ХП, а ряд авторов вообще не поддерживает добавление домена «S» к системе UPOUNT, как не повышающего ее клинической ценности [8].
Несмотря на тщательные исследования, оценивающие различные терапевтические средства, нацеленные на эти механизмы, клинические исследования не смогли определить идеальную эмпирическую стратегию лечения, однако внедрение клинического фенотипирования пациентов с ХП/СХТБ, по мнению некоторых авторов, привело к существенному прогрессу в разработке индивидуальных стратегий ведения больных с данной патологией [9]. Мономодальная терапия в настоящее время оказывается в значительной степени безуспешной из-за неясной и сложной этиологии заболевания, поэтому современная терапия ХП/СХТБ активно переходит на мультимодальный междисциплинарный подход, включающий как медикаментозные (фармакологические), так и немедикаментозные методы лечения [9]. Наиболее изученные фармакологические методы лечения ХП/СХТБ сегодня включают антибиотики, α1–адреноблокаторы, нестероидные противовоспалительные средства (НПВС) и иммуномодулирующие средства, фитотерапию, ингибиторы фосфодиэстеразы 5 типа (ФДЭ–5 типа), гормональные препараты, нейромодулирующие средства и антидепрессанты. Наиболее изученные немедикаментозные методы лечения включают физиотерапию тазового дна, разблокировку миофасциальной триггерной точки, иглоукалывание и электроакупунктуру, психологическую поддержку и биологическую обратную связь (БОС), а также электрокорпоральную ударно-волновую терапию и местную термотерапию [9]. Во всеобъемлющем обзоре 28 опубликованных рандомизированных контролируемых исследований (РКИ) с 1998 по 2014 год G. Magistro и соавт. обобщили результаты исследований с антибиотиками, α–блокаторами, противовоспалительными и иммуномодулирующими веществами, гормонами, фитотерапевтическими средствами, нейромодулирующими препаратами и физиотерапевтическим лечением и пришли к выводу, что ни один из эффективных монотерапевтических вариантов не был одинаково эффективен у всех пациентов с ХП/СХТБ [10].
Мультимодальное и индивидуальное лечение является сегодня предпочтительным выбором для пациентов с ХП/СХТБ в клиническом плане [10]. Этот режим ведения следует тщательно и осторожно выбирать, чтобы обеспечить наилучшую клиническую тактику ведения пациентов, для чего, по мнению ведущих экспертов, необходимо учесть несколько критических моментов:
Таким образом, несмотря на длительную научную историю изучения ХП/СХТБ и поистине огромное количество публикаций и проведенных клинико-экспериментальных исследований, до сих пор не созданы высоко доказательные мета-анализы и систематические обзоры по многим аспектами его медикаментозного и немедикаментозного лечения, поэтому в данном обзоре мы суммировали результаты исследований эффективности различных современных методов лечения ХП/СХТБ на основе новейших мета-анализов и систематических обзоров последних лет.
МАТЕРИАЛЫ И МЕТОДЫ
Были проанализированы результаты поиска по научным базам данных PubMed, Medline, Web of Science, Embase, Cochrane Library and PEDro, Wang-fang Database и Cnki, Edline по запросам «хронический простатит», «синдром хронической тазовой боли», «медикаментозное лечение», «немедикаментозные вмешательства», «эффективность», «безопасность».
РЕЗУЛЬТАТЫ
Немедикаментозные методы лечения ХП/СХТБ
J.V.A. Franco и соавт. провели комплексный всесторонний анализ эффективности немедикаментозных методов лечения ХП/СХТБ с использованием нескольких баз данных без ограничений по языку или статусу публикации. Датой последнего поиска по всем базам данных был август 2017 года. Авторы включили только РКИ у мужчин с диагнозом ХП/СХТБ и все доступные немедикаментозные вмешательства, которые у них применялись. Основными исходами анализа были симптомы простатита и побочные явления. Вторичными исходами были сексуальная дисфункция, симптомы нарушений функций нижних мочевых путей (СНМП), качество жизни, тревога и депрессия. Результаты оценивались на основе Индекса симптомов хронического простатита Национального института здравоохранения США (шкалы NIH–CPSI), т.е., практически только на основании клинической симптоматики и ее динамики в ходе лечения [13]. Данный Кокрейновский обзор, включивший в конечном итоге 38 РКИ (n=3290) показал, что иглоукалывание, вероятно, приводит к клинически значимому уменьшению симптомов простатита по сравнению с плацебо–процедурой при незначительной разнице между ними и полного отсутствия побочных явлений. У некоторых пациентов иглоукалывание также может привести к клинически значимому уменьшению симптомов ХП по сравнению со стандартной медикаментозной терапией. Изменения образа жизни и программа физической активности могут быть связаны с уменьшением симптомов простатита по сравнению с плацебо-контролем. Вместе с тем, остается неясным, уменьшает или усиливает массаж предстательной железы симптомы простатита по сравнению с плацебо-контролем. Низкочастотная экстракорпоральная ударно-волновая терапия (НЧЭУВТ) уменьшает симптомы простатита по сравнению с контролем, но эти результаты могут не сохраниться при среднесрочном наблюдении, хотя нежелательные явления при ее проведении наблюдаются редко. Трансректальная термотерапия самостоятельно или в сочетании с медикаментозной терапией может незначительно уменьшить симптомы простатита по сравнению с одной только медикаментозной терапией, но в одном из включенных в данный обзор исследований сообщалось, что пациенты могут испытывать временные побочные явления [13].
Основываясь на результатах с умеренным или высоким уровнем доказательности, обзор также показал, что некоторые немедикаментозные вмешательства, такие как иглоукалывание и НЧЭУВТ, вероятно, приведут к уменьшению симптомов простатита и не связаны с большей частотой нежелательных явлений. Уровень доказательности для большинства других немедикаментозных вмешательств остается преимущественно низким [13].
Для отдельной оценки эффективности низкоинтенсивной экстракорпоральной ударно-волновой терапии (НИЭКУВТ) при ХП/СХТБ был проведен отдельный поиск РКИ в базах данных MEDLINE, Web of Science, EMBASE и Библиотеке Кокрейна до 6 января 2019 года включительно, результаты которого оценивались на основе Индекса симптомов хронического простатита Национального института здравоохранения США (шкалы NIH–CPSI), т.е., практически только на основании клинической симптоматики и ее динамики в ходе применения данного вида лечения [14]. В обзор вошли 6 публикаций, включающих только 5 РКИ с общим количеством пациентов 280. Общий балл NIH–CPSI, индекс боли и качество жизни (QоL) были значительно лучше в группе, получавшей НИЭКУВТ по сравнению с контрольной группой в конечной точке (р 2 (но
Гормоны счастья и радости
Весна, весна, пора любви,
Как тяжко мне твое явленье,
Какое томное волненье
В моей душе, в моей крови…
Современная наука нашла объяснение изменению эмоционального и физического состояния человека – всему виной гормоны.
Что же это? Гормон (от греческого «возбуждаю», «привожу в действие») – это биологически активные вещества, которые вырабатывает наш организм под влиянием различных внешних и внутренних факторов. Благодаря им человек способен испытывать счастье, блаженство, влюбленность. Недостаток этих веществ проявляется апатией и хандрой, отсутствием энергии и настроения. У каждого человека есть целый набор гормонов любви и счастья!
Эндорфин дарит нам чувство легкости, вызывает желание реализовывать мечты, достигать цели, отвечает за удовольствие и эйфорию. Его уровень значительно увеличивается, когда мы обнимаем и целуем близких.
Дофамин – этот гормон своеобразный двигатель, стимул для поиска возможностей в преодолении препятствий. Именно он лишает нас сна, мешает сосредоточиться, заставляет скучать по любимому человеку.
Адреналин – гормон «стресса», но именно от него у нас чаще стучит сердце, ноги бегут быстрее, мы готовы на «подвиги» и непривычные для нас действия.
Серотонин – гормон счастья, его выброс в кровь дарит нам хорошее настроение, помогает бороться со стрессами, дает нам ощущение значимости и уважения со стороны окружающих, а недостаток приводит к депрессии.
Гормон нежности и привязанности – это окситоцин. Именно он отвечает за любовь, благодаря ему мы испытываем привязанность к друг другу, доверие и ответственность, и именно он отвечает за любовь матери к своему ребенку.
Тестостерон – гормон страсти и соперничества, долголетия и мудрости, от его количества зависит мужская привлекательность и сила.
Весной, согласно биологическим ритмам, наблюдается «гормональный» подъем, именно поэтому чаще возникают симпатии, влюбленность, повышается жизненный тонус и сексуальное влечение.
Гормональный фон человека на протяжении жизни претерпевает изменения вследствие проблем со здоровьем, неправильного питания, стрессов и хронической усталости, возрастных изменений. Если происходит гормональный сбой, очень важно своевременно обратиться к врачу-эндокринологу, который диагностирует проблему и поможет восстановить правильную работу эндокринной системы организма.
Помните, что Ваше настроение и самочувствие зависят от Вашего гормонального фона. Поддерживайте его в форме: правильно питайтесь, занимайтесь спортом, чаще улыбайтесь, влюбляйтесь! Будьте здоровы и счастливы!
Гипоэстрогенные состояния у женщин репродуктивного, пре- и менопаузального возрастов
Патогенетической терапией лечения ранневременных симптомов гипоэстрогении является заместительная гормональная терапия (ЗГТ). В случае противопоказаний к ЗГТ или отказа от нее, достаточно эффективны альтернативные фитопрепараты, которые в меньшей степени,
К гипоэстрогенным состояниям относятся изменения в организме женщин на фоне снижения или прекращения выработки эстрогенов яичниками.
В первую очередь возникает комплекс вегетативно-сосудистых, нейроэндокринных и нейропсихических симптомов (ранневременные расстройства). Затем появляются урогенитальные и сексуальные нарушения, изменения внешности (средневременные расстройства). В последнюю очередь наступают поздневременные обменные нарушения: остеопороз, ишемическая болезнь сердца, болезнь Альцгеймера [1].
Эти многочисленные симптомы гипоэстрогении связаны с наличием огромного количества рецепторов к эстрогенам в различных органах и системах женщины: половых органах, гипоталамусе и гипофизе, сердечно-сосудистой системе, уретре и мочевом пузыре, коже и волосах, толстом кишечнике, печени [2].
Вышеназванные изменения могут возникать не только естественно в климактерическом периоде, но и при воздействии на организм женщины других факторов: после хирургических операций (удаление или резекция яичников по поводу кист и апоплексии, ампутации матки); при истощении фолликулярного аппарата (синдром истощения яичников) [3, 4]; при извращенной реакции эстрогеновых рецепторов (синдром резистентных яичников); на фоне применения некоторых лекарственных препаратов, в частности агонистов рилизинг-гормонов (АГ-РГ); при лечении эстроген-зависимых заболеваний женской половой системы, а также в длинных протоколах стимуляции суперовуляции программы экстракорпорального оплодотворения (ЭКО) при лечении бесплодия (требует add-back терапии для снятия нейровегетативных симптомов) [5, 6].
Гипоэстрогенные состояния, связанные с незначительным снижением продукции эстрогенов (при щадящей резекции яичников, каутеризации не поликистозных, а мультифолликулярных яичников и др.), имеют свои особые клинические проявления, чаще всего приводящие к нарушению репродуктивной функции (ановуляция, недостаточность лютеиновой фазы; сниженный овариальный резерв, приводящий к бедному ответу яичников в программах ЭКО) [7]. По нашим данным в программах ЭКО такие пациентки встречаются в 22,3% случаев.
Гипоэстрогения в климактерическом периоде может служить моделью для изучения классических клинических проявлений этого состояния, т. к. климактерий это естественный достаточно длительный биологический процесс перехода от периода репродукции к старости, в основе которого лежит постепенное угасание функции яичников и снижение продукции эстрогенов. Наиболее ярко проявляют себя ранневременные расстройства [1]. Комплекс симптомов ранневременных расстройств при определенной степени выраженности принято называть климактерическим синдромом (КС). По нашим данным, полученным совместно с И. В. Бесман [8], КС в перименопаузе встречается в 57,6% случаев, при этом в 65% — в осложненной форме (т. е. на фоне экстрагенитальной патологии). Осложненная форма КС обуславливает максимальную выраженность симптомов КС. В настоящее время ранневременные симптомы гипоэстрогении связывают с дезорганизацией функции лимбико- ретикулярного комплекса. С нарушением функции гипоталамуса связывают такие проявления ранневременных расстройств, как приливы, гипергидроз, сердцебиение, гипертензия. С нарушением функции лимбической системы связывают депрессию, нарушение сна, головные боли, снижение памяти. Все ранневременные нарушения снижают качество жизни женщины, но особенно это касается приливов и расстройств сна. Приливы могут беспокоить женщину 5–10–20 и более раз в сутки. Расстройства сна: удлинение периода засыпания, частое пробуждение ночью, поверхностный сон — не дают ощущения полноценного отдыха. Несомненно, все эти нарушения требуют дифференцированного подхода к лечению в зависимости от причины гипоэстрогении и возраста, в котором они наступают.
Безальтернативной патогенетической терапией ранневременных симптомов гипоэстрогении считается сегодня заместительная гормональная терапия (ЗГТ) [1, 6]. У женщин репродуктивного возраста после оперативного удаления или резекции яичников, с синдромами резистентных и истощенных яичников лечение можно начинать с комбинированных эстроген-гестагенных препаратов [1]. Это могут быть современные трехфазные препараты, например Клайра. У женщин после гистерэктомии терапия проводится с использованием натуральных эстрогенов с последующим добавлением гестагенов [6]. При плохой переносимости пероральных препаратов можно рекомендовать их в виде геля или пластыря для чрезкожного введения (Эстрожель, Дивигель, Климара) с периодическим назначением гестагенов вагинально (например, Утрожестан). Длительность ЗГТ определяется состоянием и самочувствием пациентки.
В климактерическом периоде при лечении ранневременных расстройств важно придерживаться позиции Международного общества по менопаузе (2007 г.):
Кроме того, должны учитываться современные принципы назначения ЗГТ:
Противопоказания к ЗГТ:
Интересен по своему составу препарат Менопейс Плюс, в который входят капсулы с витаминами и минералами (21 компонент), а также растительные таблетки, содержащие изофлавоны сои, лигнаны семян льна, шалфей и зеленый чай. Составляющие растительной таблетки превращаются в фитоэстрогены в кишечнике, благоприятно действуют на нервную систему, уменьшают приливы, являются источниками антиоксидантов. Цикл приема этого препарата по одной капсуле и одной растительной таблетке в день составляет 28 дней.
Мы, совместно с И. В. Бесман [9], имеем опыт применения альтернативных ЗГТ растительных средств, при лечении осложненной формы КС в случаях, когда ЗГТ было противопоказано. Наши исследования показали, что качество жизни этих пациенток, определяемое по специальной шкале, несколько хуже, чем у тех, кто принимал ЗГТ; но значительно лучше, чем у тех, кто не принимал вообще никаких препаратов. Кроме того, эти средства дают хороший эффект при купировании вазомоторных симптомов в длинных протоколах с АГ-РГ программ ЭКО.
Все вышесказанное еще раз подтверждает мнение специалистов о том, что дифференцированный подход к лечению ранневременных нарушений при гипоэстрогенных состояниях с применением ЗГТ различных режимов или альтернативных растительных средств дает хороший эффект и значительно улучшает качество жизни женщин.
Литература
ГБУЗ МО МОПЦ, Балашиха
Abstract. Pathogenetic therapy treatment of early symptoms of hypoestrogenism consists of hormone replacement therapy (HRT). In the case of contraindications to the HRT medication or refusal of a woman, alternative herbal medication is effective less than HRT, but however improves the quality of life.
10 вопросов эндокринологу: интервью с доктором Либеранской Натальей Сергеевной
Эндокринология остается одной из самых неизвестных и мистифицируемых областей медицины. Между тем, нередко за утомляемостью, избыточным весом, нарушением сна, повышенным уровнем сахара в крови и даже за быстрым старением стоит гормональный дисбаланс: дефициты жизненно важных витаминов и микроэлементов или сбои в работе внутренних органов, о которых человек может даже не догадываться. Мы поговорили с ведущим эндокринологом клиники им. Н.И. Пирогова, врачом высшей категории Натальей Сергеевной Либеранской, чтобы узнать ответы на самые актуальные вопросы: как бороться с лишним весом, хронической усталостью и сахарным диабетом, какие угрозы скрывает вегетарианская диета и токсично ли молоко, как сохранить молодость, правильно спать и проводить детокс и почему на самом деле не стоит бояться гормонозаместительной терапии? Ответы на эти и другие вопросы читайте в интервью с экспертом. Надеемся, что советы нашего врача помогут вам вести здоровый образ жизни грамотно и пересмотреть бытовые привычки, от которых давно стоит отказаться.
О борьбе с лишним весом
Иногда говорят «гормоны виноваты», когда человек начинает по неизвестным причинам резко набирать вес. Получается, что гормоны могут резко разбудить среди ночи и отправить к холодильнику, причем так, что сопротивляться этому невозможно? Или это совсем по-другому работает? Расскажите, пожалуйста, каков механизм (или механизмы) набора веса, и как с этой проблемой помогает справиться врач-эндокринолог?
Наталья Сергеевна Либернаская: Если разобраться, то избыточный вес — это всегда гормональная проблема. И это действительно так — гормоны могут буквально заставить нас идти есть. Пациенты с ожирением мучаются сильным голодом. Представьте, есть хочется всегда: утром, днем и вечером — причем настолько сильно, что если голод не утолить, то человек может проявлять агрессию. Однако это вовсе не потому что человек распущенный, а например, потому что у него повышен гормон инсулин, который и вызывает сильнейшее чувство голода. По сути такие люди находятся в зависимости от гормона инсулина, и это состояние называется «инсулинорезистентностью». Поэтому, если вы вдруг резко и казалось бы без причины начали набирать лишний вес, то прежде всего необходимо обязательно проверить инсулин. Это помогает выявить наличие инсулинорезистентности и корректировать ее.
Проблема может быть также связана и с щитовидной железой. Если она вырабатывает мало гормонов, тогда тоже начинается прибавка в весе, и человеку будет очень сложно похудеть. У мужчин и женщин старше 40 лет начинается возрастное снижение выработки половых гормонов: эстрогенов, прогестерона, тестостерона. Это в нас запрограммировано — мы так стареем. Поэтому после 40 лет и появляются пресловутые «животики» — какой бы конституции человек не был и как бы он за собой не следил. В 50 лет многие женщины вступают в стадию менопаузы, и тогда даже у самых худых и стройных начинается прибавка в весе. Это тоже происходит из-за дефицита половых гормонов.
Резкая прибавка в весе может быть вызвана и проблемами с надпочечниками. Все мы живем в состоянии хронического стресса: нервничаем, много работаем, мало отдыхаем, плохо спим. А из-за этого повышается гормон кортизол. Кортизол вместе с инсулином относится к жирозапасающим гормонам. Их избыток и приводит к лишнему весу. Об этом можно долго говорить — каждый случай индивидуален, и в нем нужно разбираться. Однако это наиболее распространенные причины набора веса.
О хронической усталости
Все мы периодически устаем, а иногда ну очень сильно. В таких случаях говорят «хроническая усталость», «астенический синдром» и так далее. Как понять, что с моей усталостью просто «хорошо отдохнуть» не получится, что не поможет психотерапевт и следует обратиться именно к эндокринологу?
Наталья Сергеевна Либеранская: Нужно проверить, в норме ли гормоны щитовидной железы. Для женщин также очень характерен дефицит железа. Железо — это не совсем гормон, но этот микроэлемент с ними очень связан. При дефиците железа гормоны щитовидной железы начинают хуже вырабатываться. Из-за ежемесячной менструации женщины находятся в группе риска по потере железа. Еще одна причина железодефицита — вегетарианство. Поэтому к такой диете следует относится с особенным вниманием. Железодефицит не всегда сопряжен с анемией. Это значит, что не всегда в клиническом анализе крови мы увидим низкий гемоглобин, однако будет снижен ферритин. Ферритин — это депо железа. Недополучили нужное количество белка? Вот и все, пожалуйста — возникают усталость и утомляемость, волосы выпадают и так далее. Обязательно нужно за этими показателями смотреть.
Не стоит забывать еще про один очень важный гормон — он называется «D-гормон» или просто витамин D, с которым в Петербурге проблемы. Солнца у нас мало, поэтому нужное количество витамина D не синтезируется даже в летнее время. Это проверено уже миллионы раз, и я убеждаюсь в этом, когда изучаю результаты анализов своих пациентов. А еще витамин D — это антидепрессант, поэтому всегда, когда мы уезжаем на юг, то чувствуем прилив хорошего настроения. Поэтому важно проверить, в норме ли витамин D.
Луч света в темном царстве: как нормализовать D-гормон и стоит ли для этого идти в солярий?
Продолжая тему, а спасет ли от дефицита витамина D солярий — искусственный заменитель солнца? Советуете ли вы его своим пациентам?
Наталья Сергеевна Либеранская: Иногда, конечно, можно прибегнуть к солярию, но все равно он не способствует выработке нужного количество витамина D. И здесь есть еще один важный нюанс. Все-таки это воздействие на кожу. А где найти гарантию, что это хороший и качественный, а не какой-то застарелый солярий? Ведь он может сильно навредить — вплоть до стимулирования роста новообразований. Конечно, можно немножко «подзолотиться», но этого будет недостаточно для нормализации D-гормона. Поэтому нужно дополнительно принимать препараты с витамином D.
О вегетарианстве
А что вы думаете о вегетарианской диете? С одной стороны, в базе PubMed часто встречаются исследования и публикации, в которых подтверждается, что отказ от мяса влечет за собой дефицит витаминов В12, Д и кальция.* Не говоря уже и о том, что мясо — это все-таки ценный источник белка. С другой стороны есть мнение, что мясо содержит «плохие гормоны» стресса, который испытывают животные перед тем, как их убивают. Это правда или заблуждение?
(См. например, Gallego-Narbón A., Zapatera B., Barrios L., Vaquero M.P. Vitamin B12 and folate status in Spanish lacto-ovo vegetarians and vegans, 2019; Bousselamti A., El Hasbaoui B., Echahdi H., Krouile Y. Psychomotor regression due to vitamin B12 deficiency, 2018 и др.).
Наталья Сергеевна Либеранская: Насчет «гормонов стресса» в мясе — звучит сомнительно. Но я скорее против вегетарианства, потому что мне кажется, что в наших реалиях очень сложно правильно соблюдать эту диету, не впадая в дефициты важных питательных веществ. Среди моих пациентов много именно вегетарианцев, и мало кто из них начинал своевременно и грамотно мониторить состояние здоровья. Вегетарианцы действительно склонны к дефициту витаминов В12, железа, и они не получают с пищей нужное количество белка. Поэтому я придерживаюсь позиции, что мясо в умеренном количестве есть все-таки необходимо. Пусть не каждый день, но 1, 2 или 3 раза в неделю оно должно присутствовать в рационе. Но если человек по каким-либо своим, например, по религиозным убеждениям вообще не хочет есть мясо, тогда необходимо мониторить состояние здоровья, и желательно под контролем врача. В12, железо и источники белка необходимо восстанавливать дополнительно, иначе потом в организме могут произойти такие изменения, что решить проблемы со здоровьем будет очень трудно. Сторонники вегетарианской диеты часто говорят, что они таким образом очищаются, оздоравливаются и поэтому чувствуют себя замечательно. Однако в их организме может быть существенный перекос, о котором они могут даже не подозревать. Сами посудите: в рационе вегетарианцев много круп и фруктов — фруктозы. Для молодых людей это еще ничего, но у возрастных пациентов накопленная фруктоза дает нагрузку на печень, и она повышает тот самый инсулин, о котором мы с вами уже говорили. Поэтому нет ничего удивительного, если у взрослых пациентов, которые придерживаются вегетарианской диеты, высокий уровень сахара. А из-за этого развивается диабет и атеросклероз. Поэтому вегетарианцам нужно быть очень аккуратными.
О молоке
До сих пор многие обсуждают «китайское исследование» Колина Кэмпбелла профессора Корнеллского университета.* В частности, что от молока лучше вовсе отказаться, якобы оно гниет в желудке и может спровоцировать рак. Отказ от молока влечет за собой больше пользы или вреда?
*( Campbell, T. Colin, and Campbell, Thomas M. The China Study:The Most Comprehensive Study of Nutrition Ever Conducted and the Startling Implications for Diet, Weight Loss and Long-term Health. BenBella Books, 2006 ).
О биохакинге: «прокачиваемся» и избегаем шарлатанов
Увидела у вас в инстаграме (@doctor_liberanskaya) интересное слово «биохакинг». Поняла это как «умный подход» к «прокачке собственного организма» — начиная от составления диеты, распорядка дня в соответствии с биоритмами, подбора БАДов и гормональных контрацептивов (для женщин), вплоть до психотерапии, которая позволит сохранить мотивацию и самоконтроль, а не бросить все в тот же понедельник. Расскажите, что это за подход, насколько он сейчас актуален и возможно ли с его помощью стать «сверхчеловеком», который все может, чувствует себя бодро и всегда на позитиве?
Наталья Сергеевна Либеранская: Если честно, я не очень люблю этот термин, потому что он отдает чем-то немедицинским. Именно «биохакингом» занимаются не врачи. Всплеск всяких нутрицологов, БАДов и айхербов мы можем наблюдать сейчас в инстаграме. И меня это, если честно, пугает, потому что за красивыми словами «биохакинг», «качество жизни», «долголетие» зачастую прикрываются дилетанты. Я за профессиональный медицинский подход, за обоснованные назначения, а не просто: «Ну я попью какие-нибудь витаминки, вроде так надо». Если у человека есть какая-то проблема, то мы ее изучаем, диагностируем и даем обоснованные назначения. Препараты нужно принимать под контролем врача, потому что иногда даже, казалось бы, безобидные витамины, могут нанести серьезный вред здоровью и организму. Но в принципе сама по себе идея о том, что нужно профилактировать заболевания, вести здоровый образ жизни, правильно питаться, отдыхать, медитировать, спать и принимать какие-то помощники в виде добавок – я это очень приветствую. И мне бы хотелось, чтобы это было адекватно и на профессиональном научно-доказательном уровне. Я бы не стала доверять девочкам-нутрициологам из инстаграма без медицинского образования, которые прошли непонятные курсы и сами себе «биохакят». Более того, они еще набирают группы людей и дают им назначения.
О детоксе
Так ли необходим организму регулярный целенаправленный детокс, или это отголоски очередного модного тренда, и в большинстве случаев организм сам прекрасно справляется с этой задачей?
Наталья Сергеевна Либеранская: Вообще, в нашем организме есть органы, которые этим самым детоксом занимаются: печень, почки, наша кожа. То есть все эти выделительные системы занимаются тем, что инактивируют токсины, которые содержатся в воздухе, бытовой химии и некоторых косметических средствах, образуются в результате переваривания продуктов питания. В норме, то есть в здоровом организме, все должно функционировать так, что все лишнее выводится. Но, к сожалению, в современном мире трудно быть здоровым. С другой стороны, и токсинов в нашем организме слишком много. На это влияют качество воздуха, воды и те консерванты, которые мы получаем с пищей. Не всегда организм справляется с очищением сам, поэтому какие-то детоксы можно проводить. Под этим я подразумеваю, например, коррекцию работы печени, если по анализам мы видим какие-то нарушения. Опять же, это все нужно зафиксировать, а не так, что «сделаю-ка я себе детокс». А зачем? А какой конкретно? Какой орган страдает? Какая фаза? У той же печени несколько фаз детоксикации: нужно учитывать множество параметров. Лучше всего это делать по медицинским показаниям.
О сахарном диабете
Люди с сахарным диабетом ограничены практически во всем. Существует ли лекарство от диабета, и как врач-эндокринолог помогает пациентам справиться с этой проблемой?
Наталья Сергеевна Либеранская: Почему вы так думаете? Вообще, с сахарным диабетом можно очень много чего.
А если человеку предстоит операция? Ведь сахарный диабет является строгим противопоказанием. Нужно постоянно следить за питанием – многие продукты под запретом. Есть зависимость от определенных медикаментов, которые нужно принимать постоянно. Я предполагаю, что с пациентами, страдающими от сахарного диабета, врач работает особым образом и нужна комплексная терапия.
Наталья Сергеевна Либеранская: Вы правы, это действительно довольно тяжелое заболевание. Проблема заключается не только в высоком уровне сахара. Пациенты с сахарным диабетом автоматически попадают в группу очень серьезного риска по развитию сердечно-сосудистых патологий. Правильнее всего, конечно, это заболевание лечить. И я всегда выступаю за то, чтобы предотвратить развитие сахарного диабета на ранних этапах – выявить предпосылки для его развития. Поэтому когда ко мне приходят пациенты (не важно, с какой проблемой), я всегда стараюсь посмотреть, что у него с углеводным обменом, и есть ли какие-нибудь риски. И всегда, даже если есть малейшие изменения в сторону развития сахарного диабета, то мы начинаем это корректировать. Потому что когда диабет уже есть, то очень сложно повернуть ход этого заболевания вспять – сложно корректировать уровень сахара и осложнения, которые в связи с этим возникают.
Таким пациентам назначается комплексная сахароснижающая терапия – назначаются специальные фармпрепараты и диета, которая предполагает ограничение продуктов, которые уровень сахара повышают. В основе сахарного диабета лежит механизм инсулинорезистентности. В своей терапии я еще всегда корректирую пациенту дефициты микроэлементов, витаминов, гормонов. Например, если мы говорим о возрастных пациентах, то нужна коррекция половых гормонов: эстрогена, прогестерона, тестостерона. Нужно восполнять дефицит витамина D, поскольку этот гормон необходим для правильной работы инсулиновых рецепторов. При нехватке витамина D человеку сложно контролировать уровень сахара препаратами.
Дефициты железа и витамина В12 тоже восполняем. Мы работаем и с желудочно-кишечным трактом: нормализуем работу печени и желчного пузыря, если есть какие-либо отклонения, работу кишечника, потому что это тоже важный аспект комплексного лечения диабета.
То есть, снижая таким образом сахар, можно привести его уровень в норму?
Наталья Сергеевна Либеранская: Да, можно компенсировать и отменить инсулинотерапию, особенно если анализы показывают, что у человека есть собственные запасы инсулина в поджелудочной железе.
О режиме дня и правильном сне
Важно ли жить по режиму и циркадианным ритмам? Если да, то почему?
Наталья Сергеевна Либеранская: Да, очень важно. И это, кстати, основная проблема современного человека. Мы все очень поздно ложимся, непонятно как спим. Как эндокринолог, могу вам объяснить, почему так важен правильный сон. Когда мы ложимся спать — желательно это делать до 23:00 — у нас начинает вырабатываться два важных гормона: мелатонин и гормон роста. Производятся они в нашем организме при условии, что мы до 12 часов ночи легли спать. А это наши гормоны молодости и здоровья. Если ежедневно мы ложимся в час, два, три ночи, то мы лишаем себя этих гормонов, и адекватно они у нас уже не вырабатываются. Отсюда возникают и различные нарушения, например, та же прибавка в весе. Ведь если вы не поспали, то на следующий день съедаете больше. А если человек не спит каждую ночь? Важно не только вовремя ложиться спать, но и спать качественно: не так, что вы слышите каждый шорох, вас кто-то будит или вы просыпаетесь, чтобы сходить в туалет.
В идеале нужно ложиться спать в 23 и вставать в 7 утра, не просыпаясь в течение этого времени. Вот тогда это хороший и глубокий сон. Обычно так спят дети и молодые люди. С возрастом люди становятся очень чувствительными: просыпаются от каждого шороха, все слышат. Вот это уже очень плохой и нездоровый сон — значит, есть проблемы, которые обязательно нужно решать. Своим пациентам я всегда говорю, что за час или два до сна нужно обязательно убирать гаджеты — никаких экранов. Не забывайте вечером ставить на определенный ночной режим компьютеры и телефоны, чтобы убрать яркую подсветку — практически у каждого современного гаджета есть эта функция.
Итак, ночью обязательно выключаем подсветки, лампы и гаджеты. Полезны и блэкаут шторы, особенно летом, когда рано рассветает, а в Петербурге начинаются белые ночи. Это же тоже нарушает качество сна. Беруши — в уши, чтобы не слышать шорохов. Если уснуть трудно, то нужны успокоительные, можно принять ванну с магнием.* На самом деле, даже просто чтобы хорошо уснуть, нередко нужно приложить усилия.
*Есть противопоказания (например, беременность). Проконсультируйтесь с врачом!
Сохраняем красоту и молодость изнутри
Мне кажется, вы сейчас не просто перевернули представления наших читателей о здоровом образе жизни, но и очень многих расстроили. Ведь казалось бы, что может быть проще сна? Это очень интересно, большое спасибо! А теперь последний вопрос. Одно из флагманских направлений нашей клиники — это эстетическая медицина: пластическая хирургия и косметология. Скажите, если консультироваться и советоваться с эндокринологом, поможет ли врач этой специализации сохранить молодость и красоту, скажем так, «изнутри»? Можно ли таким образом отсрочить необходимость в фейслифтинге и курсах биоревитализации? Или к эндокринологу с такими «косметическими» вопросами не обращаются обращаются?
Наталья Сергеевна Либеранская: Да, конечно. Вообще, мудрые косметологи нашей клиники пациентов и направляют ко мне. Они видят, что если человек, что называется, стар изнутри, то эффект от инъекций и пластических операций не будет таким впечатляющим. То есть обновление, конечно же, должно идти еще и изнутри. Естественно, те процедуры, которые женщины начинают делать с возрастом, во много раз эффективнее, когда восстановлен внутренний баланс: нет дефицита витаминов и микроэлементов. Я вижу много пациенток, которые, сделав подтяжку лица и устранив глубокие морщины, все равно не выглядят молодыми. Возраст выдают качество кожи, фигура, состояние мышц. Даже если женщина занимается спортом, но у нее нет нужных гормонов, тело не будет выглядеть подтянутым. Поэтому так важно работать с эндокринологом, гинекологом-эндокринологом или урологом, который поможет подобрать пациентке гормональную терапию, и тогда результат бьюти-процедур и эстетических операций будет шикарным. А если мы говорим про молодых девушек, то мониторинг здоровья у врача-эндокринолога поможет отсрочить инъекции.
Подписывайтесь на блог эндокринолога Натальи Сергеевны Либеранской @doctor_liberanskaya, чтобы получать больше полезной медицинской информации!
ГОРМОНЛАЙФ
Компания ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «ГОРМОНЛАЙФ» зарегистрирована 18.10.2019 г. Краткое наименование: ГОРМОНЛАЙФ. При регистрации организации присвоен ОГРН 1197746620202, ИНН 9715365768 и КПП 770301001. Юридический адрес: Г.Москва МУНИЦИПАЛЬНЫЙ ОКРУГ ПРЕСНЕНСКИЙ РАЙОН УЛ 1905 ГОДА 23 ЭТАЖ 1, КОМ. 1,.
Греков Евгений Александрович является генеральным директором организации. Учредители компании — Греков Евгений Александрович, Макшанова Елена Владимировна. Среднесписочная численность (ССЧ) работников организации — 7.
В соответствии с данными ЕГРЮЛ, основной вид деятельности компании ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «ГОРМОНЛАЙФ» по ОКВЭД: 86.90.9 Деятельность в области медицины прочая, не включенная в другие группировки. Общее количество направлений деятельности — 24.
За 2021 год прибыль компании составляет — 13 951 000 ₽, выручка за 2021 год — 58 827 000 ₽. Размер уставного капитала ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «ГОРМОНЛАЙФ» — 50 000,00 ₽. Выручка на начало 2021 года составила 6 157 000 ₽, на конец — 58 827 000 ₽. Себестоимость продаж за 2021 год — 40 280 000 ₽.
На 01 сентября 2022 организация действует.
У компании ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «ГОРМОНЛАЙФ» есть торговые марки, общее количество — 1, среди них HORMONE LIFE HL SPORTS ENDOCRINOLOGIST КЛИНИКА СПОРТИВНОЙ РЕПРОДУКТИВНОЙ ANTIAGE ЭНДОКРИНОЛОГИИ. Первая торговая марка зарегистрирована 28 октября 2020 г. — действительна до 1 мая 2030 г.
Юридический адрес ГОРМОНЛАЙФ, выписка ЕГРЮЛ, аналитические данные и бухгалтерская отчетность организации доступны в системе.
Профиль
Аналитика и проверка
Аналитический отчет, его расшифровка и рекомендации на основании 1500 факторов из 50-ти источников с учетом чёрных списков
Данные по финансовым показателям приведены на основании бухгалтерской отчетности
Возраст-ассоциированные заболевания и менопаузальная гормональная терапия — фокус на прогестагены

Гормональная терапия является наиболее эффективным методом лечения симптомов менопаузы. Польза применения менопаузальной гормональной терапии перевешивает риски у соматически здоровых женщин. Однако ситуация усложняется у женщин с одним или несколькими хр
Резюме. Гормональная терапия является наиболее эффективным методом лечения симптомов менопаузы. Польза применения менопаузальной гормональной терапии перевешивает риски у соматически здоровых женщин. Однако ситуация усложняется у женщин с одним или несколькими хроническими заболеваниями. Это в первую очередь возраст-ассоциированные заболевания, такие как гипертоническая болезнь, ожирение, жировая болезнь печени, атеросклероз, сахарный диабет 2 типа, а также варикозная болезнь вен нижних конечностей и другие. В патогенезе перечисленных состояний участвуют факторы, находящиеся под гормональным контролем, поэтому применение гормоноактивных соединений может оказать как саногенетическое влияние, так и усугубить болезненное состояние пациентки. Оптимизация менопаузальной гормональной терапии требует углубленной информации о влиянии гормонов и их синтетических аналогов на биохимические контрольные точки возраст-ассоциированных заболеваний. Фармакологический эффект менопаузальной гормональной терапии зависит не только от дозы и длительности, но и от времени старта, что переводит применение гормонов из терапевтической в профилактическую плоскость. Гестагенный компонент менопаузальной гормональной терапии за счет дополнительных свойств может снижать положительный метаболический эффект эстрогена. Сравнительный анализ свойств гестагенов показал, что микронизированный прогестерон и дидрогестерон являются наиболее безопасными вариантами, с более низким риском сердечно-сосудистых заболеваний, тромбоэмболии и рака молочной железы по сравнению с другими прогестагенами и служат препаратами выбора у женщин с высокой плотностью ткани молочной железы, диабетом, ожирением, курящих и с факторами риска венозной тромбоэмболии. Фармакокинетическое профилирование показывает ряд преимуществ дидрогестерона: надежный количественный учет, отсутствие биологически активных метаболитов (меньше побочных эффектов, в том числе центральных), меньше противопоказаний к назначению. В этой статье мы представляем данные, касающиеся особенностей использования менопаузальной гормональной терапии у женщин с хроническими заболеваниями, такими как ожирение, гипертония, дислипидемия, диабет, венозная тромбоэмболия.
Преимущества менопаузальной гормональной терапии (МГТ) перевешивают риски у более молодых соматически здоровых женщин с симптомами менопаузы в возрасте до 60 лет и в течение 10 лет постменопаузы [1]. Однако около 80% женщин старше 55 лет имеют хотя бы одно хроническое заболевание [2]. Это в первую очередь возраст-ассоциированные заболевания, такие как гипертоническая болезнь (ГБ), ожирение, жировая болезнь печени, атеросклероз, сахарный диабет (СД) 2 типа, а также варикозная болезнь вен нижних конечностей и др. В патогенезе перечисленных состояний участвуют факторы, находящиеся под гормональным контролем, поэтому применение гормоноактивных соединений может оказать как саногенетическое влияние, так и усугубить болезненное состояние пациентки. Дополнительную особенность применению МГТ придает патогенез заболеваний, являющихся противопоказанием к назначению МГТ. Пример – ишемическая болезнь сердца (ИБС), которая развивается у женщин в том числе по причине длительного дефицита эндогенных эстрогенов. Следовательно, вовремя начатая терапия не даст появиться и причинам отказа от нее.
Препараты МГТ
Эстроген является основным компонентом МГТ, облегчающим вазомоторные и урогенитальные симптомы менопаузы у женщины и защищающим от остеопороза [3]. Введенный в начале менопаузы эстроген также ослабляет атеросклеротический процесс, тем самым защищая женщин от ИБС, что особенно важно у женщин с ранней менопаузой [4]. Женщинам с интактной маткой дополнительно требуется гестагенный компонент в составе МГТ для предотвращения гиперплазии и снижения риска рака эндометрия [5].
Фармакология прогестагенов
Прогестагены — это собирательный термин, который включает природный прогестерон, дидрогестерон (стерео-изомер прогестерона) и ряд синтетических соединений, имитирующих действие эндогенного прогестерона. Хотя прогестагены значительно различаются по своей молекулярной структуре, все они являются производными прогестерона, тестостерона или спиронолактона. Прогестагены, используемые для МГТ в клинической практике в Европе, включают прогестерон, дидрогестерон, медроксипрогестерона ацетат, норэтистерона ацетат (норэтиндрон), номегестрола ацетат, левоноргестрел и диеногест.
Помимо связывания с рецепторами прогестерона, прогестагены могут в разной степени взаимодействовать с другими ядерными рецепторами (андрогенов, глюкокортикоидов и минералокортикоидов), и это может обеспечивать как дополнительные метаболические бонусы, так и влиять на переносимость препаратов. Например, андрогенные прогестагены могут противодействовать влиянию эстрогена на углеводный и липидный обмен, синтез факторов свертывания крови и фибринолиза, ангиотензиногена и гормоносвязывающих глобулинов. Так, прогестагены с глюкокортикоидной активностью могут повышать прокоагулянтную активность. Андрогенные прогестагены могут ослаблять вызванную эстрогеном гиперкоагуляцию и риск венозной тромбоэмболии (ВТЭ) [6]. Прогестагены с антиандрогенным действием могут быть полезны для лечения андрогенных кожных проявлений. Прогестагены с антиминералокортикоидными свойствами могут вызывать временное уменьшение вызванной альдостероном задержки жидкости у предрасположенных пациентов, борясь с отечностью и снижая артериальное давление (АД) [7]. Выбор прогестагена для МГТ требует понимания всех рисков и преимуществ, связанных с их метаболическими профилями. Хотя прямых клинических сравнений прогестагенов не проводилось, данные о биологическом и клиническом воздействии отдельных прогестагенов на эндометрий, молочные железы, сердечно-сосудистую систему (ССС), кости и головной мозг уже рассматривались ранее [5, 8].
Прогестагены для МГТ доступны в виде отдельных препаратов для параллельного применения с локальными эстрогенами или в виде фиксированных комбинаций с эстрадиолом для системного применения. Наличие нескольких вариантов лекарственных форм МГТ облегчает индивидуализацию лечения с точки зрения дозировки и состава. Пути введения МГТ включают пероральный, вагинальный, чрескожный и внутриматочный (интраназальный и сублингвальный пока не получили широкого применения). Прогестерон для использования в МГТ микронизируется для повышения его биодоступности, его обычно вводят перорально, вагинально или трансдермально [9]. Дидрогестерон может применяться перорально в качестве монотерапии (Дюфастон®), а также в комбинации с эстрадиолом (Фемостон®). Другие прогестагены обычно вводят перорально, хотя некоторые из них доступны в виде внутриматочной системы (левоноргестрел) или могут быть включены в состав трансдермального пластыря с эстрогеном.
При выборе лечения необходимо учитывать преимущества и недостатки, связанные с каждым путем введения. В частности, для получения положительных эффектов эстрогена на углеводный и липидный метаболизм, в реализации которых ведущую роль играет печень, необходимо его пероральное введение. Однако печень опосредует эффект эстрадиола на синтез прокоагулянтных факторов, поэтому у пациентов с высоким риском ВТЭ эстроген должен миновать печень, в этих случаях предпочтительно его трансдермальное введение. Сразу отметим, что такой путь введения не обеспечивает в должной мере положительных метаболических эффектов эстрогенов. Но даже чрескожное введение эстрадиола повышает пролиферацию эндометрия, которой должны противодействовать прогестагены. Из прогестагенов с благоприятным метаболическим профилем предпочтительны прогестерон и дидрогестерон. Трансдермальный микронизированный прогестерон практически весь метаболизируется в коже и не способен защитить эндометрий, таким пациенткам локальную форму эстрогена целесообразно поддерживать пероральным прогестином.
Поскольку риски и преимущества МГТ различаются в зависимости от типа, дозы, состава, пути введения, продолжительности использования и времени начала лечения [10], лечащие врачи должны быть хорошо информированы для оптимизации лечения [11]. МГТ, включая ее прогестагенный компонент, должна быть адаптирована к каждой женщине и иметь самый безопасный профиль в отношении рака молочной железы (РМЖ) и ССС, а также учитывать специфические потребности пациентки и цели лечения.
Выбор прогестагена
Переносимость прогестагенов у женщин значительно различается. Терапию следует начинать с прогестагена с наиболее благоприятным профилем безопасности [12]. Международные и национальные научные общества по менопаузе рекомендуют из всех гестагенов в МГТ применять микронизированный прогестерон или дидрогестерон в дополнение к эстрогенам для снижения рисков сердечно-сосудистых заболеваний (ССЗ), тромбоэмболии и РМЖ [13]. Прогестерон и дидрогестерон с меньшей вероятностью, чем андрогенные прогестагены, ослабляют положительное влияние эстрогенов на метаболизм липопротеинов, что может иметь значение для пациентов с высоким риском ССЗ [14].
Назначение МГТ
Цель ведения женщин в постменопаузе предполагает не только устранение первоначальных симптомов, но и уменьшение рисков отдаленных постменопаузальных событий. МГТ является частью общей стратегии курации пациенток старшей возрастной группы, которая включает изменения образа жизни, направленные на укрепление здоровья, такие как воздержание от курения, здоровое питание, регулярная физическая активность, умеренное потребление алкоголя и контроль веса [15].
Руководящие принципы МГТ требуют начинать терапию с самой низкой эффективной дозы и повышать ее по мере необходимости в зависимости от клинического ответа [16]. Полностью эффективная доза будет варьировать в зависимости от возраста, типа и тяжести симптомов, индекса массы тела (ИМТ), времени после менопаузы и толщины эндометрия. Доза будет нуждаться в корректировке в течение терапии [10].
В Европе предпочтительным эстрогеном для МГТ является эстрадиол, а предпочтительным прогестагеном – обычно микронизированный прогестерон или дидрогестерон. Оценка риска для выявления сопутствующих заболеваний необходима всем кандидаткам на МГТ, для чего в настоящее время разработаны специальные инструменты:
1) оценка риска остеопороза (FRAX®);
2) РМЖ (IBIS);
3) ССЗ (SCORE);
4) диабета (QDiabetes®) [8].
В целом оценка сопутствующих заболеваний может дать информацию о выборе препарата и пути его введения для минимизации рисков.
Метаболические нарушения
У женщин в возрасте 50-59 лет, которым требуется помощь для облегчения симптомов менопаузы, МГТ может улучшить профиль сердечно-сосудистого риска путем изменения определенных метаболических параметров [17]. Эстроген благотворно влияет на уровень глюкозы в крови, чувствительность тканей к инсулину, уровни холестерина липопротеинов низкой (Хс-ЛПНП) и высокой (Хс-ЛПВП) плотности [18]. Прогестагены по своей способности противодействовать положительным метаболическим эффектам эстрогенов можно расположить в следующей последовательности (от наименьшего к наибольшему): дидрогестерон и медрогестон, прогестерон, ципротерона ацетат, медроксипрогестерона ацетат, трансдермальный норэтиндрона ацетат, норгестрел и пероральный норэтиндрона ацетат [8, 19].
Дислипидемия
Менопаузальный переход сопровождается изменениями ряда показателей липидного обмена. Уровни общего холестерина, Хс-ЛПНП и аполипопротеина В резко возрастают в этот период и не зависят от возраста [20]. У женщин в постменопаузе уровни триглицеридов (ТГ) и Хс-ЛПВП в крови являются более важными факторами риска ССЗ, чем у мужчин [21]. Хотя все эстрогены снижают уровень Хс-ЛПНП и повышают уровень Хс-ЛПВП, параллельно они повышают уровень ТГ. Путь введения эстрогена также влияет на параметры липидного метаболизма. Повышение уровня ТГ и Хс-ЛПВП в основном наблюдается при пероральной монотерапии эстрогенами, тогда как комбинация эстрогена и гестагена чаще приводит к меньшему эффекту, в то время как трансдермальные эстрогены не показали эффективности по данному параметру в краткосрочных исследованиях [22]. Однако долгосрочные исследования показывают, что трансдермальный эстроген может привести к снижению общего уровня холестерина и Хс-ЛПНП без существенного влияния на уровни Хс-ЛПВП и ТГ. Дидрогестерон и левоноргестрел (в составе внутриматочной системы) практически нейтральны в этом отношении и не препятствуют эффектам эстрогена.
Таким образом, трансдермальное введение эстрогена может быть наиболее подходящим у женщин с гиперлипидемией и гипертриглицеридемией, тогда как пероральный эстроген больше подходит женщинам с низким уровнем Хс-ЛПВП. Среди прогестагенов, обычно используемых в составе МГТ, прогестерон, дидрогестерон [23] и номегестрола ацетат оказывают нейтральное влияние на эстроген-индуцированные модификации липидов крови; андрогенные гестагены противодействуют эффектам эстрогена – норэтистерона ацетат ослабляет благотворное влияние эстрадиола на Хс-ЛПВП, но благоприятно влияет на уровень ТГ, Хс-ЛПНП и Хс-ЛПОНП; и антиандрогенные гестагены (дроспиренон) не мешают эстрогенам [14].
При анализе вопроса о применении МГТ у женщины с дислипидемией ее общий риск ССЗ следует рассматривать в контексте сопутствующих заболеваний, влияющих на этот риск. МГТ следует избегать у женщин с уже существующими ССЗ и с их высоким риском. У женщин моложе 60 лет и в течение 10 лет после последней менструации МГТ оказывает благоприятное или нейтральное влияние на показатели липидного обмена и общий риск ССЗ.
Ожирение
Согласно статистике Всемирной организации здравоохранения (ВОЗ) за 2016 г., почти половина всех взрослых женщин в мире страдают избыточным весом (ИМТ – 25-29,9 кг/м 2 ) или ожирением (ИМТ ≥ 30 кг/м 2 ) [24]. Показатели ожирения заметно увеличиваются с возрастом [25]. Важно, что увеличивается не просто ИМТ, а растет доля висцеральной жировой ткани, ассоциированной с высоким риском таких метаболических осложнений, как СД 2 типа, ГБ, дислипидемия, метаболический синдром и, в конечном итоге, ИБС [26]. Прибавка веса у женщин в переходный период является следствием как хронологического старения [27], так и дефицита эстрогенов [28].
Помимо метаболических осложнений и повышенного риска ИБС, ожирение повышает риск ВТЭ и некоторых гормонозависимых видов рака, включая РМЖ и рак эндометрия. Эти факторы необходимо учитывать при принятии решений относительно применения МГТ. С другой стороны, женщины в перименопаузе с ожирением чаще сообщают о более тяжелых менопаузальных симптомах, что актуализирует их потребность в эффективных методах лечения.
В исследовании Postmenopausal Estrogen/Progestin Interventions (PEPI) женщины, получавшие эквилинэстрогены (в комбинации с гестагеном или без), весили примерно на 1 кг меньше женщин из группы плацебо после 3-летнего периода наблюдения [29]. Использование МГТ не подходит и не рекомендуется для лечения абдоминального ожирения, но если такая терапия используется для коррекции менопаузальных симптомов, то она, вероятно, приведет к профилактике ожирения. Очевидно, что положительное действие эстрогена на липидный обмен осуществляется за счет его эффектов на печень и выражено в большей степени при пероральном применении МГТ по сравнению с трансдермальным путем введения [30].
Сахарный диабет
Имеются убедительные доказательства того, что МГТ улучшает гликемический контроль и резистентность к инсулину у женщин в постменопаузе с СД 2 типа и без него. Положительный эффект МГТ на углеводный обмен, по-видимому, является результатом множества физиологических механизмов, включая изменения в распределении жира с уменьшением висцерального ожирения, снижением резистентности к инсулину и усилением секреции инсулина. Пероральные эстрогены имеют преимущество в отношении улучшения чувствительности тканей к инсулину по сравнению с биоэквивалентными трансдермальными дозами эстрадиола.
Учитывая благотворное влияние МГТ на углеводный обмен и другие компоненты метаболического синдрома, не следует избегать применения МГТ у женщин в постменопаузе с СД 2 типа, ее следует подбирать индивидуально. Женщины с СД 2 типа могут быть отличными кандидатами на МГТ при соответствующих клинических обстоятельствах и после оценки риска ССЗ и симптомов менопаузы. У пациенток с СД 2 типа с нормальным весом и низким риском ССЗ пероральный эстроген будет предпочтительнее [31]. У женщин с ожирением, СД 2 типа и повышенным риском ССЗ трансдермальное введение эстрогена обладает преимуществом из-за более благоприятного воздействия на маркеры воспаления и ТГ, а также более низкого риска ВТЭ. В любом случае прогестагены с нейтральным влиянием на метаболизм глюкозы, такие как микронизированный прогестерон или дидрогестерон, следует использовать у женщин с резистентностью к инсулину или СД 2 типа [32].
Гипертония
Артериальная гипертония (АГ) – наиболее распространенный модифицируемый фактор риска ССЗ. Она чаще встречается у мужчин, чем у женщин, в возрасте до 50 лет, но ситуация диаметрально меняется в старшем возрасте [33]. Более того, неблагоприятные сосудистые изменения, вызванные гипертонией, не только развиваются раньше у женщин, но и прогрессируют быстрее [34]. Факторы риска АГ у женщин в постменопаузе включают генетическую предрасположенность, старение, ожирение, отсутствие физической активности, повышенное потребление натрия, диабет и преэклампсию в анамнезе [35]. АГ не является противопоказанием для МГТ, однако следует контролировать АД, чтобы свести к минимуму риск ССЗ.
Женщины имеют более низкое АД до перехода к менопаузе, что позволяет предположить, что дефицит половых гормонов играет заметную роль в генезе гипертонии [36]. Однако продольные и перекрестные исследования связи между менопаузальным статусом и изменениями АД дали противоречивые результаты [37]. Повышенная предрасположенность к АГ у женщин среднего возраста может быть результатом хронологического старения. МГТ иногда избегают у женщин с АГ из-за убеждения, что она оказывает неблагоприятное влияние на АД. Однако текущие научные данные, в том числе данные рандомизированных контролируемых клинических испытаний, не подтверждают отрицательного влияния МГТ на АД у молодых женщин в постменопаузе с нормотензией или гипертонией [38].
Влияние эстрогенов на АД является многофакторным и связано с индивидуальной реакцией пациента [39]. Эстрогены могут снижать АД за счет усиления вазодилатации, как эндотелий-зависимой, так и независимой, за счет уменьшения выброса адреналина и норадреналина и нормализации вегетативного контроля ССС. С другой стороны, эстрогены могут стимулировать синтез ангиотензина в печени, что, в свою очередь, повышает уровень альдостерона в плазме за счет активации ренин-ангиотензиновой системы (РАС). Поэтому у предрасположенных женщин эстрогены могут вызывать задержку натрия и воды. Трансдермальный эстроген в низких дозах может быть предпочтительнее у пациенток с АГ [16].
Прогестины по-разному влияют на обмен натрия – от чрезмерной задержки до стимуляции его секреции. Прогестерон конкурирует с альдостероном, вызывая дозозависимый натрийуретический эффект. Дроспиренон оказывает антиминералокортикоидное действие, о чем свидетельствует повышение активности ренина и концентрации альдостерона в плазме. При назначении МГТ, содержащей эстрадиол с норэтистероном, наблюдается увеличение как систолического, так и диастолического АД у женщин с АГ, возможно, из-за андрогенной активности [40]. И наоборот, показано снижение АД у женщин в ответ на прием эстрадиола с дидрогестероном или эстрадиола с гестоденом. Таким образом, общее влияние МГТ на АД связано с индивидуальной реакцией на активацию РАС, а с другой стороны, с дозой и типом используемых молекул.
Микронизированный прогестерон, дидрогестерон и дроспиренон противодействуют эффекту удержания натрия эстрогенами. Этим прогестинам следует отдавать предпочтение у пациенток с пограничной гипертензией и у всех женщин с тенденцией к задержке натрия [41]. Однако дроспиренон кроме антиминералокортикоидной активности несет антиандрогенный потенциал, который может объяснять выявленную способность дроспиренона удлинять интервал QTc [42]. Этот факт был подтвержден Европейской базой данных фармаконадзора, которая показала более высокую частоту сообщений о подозрении на желудочковые аритмии, вызванные препаратами, содержащими дроспиренон, по сравнению с левоноргестрелом. Авторы настаивают на необходимости дополнительных исследований для проверки связи антиандрогенности гестагена с удлинением интервала QTc. Тем не менее, независимо от механизма, для дроспиренона показано потенциальное проаритмогенное действие, которое может повышать риск ССЗ.
При принятии решения о применении препаратов МГТ у женщины с предшествующей АГ следует учитывать ее общий риск ССЗ. Использование МГТ целесообразно для лечения беспокоящих симптомов менопаузы у женщин в возрасте до 60 лет, в течение 10 лет после последнего менструального цикла и не подверженных высокому риску ССЗ.
Венозная тромбоэмболия
Годовая заболеваемость ВТЭ составляет 117 на 100 000 человек, частота увеличивается с возрастом, почти удваиваясь у женщин в возрасте от 25 до 50 лет (от 51 до 123 на 100 000 в год) [43]. К факторам риска ВТЭ, характерным для женщин, относятся беременность и использование комбинированных пероральных контрацептивов. Другие факторы риска, связанные с ВТЭ, включают ожирение, обширные хирургические вмешательства, травмы, неподвижность, злокачественные новообразования, предшествующую тромбоэмболию и курение [44]. Варикозная болезнь вен нижних конечностей не является непосредственным фактором риска тромбозов, а следовательно, и противопоказанием к назначению МГТ. Риск ВТЭ при использовании МГТ (доза эстрадиола более 0,5 мг) в целом повышен по сравнению с плацебо, но этот риск ниже, если лечение начато в течение 10 лет после последней менструации [45]. При этом тип, доза, форма и способ введения МГТ влияют на риски ВТЭ. Снижение дозы перорального эстрогена может снизить риск по сравнению с его стандартными (1 мг) и высокими дозами [46]. Ультранизкие дозы эстрадиола (0,5 мг) положительно влияют на систему гемостаза за счет активации фибринолиза и отсутствия эффекта на синтез тромбина и поэтому могут рассматриваться как безопасные даже у женщин с наличием косвенных факторов риска венозного тромбоза (варикозной болезни вен нижних конечностей, избыточной массы тела, гиподинамии и пр.) [47]. Ряд исследований ранее позволял предположить, что трансдермальный путь, возможно, ассоциирован с наименьшим риском тромбоэмболии [48]. Однако в недавнем исследовании было показано, что путь введения эстрогена (пероральный vs трансдермальный) не влияет на риск венозных тромбозов [49]. При этом тип гестагена, используемого женщинами с интактной маткой, влияет на риск ВТЭ: так, микронизированный прогестерон и дидрогестерон [50] связаны с наименьшим риском ВТЭ, чем другие гестагены [51].
У женщин с ВТЭ в анамнезе следует рассмотреть негормональные варианты лечения симптомов менопаузы (фито-эстрогены на основе транс-ресвератрола [52]).
По данным некоторых авторов, комбинация трансдермального эстрогена в сочетании с дидрогестероном или микронизированным прогестероном может быть связана с наименьшим риском ВТЭ [53]. Однако микронизированный прогестерон не всегда хорошо переносится пациентками из-за его влияния на центральную нервную систему. Как стерео-изомер прогестерона, дидрогестерон не проявляет таких эффектов и может быть использован в качестве оптимальной альтернативы. Фармакокинетическое профилирование показывает ряд особенностей дидрогестерона относительно прогестерона (микронизированного) [19]: более высокая активность (дозы для защиты эндометрия 5-10 мг vs 100-300 мг), лучшая биодоступность (28% vs
1 Институт биодизайна и моделирования сложных систем, Научно-технологический парк биомедицины, Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И. М. Сеченова Министерства здравоохранения Российской Федерации; 119019, Россия, Москва, Никитский бульвар, 13
2 Федеральное государственное автономное образовательное учреждение высшего образования Российский национальный исследовательский медицинский университет имени Н. И. Пирогова Министерства здравоохранения Российской Федерации; 117997, Россия, Москва, ул. Островитянова, 1
Сведения об авторе:
Карева Елена Николаевна, д.м.н., профессор, кафедра фармакологии Института биодизайна и моделирования сложных систем, Научно-технологический парк биомедицины, Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И. М. Сеченова Министерства здравоохранения Российской Федерации; 119019, Россия, Москва, Никитский бульвар, 13; кафедра молекулярной фармакологии и радиобиологии, Федеральное государственное автономное образовательное учреждение высшего образования Российский национальный исследовательский медицинский университет имени Н. И. Пирогова Министерства здравоохранения Российской Федерации; 117997, Россия, Москва, ул. Островитянова, 1; kareva_e_n@staff.sechenov.ru
Information about the author:
Elena N. Kareva, Dr. of Sci. (Med.), Professor, Department of Pharmacology, Institute of Biodesign and Complex Systems Modeling, Science and Technology Park of Biomedicine, Institute of Biodesign and Complex Systems Modeling, Science and Technology Park of Biomedicine, Federal State Autonomous Educational Institution of Higher Education Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation; 13 Nikitsky Boulevard, Moscow, 119019, Russia; Department of Molecular Pharmacology and Radiobiology, Federal State Autonomous Educational Institution of Higher Education Pirogov Russian National Research Medical University Ministry of Health of the Russian Federation; 1 Ostrovityanov str., Moscow, 117997, Russia; kareva_e_n@staff.sechenov.ru
Возраст-ассоциированные заболевания и менопаузальная гормональная терапия – фокус на прогестагены/ Е. Н. Карева
Для цитирования: Карева Е. Н. Возраст-ассоциированные заболевания и менопаузальная гормональная терапия – фокус на прогестагены // Лечащий Врач. 2022; 3 (25): 27-33. DOI: 10.51793/OS.2022.25.3.004
Теги: менопауза, климактерические состояния, дефицит эндогенных эстрогенов
Многоликий грелин: как он работает
Что такое грелин, откуда он берется, каковы его функции? Об этом, и о других интересных вещах читайте в статье MedAboutMe.
Гормоны насыщения и голода
Ощущение сытости и голода регулируют в организме два пептида, лептин и грелин. Первый «отвечает» за чувство сытости. Второй пептид, грелин, был открыт совсем недавно — в 1999 году. Все его функции до сих пор изучаются, но кое-что уже известно ученым.
Грелин вырабатывается преимущественно слизистой оболочкой пустого желудка, а когда этот орган наполняется и принимается за работу — секреция грелина снижается. Но клетки, продуцирующие грелин, есть и в других органах — в поджелудочной железе, в почках, легких, в кишечнике, а также в половых железах и в плаценте. Недавними исследованиями было доказано, что грелин может также вырабатываться в ядре гипоталамуса.
Попадая в кровь, грелин «путешествует» по организму, вступая в контакт с грелиновыми рецепторами, которые тоже расположены почти по всему телу. Но основной «центр управления» находится в головном мозге, куда грелин также приносит кровь. Там и происходят основные реакции, в которых задействован этот небольшой, составленный всего из 28 аминокислот, пептид.
Функции грелина
Грелин стимулирует аппетит, одновременно тормозя выработку лептина — своего антагониста.
Помимо чувства голода грелин влияет на множество других процессов, среди которых нет неважных. Но есть интересная особенность у этого гормона: на грелин ацилированный, то есть присоединивший к своей молекуле вместо атома водорода октановую кислоту, специфический грелиновый рецептор не реагирует, хотя гормон сохраняет активность на ряд важных процессов в организме.
Что же зависит от уровня грелина?
Грелин и ожирение
Система регуляции голода-сытости тесно связана с запасами энергии в организме, и, соответственно, с массой тела.
Человек голоден — у него в пустом желудке вырабатывается много грелина, стимулирующего аппетит и толкающего на поиски пищи. Когда пища найдена, тот же грелин «включает» центр удовольствия от утоления голода. При этом его выработка снижается, и на первый план выходир антагонист грелина, лептин, формирующий ощущение сытости и «выключающий» аппетит. Потом желудок постепенно освобождается, и через несколько часов секреция грелина возобновляется. Когда его уровень возрастает — человек вновь ощущает голод и готов отправляться на поиски еды.
Но так все работало бы, если бы не вмешалась цивилизация, позволившая человеку обладать большим количеством калорийной пищи без больших затрат физической энергии. Иными словами, чтобы набить желудок, в какой-то момент перестало быть нужным сначала основательно потрудиться, или побегать за добычей, или пройти десяток километров в поисках съедобных корешков. Человек стал есть больше необходимого, меньше двигаться. А организм продолжал запасать энергию в виде жира, как «научила» эволюция. И начались сбои.
Например, выяснилось, что у людей с избыточным весом после наполнения желудка уровень грелина в крови не снижается в той же мере, как у людей с нормальным или худощавым телосложением. То есть, аппетит у полных более «долгоиграющий», они склонны съедать больше, несмотря на то, что у них и энергии в жировых отложениях запасено больше. И еще это мешает худеть: постоянно высокий уровень грелина побуждает срывать диету. Дело осложняется еще и тем, что люди с избыточным весом более чувствительны к грелину, то есть склонны к перееданию под его действием в большей степени, чем стройные.
Одновременно высокой уровень грелина уменьшает активность бурых жировых клеток, задача которых — сжигать калории.
Замечено, что снизить уровень грелина помогает, в частности, операция по уменьшению желудка. Это связано с тем, что при гастрэктомии удаляется именно та часть желудка, в которой расположено наибольшее число клеток, вырабатывающих грелин.
Но слишком сильно снижать уровень этого гормона не стоит, ведь он выполняет ряд важнейших функций в организме. Как же достичь баланса?
Методы регуляции уровня грелина
Рекомендации несложные, и всем давно знакомые: это рациональное питание, здоровый сон и отсутствие стрессов. Скучно, зато действенно, и жизнь продлевает.
Питание должно быть сбалансированным, без избытка сахара и жира, с преобладанием свежих овощей и легкоусвояемого белка. Рекомендуем к ознакомлению статью «Лептиновая диета: путь к снижению веса?», в которой описаны основные принципы такого питания.
Очень важен нормальный по продолжительности ночной сон. Выработка грелина зависит от времени суток, и нарушение естественных ритмов сна и бодрствования сбивает этот механизм. Уменьшение времени ночного сна с 8 часов до 5 вызывает увеличение выработки грелина на 15%. У тех, кто не придерживается правильного режима сна, даже после насыщения не происходит снижения уровня грелина, а еще увеличивается тяга к крахмалистым, сладким, жирным продуктам, от которых вес растет как на дрожжах.
Отсутствие нормального распорядка жизни способствует и увеличению уровня стресса, что также ведет к повышенной выработке грелина.
Так что, для начала стоит просто навести порядок в собственном образе жизни, и этого может хватить для того, чтобы постепенно избавиться от лишнего веса и укрепить здоровье.
Американская ассоциация диетологов рекомендует для снижения уровня грелина следующее:
Соблюдение этих рекомендаций поможет поддерживать здоровый баланс в организме в целом, и уровень грелина — только один из аспектов.
Гипогликемический синдром: причины, диагностика
Глюкоза — важнейший компонент процессов метаболизма человека. Являясь источником энергии для жизнедеятельности клеток и, в частности, клеток мозга, она выполняет в организме пластические функции.
Глюкоза — важнейший компонент процессов метаболизма человека. Являясь источником энергии для жизнедеятельности клеток и, в частности, клеток мозга, она выполняет в организме пластические функции.
Внутри клеток свободная глюкоза практически отсутствует. В клетках глюкоза накапливается в виде гликогена. В ходе окисления она превращается в пируват и лактат (анаэробный путь) или в углекислый газ (аэробный путь), в жирные кислоты в виде триглицеридов. Глюкоза является составной частью молекулы нуклеотидов и нуклеиновых кислот. Глюкоза необходима для синтеза некоторых аминокислот, синтеза и окисления липидов, полисахаридов.
Концентрация глюкозы в крови человека поддерживается в относительно узких пределах — 2,8–7,8 ммоль/л, вне зависимости от пола и возраста, несмотря на большие различия в питании и физической активности (постпрандиальная гипергликемия — повышение уровня глюкозы в крови после приема пищи, стрессовых факторов и ее снижение через 3–4 часа после приема пищи и физической нагрузки). Это постоянство обеспечивает ткани мозга достаточным количеством глюкозы, единственного метаболического топлива, которое они могут использовать в обычных условиях.
В зависимости от способа поступления глюкозы все органы и ткани организма делятся на инсулинозависимые: глюкоза поступает в эти органы и ткани только при наличии инсулина (жировая ткань, мышцы, костная, соединительная ткань); инсулинонезависимые органы: глюкоза попадает в них по градиенту концентрации (головной мозг, глаза, надпочечники, гонады); относительно инсулинонезависимые органы: в качестве питательных веществ ткани этих органов используют свободные жирные кислоты (сердце, печень, почки). Поддержание глюкозы в определенных пределах — важная задача сложной системы гормональных факторов. Каждый раз при приеме пищи повышается уровень глюкозы и параллельно растет уровень инсулина. Инсулин способствует поступлению глюкозы в клетки, что не только предотвращает существенное увеличение ее концентрации в крови, но также обеспечивает глюкозой внутриклеточный метаболизм.
Концентрация инсулина в период голодания колеблется около 10 мкЕд/мл и повышается до 100 мкЕд/мл после обычного приема пищи, достигая максимальных значений через 30–45 минут после еды. Это влияние опосредуется через АТФ-чувствительные калиевые каналы, которые состоят из белковых субъединиц SUR-1 и Kir 6.2. Поступающая в бета-клетку глюкоза при участии фермента глюкокиназы подвергается превращению с образованием АТФ. Повышение АТФ способствует закрытию калиевых каналов. Концентрация калия в цитозоле клетки увеличивается. Таким же образом на эти каналы действуют и метаболиты глютамата, через окисление ферментом глютаматдекарбоксилазой. Повышение калия в клетке вызывает открытие кальциевых каналов, и кальций устремляется в клетку. Кальций способствует переносу секреторных гранул к периферии клетки и последующему выделению инсулина в межклеточное пространство, а затем в кровь [1]. Пищевыми секретогенами инсулина являются аминокислоты (лейцин, валин и др.). Их эффект усиливается гормонами тонкого кишечника (желудочный ингибирующий полипептид, секретин). Другие вещества стимулируют его выделение (препараты сульфанилмочевины, агонисты бета-адренорецепторов).
В кровь глюкоза поступает разными путями. После приема пищи, в течение 2–3 часов, экзогенные углеводы служат основным источником гликемии. У человека, занимающегося физическим трудом, в пище должно содержаться 400–500 г глюкозы. Между приемами пищи большая часть глюкозы в циркулирующую кровь поставляется за счет гликогенолиза (накопленный гликоген в печени разрушается до глюкозы, а гликоген в мышцах до лактата и пирувата). При голодании и истощении запасов гликогена глюконеогенез становятся источником глюкозы в крови (образование глюкозы из неуглеводных субстратов: лактата, пирувата, глицерина, аланина).
Большая часть пищевых углеводов представлена полисахаридами и состоит в основном из крахмалов; меньшая часть содержит лактозу (молочный сахар) и сахарозу. Переваривание крахмалов начинается в ротовой полости с помощью птиалина слюны, который продолжает свое гидролитическое действие и в желудке, пока pH среды не становится слишком низким. В тонком кишечнике амилаза поджелудочной железы расщепляет крахмалы до мальтозы и других полимеров глюкозы. Ферменты лактаза, сахараза и альфа-декстриназа, которые выделяются эпителиальными клетками щеточной каемки тонкой кишки, расщепляют все дисахариды на глюкозу, галактозу и фруктозу. Глюкоза, составляющая более 80% конечного продукта переваривания углеводов, сразу всасывается и поступает в воротный кровоток.
Глюкагон, синтезируемый А-клетками островков Лангерганса, изменяет доступность субстратов в интервалах между приемами пищи. Стимулируя гликогенолиз, он обеспечивает достаточный выход глюкозы из печени в ранний период времени после еды. По мере истощения запасов гликогена в печени, глюкагон вместе с кортизолом стимулируют глюконеогенез и обеспечивают поддержание нормальной гликемии натощак.
Во время ночного голодания глюкоза синтезируется исключительно в печени и ее большую часть (80%) потребляет головной мозг. В состоянии физиологического покоя интенсивность обмена глюкозы составляет примерно 2 мг/кг/мин. Люди с массой тела 70 кг нуждаются в 95–105 г глюкозы на 12-часовой интервал между ужином и завтраком. Гликогенолиз отвечает примерно за 75% ночной продукции глюкозы в печени; оставшуюся часть обеспечивает глюконеогенез. Основными субстратами для глюконеогенеза являются лактат, пируват и аминокислоты, особенно аланин и глицерин. Когда период голодания затягивается и содержание инсулина падает, глюконеогенез в печени становится единственным источником поддержания эугликемии, поскольку все запасы гликогена в печени уже израсходованы. Одновременно из жировой ткани метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и бета-гидроксибутирата.
Если голодание продолжается дни и недели, включаются другие гомеостатические механизмы, которые обеспечивают сохранение белковой структуры организма, замедляя глюконеогенез и переключая мозг на утилизацию кетоновых молекул, ацетоацетата и бета-гидроксибутирата. Сигналом для использования кетонов служит повышение их концентрации в артериальной крови. При длительном голодании и тяжелом течении диабета наблюдаются крайне низкие концентрации инсулина в крови.
Гипогликемия и гипогликемические состояния
Гипогликемией принято считать снижение концентрации глюкозы в крови ниже 2,5–2,8 ммоль/л у мужчин и менее 1,9–2,2 ммоль/л у женщин.
У здоровых людей угнетение эндогенной секреции инсулина после всасывания глюкозы в кровь начинается при концентрации 4,2–4 ммоль/л, при дальнейшем снижении ее — сопровождается выбросом контринсулярных гормонов. Спустя 3–5 часов после приема пищи прогрессивно уменьшается количество всасываемой глюкозы из кишечника и организм переключается на эндогенную выработку глюкозы (гликогенолиз, глюконеогенез, липолиз). Во время этого перехода возможно развитие функциональной гипогликемии: ранней — в первые 1,5–3 часа и поздней — через 3–5 часов. «Голодовая» гипогликемия не связана с приемом пищи и развивается натощак или через 5 часов после ее приема. Нет жесткой корреляции между уровнем глюкозы в крови и клиническими симптомами гипогликемии.
Проявления гипогликемии
Гипогликемия больше клиническое понятие, нежели лабораторное, симптомы которой исчезают после нормализации содержания глюкозы в крови. На развитие симптомов гипогликемии влияет быстрое снижение глюкозы в крови. Об этом свидетельствуют факторы быстрого снижения высокой гликемии у больных сахарным диабетом. Появление клинических симптомов гипогликемии наблюдается у этих больных с высокими показателями гликемии при активной инсулинотерапии.
Симптомы гипогликемии отличаются полиморфизмом и неспецифичностью. Для гипогликемической болезни патогомоничной является триада Уиппла:
Симптомы гипогликемии обусловлены двумя факторами:
Такие симптомы, как обильное потоотделение, постоянное чувство голода, ощущение покалывания губ и пальцев, бледность, сердцебиение, мелкая дрожь, мышечная слабость и утомляемость, обусловлены возбуждением симпатоадреналовой системы. Эти симптомы являются ранними предвестниками приступа гипогликемии.
Нейрогликемические симптомы проявляются головной болью, зевотой, невозможностью сосредоточиться, утомляемостью, неадекватностью поведения, галлюцинациями. Иногда возникают и психические симптомы в виде депрессии и раздражительности, дремотного состояния днем и бессонницы по ночам. Из-за разнообразия симптомов гипогликемии, среди которых часто доминирует реакция тревоги, многим больным ставят ошибочные диагнозы невроза или депрессии.
Длительная и глубокая гипогликемическая кома может вызвать отек и набухание головного мозга с последующим необратимым повреждением ЦНС. Частые приступы гипогликемии приводят к изменению личности у взрослых, снижению интеллекта у детей. Отличие симптомов гипогликемии от настоящих неврологических состояний — положительный эффект приема пищи, обилие симптомов, не укладывающихся в клинику неврологического заболевания.
Наличие выраженных нервно-психических нарушений и недостаточная осведомленность врачей о гипогликемических состояниях часто приводят к тому, что вследствие диагностических ошибок больные с органическим гиперинсулинизмом длительно и безуспешно лечатся под самыми разными диагнозами. Ошибочные диагнозы ставятся у 3/4 больных с инсулиномой (эпилепсия диагностируется в 34% случаев, опухоль головного мозга — в 15%, вегетососудистая дистония — в 11%, диэнцефальный синдром — в 9%, психозы, неврастения — в 3% [2]).
Большинство симптомов гипогликемии обусловлены недостаточным снабжением центральной нервной системы глюкозой. Это приводит к быстрому повышению содержания адреналина, норадреналина, кортизола, гормона роста, глюкагона.
Эпизодические гипогликемические состояния могут компенсироваться срабатыванием контринсулярных механизмов или приемом пищи. В том случае, если этого недостаточно, развивается обморочное состояние или даже кома.
Гипогликемическая кома
Гипогликемическая кома — это состояние, которое развивается при снижении уровня глюкозы в крови до 2,2 ммоль/л и ниже. При быстром падении сахара в крови может развиваться стремительно, без предвестников и иногда даже внезапно.
При непродолжительной коме кожа обычно бледная, влажная, ее тургор сохранен. Тонус глазных яблок обычный, зрачки широкие. Язык влажный. Характерна тахикардия. Артериальное давление (АД) нормальное или слегка повышенное. Дыхание обычное. Температура нормальная. Мышечный тонус, сухожильные и периостальные рефлексы повышены. Могут отмечаться мышечная дрожь, судорожные подергивания мимической мускулатуры.
По мере углубления и увеличения продолжительности комы прекращается потоотделение, учащается и становится поверхностным дыхание, снижается АД, иногда появляется брадикардия. Отчетливо нарастают изменения в неврологическом статусе: появляются патологические симптомы — нистагм, анизокория, явления менингизма, пирамидные знаки, снижается мышечный тонус, угнетаются сухожильные и брюшные рефлексы. В затянувшихся случаях возможен летальный исход.
Особую опасность гипогликемические приступы представляют у пожилых лиц, страдающих ишемической болезнью сердца и мозга. Гипогликемия может осложниться инфарктом миокарда или инсультом, поэтому контроль ЭКГ обязателен после купирования гипогликемического состояния. Частые, тяжелые, продолжительные гипогликемические эпизоды постепенно приводят к энцефалопатии, а затем и к деградации личности.
Причины гипогликемии
Гипогликемия — это синдром, который может развиваться как у здоровых людей, так и при различных заболеваниях (таблица).
Гипогликемии при недостаточности продукции глюкозы
Гипогликемия всегда встречается при пангипопитуитаризме — заболевании, характеризующемся снижением и выпадением функции передней доли гипофиза (секреции адренокортикотропина, пролактина, соматотропина, фоллитропина, лютропина, тиреотропина). В результате резко снижается функция периферических эндокринных желез. Однако гипогликемия встречается и при первичном поражении эндокринных органов (врожденная дисфункция коры надпочечников, болезнь Аддисона, гипотиреоз, гипофункция мозгового слоя надпочечников, дефиците глюкагона). При дефиците контринсулярных гормонов снижается скорость глюконеогенеза в печени (влияние на синтез ключевых ферментов), повышается утилизация глюкозы на периферии, снижается образование аминокислот в мышцах — субстрата для глюконеогенеза.
Первичная надпочечниковая недостаточность является следствием уменьшения секреции гормонов коры надпочечников. Под этим термином подразумевают различные по этиологии и патогенезу варианты гипокортицизма. Симптомы надпочечниковой недостаточности развиваются только после разрушения 90% объема ткани надпочечников.
Причины гипогликемии при надпочечниковой недостаточности схожи с причинами гипогликемии при гипопитуитаризме. Отличием является уровень возникновения блока — при гипопитуитаризме снижается секреция кортизола из-за дефицита АКТГ, а при надпочечниковой недостаточности из-за разрушения ткани самих надпочечников.
Гипогликемические состояния у больных с хронической надпочечниковой недостаточностью могут возникать как натощак, так и через 2–3 часа после приема пищи, богатой углеводами. Приступы сопровождаются слабостью, чувством голода, потливостью. Гипогликемия развивается в результате снижения секреции кортизола, уменьшения глюконеогенеза, запасов гликогена в печени.
Данное состояние может возникать при надпочечниковой недостаточности с поражением мозгового слоя надпочечников. Катехоламины, попадая в кровь, регулируют высвобождение и метаболизм инсулина, снижая его, а также увеличивают высвобождение глюкагона. При снижении секреции катехоламинов наблюдаются гипогликемические состояния, вызванные избыточной продукцией инсулина и пониженной активностью гликогенолиза.
Глюкагон — гормон, являющийся физиологическим антагонистом инсулина. Он участвует в регуляции углеводного обмена, влияет на жировой обмен, активируя ферменты, расщепляющие жиры. Основное количество глюкагона синтезируется альфа-клетками островков поджелудочной железы. Однако установлено, что специальные клетки слизистой оболочки двенадцатиперстной кишки и слизистой оболочки желудка также синтезируют глюкагон. При поступлении в кровоток глюкагон вызывает повышение в крови концентрации глюкозы, вплоть до развития гипергликемии. В норме глюкагон предотвращает чрезмерное снижение концентрации глюкозы. Благодаря существованию глюкагона, препятствующего гипогликемическому действию инсулина, достигается тонкая регуляция обмена глюкозы в организме.
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенетальная дистрофия).
При этих синдромах содержание инсулина снижено, а экскреция кетоновых тел с мочой повышена.
Гипогликемии при дефиците ферментов
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке)
Дефицит глюкозо-6-фосфатазы составляет основу болезни Гирке, или гликогеноза типа 1. Недостаточность этого фермента приводит к невозможности превращения глюкозо-6-фосфата в глюкозу, что сопровождается накоплением гликогена в печени и почках. Болезнь наследуется по аутосомно-рецессивному типу.
Поступление глюкозы в организм с пищей, в принципе, дает возможность поддерживать в крови нормальный уровень глюкозы, однако для этого поступление пищи, содержащей глюкозу, должно быть практически непрерывным. В реальных условиях существования, т. е. при отсутствии непрерывного поступления глюкозы, в здоровом организме последняя депонируется в виде гликогена, который при необходимости используется при его полимеризации.
Первичное нарушение при болезни Гирке происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата. Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Если недостаток фермента умеренный, больные достигают юношеского, а нередко и более старшего возраста. Однако психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Характерными чертами являются олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Нарушение обмена липидов сопровождается панкреатитом.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [3].
Недостаточность амило-1,6-глюкозидазы, обозначаемая как гликогеноз типа 3 или болезнь Кори, относится к числу наиболее частых гликогенозов и имеет относительно легкое клиническое течение. Функция данного фермента заключается в деградации белковых ветвей гликогена и отщеплении от них свободной глюкозы. Однако снижение содержания глюкозы в крови при этом заболевании не настолько существенное, как при гликогенозе типа 1, так как определенное количество глюкозы образуется активированием фосфорилазы в печени. Для клинической картины заболевания характерны гепатомегалия, мышечная слабость, задержка роста и периодические «голодовые» гипогликемии. При лабораторном исследовании выявляется повышение уровня печеночных трансаминаз. Содержание лактата и мочевой кислоты в плазме крови обычно в норме. В ответ на введение глюкагона отсутствует повышение содержания глюкозы в плазме крови, если проба с глюкагоном проводится натощак, тогда как при введении глюкагона через 2 часа после приема пищи — ответ уже нормальный. Для подтверждения диагноза необходима биопсия печени и мышц, в которых выявляют измененный гликоген и недостаточность соответствующего фермента.
Дефект печеночной фосфорилазы — болезнь Герса
Гликогеноз, вызванный недостаточностью фосфорилазы печени (гликогеновая болезнь типа 6). Фосфорилаза печени катализирует фосфорилирование (расщепление) гликогена с образованием глюкозо-1-фосфата. Нарушение этого механизма приводит к избыточному отложению гликогена в печени. Наследуется предположительно по аутосомно-рецессивному типу.
Проявляется обычно на первом году жизни. Характерны задержка роста, кукольное лицо, значительное увеличение печени в результате гликогенной инфильтрации гепатоцитов, гипогликемия, гиперлипемия, повышенное содержание гликогена в эритроцитах. Диагноз основывается на снижении активности фосфорилазы в лейкоцитах.
Очень редкое наследственное заболевание. У больных, имеющих дефект синтеза этого фермента, гликоген вообще не синтезируется. Голодание вызывает тяжелую гипогликемию.
Фосфоэнолпируваткарбоксикиназа — ключевой фермент глюконеогенеза. Дефект данного фермента является очень редкой причиной гипогликемии. Фосфоэнолпируваткарбоксикиназа участвует в синтезе глюкозы из лактата, метаболитов цикла Кребса, аминокислот и жирных кислот. Поэтому при недостаточности этого фермента инфузия лактата или аланина не позволяет добиться нормогликемии. Напротив, введение глицерина нормализует концентрацию глюкозы, поскольку для синтеза глюкозы из глицерина фосфоэнолпируваткарбоксикиназа не требуется. При тяжелой гипогликемии проводят инфузию глюкозы.
Тяжелое нарушение питания
Голодание — самая распространенная причина гипогликемии у здоровых людей. При голодании глюкоза не поступает в организм, но продолжает потребляться мышцами и другими органами. Во время кратковременного голодания дефицит глюкозы покрывается за счет гликогенолиза и глюконеогенеза в печени. При длительном голодании запасы гликогена в печени истощаются и возникает гипогликемия.
Гипогликемия нередко случается у людей, соблюдающих религиозные каноны в питании (например, у православных во время Великого Поста и у мусульман во время Рамадана). Понятно, что в таких случаях гипогликемия обусловлена полным или практически полным длительным отсутствием пищи.
Эта же форма гипогликемии развивается на фоне изнуряющей физической нагрузки, например, при беге, плавании и велогонках на длительные дистанции, у многоборцев, альпинистов, лыжников, культуристов. В таких ситуациях основная причина гипогликемии — усиленное потребление глюкозы мышцами.
Гипогликемия во время беременности
Все виды обмена веществ во время беременности претерпевают значительные изменения, перестраиваются ферментативные реакции. Глюкоза является основным материалом для обеспечения энергетических потребностей плода и матери. С прогрессированием беременности расход глюкозы непрерывно увеличивается, что требует постоянной перестройки регулирующих механизмов. Увеличивается секреция как гипергликемических гормонов (глюкагон, эстрогены, кортизол, гипофизарный пролактин, плацентарный лактоген, соматотропин), так и гипогликемического гормона инсулина. Таким образом устанавливается динамическое равновесие механизмов, регулирующих углеводный обмен. Уровень глюкозы в крови у беременных женщин остается в пределах нормы, полностью обеспечивается при этом потребность в глюкозе организмов матери и плода.
На поздних сроках беременности, на фоне истощения компенсаторных механизмов, может возникать гипогликемическое состояние. Клиническая картина гипогликемии беременных включает в себя чувство голода, головную боль, потливость, слабость, тремор, тошноту, парестезии, нечеткость и сужение полей зрения, спутанность сознания, сопор, потерю сознания, кому и судороги.
Приобретенные заболевания печени
Диффузное и тяжелое поражение печени, при котором выходит из строя 80–85% ее массы, может привести к гипогликемии вследствие нарушения гликогенолиза и глюконеогенеза. Это связывают с такими поражениями, как острый некроз печени, острый вирусный гепатит, синдром Рейе и тяжелая пассивная застойная сердечная недостаточность. Метастатическая или первичная опухоль печени (если затрагивается большая часть печеночной ткани) может вызвать гипогликемию, но метастазы в печень обычно не сопровождаются гипогликемией. Гипогликемия была описана как часть синдрома жирового перерождения печени при беременности. Сообщалось также о сочетании гипогликемии с HELLP синдромом (гемолиз, повышенный уровень печеночных ферментов и снижение числа тромбоцитов в периферической крови). Во время беременности могут иметь место самые различные поражения печени — от преэклампсии и HELLP синдрома до острого жирового ее перерождения. Поэтому у всех нездоровых женщин в III триместре беременности следует определять уровень глюкозы. Хроническое заболевание печени очень редко сопровождается гипогликемией. Больные с тяжелой печеночной недостаточностью, способной вызвать гипогликемию, часто находятся в коматозном состоянии. Гипогликемия как причина коматозного состояния может быть пропущена, если кома расценивается как следствие печеночной энцефалопатии.
Гипогликемией может сопровождаться хроническая почечная недостаточность. Это связано с тем, что здоровая почка способна к глюконеогенезу. В некоторых случаях этот процесс составляет до 50% образуемой эндогенной глюкозы. При уремии глюконеогенез может быть подавлен. К тому же почка вырабатывает инсулиназы, разрушающие инсулин, который у больных с хронической почечной недостаточностью кумулируется. По этой же причине опасность гипогликемии увеличивается и у больных с сахарным диабетом, осложненным хронической почечной недостаточностью.
Алкоголь и медикаменты
Употребление спиртных напитков — распространенная причина гипогликемии как у взрослых людей, так и у детей. Расщепление этанола с образованием ацетальдегида в печени катализируется ферментом алкогольдегидрогеназой. Этот фермент работает только в присутствии особого кофактора — никотинамиддинуклеотида (НАД). Но это же вещество необходимо и для печеночного глюконеогенеза. Прием алкоголя приводит к быстрому расходованию НАД и резкому торможению глюконеогенеза. Поэтому алкогольная гипогликемия возникает при истощении запасов гликогена, когда для поддержания нормального уровня глюкозы в крови особенно необходим глюконеогенез. При приеме большого количества алкоголя вечером, симптомы гипогликемии обычно возникают на следующее утро.
Чаще всего алкогольная гипогликемия наблюдается у истощенных больных алкоголизмом, но бывает и у здоровых людей после приемов большого количества алкоголя или при употреблении алкоголя «на голодный желудок».
Алкогольная гипогликемия нередко случается у детей, которые по ошибке или намеренно выпивают пиво, вино или более крепкие напитки. Особенно чувствительны к алкоголю дети до 6 лет — алкогольная гипогликемия встречается после спиртовых компрессов. Смертность при алкогольной гипогликемии у детей достигает 30%, тогда как у взрослых она составляет примерно 10%. [4]. Диагноз алкогольной гипогликемии основывается на данных анамнеза и обнаружении гипогликемии в сочетании с повышенным уровнем алкоголя и молочной кислоты в крови.
Описаны случаи гипогликемии при приеме неселективных бета-блокаторов. Они применяются для лечения ишемической болезни сердца, нарушений сердечного ритма, а также некоторых форм гипертонической болезни. Такой эффект обусловлен повышенной утилизацией глюкозы мышцами, снижением образования глюкозы из гликогена, ингибированием липолиза и снижением содержания неэстерифицированных жирных кислот в крови. Бета-блокаторы не рекомендуется применять в случае инсулинозависимого сахарного диабета, потому что они маскируют большинство симптомов гипогликемии и могут быть токсичными для клеток островков поджелудочной железы. Также стоит помнить, что при одновременном применении пропранолола и гипогликемических препаратов существует риск развития гипогликемии, за счет усиления их действия.
Гипогликемию могут вызвать противовоспалительные и обезболивающие препараты из класса салицилатов (Парацетамол, Аспирин). Салицилаты оказывают влияние на обмен веществ: при введении в больших дозах наблюдаются уменьшение синтеза и увеличение распада аминокислот, белков и жирных кислот. При сахарном диабете салицилаты способствуют снижению содержания глюкозы в крови. Также салицилаты, как и бета-адреноблокаторы, усиливают действие препаратов, применяемых для снижения уровня сахара в крови.
Гипогликемии, связанные с повышением потребления глюкозы
Инсулинома — инсулинпродуцирующая опухоль, происходящая из бета-клеток островков Лангерганса, обуславливающая развитие гипогликемического синдрома натощак. В опухолевых клетках нарушена секреция инсулина: секреция не подавляется при снижении уровня глюкозы крови. В 85–90% случаев опухоль солитарная и доброкачественная, только в 10–15% случаев опухоли множественные, и крайне редко опухоли расположены вне поджелудочной железы (ворота селезенки, печень, стенка двенадцатиперстной кишки). Частота новых случаев опухоли — 12 на 1 млн человек в год, чаще всего опухоль диагностируется в возрасте от 25 до 55 лет.
В клинике при инсулиноме характерны приступы гипогликемии, связанные с постоянным, независимым от уровня глюкозы в крови, выбросом инсулина. Частые приступы гипогликемии вызывают изменения в центральной нервной системе. У некоторых больных они напоминают эпилептический припадок, с которым госпитализируют в неврологическое отделение. Приступы гипогликемии прерываются приемом пищи, в связи с чем больные постоянно употребляют большое количество продуктов, главным образом углеводов, что способствует развитию ожирения.
Диагностика инсулиномы базируется на выявлении классической и патогомоничной для нее триады Уиппла, а также типичной для гипогликемии клинической картины. «Золотым стандартом» на первом этапе диагностики гипогликемического синдрома и подтверждения эндогенного гиперинсулинизма является проба с голоданием. Проба проводится в течение 72 часов и считается положительной при развитии триады Уиппла. Начало голодания отмечают как время последнего приема пищи. Уровень глюкозы в крови на пробе оценивают исходно через 3 часа после последнего приема пищи, затем через каждые 6 часов, а при снижении уровня глюкозы в крови ниже 3,4 ммоль/л интервал между ее исследованиями сокращают до 30–60 мин.
Скорость секреции инсулина при инсулиноме не угнетается снижением уровня глюкозы в крови. У находящихся в условиях голодания больных инсулиномой гипогликемия развивается в связи с тем, что количество глюкозы в крови натощак зависит от интенсивности гликогенолиза и глюконеогеноза в печени, а избыточная инсулиносекреция блокирует продукцию глюкозы. Рекомендуется вычислить инсулин/гликемический индекс. В норме он составляет не более 0,3, а при инсулиноме превышает 1,0. Концентрация С-пептида также резко повышена.
Вторым этапом в диагностике инсулиномы является топическая диагностика опухоли. Используют УЗИ, компьютерную томографию, магниторезонансную томографию, эндоскопическое УЗИ, сцинтиграфию, ангиографию, интраоперационное УЗИ. Наиболее информативны в диагностике инсулином эндоскопическое ультразвуковое исследование (эндо-УЗИ) и забор крови из печеночных вен после внутриартериальной стимуляции поджелудочной железы кальцием. Многим пациентам, с помощью современных методов исследования, удается на дооперационном этапе установить локализацию опухоли, ее размер, стадию и темпы прогрессирования опухолевого процесса, выявить метастазы.
Определенные трудности в диагностике инсулиномы могут возникнуть у пациентов, применяющих препараты инсулина или сульфанилмочевины. Для доказательства экзогенного введения инсулина необходимо посмотреть анализ крови: при экзогенном введении инсулина в крови обнаружатся антитела к инсулину, низкий уровень С-пептида при высоком уровне общего иммунореактивного инсулина (ИРИ). С целью исключения гипогликемии, вызванной приемом препаратов сульфанилмочевины, целесообразным будет определение содержания сульфанилмочевины в моче.
Лечение инсулиномы в большинстве случаев хирургическое: энуклеация опухоли, дистальная резекция поджелудочной железы. Консервативная терапия проводится в случае нерезектабельной опухоли и ее метастазов, а также при отказе пациента от оперативного лечения и включает в себя:
Пятилетняя выживаемость среди радикально прооперированных пациентов — 90%, при обнаружении метастазов — 20% [5].
Гиперплазия бета-клеток у новорожденных и грудных детей
Инсулиному следует дифференцировать с гиперплазией или увеличением количества островков поджелудочной железы. В норме объем эндокринной части составляет 1–2% у взрослых и 10% у новорожденных. У детей раннего возраста гиперплазия островков встречается при незидиобластозе, фетальном эритробластозе, синдроме Беквита–Видемана, а также у детей, родившихся от матерей с сахарным диабетом.
Незидиобластоз — врожденная дисплазия эндокринных клеток (микроаденоматоз). Из незидиобластов, которые внутриутробно формируются из эпителия панкреатических протоков, образуются островки Лангерганса. Этот процесс начинается с 10–19 недели внутриутробного развития и заканчивается на 1–2 году жизни ребенка. В некоторых случаях формирование эндокринных клеток может ускоряться или образовываются дополнительные клетки в ацинарной ткани поджелудочной железы. Подобные нарушения, которые имеют транзиторный характер, часто встречаются в нормально развивающейся ткани поджелудочной железы. Считается, что до двух лет незидиобластоз является вариантом нормы, у детей старше двух лет представляет патологию. Клетки, формирующие очаг незидиобластоза, дают положительную реакцию на инсулин, глюкагон, соматостатин и панкреатический полипептид. Однако пропорция бета-клеток значительно выше, чем в норме. Дисплазия эндокринной части поджелудочной железы сочетается с множественной эндокринной неоплазией типа 1 (МЭН 1). Незидиобластоз сопровождается нерегулируемой секрецией инсулина и выраженной гипогликемией.
Некоторые авторы предполагают ввести термин «врожденный гиперинсулинизм», под которым понимают все разновидности незидиобластоза, а конкретную форму следует ставить после гистологической диагностики [1]. Гиперинсулинемическая гипогликемия встречается у детей, родившихся от матерей, болеющих сахарным диабетом. Патогенез гипогликемии у таких новорожденных вызван тем, что внутриутробно избыточное количество глюкозы диффундирует от беременной к плоду и вызывает у последнего гипертрофию островкового аппарата. После рождения ребенка бета-клетки продолжают избыточно вырабатывать инсулин, вызывая у части детей симптомы гипогликемии. Следует учитывать, что при длительном введении концентрированных растворов глюкозы беременным возможно развитие транзиторной гипогликемии у новорожденных.
Гиперплазия островкового аппарата у новорожденных может встречаться при гемолитической болезни. Разрушение эритроцитов внутриутробно сопровождается деградацией инсулина, что вызывает гипертрофию бета-клеток. Лечение таких больных заменным переливанием крови прекращает гемолиз, а следовательно, разрушение инсулина. Но транзиторная гипогликемия сохраняется некоторое время [6]. В периоде новорожденности гипогликемия может быть проявлением у детей синдрома Видемана–Беквита. Причиной тяжелой неонатальной гипогликемии является гипертрофия и гиперплазия островков поджелудочной железы. Дети рождаются крупные. Характерно увеличение органов: печени, почек, поджелудочной железы. Типичны наличие кисты пупочного канатика, макроглосия, различные органные аномалии. Если больные не погибают в неонатальном периоде, то отставание в психическом развитии связывают с гипогликемическими состояниями.
Аутосомно-рецессивная гиперинсулинемическая гипогликемия
Семейное заболевание, которое является следствием мутации генов, ответственных за синтез белка SUR-1 и Kir 6.2, которые находятся на хромосоме 11 р151. Изоформа белка SUR-1, обозначаемая как SUR-2, участвует в функции калиевых каналов, локализованных внепанкреатически, т. е. в тканях других органов. Любое нарушение, приводящее к потере функции SUR-1 или Kir 6.2, способствует нерегулярному закрытию АТФ-чувствительных калиевых каналов, деполяризации мембран бета-клетки, увеличению выхода кальция и повышению высокого уровня базальной его концентрации в цитозоле и, наконец, нерегулируемой секреции инсулина.
Гипогликемия при сахарном диабете
У больных сахарным диабетом гипогликемия представляет серьезную проблему при лечении сахароснижающими препаратами. Это связано с тем, что снижены запасы гликогена в печени, который в экстренных случаях должен пополнять глюкозой кровь.
Основные причины гипогликемии при лечении сахарного диабета это передозировка инсулина, т. е. несоответствие дозы инсулина и количества углеводов в пище, задержка приема пищи, чрезмерные физические нагрузки, инъекция инсулина в мышцу, приводящая к более быстрому всасыванию его, или инъекции инсулина в участки липодистрофии, откуда он всасывается с разной скоростью. Риск развития гипогликемии у больных сахарным диабетом увеличивается в связи с внедрением интенсифицированной инсулинотерапии, которая предполагает поддержание гликемии в течение суток близких к нормальным значениям глюкозы в крови. Этим провоцируется риск развития гипогликемии. Нижняя граница концентрации глюкозы рекомендуется ограничить в пределах 4–4,2 ммоль/л.
Не распознанная гипогликемия у больных с длительным сахарным диабетом может возникать во сне (феномен Сомоджи). На это состояние организм реагирует избыточной секрецией контринсулярных гормонов. В утренние часы показатели глюкозы в крови значительно возрастают, и их неправильно оценивают как следствие недостаточной дозы инсулина. В связи с этим увеличивается доза препарата, тем самым ухудшается течение сахарного диабета. В этом случае заболевание протекает с резкими колебаниями гликемии в течение суток [7]. Учитывая большое количество препаратов инсулина, используемых в разных клиниках, стоит помнить отличия животного и синтетического инсулина в проявлениях симптомов гипогликемии при передозировке данных препаратов.
При лечении синтетическими человеческими инсулинами, а также у больных с нейропатией симптомы надвигающейся тяжелой гипогликемии носят нейрогликопенический характер. Она развивается неожиданно и очень быстро. Нарушается координация и концентрация внимания. Больной теряет сознание, или возникает эпилептиформный судорожный припадок. По этой причине больной слишком поздно осознает угрозу гипогликемии. Самостоятельный выход из нее затруднен. С этой формой гипогликемической комы связаны отек и набухание головного мозга и развитие постгликемической энцефалопатии.
При передозировке животным инсулином началу гипогликемического приступа предшествуют так называемые «адреналиновые симптомы»: ранние — острое чувство голода, сердцебиение, холодный пот, дрожь, головная боль. Больной может своевременно принять необходимые меры и избежать переход в гипогликемическую кому.
Искусственно вызванная гипогликемия
Эйфория, вызванная введением инсулина, встречается у здоровых девушек (синдром Мюнхаузена). Некоторые больные с сахарным диабетом также активно вызывают симптомы гипогликемии. Мотив такого поведения связан с особенностями характера и социальной средой. Такие больные весьма изобретательны и активно скрывают препараты. Предполагаемая искусственная гипогликемия диагностируется по наличию ее симптомов, высоких показателей инсулина и низкого С-пептида в крови.
Аутоиммунный гипогликемический синдром
Аутоантитела, направленные против инсулина или его рецепторов, могут провоцировать гипогликемию. У здоровых людей в крови постоянно образуются антитела к инсулину, но выявляются лишь у 1–8%. Аутоантитела к инсулину обнаруживаются в 40% у больных с впервые выявленным сахарным диабетом, не леченных инсулином, и в 30% при сочетании его с аутоиммунными заболеваниями. Аутоантитела, которые связывают инсулин, могут подвергаться несвоевременной диссоциации, обычно в течение короткого периода сразу после приема пищи, и резко повышают концентрацию свободного инсулина в сыворотке, таким образом вызывая гипогликемию в поздний постпрандиальный период. Этому может предшествовать гипергликемия в ответ на прием пищи. Диагноз аутоиммунной гипогликемии ставится на основании сочетания с аутоиммунными заболеваниями, наличия высокого титра антител к инсулину, высоких концентраций инсулина и отсутствия снижения уровня С-пептида на фоне гипогликемии.
Провоцировать гипогликемию могут антитела к рецепторам инсулина. Эти антитела связывают рецепторы и имитируют действие инсулина путем повышения утилизации глюкозы из крови. Чаще антитела к рецепторам инсулина встречаются у женщин и сочетаются со многими аутоиммунными заболеваниями. Приступы гипогликемии, как правило, развиваются натощак.
Гипогликемия при нормальном уровне инсулина
С гипогликемией могут быть связаны разные мезенхимальные опухоли (мезотелиома, фибросаркома, рабдомиосаркома, лейомиосаркома, липосаркома и гемангиоперицитома) и органоспецифические карциномы (печеночная, адренокортикальная, мочеполовой системы и молочной железы). Гипогликемия может сопутствовать феохромоцитоме, карциноиду и злокачественным заболеваниям крови (лейкемии, лимфоме и миеломе). Механизм ее варьирует в соответствии с типом опухоли, но во многих случаях гипогликемия связана с нарушением питания, обусловленным опухолью, и потерей веса вследствие жирового, мышечного и тканевого истощения, которое нарушает глюконеогенез в печени. В некоторых случаях утилизация глюкозы исключительно большими опухолями может привести к гипогликемии. Опухоли могут также секретировать гипогликемические факторы, такие как неподавляемая инсулиноподобная активность и инсулиноподобные факторы роста. Путем связывания с инсулиновыми рецепторами печени инсулиноподобный фактор-2 тормозит продукцию глюкозы печенью и способствует гипогликемии. Под подозрением находятся также опухолевые цитокины, особенно фактор опухолевого некроза (кахектин). Очень редко опухоль секретирует внепеченочный инсулин.
Системный дефицит карнитина
Тяжелая гипогликемия может возникнуть у больных с системной карнитиновой недостаточностью. Карнитин — биологически активное витаминоподобное вещество. Основными его функциями являются участие в энергетическом обмене, связывание и выведение из организма токсичных производных органических кислот. При системном дефиците карнитина в плазме, мышцах, печени и других тканях снижено содержание карнитина, необходимого для транспорта жирных кислот в митохондрии, где происходит их окисление. В результате периферические ткани лишаются способности утилизировать жирные кислоты для образования энергии, а печень не может производить альтернативный субстрат — кетоновые тела. Все это приводит к тому, что все ткани становятся зависимыми от глюкозы и печень оказывается не в состоянии удовлетворить их потребности. Системная карнитиновая недостаточность проявляется тошнотой, рвотой, гипераммониемией и печеночной энцефалопатией. Эта патология является одной из форм синдрома Рейе.
Реже гипогликемия встречается при недостаточности карнитинпальмитоилтрансферазы — фермента, переносящего жирные кислоты с жирного ацил-КоА на карнитин для окисления. У большинства больных имеет место, по-видимому, частичный дефект, так что окисление жирных кислот в какой-то мере сохраняется и тенденция к гипогликемии сводится к минимуму. Клинически это проявляется миопатией при физической нагрузке с миоглобинурией. Некетозная (или гипокетозная) гипогликемия может встречаться также при снижении активности других ферментов окисления жирных кислот, например, при недостаточности дегидрогеназы средне- или длинноцепочечного ацилкоэнзима А (ацил-КоА).
Дети раннего возраста особенно чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания). Биосинтез карнитина резко ограничен в связи с небольшой мышечной массой, а поступление с обычными пищевыми продуктами не способно поддержать достаточный уровень в крови и тканях.
Диагностика и дифференциальная диагностика гипогликемии
При подозрении на гипогликемию следует срочно определить концентрацию глюкозы в крови или в плазме и начать лечение. При сборе анамнеза заболевания, прежде всего, нужно выяснить, в каких условиях она возникает. У одних больных приступы гипогликемии случаются, если они вовремя не поели (гипогликемия голодания). У других приступы возникают после еды, особенно после приема пищи, богатой углеводами (реактивная гипогликемия). Эти сведения очень важны, так как этиология и механизмы развития гипогликемии голодания и реактивной гипогликемии различаются. Гипогликемия голодания нередко бывает проявлением тяжелого заболевания (например, инсулиномы) и более опасна для головного мозга.
Для установления диагноза необходимо найти связь между появлением симптомов и аномально низким уровнем глюкозы в плазме, а также показать, что при повышении этого уровня симптомы исчезают. Уровень глюкозы в плазме, при котором возникают симптомы, у разных больных и в разных физиологических состояниях неодинаков. Аномально низкой концентрацию глюкозы в плазме обычно называют тогда, когда она не достигает 2,7 ммоль/л у мужчин или 2,5 ммоль/л у женщин (т. е. оказывается ниже нижней границы у здоровых мужчин и женщин после голодания в течение 72 ч) и 2,2 ммоль/л у детей.
У любого больного с нарушениями сознания (или судорогами неизвестной этиологии) необходимо определять содержание глюкозы в крови с помощью тест-полосок, используя для этого каплю крови. Если обнаруживается аномально низкий уровень глюкозы, сразу же начинают вводить глюкозу. Быстрое смягчение симптомов со стороны ЦНС (наблюдаемое у большинства больных) при повышении уровня глюкозы в крови подтверждает диагноз гипогликемии натощак или лекарственной гипогликемии. Часть первоначальной пробы крови следует сохранить в виде замороженной плазмы для определения исходных концентраций инсулина, проинсулина и С-пептида или — при необходимости — для выявления в крови каких-либо соединений, послуживших причиной гипогликемии. Нужно определять также рН крови и содержание в ней лактата и с помощью тест-полосок проверять содержание кетоновых тел в плазме.
Часто вероятную причину гипогликемии удается установить уже с самого начала (запах алкоголя изо рта, применение сахаропонижающих средств в анамнезе, признаки обширного поражения печени или почек, присутствие крупной опухоли в забрюшинном пространстве или в грудной полости, а также существование врожденных причин гипогликемии натощак).
У больных с инсулиносекретирующими опухолями поджелудочной железы (инсулиномы, островковоклеточные карциномы) повышенному уровню инсулина обычно сопутствуют повышенные уровни проинсулина и С-пептида. У больных, получающих препараты сульфанилмочевины, тоже следует ожидать повышения уровня С-пептида, но в этом случае в крови должны присутствовать и значительные количества препарата.
Если гипогликемия связана с передозировкой препаратов инсулина, то уровень проинсулина нормален, а содержание С-пептида снижено. При аутоиммунном инсулиновом синдроме содержание свободного инсулина в плазме во время приступа гипогликемии обычно бывает резко повышено, уровень С-пептида снижен, но в плазме легко определяются антитела к инсулину. Дифференциальный диагноз между аутоиммунной гипогликемией и состоянием, вызванным избыточным введением инсулина, требует специальных исследований.
У пациентов с инсулиномой при обращении к врачу симптомы гипогликемии часто отсутствуют. Обращаться в медицинские учреждения их заставляют приступы внезапного помутнения или потери сознания, которыми они страдали на протяжении ряда лет и которые участились в последнее время. Характерной особенностью таких приступов является то, что они возникают между приемами пищи или после ночного голодания; иногда они провоцируются физической нагрузкой. Приступы могут проходить самопроизвольно, но чаще они быстро исчезают после приема сладких продуктов или напитков. Эта особенность является важнейшим диагностическим признаком.
При обследовании таких больных можно обнаружить несоответственно высокий исходный уровень инсулина в плазме (> 6 мкЕД/мл и тем более > 10 мкЕД/мл) на фоне гипогликемии. Эта находка служит веским аргументом в пользу инсулиносекретирующей опухоли, если удается исключить тайное использование инсулина или препаратов сульфанилмочевины. Обычно в тех случаях, когда гликемия падает до аномально низкого уровня, содержание инсулина в плазме снижается до нормального базального уровня, который все же оказывается слишком высоким для данных условий. Другие состояния, кроме наличия инсулиносекретирующей опухоли, предрасполагающие к гипогликемии натощак, обычно удается исключить при амбулаторном обследовании.
Если у пациента не выявлены объективные причины со стороны других органов и систем, при которых характерны эпизодические появления симптомов со стороны ЦНС, больного госпитализируют в стационар и проводят пробу с голоданием. Целью данной пробы является воспроизведение симптомов в условиях регистрации уровней глюкозы, инсулина, проинсулина и С-пептида в плазме. У 79% больных с инсулиномой симптомы возникают уже в течение 48 ч голодания, а у 98% — в течение 72 ч. Голодание прекращают через 72 ч или в момент появления симптомов. Если голодание провоцирует возникновение характерных для больного симптомов, которые быстро купируются введением глюкозы, или если симптомы появляются на фоне аномально низкого уровня глюкозы и несоответственно высокого уровня инсулина в плазме, то предположительный диагноз инсулиносекретирующей опухоли можно считать подтвержденным. Использование рентгенологического исследования и КТ-сканирования нецелесообразно для диагностики инсулиномы, так как данные опухоли обычно слишком малы, чтобы их удалось обнаружить с помощью данных исследований.
Лечение гипогликемических состояний
Лечение гипогликемических состояний на начальных их этапах включает в себя пероральное введение легко всасываемых углеводов: сахара, варенья, меда, сладкого печенья, конфет, леденцов, белого хлеба или фруктового сока.
При малейшем подозрении на гипогликемическую кому, даже при затруднениях в ее дифференцировке с кетоацидемической комой, врач обязан, взяв кровь для анализа, тут же ввести больному внутривенно струйно 40–60 мл 40% раствора глюкозы. Если гипогликемическая кома неглубока и непродолжительна, то больной приходит в сознание сразу же после окончания инъекции. Если этого не происходит, можно думать, что кома не связана с гипогликемией либо кома гипогликемическая, но функции ЦНС восстановятся позднее. Выполнив этот важнейший лечебный прием, необходимый при гипогликемии, врач получает время для дальнейших диагностических исследований. Введение указанного количества глюкозы не принесет больному вреда, если кома окажется кетоацидемической.
Если сознание возвращается к больному после первой внутривенной инъекции глюкозы, дальнейшую инфузию глюкозы можно прекратить. Больному дают сладкий чай, кормят его с короткими интервалами. При отсутствии сознания после введения 60 мл глюкозы налаживают внутривенное капельное введение 5% раствора глюкозы, которое продолжается часами и сутками. В капельницу добавляют 30–60 мг преднизолона, в/в вводят 100 мг кокарбоксилазы, 5 мл 5% раствора аскорбиновой кислоты.
Уровень гликемии должен поддерживаться в пределах 8–12 ммоль/л. При ее дальнейшем повышении вводят дробно инсулин в малых дозах (4–8 ЕД). Перед капельным введением раствора глюкозы подкожно вводится 1 мл 0,1% раствора адреналина, 1–2 мл глюкагона внутривенно или внутримышечно (последний можно вводить повторно каждые 3 часа).
При длительном отсутствии сознания проводятся мероприятия по профилактике отека головного мозга: в/в капельно вводится 15–20% раствор маннитола, в/в струйно — 60–80 мг Лазикса, 10 мл 25% раствора сульфата магния, 30–60 мг преднизолона. Показана ингаляция увлажненного кислорода. В случае угнетения дыхания больной переводится на искусственную вентиляцию легких.
После выведения больного из комы применяют средства, улучшающие метаболизм клеток ЦНС (глютаминовая кислота, Стугерон, Аминалон, Церебролизин, Кавинтон) в течение 3–5 недель.
Литература
Источники:
- http://doctu.ru/msk/clinic/klinika-gormon-lajjf
- http://hormonelife.ru/nashi-speczialisty/
- http://hormonelife.ru/stati/
- http://hormonelife.ru/novoe/
- http://hormonelife.ru/medanaliz/
- http://hormonelife.ru/grekov/
- http://www.uroweb.ru/news/yatrogenniy-gipogonadizm-u-mugchin
- http://medcentr-diana-spb.ru/blog/gormonalnyie-narusheniya-u-zhenshhin-a-ona-i-ne-znala-chto-gormon-byivaet-zhestokim/
- http://oxy-center.ru/for-doctors/specialistam/zamestitelnaya-gormonalnaya-terapiya-dlya-muzhchin-s-vozrastnym-androgennym-defitsitom/
- http://www.lvrach.ru/2001/09/4528981
- http://medcentr-diana-spb.ru/ginekologiya/zachem-nuzhna-zamestitelnaja-gormonalnaja-terapija-zhenshhine-posle-50-let-riski-i-jeffekty/
- http://klinik.by/stati-o-gormonah/gormon-rosta/
- http://www.lvrach.ru/2015/12/15436356
- http://www.lvrach.ru/2020/03/15437517
- http://www.lvrach.ru/2018/03/15436928
- http://gemostaz.ru/uslugi/tsentr_ginekologii/akusherstvo_i_ginekologiya/lechenie-gormonalnykh-narusheniy/
- http://mc21.ru/
- http://el-klinika.ru/shhitovidnaya-zheleza/
- http://cirpp.ru/blog/depressiya-kak-v-mozge-otklyuchaetsya-radost/
- http://www.lvrach.ru/2016/09/15436558
- http://www.uroweb.ru/article/hronicheskiy-prostatitsindrom-hronicheskoy-tazovoy-boli-sovremennie-trendi-i-perspektivi-lecheniya-s-pozitsiy-dokazateln
- http://familydoctor.ru/about/publications/endokrinologiya/gormony_schastya.html
- http://www.lvrach.ru/2014/03/15435913
- http://pirogovclinic.ru/otdeleniya/lechebno-diagnosticheskoe-otdelenie/konsultatsiya-endokrinologa/blog/10-voprosov-endokrinologu-intervyu-s-doktorom-liberanskoy-nataley-sergeevnoy/
- http://companies.rbc.ru/id/1197746620202-obschestvo-s-ogranichennoj-otvetstvennostyu-gormonlajf/
- http://www.lvrach.ru/2022/03/15438242
- http://medaboutme.ru/articles/mnogolikiy_grelin_kak_on_rabotaet/
- http://www.lvrach.ru/2010/11/15435078














.gif)
.gif)
_575.gif)
.gif)
_575.gif)







