Ципрофлоксацин или норфлоксацин что лучше
Ципрофлоксацин или норфлоксацин что лучше
Препараты класса хинолонов, используемые в клинической практике с начала 60-х годов, по механизму действия принципиально отличаются от других АМП, что обеспечивает их активность в отношении устойчивых, в том числе полирезистентных, штаммов микроорганизмов. Класс хинолонов включает две основные группы препаратов, принципиально различающихся по структуре, активности, фармакокинетике и широте показаний к применению: нефторированные хинолоны и фторхинолоны. Хинолоны классифицируют по времени введения в практику новых препаратов с улучшенными антимикробными свойствами. Согласно рабочей классификации, предложенной R. Quintiliani (1999), хинолоны разделяют на четыре поколения:
Классификация хинолонов
Пипемидовая (пипемидиевая) кислота
Перечисленные препараты зарегистрированы в России. За рубежом применяются и некоторые другие препараты класса хинолонов, главным образом фторхинолоны.
Хинолоны I поколения преимущественно активны в отношении грамотрицательной флоры и не создают высоких концентраций в крови и тканях.
Фторхинолоны, разрешенные для клинического применения с начала 80-х годов (II поколение), отличаются широким спектром антимикробного действия, включая стафилококки, высокой бактерицидной активностью и хорошей фармакокинетикой, что позволяет применять их для лечения инфекций различной локализации. Фторхинолоны, введенные в практику с середины 90-х годов (III-IV поколение), характеризуются более высокой активностью в отношении грамположительных бактерий (прежде всего пневмококков), внутриклеточных патогенов, анаэробов (IV поколение), а также еще более оптимизированной фармакокинетикой. Наличие у ряда препаратов лекарственных форм для в/в введения и приема внутрь в сочетании с высокой биодоступностью позволяет проводить ступенчатую терапию, которая при сопоставимой клинической эффективности существенно дешевле парентеральной.
Высокая бактерицидная активность фторхинолонов позволила разработать для ряда препаратов (ципрофлоксацин, офлоксацин, ломефлоксацин, норфлоксацин) лекарственные формы для местного применения в виде глазных и ушных капель.
Механизм действия
Спектр активности
Нефторированные хинолоны действуют преимущественно на грамотрицательные бактерии семейства Enterobacteriaceae
(Е.coli, Enterobacter spp., Proteus spp., Klebsiella spp., Shigella spp., Salmonella spp.), а также Haemophillus spp. и Neisseria spp. Оксолиновая и пипемидовая кислоты, кроме того, активны в отношении S.aureus и некоторых штаммов P.aeruginosa, но это не имеет клинического значения.
Фторхинолоны имеют значительно более широкий спектр. Они активны в отношении ряда грамположительных аэробных бактерий (Staphylococcus spp.), большинства штаммов грамотрицательных, в том числе Е.coli (включая энтеротоксигенные штаммы), Shigella spp., Salmonella spp., Enterobacter spp., Klebsiella spp., Proteus spp., Serratia spp., Providencia spp., Citrobacter spp., M.morganii, Vibrio spp., Haemophilus spp., Neisseria spp., Pasteurella spp., Pseudomonas spp., Legionella spp., Brucella spp., Listeria spp.
Кроме того, фторхинолоны, как правило, активны в отношении бактерий, устойчивых к хинолонам I поколения. Фторхинолоны III и, особенно, IV поколения высокоактивны в отношении пневмококков, более активны, чем препараты II поколения, в отношении внутриклеточных возбудителей (Chlamydia spp., Mycoplasma spp., M.tuberculosis, быстрорастущих атипичных микобактерий (M.avium и др.), анаэробных бактерий (моксифлоксацин). При этом не уменьшается активность в отношении грамотрицательных бактерий. Важным свойством этих препаратов является активность в отношении ряда бактерий, устойчивых к фторхинолонам II поколения. В связи с высокой активностью в отношении возбудителей бактериальных инфекций ВДП и НДП их иногда называют “респираторными” фторхинолонами.
В различной степени к фторхинолонам чувствительны энтерококки, Corynebacterium spp., Campylobacter spp., H.pylori, U.urealyticum.
Фармакокинетика
Все хинолоны хорошо всасываются в ЖКТ. Пища может замедлять всасывание хинолонов, но не оказывает существенного влияния на биодоступность. Максимальные концентрации в крови достигаются в среднем через 1-3 ч после приема внутрь. Препараты проходят плацентарный барьер, и в небольших количествах проникают в грудное молоко. Выводятся из организма преимущественно почками и создают высокие концентрации в моче. Частично выводятся с желчью.
При нарушении функции почек выведение хинолонов значительно замедляется.
Фторхинолоны, в отличие от нефторированных хинолонов, имеют большой объем распределения, создают высокие концентрации в органах и тканях, проникают внутрь клеток. Исключение составляет норфлоксацин, наиболее высокие уровни которого отмечаются в кишечнике, МВП и предстательной железе. Наибольших тканевых концентраций достигают офлоксацин, левофлоксацин, ломефлоксацин, спарфлоксацин, моксифлоксацин. Ципрофлоксацин, офлоксацин, левофлоксацин и пефлоксацин проходят через ГЭБ, достигая терапевтических концентраций.
Период полувыведения у различных фторхинолонов колеблется от 3-4 ч (норфлоксацин) до 12-14 ч (пефлоксацин, моксифлоксацин) и даже до 18-20 ч (спарфлоксацин).
При нарушении функции почек наиболее значительно удлиняется период полувыведения офлоксацина, левофлоксацина и ломефлоксацина. При тяжелой почечной недостаточности необходима коррекция доз всех фторхинолонов. При тяжелых нарушениях функции печени может потребоваться коррекция дозы пефлоксацина.
Нежелательные реакции
Общие для всех хинолонов
ЖКТ: изжога, боль в эпигастральной области, нарушение аппетита, тошнота, рвота, диарея.
ЦНС: ототоксичность, сонливость, бессонница, головная боль, головокружение, нарушения зрения, парестезии, тремор, судороги.
Аллергические реакции: сыпь, зуд, ангионевротический отек; фотосенсибилизация (наиболее характерна для ломефлоксацина и спарфлоксацина).
Характерные для хинолонов I поколения
Печень: холестатическая желтуха, гепатит.
Характерные для фторхинолонов (редкие и очень редкие)
Опорно-двигательный аппарат: артропатия, артралгия, миалгия, тендинит, тендовагинит, разрыв сухожилий.
Почки: кристаллурия, транзиторный нефрит.
Сердце: удлинение интервала QT на электрокардиограмме.
Показания
Хинолоны I поколения
Инфекции МВП: острый цистит, противорецидивная терапия при хронических формах инфекций. Не следует применять при остром пиелонефрите.
Кишечные инфекции: шигеллез, бактериальные энтероколиты (налидиксовая кислота).
Фторхинолоны
Инфекции ВДП: синусит, особенно вызванный полирезистентными штаммами, злокачественный наружный отит.
Инфекции НДП: обострение хронического бронхита, внебольничная и нозокомиальная пневмония, легионеллез.
Кишечные инфекции: шигеллез, брюшной тиф, генерализованный сальмонеллез, иерсиниоз, холера.
Менингит, вызванный грамотрицательной микрофлорой (ципрофлоксацин).
Бактериальные инфекции у пациентов с муковисцидозом.
Туберкулез (ципрофлоксацин, офлоксацин и ломефлоксацин в комбинированной терапии при лекарственноустойчивом туберкулезе).
Норфлоксацин, с учетом особенностей фармакокинетики, применяется только при кишечных инфекциях, инфекциях МВП и простатите.
Противопоказания
Для всех хинолонов
Аллергическая реакция на препараты группы хинолонов.
Дополнительно для хинолонов I поколения
Тяжелые нарушения функции печени и почек.
Тяжелый церебральный атеросклероз.
Дополнительно для всех фторхинолонов
Предупреждения
Аллергия. Перекрестная ко всем препаратам группы хинолонов.
Беременность. Достоверных клинических данных о токсическом действии хинолонов на плод нет. Имеются единичные сообщения о гидроцефалии, повышении внутричерепного давления и выбухании родничка у новорожденных, матери которых во время беременности принимали налидиксовую кислоту. В связи с развитием в эксперименте артропатий у неполовозрелых животных применение всех хинолонов при беременности не рекомендуется.
Кормление грудью. Хинолоны в небольших количествах проникают в грудное молоко. Есть сообщения о гемолитической анемии у новорожденных, матери которых принимали налидиксовую кислоту в период кормления грудью. В эксперименте хинолоны вызывали артропатии у неполовозрелых животных, поэтому при назначении их кормящим матерям рекомендуется перевести ребенка на искусственное вскармливание.
Фторхинолоны не рекомендуется назначать детям и подросткам. Однако имеющийся клинический опыт и специальные исследования применения фторхинолонов в педиатрии не подтвердили риск повреждения костно-суставной системы, в связи с чем допускается назначение фторхинолонов детям по жизненным показаниям (обострение инфекции при муковисцидозе; тяжелые инфекции различной локализации, вызванные полирезистентными штаммами бактерий; инфекции при нейтропении).
Гериатрия. У пожилых людей увеличивается риск разрыва сухожилий при применении фторхинолонов, особенно в сочетании с глюкокортикоидами.
Заболевания ЦНС. Хинолоны оказывают возбуждающее действие на ЦНС, поэтому их не рекомендуют применять пациентам с судорожным синдромом в анамнезе. Риск развития судорог повышается у больных с нарушениями мозгового кровообращения, эпилепсией и паркинсонизмом. При использовании налидиксовой кислоты возможно повышение внутричерепного давления.
Нарушения функции почек и печени. Хинолоны I поколения нельзя применять при почечной и печеночной недостаточности, так как вследствие кумуляции препаратов и их метаболитов повышается риск токсических эффектов. Дозы фторхинолонов при тяжелой почечной недостаточности подлежат коррекции.
Острая порфирия. Хинолоны не следует применять пациентам с острой порфирией, так как в эксперименте на животных они оказывают порфириногенный эффект.
Лекарственные взаимодействия
При одновременном применении с антацидами и другими препаратами, содержащими ионы магния, цинка, железа, висмута, может снижаться биодоступность хинолонов вследствие образования невсасывающихся хелатных комплексов.
Пипемидовая кислота, ципрофлоксацин, норфлоксацин и пефлоксацин могут замедлять элиминацию метилксантинов (теофиллин, кофеин) и повышать риск их токсических эффектов.
Риск нейротоксических эффектов хинолонов повышается при совместном применении с НПВС, производными нитроимидазола и метилксантинами.
Хинолоны проявляют антагонизм с производными нитрофурана, поэтому следует избегать комбинаций этих препаратов.
Хинолоны I поколения, ципрофлоксацин и норфлоксацин могут нарушать метаболизм непрямых антикоагулянтов в печени, что приводит к увеличению протромбинового времени и риску кровотечений. При одновременном применении может понадобиться коррекция дозы антикоагулянта.
Следует с осторожностью назначать фторхинолоны одновременно с препаратами, удлиняющими интервал QT, так как увеличивается риск развития сердечных аритмий.
При одновременном применении с глюкокортикоидами повышается риск разрыва сухожилий, особенно у пожилых людей.
При использовании ципрофлоксацина, норфлоксацина и пефлоксацина совместно с препаратами, ощелачивающими мочу (ингибиторы карбоангидразы, цитраты, натрия бикарбонат), увеличивается риск кристаллурии и нефротоксических эффектов.
При одновременном применении с азлоциллином и циметидином в связи с понижением канальцевой секреции замедляется элиминация фторхинолонов и повышаются их концентрации в крови.
Информация для пациентов
Препараты хинолонов при приеме внутрь следует запивать полным стаканом воды. Принимать не менее чем за 2 ч до или через 6 ч после приема антацидов и препаратов железа, цинка, висмута.
Строго соблюдать режим и схемы лечения в течение всего курса терапии, не пропускать дозу и принимать ее через равные промежутки времени. В случае пропуска дозы принять ее как можно скорее; не принимать, если почти наступило время приема следующей дозы; не удваивать дозу. Выдерживать длительность терапии.
Не использовать препараты с истекшим сроком годности.
В период лечения соблюдать достаточный водный режим (1,2-1,5 л/сут).
Не подвергаться прямому воздействию солнечных и ультрафиолетовых лучей во время применения препаратов и в течение не менее 3 дней после окончания лечения.
Проконсультироваться с врачом, если улучшение не наступает в течение нескольких дней или появляются новые симптомы. При появлении боли в сухожилиях следует обеспечить покой пораженному суставу и обратиться к врачу.
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
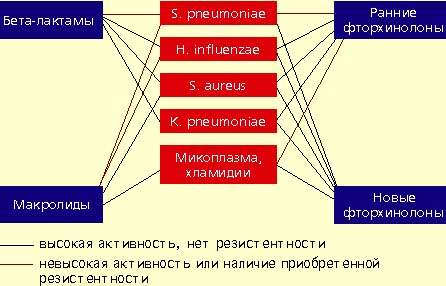 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Ципрофлоксацин или норфлоксацин что лучше
Антибактериальные препараты. Часть 6. Синтетические антибактериальные средства
Синтетические антибактериальные средства:
• Сульфаниламиды
• Хинолоны/фторхинолоны
• Другие синтетические антибактериальные средства
Сульфаниламиды
Сульфаниламиды были первыми химиотерапевтическими (системными) антибактериальными средствами, которые нашли широкое применение в практической медицине.
С появлением пенициллина и других антибиотиков, а в последнее время фторхинолонов, их использование сократилось, однако значения препараты этой группы не потеряли и в ряде случаев успешно назначаются при инфекционных заболеваниях, вызванных чувствительными к ним микроорганизмами.
Сульфаниламиды подавляют рост грамположительных и грамотрицательных бактерий, некоторых простейших (возбудители малярии, токсоплазмоза), хламидий (при трахоме, паратрахоме).
Их действие связано главным образом с нарушением образования необходимых для развития микроорганизмов фолата и дигидрофолата, в молекулу которых входит пара-аминобензойная кислота: сульфаниламиды близки по химическому строению к пара-аминобензойной кислоте, они захватываются микробной клеткой вместо пара-аминобензойной кислоты и тем самым нарушают течение в ней обменных процессов.
4 группы:
а) короткого действия (сульфаниламид, сульфатиазол, сульфаэтидол, сульфадимидин и др.);
б) среднего действия (сульфадиазин и др.);
в) длительного действия (сульфаметоксипиридазин, сульфамонометоксин, сульфадиметоксин и др.);
г) сверхдлительного действия (сульфален и др.)
Почти 65-летний период применения обусловил появление большого количества микробных штаммов, устойчивых к сульфаниламидам.
Преодолеть устойчивость удается, сочетая сульфаниламиды с триметопримом.
Ко-тримоксазол (сульфаметоксазол+триметоприм) – бисептол, гросептол
Мафенид
Месульфамид (стрептоцид растворимый)
Сульфагуанидин (сульгин)
Сульфадимидин (сульфадимезин)
Сульфадиметоксин
Сульфален
Сульфаметоксазол
Сульфаметрол+ Триметоприм (лидаприм)
Сульфаниламид (ранавексим, стрептоцид белый)
Сульфасалазин
Сульфатиазол серебра (аргосульфан)
Сульфацетамид (сульфацил натрия)
Сульфаэтидол (этазол натрия)
Фталсульфатиазол (фталазол)
Хинолоны/Фторхинолоны
Хинолоны. Налидиксовая кислота, пипемидиевая кислота, оксолиниевая кислота вследствие достаточно узкого антимикробного спектра и плохих фармакокинетических свойств нашли ограниченное применение в клинике, преимущественно при лечении инфекций мочевыводящих путей и некоторых кишечных инфекций.
Только после модификации молекулы хинолина (или нафтиридина) путем введения в нее атома фтора появились антимикробные препараты с уникальными свойствами, которые получили обобщенное название «фторхинолоны».
Классификация хинолонов
I поколение (нефторированные хинолоны):
Налидиксовая кислота (невиграмон, неграм)
Оксолиновая кислота (грамурин)
Пипемидовая кислота (палин)
II поколение (грамотрицательные фторхинолоны):
Ломефлоксацин
Норфлоксацин
Офлоксацин
Пефлоксацин
Ципрофлоксацин
III поколение (респираторные фторхинолоны):
Левофлоксацин
Спарфлоксацин
IV поколение (респираторно-антианаэробные фторхинолоны):
Моксифлоксацин
• Офлоксацин (таривид) наиболее эффективен в отношении стафилококка и также является препаратом II ряда при лечении туберкулеза
• Пефлоксацин (абактал) высоко эффективен при менингитах грамотрицательной этиологии, а при почечной недостаточности не требуется коррекции его дозы (выводится печенью).
• Норфлоксацин (нолицин, норбактин) был высоко эффективен при инфекции мочевых путей (особенно при цистите).
• Ципрофлоксацин и офлоксацин включены как препараты первого ряда или как альтернативные для лечения и профилактики сибирской язвы и чумы, в том числе у детей и беременных.
• Ломефлоксацин (максаквин) в России применяются в комплексной терапии туберкулеза
Ципрофлоксацин (ципролет, ципробай, ципринол) высоко эффективен при бактериальных инфекциях, вызванных синегнойной палочкой, при тяжелых кишечных инфекциях (сальмонеллез), протекающих с бактериемией, при туберкулезе (препарат II ряда).
В настоящее время новые фторхинолоны рассматриваются как наиболее надежные средства при лечении больных с тяжелой внебольничной пневмонией, в том числе госпитализированных в отделение реанимации и интенсивной терапии.
Показано, что на фоне лечения левофлоксацином летальность достоверно ниже по сравнению с комбинированной терапией цефтриаксоном и кларитромицином
• Получены убедительные клинические данные об эффективности моксифлоксацина (авелокс) в режиме монотерапии при лечении осложненных инфекций кожи и мягких тканей, гинекологических и абдоминальных инфекций.
• Возможность применения моксифлоксацина в режиме монотерапии обусловлена высокой природной активностью препарата в отношении анаэробных микроорганизмов.
Таким образом, полученные в последние годы клинические данные свидетельствуют, что новые фторхинолоны являются не только «респираторными», а имеют большой терапевтический потенциал в разных областях антибактериальной химиотерапии.
Гемифлоксацин (фактив)
• Обладает самой высокой активностью среди фторхинолонов в отношении Streptococcus pneumoniae.
• Активность гемифлоксацина в отношении грамотрицательных микроорганизмов оказалась сравнимой с таковой ципрофлоксацина.
• Длительный период полувыведения гемифлоксацина (8 часов) позволяет принимать препарат один раз в сутки.
• В отличие от левофлоксацина лишь 27–30 % гемифлоксацина выводятся из организма в неизмененном виде через почки
История создания и последующего клинического применения фторхинолонов является весьма показательной иллюстрацией того положения, что за расширение спектра и усиление антимикробного действия нередко приходится «платить» возрастанием частоты и появлением серьезных нежелательных явлений при назначении антибиотика
В отношении гемифлоксацина основной проблемой было появление макулопапулезной кожной сыпи при длительных курсах его приема женщинами моложе 40 лет и женщинами в постменопаузальном периоде, находящимися на заместительной гормональной терапии
Поэтоу производитель не рекомендует назначать препарат курсами более 7 дней.
Гемифлоксацин хорошо переносится пожилыми пациентами, а также больными с нарушенной функцией печени и почек.
Гемифлоксацин может приводить к удлинению интервала QT, в связи с чем не рекомендуется для использования у пациентов с удлинением интервала QT в анамнезе, электролитным дисбалансом и у принимающих антиаритмические препараты IА и III классов.
При приеме внутрь нитроимидазолы хорошо всасываются, биодоступность составляет более 80% и не зависит от пищи. Метронидазол хорошо всасывается при интравагинальном введении в виде таблеток. Пиковые концентрации в крови в этом случае составляют примерно 50% тех, которые достигаются при приеме эквивалентной дозы внутрь. При использовании вагинального геля абсорбция значительно ниже. При наружном применении метронидазол практически не всасывается.
Нитроимидазолы распределяются во многих тканях и биологических жидкостях, хорошо проходят через ГЭБ (создавая высокие концентрации в СМЖ и в ткани мозга) и плацентарный барьер, проникают в грудное молоко, активно секретируются со слюной и желудочным соком.
Показания
Системно
Анаэробные или смешанные аэробно-анаэробные инфекции различной локализации:
инфекции НДП (аспирационная пневмония, эмпиема плевры, абсцесс легкого); инфекции ЦНС (менингит, абсцесс мозга);
интраабдоминальные, включая инфекции органов малого таза;
инфекции полости рта;
псевдомембранозный колит;
периоперационная профилактика при интраабдоминальных и гинекологических вмешательствах.
Протозойные инфекции: трихомониаз, лямблиоз, балантидиаз, амебная дизентерия и внекишечный амебиаз (амебный гепатит, абсцесс печени, абсцесс мозга).
Эрадикация H.pylori при язвенной болезни (в сочетании с другими препаратами).
Местно: вагинит, бактериальный вагиноз, розовые угри, себорейная экзема, периоральный дерматит.
Противопоказания
• Аллергическая реакция на нитроимидазолы.
• Органические заболевания ЦНС с выраженными клиническими проявлениями.
• Беременность (I триместр).
• Кормление грудью.
Хиноксалины
В России в медицинскую практику введены два ЛС этого класса –диоксидин (для парентерального применения) и хиноксидин (для приема внутрь). Действующим началом хиноксидина является диоксидин. Таким образом, хиноксидин – пероральная лекарственная форма диоксидина.
Диоксидин для системного применения используют только у взрослых пациентов в качестве резервного ЛС (при неэффективности и непереносимости менее токсичных антибиотиков, а также невозможности их применения по каким-либо другим причинам) при тяжелых формах инфекции:
1. нижних отделов дыхательных путей (гнойный плеврит, эмпиема, абсцесс легкого);
2. интраабдоминальных;
3. кожи и мягких тканей (флегмоны, гнойные посттравматические, послеоперационные и ожоговые раны);
4. раневой и ожоговой инфекции (местно).
Клиническое значение диоксидина для системного применения обусловлено его активностью в отношении штаммов бактерий, устойчивых к ЛС других антибактериальных групп, и эффективностью при различных гнойных инфекциях, вызванных устойчивыми, в том числе полирезистентными, штаммами бактерий.
Побочные эффекты, встречающиеся у пациентов:
ЖКТ: боль в животе, тошнота, диарея, рвота.
Нервная система: головная боль, судорожные сокращения икроножных мышц.
Аллергические реакции: кожные сыпи, крапивница, при внутривенном введении нельзя исключить анафилактический шок.
При внутривенном введении: озноб, повышении температуры тела.
Кора надпочечников: при передозировке возможно развитие симптомов недостаточности надпочечников.
При строгом контроле за дозировками ЛС нежелательные реакции наблюдаются редко.
Фузидины
Класс фузидинов представленфузидиевой кислотой и ее солями – натриевой (фузидин натрия, фуцидин) и диэтиламиновой.
За последние годы значение фузидиевой кислоты в терапии инфекций стафилококковой этиологии стало возрастать, так как она эффективна в отношении большинства полирезистентных штаммов золотистого и эпидермального стафилококка.
Фузидиевая кислота обладает преимущественной активностью в отношении грамположительных бактерий, в первую очередь, стафилококков и стрептококков, в том числе устойчивых к оксациллину/метициллину и пенициллину.
Фузидиевую кислоту применяют для лечения гнойно-воспалительных процессов различной локализации, вызванных, в первую очередь, грамположительной кокковой флорой. Эффективность лечения при системном применении стафилококковых инфекций составляет 90% и более, при стрептококковых – 75-85%. Наличие парентеральной и пероральной лекарственных форм позволяет проводить ступенчатую терапию.
Важной областью применения фузидиевой кислоты является возможность лечения инфекций костей и суставов, а также использование при вторичном инфицировании протезов и средств остеосинтеза.
Получены положительные результаты применения фузидиевой кислоты в сочетании с антистафилококковыми пенициллинами при стафилококковых эндокардитах.
Противопоказания
1. Гиперчувствительность к фузидиевой кислоте и ко вспомогательным компонентам в лекарственной форме;
2. Облитерирующие заболевания сосудов (для внутривенного введения).
Для лекарственных форм фузидиевой кислоты с гормональными лс:
1. Первичные бактериальные, микотические или вирусные поражения кожи;
2. Периоральный дерматит;
3. Туберкулез легких;
4. Кожные проявления сифилиса;
5. Розовые угри;
6. Повышенная чувствительность к компонентам лекарственной формы.
Липопептиды
Даптомицин (кубицин). Активен только в отношении грамположительных бактерий.
Даптомицин в присутствии ионов кальция связывается с клеточной мембраной (как в фазе роста бактериальной клетки, так и в состоянии покоя), вызывает ее деполяризацию, что приводит к стремительному ингибированию синтеза белка, ДНК и РНК и гибели клетки с незначительным лизисом.
Даптомицин эффективен у больных с осложненными инфекциями кожи и мягких тканей (раневые инфекции, подкожные абсцессы), с бактериемией, вызванной Staphylococcus aureus, в т.ч. метициллинорезистентными штаммами (инфекционные эндокардиты, включая ранние послеоперационные эндокардиты)
Механизм действия даптомицина отличается от такового у всех известных на сегодняшний день антибиотиков. Необратимо связывается с клеточной мембраной грам(+) бактерий. Формируется канал, приводящий к быстрой деполяризации клеточной мембраны из-за выхода калия и, возможно, других ионов, содержащихся в цитоплазме. В результате грубого нарушения процессов синтеза макромолекул наступает гибель бактериальной клетки. В отличие от бета-лактамных антибиотиков, бактерицидное действие даптомицина не связано с разрушением клетки.
Антибиотикорезистентность
• Природная или генетическая: генетически обусловленное отсутствие чувствительности микроорганизмов к антибактериальному препарату
• Приобретенная: возникает в результате мутации отдельных штаммов бактерий и селекции устойчивых клонов в результате внехромосомного (плазмидного) обмена генетической информацией между отдельными бактериальными клетками
• Приобретенная резистенность может быть:
Первичная – до начала лечения
Вторичная – на фоне лечения антибактериальными препаратами
Перекрестная – в пределах одной группы (полная, частичная)
Ассоциированная – между различными группами
Механизмы формирования антибиотикорезистентности
• Нарушение проницаемости клеточной стенки микрооганизмов для антибактериального препарата (АБП) – модификация пориновых каналов
• Ферментативная инактивация АБП – продукция бактериями ферментов (бета-лактамазы, карбапенемазы, металлопротеазы и др.)
• Модификация мишеней действия АБП – клеточных структур (фторхинолоны, сульфаниламиды)
• Активное выведение АБП из микробной клетки – эффлюкс (тетрациклины, макролиды)
• Формирование метаболического «шунта» (сульфаниламиды)
Категории чувствительности микроорганизмов к антибиотикам
Чувствительный
• лечение инфекции, вызванной данным микроорганизмом при применении данного антибиотика вероятно будет эффективным
Промежуточный
• лечение инфекции, вызванной данным микроорганизмом при применении данного антибиотика может быть эффективным при использовании повышенных доз и при локализации очага инфекции в том участке, где возможно формирование повышенных концентраций антибиотика
Устойчивый
• лечение инфекции, вызванной данным микроорганизмом при применении данного антибиотика вероятно будет неэффективным
Контроль эффективности антибактериальной терапии – через 48-72 час.