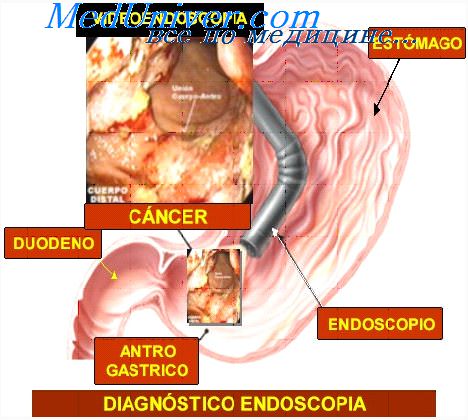
Цитология легких что показывает
Цитология легких что показывает
Созданная в 1959 г международная номенклатура опухолей человека послужила исходной основой для создания гистологическкх классификаций опухолей специальными комиссиями ВОЗ. В настоящее время имеются 2 серии цитологических классификаций ВОЗ и одна СЭВ, в которых отражены только некоторые локализации новообразований. В вышедшей в 1985 г. книге «Цитологическая диагностика опухолей и предопухолевых процессов» при описании новообразований за основу были взяты имеющиеся гистологические классификации ВОЗ с учетом возможностей цитологического метода и имеющиеся уже цитологические классификации.
При острых воспалительных заболеваниях в эпителии могут развиваться реактивные изменения, симулирующие новообразование и являющиеся причиной ошибочного диагноза, иногда же. наоборот, воспалительный процесс маскирует опухоль.
Достоверная цитологическая диагностика туберкулеза легких основана на обнаружении в мазках из мокроты или содержимого бронхов двух видов клеток эпителноидных и клеток Пирогова — Лангханса.
При цитологической диагностике опухолей легких процент обнаружения опухолевых клеток зависит от расположения опухоли в верхних или нижних долях, от формы роста. Около половины всех злокачественных опухолей легкого приходится на долю плоскоклеточного неороговевающего и ороговевающего рака. Цитологический материал при раке легкого характеризуется полиморфизмом размеров и формы клеток, которые располагаются среди слизи и бесструктурных масс.
Клетки плоскоклеточного ороговевающего рака лежат разрозненно или скоплениями. Изредка они располагаются в виде луковиц. Ядра опухолевых клеток, чаще всего гилерхромны, с грубым, неравномерно распределенным хроматином с неровными контурами. По форме ядра — неправильно округлые, палочковидные. Цитоплазма клеток плотная, часто с признаками жировой дегенерации. При плоскоклеточном ороговевающем раке нередко отмечают раннее ороговение.
Плоскоклеточный неороговевающий рак характеризуется наличием крупных округлых клеток, расположенных разрозненно или в виде комплексов. Ядра крупные, расположены центрально и занимают большую часть клетки, хроматин нежный, равномерно распределен по ядру. В ядрах нередко встречаются ядрышки, иногда гипертрофированные.
При железистой форме рака обнаруживают атипичные клетки крупных, средних и иногда мелких размеров округлой, овальной, призматической формы. Клетки расположены разрозненно, в виде железистых структур, папиллярных образований. Ядра крупные, округлой или овальной формы, расположены чаще всего эксцентрично. Хроматин нежный, в ядрах часто видно по нескольку гипертрофированных ядрышек. Встречаются дву- и трехъядерные клетки, цитоплазма очень нежная, в одних клетках она узким ободком окружает ядро, в других — занимает больший объем, вакуолизированная.
В зависимости от степени зрелости клеток можно говорить о степени дифференцировки данного варианта опухоли.
При недифференцированном мелкоклеточном раке опухолевые клетки расположены разрозненно, плотными группами, следующими друг за другом по ходу слизи, скоплениями. Клетки мелкие, округлые, напоминают лимфоциты. Ядра их крупные, плотные, гиперхромные, с компактным хроматином занимают почти всю клетку. Цитоплазма узеньким, еле заметным ободком окружает ядро. В комплексах клетки настолько тесно прилежат друг к другу, что в соседних клетках образуются вдавления, в связи с чем они принимают самую разнообразную форму треугольную, палочковидную, полулунную. Ядра принимают форму клетки.
Крупноклеточный недифференцированный рак характеризуется наличием крупных светлых клеток, расположенных разрозненно или в виде комплексов. Ядра повторяют форму клетки. Хроматин нежно-гранулярный или мелкопетлистый, равномерно распределен по ядру. Цитоплазма узеньким ободком окружает ядро, клетки часто выглядят голоядерными.
При цитологической диагностике заболеваний органов пищеварения исследуются смывы из пищевода, желудка, двенадцатиперстной, сигмовидной, прямой кишки («слепой» способ), целенаправленные смывы под визуальным контролем, аспираты через катетер, подведенный к участку поражения; соскобы нейлоновой щеткой во время эзофаго-, гастро-, дуодено-, сигмо-, ректоскопии; аспираты и соскобы щеткой из общего желчного и главного панкреатического протока во время ретроградной эндоскопической панкреатохолангиографии; пунктаты слюнных желез, печени; пунктаты, соскобы и отпечатки из различных органов брюшной полости при лапароскопии; асцитическая жидкость.
В пищеводе встречаются доброкачественные опухоли, такие как плоскоклеточная папиллома, а также некоторые неопухолевые заболевания эзофагиты различного происхождения, лейкоплакии. При цитологическом исследовании материала, полученного ил пищевода в этих случаях, в препаратах обнаруживается значительное количество клеток плоского эпителия и лейкоцитов. Нередко встречаются эпителиальные клетки в состоянии дистрофии
Из злокачественных новообразований в пищеводе встречают преимущественно плоскоклеточный рак, реже аденокарциному. Для цитологической картины плоскоклеточного рака характерно наличие детрита, разрушенных клеток-чешуек плоского эпителии, крупных полигональных клеток и клеток округлой формы. Ядра клеток грубые, пикнотизированные с неровными контурами, грубым глыбчатым хроматином. Цитоплазма преимущественно широкая, гомогенная от базофильной до почти бесцветной, местами с розоватым оттенком, мелковакуолизированная.
Цитологическое исследование помогает выявить рак на ранней стадии
При выявлении ракового заболевания на ранней стадии шансы выздоровления повышаются до 95%. Цитологическое исследование относят к высокоточной морфологической диагностике рака. Это безопасный и быстрый способ выявить злокачественную опухоль еще до того, как она разрастется и пустит метастазы.
Что представляет собой цитологический метод диагностики
Цитология изучает строение и функции клеток. Соответственно, цитологическая диагностика предполагает лабораторное исследование под микроскопом клеточного материала тканей, органов, жидкостей, из которых состоит организм человека. Любые изменения в строении клеток, ядре, цитоплазме, их функционировании свидетельствуют об отклонениях в работе организма.
Раковые заболевания вызывают нарушения в клеточной структуре. По этим нарушениям специалисты могут судить о наличии или отсутствии злокачественной опухоли. Таким образом, цель цитологического исследования — подтвердить или опровергнуть рак.
Нередко цитологическую диагностику проводят параллельно с гистологической. Отличие этих методов — в материалах для исследования. Гистология изучает срезы тканей органов, для забора образца биоматериала применяют биопсию (чаще всего пункционную). Цитология в ряде случаев менее травматична, так как материалами служат смывы, соскобы, мазки, выделения, жидкости (например, моча), получить которые проще. Однако гистологический метод все же считается более точным и информативным, так как дает возможность изучить саму ткань новообразования.
Преимущества цитологического анализа
В каких случаях проводят цитологическую диагностику
Хотите мы вам перезвоним?
Какие материалы используют
Забор биоматериалов для цитологического анализа проводят тремя методами.
Эксфолиативный
Клетки слущивают с поверхности биоматериала с помощью специальных лабораторных инструментов. Материалом может служить любая жидкость, выделяемая организмом. Образцы также получают с помощью мазков, соскобов с пораженного участка кожи, внутренних органов (например, матки). Для этого применяют тампоны или специальные щетки. Также исследуют смывы из полых органов, полученные с помощью физраствора, ферментированных растворов.
Пункционный
Забор биоматериала осуществляют из внутренних органов с помощью тонкой пункционной иглы. Этим методом получают образцы клеток лимфоузлов, молочной, щитовидной желез, костного мозга, различных полостей, а также новообразований, расположенных на периферии легкого. К пункционным биообразцам относят содержимое кист, плевральную, перикардиальную жидкости. Для получения и препарирования материала применяют сложные способы смывов, соскобов.
Эндоскопический
Биоматериал забирают во время эндоскопического исследования и биопсии внутренних органов. С помощью специальной аппаратуры извлекают образцы тканей. Затем в лаборатории с них снимают мазки, которые и подвергают исследованию.
Как проводят цитологический анализ при раковых заболеваниях
Рак легкого
Чтобы получить биоматериал, используют эндоскопический метод – бронхоскопию. В ходе процедуры делают мазок или биопсию. Также применяют трансторакальную пункцию с последующим изучением мазков биоматериала. Этот метод подходит и для определения метастазов в легких. В ряде случаев достаточно 5-кратного исследования мокроты, однако точность результатов в данном случае ниже.
Рак органов ЖКТ
При раке желудка, пищевода биоматериал можно получить с помощью смывов физраствором или в ходе эндоскопического исследования — фиброэзофагогастроскопии. Для забора материала при раке кишечника применяют ректороманоскопию, фиброколоноскопию.
Рак шейки и тела матки
Для получения материала при подозрении на рак шейки матки достаточно соскоба с поверхности органа во время осмотра у гинеколога. Метод эффективен при профилактической диагностике и очень информативен (точность – до 97%). Для исследования тела матки используют смыв или аспирацию тонкой иглой.
Рак молочной железы
Материалом для исследования могут служить выделения из соска, пунктат, отпечаток со взятого при биопсии образца, соскоб из ткани молочной железы или эрозивной поверхности.
Рак кожи
Биоматериал забирают относительно простыми способами — соскобом или отпечатком. Если в новообразовании скапливается жидкость, забор проводят пункционной иглой.
Цитологическое исследование в Онкологическом центре «СМ-Клиника»
В онкоцентре действует собственная лаборатория с высокоточным оборудованием, позволяющим проводить цитологический анализ в соответствии с международными стандартами.
Забор материала и лабораторные исследования осуществляют квалифицированные специалисты с опытом от 10 лет, которые работают с любыми видами онкологических заболеваний.
Пациент в минимальные сроки получает результат в бумажном или цифровом виде.Биообразцы хранятся в специальных условиях, поэтому возможно проведение повторных исследований.
Пройти диагностику в Онкологическом центре «СМ-Клиника» можно после предварительной записи. Достаточно оставить заявку на сайте или позвонить: +7 (495) 777-48-49
Цитология легких что показывает
Слизистый характер бронхиального секрета обусловлен сочетанным функционированием желез подслизистой оболочки бронхов и бокаловидных клеток эпителия. В ответ на инвазию инфекционными агентами эпителий бронхов выделяет цитоки- ны IL-8, IL-6, колониеобразующие факторы гранулоцитов, моноцитов, и др. Так, тучные клетки выделяют хемотаксические факторы «быстрого реагирования»: эозинофильный хемотаксический фактор анафилаксии; хемотаксический фактор нейтрофилов высокой молекулярной массы; хемотаксические факторы, направленные на лимфоциты, базофилы, моноциты; фактор, активирующий тромбоциты (ФАТ). Усиливается синтез и выделение простогландинов, простациклинов, Т-хелперов. Также увеличивается содержание альвеолярных макрофагов. Они осуществляют фагоцитоз, переработку антигена и «передачу» информации лимфоцитам, предотвращают развитие аллергических реакций. Иммунная защита, секреторная активность являются индукторами микроваскулярного просачивания и секреции слизи.
Цитологическое исследование мокроты позволяет выявить болезнетворные микроорганизмы (в том числе микобакте- рию туберкулеза), клетки злокачественных опухолей, примеси (кровь, гной и т.п.), характерные для определенных болезней, а также определить чувствительность бактериальной флоры к антибиотикам.
Возможно обнаружение в мокроте следующих клеток: эпителиальные клетки, или клетки цилиндрического мерцательного эпителия (при бронхитах, бронхиальной астме или злокачественных новообразованиях легких); бокаловидные клетки (при усиленной секреции); базальные или промежуточные клетки; альвеолярные макрофаги из нижних респираторных отделов. Плоский эпителий попадает в мокроту из полости рта и не имеет диагностического значения. Наличие в мокроте более 25 клеток плоского эпителия указывает на то, что данный образец мокроты загрязнен отделяемым из ротовой полости. Альвеолярные макрофаги локализуется в основном в межальвеолярных перегородках. Поэтому анализ мокроты, где присутствует хотя бы 1 макрофаг, указывает на то, что поражены нижние отделы дыхательной системы. При инфаркте легкого, застое в малом кругу кровообращения обнаруживаются «клетки сердечных пороков», т.е. альвеолярные макрофаги с включениями гемосидерина [2].
Встречаются также и макрофаги с липид- ными включениями (липофаги) при туберкулезе, хроническом заболевании легких. Отмечают повышение в мазке мокроты количества нейтрофилов, лимфоцитов, эозинофилов, моноцитов, «гигантских» клеток Пирогова-Лангерганса. Обнаружение более 25 нейтрофилов в поле зрения свидетельствует об инфекции (пневмония, бронхит). Единичные эозинофилы могут встречаться в любой мокроте; в большом количестве (до 50-90% всех лейкоцитов). Они обнаруживаются при бронхиальной астме, эози- нофильных инфильтратах, глистных инвазиях легких и т.п. Эритроциты появляются в мокроте при разрушении ткани легкого, пневмонии, застое в малом круге кровообращения, инфаркте легкого и т.д. Мокрота может содержать клетки злокачественных опухолей, особенно если опухоль растет эндобронхиально или распадается. Определять клетки как опухолевые можно только в случае нахождения комплекса атипичных полиморфных клеток, особенно если они располагаются вместе с эластическими волокнами.
В мазке мокроты могут встречаться волокнистые образования: эластические волокна, фибриновые волокна и спирали Куршмана (при туберкулезе, абсцессе легкого,раке). Эластические волокна имеют вид тонких двухконтурных волоконец одинаковой на всем протяжении толщины, дихотомически ветвящихся. Эластичные волокна исходят из легочной паренхимы. Выявление в мокроте эластичных волокон свидетельствует о разрушении легочной паренхимы (туберкулез, рак, абсцесс). Иногда их присутствие в мокроте используют для подтверждения диагноза абсцедирую- щей пневмонии.
Исследование мокроты в Москве
Рак легких — распространенное злокачественное новообразование, которое чаще других онкологических заболеваний приводит к летальному исходу. Данное исследование может быть использовано в рамках раннего выявления рака легких в сочетании с бронхоскопией и другими методами диагностики.
Приём и исследование биоматериала
Когда нужно сдавать анализ Исследование мокроты?
Комплексная диагностика рака легких — особенно центрального подтипа — у пациентов с клинической картиной: кашель, кровохарканье и др.
Подробное описание исследования
Мокрота — это отделяемое, которое вырабатывается в легких, верхних и нижних дыхательных путях. В норме образование мокроты протекает практически без проявлений — её образуется настолько мало, что обычно человек незаметно для себя её проглатывает. По консистенции мокрота представляет собой слизь. При развитии патологических процессов в трахее, бронхах или легких количество и свойства мокроты обычно меняются. К последним можно отнести:
Изменение цвета. Мокрота может иметь прозрачный, зеленоватый, красноватый, ржавый и даже черный цвет. Некоторые заболевания (долевая пневмония, отек легких и др.) можно заподозрить уже по цвету выделившейся мокроты.
Изменение запаха. В норме мокрота не имеет запаха. Как правило, его появление связано с застоем мокроты в бронхах или полостях легкого.
Изменение консистенции. Мокрота может выделяться в виде густой или жидкой слизи. Во многом консистенцию мокроты определяет её состав, в котором могут содержаться клетки иммунной защиты (лейкоциты), антитела и другие белки, микроорганизмы, а также частицы инородных веществ. Также в мокроте могут быть различные примеси, которые можно увидеть невооруженным глазом: гнойные пробки, фиброзные сгустки, кусочки омертвевших тканей и др.
В медицинской практике исследование мокроты является многофункциональным, поэтому при помощи разных методов его могут проводить для диагностики инфекционных, аллергических и онкологических заболеваний органов дыхания. Данный лабораторный тест — цитологический анализ — мокроты направлен на выявление у больного злокачественного новообразования в лёгких.
Для цитологического исследования (цитологии) можно использовать откашливаемую мокроту (утреннюю порцию), а также мокроту, полученную во время эндоскопического обследования бронхов. Полученный материал наносят на предметные стекла и производят микроскопическое исследование (микроскопию) мазка. Данный метод позволяет выявить в исследуемом образце мокроты раковые или атипичные клетки.
Установлено, что цитология мокроты чаще всего — около 70 % случаев — обнаруживает центральный рак лёгкого, реже (40 %) – периферический рак легкого. Их отличие заключается в следующем: центральный рак представляет собой опухоль в условном центре легкого — корне (крупные бронхи и сосуды), а периферический рак — это новообразование на периферии легочной ткани. Одним из преимуществ цитологического метода диагностики также является то, что с помощью него можно выявить даже рак легких на начальных стадиях (in situ).
Цитологического исследование мокроты является простым и неинвазивным тестом, который можно использовать при ранней диагностике патологий легких. Для более точной верификации исследование рекомендуется проводить 5-6 раз и в сочетании с бронхоскопией.
Цитология легких что показывает
Мелкоклеточный рак легкого (МРЛ) составляет 13% всех опухолей легкого [1]. МРЛ является формой рака легкого с характерными клиническими характеристиками, чувствительностью к химиотерапии, генетическими особенностями и морфологической картиной. МРЛ — особый гистологический тип опухоли, характеризующийся высокой скоростью роста, быстрым удвоением опухоли и ранним развитием метастазов. У подавляющего большинства пациентов развитие МРЛ связано с курением. У 75—90% пациентов имеется мутация гена TP53, определяющая экстремальную генетическую нестабильность, что приводит к агрессивному, очень сложному заболеванию на молекулярном уровне с большим количеством мутаций. В отличие от немелкоклеточного рака легкого, в лечении которого достигнуты значительные успехи с использованием целевых методов, для МРЛ до сих пор нет одобренных таргетных препаратов [2]. Химиотерапия на основе платины является основным методом лечения МРЛ, который очень чувствителен к начальной химиотерапии с добавлением лучевой терапии и профилактического краниального облучения. Хирургическое лечение при МРЛ невозможно, поскольку практически у 95% пациентов при постановке диагноза имеются отдаленные метастазы. Общая 5-летняя выживаемость составляет менее 7% [2]. Основное внимание уделяется дифференциальной диагностике. МРЛ диагностируют от лимфом, плоскоклеточных, железистых и крупноклеточных карцином, которые чаще всего удаляются хирургическим путем или требуют другого химиотерапевтического лечения. Предоперационно диагноз МРЛ ставится на основании морфологического исследования материала малых биопсий и цитологических образцов. Проблема состоит в том, что часто из-за морфологических особенностей опухоли возникают сложности в диагностике как на цитологическом, так и на гистологическом материале.
Цель исследования — улучшение морфологической диагностики МРЛ на материале бронхобиопсий.
Материал и методы
Ретроспективно проанализированы цитологические и гистологические препараты у 34 пациентов с диагнозом МРЛ за 2016—2017 гг. Для цитологического исследования брали мазки-отпечатки с кусочка биоптата, полученного при бронхобиопсии. Цитологические препараты окрашивали по Паппенгейму. Гистологические препараты подвергали стандартной гистологической проводке и окрашивали гематоксилином и эозином. Для иммуногистохимического исследования использовали систему детекции EnVision Flex («Dako», Дания) и антитела к общим цитокератинам, хромогранину А, синаптофизину, CD56, Ki-67, СК5/6, СК7 и TTF1 («Dako», Дания).
Результаты и обсуждение
У 34 пациентов с диагнозом МРЛ уверенное цитологическое заключение составляет 59%, гистологическое — 21%, злокачественное круглоклеточное мелкоклеточное новообразование, больше данных за МРЛ — 68%. Достаточно низкая воспроизводимость диагноза МРЛ без дополнительного иммуноморфологического исследования связана с морфологическими особенностями опухоли.
Несмотря на характерную цитологическую картину, клеточные элементы МРЛ часто разрушены, вследствие чего в 23% наблюдений заключение дается в предположительной форме.
Исходя из полученных данных, гистологическое исследование МРЛ на материале бронхобиопсий вызывает трудности. Как правило, опухолевые клетки располагаются в хаотично расположенных пластах, разделенных тонкой соединительнотканной перегородкой, но могут присутствовать розетки, периферические палисадоподобные структуры, гнезда, цепочки и редко трубочки. Диффузная картина роста может напоминать злокачественную лимфому. Редко возникают сосочки, когда периваскулярные опухолевые клетки остаются жизнеспособными, а на остальных участках выражен некроз [4, 5]. На качество гистологического материала при МРЛ из-за особенностей опухолевых клеток влияет гистологическая проводка. Хрупкие опухолевые клетки не выдерживают гистологическую проводку с агрессивными химическими реактивами, сморщиваются и разрушаются, поэтому оценить клеточную характеристику сложно. Клетки мелкие, с плохо выраженными цитологическими критериями МРЛ. Характерным симптомом является базофильная «инкрустация» стенок сосудов ДНК из некротизирующихся опухолевых клеток (ядерный мусор, эффект Azzopardi) [6, 7]. Наиболее частое гистологическое заключение — злокачественное мелкое круглоклеточное новообразование. Митотический индекс высокий, в среднем 60—80 митозов на 2 мм площади. В малых биопсиях митозы иногда трудно идентифицировать, материал часто представлен некротическими массами, иногда некроз может отсутствовать из-за ограниченного отбора проб. На материале малых биопсий в случае небольших образцов инвазивный компонент опухоли может быть не обнаружен и оценка производится только на ограниченном количестве цитологических критериев. Артефакт раздавливания часто встречается в малых биопсиях и может затруднить гистологическую интерпретацию [8, 9].
Кроме того, на качество гистологических препаратов влияют такие факторы, как небольшие измельченные образцы биопсии, ишемические изменения, плохая фиксация и некачественно приготовленные гистологические препараты.
Решить сложности морфологической диагностики МРЛ позволяет иммуноморфологическое исследование. Иммуногистохимическое исследование гистологического материала проведено в 90% наблюдений, что позволило уточнить диагноз МРЛ. Для МРЛ характерна экспрессия маркеров нейроэндокринной дифференцировки: CD56, хромогранина A и синаптофизина, которые лучше всего использовать совместно. CD56 экспрессировался практически в 100% наблюдений, синаптофизин — в 70%, хромогранин, А — в 26%. Индекс пролиферативной активности Ki-67 в МРЛ высокий, составляет в среднем 70—90%. Несмотря на то что иммуногистохимическое исследование существенно помогает в постановке диагноза МРЛ, интерпретация иммуногистохимической картины должна быть тщательно выполнена в соответствии с морфологическим исследованием. Одинаковая иммуногистохимическая картина экспрессии антител отмечена при других нейроэндокринных опухолях легких (включая карциноид и крупноклеточную нейроэндокринную карциному), а также при метастатических нейроэндокринных карциномах из других органов.
Дифференциальная диагностика проводится с низкодифференцированным плоскоклеточным и аденогенным раком, лимфомой, хроническим воспалительным инфильтратом и атипичным карциноидом. Для дифференциальной диагностики МРЛ и низкодифференцированного плоскоклеточного и аденогенного рака используется следующая панель маркеров: TTF1, СК7, напсин А, СК5/6 и белок р63 (р40). На нашем материале в 2 наблюдениях проведено иммуногистохимическое исследование и диагностирован плоскоклеточный и аденогенный рак. По данным литературы, в 70—90% МРЛ присутствует экспрессия TTF1, но необходимо учитывать, что он может быть положительным в 44—80% внелегочных мелкоклеточных карциномах (рис. 2 ). 

В классификации ВОЗ (2015) опухолей легких выделено два подтипа МРЛ: классический и комбинированный. При комбинированном МРЛ компонент немелкоклеточного рака составляет не менее 10% объема опухолевого узла. По данным литературы [13], комбинированный МРЛ составляет 10—28% наблюдений: сочетание с крупноклеточным раком — 16%, аденокарциномой — 9% и плоскоклеточной карциномой — 3%. Морфологи не всегда отмечают комбинированный характер опухоли. В большинстве комбинированных опухолей МРЛ является преобладающим компонентом. Поскольку присутствие компонента МРЛ определяет прогноз и терапию заболевания, необходимо определение этого компонента в опухоли. Если диагноз МРЛ подтвержден, следует рассмотреть очень редкую возможность комбинированного МРЛ с компонентом аденокарциномы. Увеличивается число сообщений о мутации гена EGFR в компоненте аденокарциномы при комбинированном МРЛ, что повышает вероятность лечения ингибиторами тирозинкиназы [15].
Чрезвычайно редко МРЛ встречается у некурильщиков. В этом случае диагноз должен быть тщательно документирован с иммуногистохимической оценкой, чтобы исключить лимфому, меланому, карциноид и PNET.
Гистологическая трансформация в МРЛ может происходить у 3—15% пациентов с немелкоклеточным или комбинированным раком легкого, особенно при лечении ингибиторами тирозинкиназы. Гистологическую трансформацию в МРЛ можно заподозрить у пациентов с клинически ухудшающимся течением заболевания. Поэтому настоятельно рекомендуют проводить биопсию каждого нового очага поражения.
Заключение
МРЛ является особой формой рака легкого с характерными морфологическими особенностями. На качество гистологического материала при МРЛ из-за особенностей опухолевых клеток влияет гистологическая проводка. В цитологических препаратах мазков-отпечатков биоптатов опухоли, полученных при бронхобиопсии, опухолевые клетки МРЛ сохраняются лучше, чем в гистологических препаратах, прошедших агрессивную химическую проводку. Иммуногистохимическое исследование для уточнения диагноза МРЛ потребовалось провести в 90% наблюдений.
Цитология является надежным методом, часто более информативным, чем малая биопсия со скудным количеством опухолевых клеток и выраженным краш-синдромом. Совместное применение цитологического и гистологического исследования при МРЛ должно быть стандартом морфологической диагностики, повышающим эффективность предоперационной морфологической диагностики.
Концепция и дизайн исследования — Н.Н.В., О.В.Б.
Сбор и обработка материала — О.В.Б., А.Г.Е., В.Ю.М.
Написание текста — О.В.Б.
Авторы заявляют об отсутствии конфликта интересов.