Цитопротекторы что это такое
Цитопротекторы в терапии заболеваний желудка. Оптимальный подход к выбору препарата
Яковенко А.В., Григорьев П.Я., Яковенко Э.П., Агафонова Н.А., Прянишникова А.С.,
Иванов А.Н., Алдиярова М.А., Солуянова И.П., Анашкин В.А., Оприщенко И.В.
Российский государственный медицинский университет, Москва.
Слизистая оболочка желудка (СОЖ) постоянно подвергается воздействию экзогенных и эндогенных агрессивных субстанций, в связи с чем она обладает целым рядом взаимосвязанных цитопротективных механизмов, предупреждающих ее повреждение [5, 7]. Агрессивные факторы подразделяются на экзогенные и эндогенные, а также на внутрипросветные и гематогенные. К основным внутрипросветным эндогенным повреждающим субстанциям, с которыми СОЖ контактирует постоянно, относятся соляная кислота, пепсин и забрасываемые в желудок желчь и панкреатические ферменты. Экзогенные внутрипросветные факторы поступают в желудок периодически, в различных сочетаниях и количествах. К ним относятся бактерии, в первую очередь Helicobacter pylori (HP), вирусы, этанол, лекарственные препараты (НПВП, кортикостероиды, цитостатики и др.), пищевые компоненты (специи), а также термические характеристики принимаемых продуктов.
К гематогенным эндогенным повреждающим факторам относятся провоспалительные и вазоактивные медиаторы, продукты нарушенных метаболических процессов в организме (мочевина, мочевая кислота и др.), а также ряд экзогенных повреждающих субстанций: вирусы, бактерии и их токсины, лекарства, химические субстанции, соли тяжелых металлов и др., поступающие в организм, минуя желудочно-кишечный тракт. Под влиянием экзогенных и эндогенных ксенобиотиков в СОЖ нарушаются метаболические процессы, что приводит к появлению новых биологических субстратов, оказывающих тканевой деструктивный эффект.
Основными механизмами действия повреждающих СОЖ агентов являются [1, 7]:
1) падение трансмембранного потенциала поверхностного эпителия, способствующего обратной диффузии водородных ионов в СОЖ;
2) деградация пристеночной слизи и повреждение поверхностного эпителия СОЖ;
3) индукция синтеза провоспалительных субстанций в СОЖ;
4) блокада продукции противовоспалительных тканевых простагландинов и АТФ;
5) активация тканевых фосфолипаз;
6) активация перекисного окисления липидов в эпителии СОЖ;
7) нарушение кровотока и сосудистой проницаемости в СОЖ.
При этом механизмы повреждения СОЖ при воздействии различных факторов агрессии нередко суммируются и в то же время имеют определенные различия (табл. 1).
Таблица 1. Факторы, повреждающие СОЖ, и ведущие механизмы их действия
| Механизмы действия | Основные повреждающие факторы | |||||
| H + | HПВП | желчные кислоты | этанол | HP | пепсин | |
| Падение трансмембранного потенциала, обратная диффузия H + | + | + | + | + | + | — |
| Прямое повреждение эпителия СОЖ | + | + | + | + | + | + |
| Индукция синтеза провоспалительных субстанций | — | — | — | + | + | — |
| Снижение синтеза тканевых простагландинов, АТФ | — | + | — | — | + | — |
| Активация тканевых фосфолипаз | — | — | — | + | + | — |
| Активация перекисного окисления липидов | — | + | — | + | + | — |
| Нарушение сосудистой проницаемости | — | + | — | — | + | + |
| Снижение кровотока СОЖ | — | + | — | — | + | — |
| Деградация защитной слизи | — | + | + | + | + | + |
| Повреждение поверхностного эпителия СОЖ | + | + | + | + | + | + |
| Нарушение процессов регенерации эпителия СОЖ | + | + | + | + | + | — |
Желудочная цитопротекция включает большой спектр внутрипросветных и тканевых механизмов, взаимодействие которых обеспечивает целостность СОЖ и ее устойчивость к факторам агрессии. Протективные механизмы СОЖ находятся в тесном взаимодействии и регулируются нервными и гуморальными механизмами с участием нейропептидов и вазоактивных медиаторов [5].
Слизистый протективный барьер желудка имеет три линии защиты [3]. Первая линия включает слизь, желудочную и дуоденальную секрецию бикарбонатов, гидрофобную поверхность СОЖ и двенадцатиперстной кишки. Слизь представляет собой водонерастворимый гель, состоящий из гликопротеиновых полимеров, тесно прилегающих к поверхности эпителиальных клеток. В состав ее входят IgA, лизоцим, лактоферрин и другие компоненты. Слой слизи защищает СОЖ от физических и химических воздействий, от действия соляной кислоты и пепсина, бактерий, вирусов и их токсинов. Секреция бикарбонатов уменьшает агрессивные свойства соляной кислоты и повышает уровень рН защитного слоя слизи.
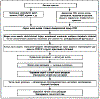
Третья линия защиты включает нормальный кровоток, который способствует удалению H +, обеспечивает энергией метаболические процессы, поддерживает первую и вторую линии защиты, а также репаративные процессы в СОЖ. Схема функционирования протективных и репаративных механизмов СОЖ представлена на рис. 1.
Рис. 1 Защитные и репаративные механизмы слизистой оболочки желудка
Для восстановления защитных свойств СОЖ используются цитопротекторы. Последние включают группы лекарственных средств с различными механизмами действия, которые стабилизируют защитные свойства слизи за счет снижения факторов агрессии и/или повышения факторов защиты; способствуют заживлению эрозий и язв; восстанавливают структуру и функцию эпителия желудочно-кишечного тракта.
Механизмы действия основных цитопротекторов представлены в табл. 2 [2, 6, 7].
Таблица 2. Механизмы действия цитопротекторов СОЖ
| Механизм действия | Препараты | |||
| сукральфат | мизопростол | пентокси- филлин | ||
| Повышение синтеза слизи и бикарбонатов | + | — | — | — |
| Повышение синтеза простагландинов | + | + | + | — |
| Антиоксидантный эффект | + | + | — | — |
| Снижение содержания провоспалительных цитокинов | + | + | — | + |
| Снижение активности пепсина | + | + | — | — |
| Связывание желчных кислот | ± | + | — | — |
| Связывание с белками в зоне воспаления и некроза | + | + | — | — |
| Улучшение микроциркуляции в слизистой оболочке | + | — | + | + |
| Повышение содержания эпидермального фактора роста | + | — | — | — |
| Ингибирование NO синтетазы и адгезии бактерий | + | — | — | — |
| Заболевания ЖКТ | Препарат выбора | |||
| сукральфат | мизопростол | пентокси- филлин | ||
| Язвенная болезнь, ассоциированная с НР | + | — | — | ± |
| Хронический гастрит, ассоциированный с НР | + | — | — | ± |
| Гастропатии, обусловленные приемом: | — | — | — | — |
| НПВП | + | — | + | — |
| алкоголя | + | + | — | + |
| цитостатиков | — | + | — | + |
| Стрессовые язвы | + | + | — | + |
| Рефлюкс-гастрит | — | + | — | — |
| Мукозиты, связанные с приемом цитостатиков | + | ± | — | ± |
| Инфекционная диарея | + | — | — | — |
Как следует из приведенных в табл. 3 данных, де-нол является универсальным цитопротектором, который может быть использован практически при всех этиопатогенетических вариантах воспалительно-деструктивных поражений слизистой оболочки пищеварительного тракта [2].
Общепринятые схемы терапии цитопротекторами:
2. сукральфат, 1,0 г 4 раза в день, 2-4 нед;
3. мизопростол, 200 мкг 4 раза в день, 4-8 нед;
4. пентоксифиллин, 400 мг 3 раза в день, 4 нед.
3. Powell D.W. Physiological concepts of epithelial barriers / D.W. Powell // Ed. А. Allen.
7. Tarnawski F. Cellular and molecular mechanisms of ulcer healing. Is quality of mucosal scar affected by treatment? / F. Tarnawski, К. Таnue, А.М. Santos et al // Scand. J. GastroenteroL 1995. Suppl. 210. Vol. 9.
Экспериментальная и клиническая гастроэнтерология. 2006, №2, с.1-4.
Перспективы применения цитопротекторов в пожилом возрасте на примере кальцинированного аортального стеноза и ишемической болезни сердца
Опубликовано в журнале:
«РАЦИОНАЛЬНАЯ ФАРМАКОТЕРАПИЯ В КАРДИОЛОГИИ»; № 11(4); 2015; стр. 435-441.
В статье рассматриваются актуальные вопросы патогенеза кальцинированного аортального стеноза и ишемической болезни сердца в пожилом возрасте. Отмечена актуальность раннего выявления стенокардии, обмороков и одышки с учетом их стертого и неспецифического течения для своевременного выявления порока сердца. Приведены современные научные взгляды на биоэнергетику сердечной мышцы и ее роль в генезе хронической сердечной недостаточности. Особое внимание уделено месту цитопротекторов, в частности триметазидина, в ведении больных с кардиальной патологией.
Ключевые слова: кальцинированный аортальный стеноз, ишемическая болезнь сердца, цитопротекторы, триметазидин, биоэнергетика сердца.
PROSPECTS FOR CYTOPROTECTORS USE IN THE ELDERLY PATIENTS WITH CALCINED AORTIC STENOSIS AND CORONARY HEART DISEASE.
Actual questions of pathogenesis of the calcined aortic stenosis and coronary heart disease in the elderly are considered in the article. The relevance of early detection of angina, syncope, and dyspnea in view of their non-specific and erased flow for early detection of heart disease is marked. Current scientific views on the myocardial bioenergy and its role in the genesis of chronic heart failure are presented. Particular attention is paid to the place cytoprotectors, especially trimetazidine, in the management of patients with cardiac disease.
Key words: calcified aortic stenosis, coronary heart disease, cytoprotectors, trimetazidine, heart bioenergy Ration Pharmacother Cardiol 2015;11 (4)
Введение
Болезни пожилых лиц являются актуальной проблемой современного здравоохранения. Это обусловлено рядом причин: неуклонным старением человеческой популяции, концентрацией классических факторов риска и острых сердечно-сосудистых событий [артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), нарушения мозгового кровообращения, хроническая сердечная недостаточность (ХСН), нарушения ритма сердца, сахарный диабет (СД) и др.], а также появлением множества коморбидных состояний (хроническая болезнь почек, анемии, онкологическая патология) [1].
Наряду с АГ и ИБС третье место по распространенности среди кардиальной патологии занимают болезни аортального клапана, в структуре которых более 90% отводится кальцинированному аортальному стенозу (КАС). В целом кальцинирующее поражение клапанов аорты встречается у 25% лиц в возрасте старше 65 лет [5].
В общей популяции распространенность КАС колеблется от 2% до 5%. В связи с демографическими тенденциями в мире ближайшие десятилетия ожидается существенный прирост числа пожилых лиц с КАС [6].
Кальцинированный аортальный стеноз и ишемическая болезнь сердца: коморбидность в пожилом возрасте
Ишемическая болезнь сердца и КАС могут сосуществовать вместе. Наличие тяжелого КАС влечет за собой увеличение риска возникновения инфаркта миокарда и внезапной смерти на 50% в сравнении с общей популяцией [5]. Однако по результатам работ J. Ortlepp и соавт. (2003) ни один из традиционных факторов риска ИБС, в том числе и гиперхолестеринемия, не наблюдался у пациентов с КАС чаще, чем у больных ИБС, несмотря на старший возраст последних [7]. Также не более чем у половины пациентов с КАС обнаруживаются признаки атеросклеротического поражения коронарных артерий, и лишь у незначительной части больных с ИБС отмечаются признаки аортального стеноза [8]. В тоже время КАС и ИБС обладают рядом общих клинических факторов риска, с различной степенью выраженности (курение, АГ, СД, дислипидемия, хроническая болезнь почек, дисфункция эндотелия). Сходство двух заболеваний прослеживается и на морфологическом уровне наличием оксиленных липопротеидов, кальцинирующих узелков и признаков воспаления в зоне поражения [9].
В последнее время в литературных источниках обсуждается механизм формирования ранних изменений в клапанах аорты в пожилом возрасте. Благодаря работам С. Otto легкое центральное фокальное утолщение створок клапана аорты получило название аортальный склероз (АСК) или стадия А по дефинициям Американской ассоциации сердца и Американского колледжа кардиологов (ACC/AHA) [1 2,13].
Синкопальные состояния (обмороки) при КАС нередко протекают под маской приступов необъяснимой «пепельной слабости» и головокружений, вследствие кардиогенных и ортостатических причин, грозным осложнением которых являются падения с последующими переломами опорных частей скелета. Причиной синкопальных состояний являются: обструкция выходного тракта левого желудочка (ЛЖ) сердца, нарушения ритма и проводимости, снижение вазомоторного тонуса, синдром гиперчувствительности каротидного синуса, гиперактивация механорецепторов сердца, возрастное снижение количества пейсмейкерных клеток [16,17].
Одышка нередко является первым и единственным клиническим симптомом аортального стеноза. При первичном обследовании ХСН III-IV функционального класса по NYHA отмечается у 86% пациентов с КАС. Причиной данного факта является диастолическая дисфункция, повышенная жесткость миокарда ЛЖ, неоднородная избыточная ГЛЖ, а также накопление коллагена в миокарде с изменением его поперечной исчерченности [19,20]. Описаны два варианта тахипноэ при КАС: а) пароксизмальная ночная одышка вследствие снижения симпатического и повышения парасимпатического тонуса вегетативной нервной системы, вызванных кальцинозом проводящей системы и снижением количества пейсмейкерных клеток с возрастом; б) приступы кардиальной астмы/альвеолярного отека легких, возникающих внезапно, чаще ночью без других проявлений ХСН из-за неуточненных нейрогуморальных механизмов [10].
В отношении потребления энергетического субстрата сердце считается «всеядным», т.е. способным окислять жирные кислоты (предпочтительный субстрат), углеводы, кетоновые тела, лактат и даже аминокислоты. Такая метаболическая пластичность позволяет сердцу адаптироваться к изменениям нагрузки, количества субстрата, уровню циркулирующих гормонов и коронарного кровотока, а также к состоянию общего метаболизма в организме путем выбора предпочтительного энергетического субстрата в каждом случае. В настоящее время эта сфера биохимии человека является наиболее изучаемой. Несмотря на противоречивые результаты работ, ряд положений считается доказанным 24:
Для дезадаптивной фазы ГЛЖ, сопровождающейся проявлениями ХСН, типично:
Таким образом, в настоящее время описаны различные механизмы нарушений энергетического обмена при ХСН на уровне утилизации субстрата, структуры и функции митохондрий, состояния цитоскелета, транспорта энергетических фосфатов, целостности мембранных фосфолипидов и т.д. Примечательно, что действия ряда известных кардиологических препаратов (ингибиторы АПФ, бета-адреноблокаторы), медицинских манипуляций (ресинхронизирующая терапия) рассматриваются в настоящее время через призму энергетического обмена. Благодаря вышеперечисленному, удается в той или иной мере лишь уменьшить потребление энергии сердцем [37].
В середине 1980-х годов было разработано вещество триметазидин (ТМД), принципиальной особенностью которого является прямое воздействие на ишемизированный миокард, что приводит к более рациональному использованию поступающего кислорода. Триметазидин является первым (и на сегодняшний день единственным) препаратом метаболического действия, сопоставимым по антиангинальному эффекту с блокаторами p-адренорецепторов, блокаторами кальциевых каналов и нитратами.
Механизм действия триметазидина связан с:
Указанные процессы помогают сохранить в кардиомиоцитах необходимый уровень АТФ, снизить внутриклеточный ацидоз и избыточное накопление ионов кальция. Таким образом, противоишемическое действие триметазидина осуществляется на уровне миокардиальной клетки за счет изменения метаболических процессов, что позволяет клетке повысить эффективность использования кислорода в условиях его сниженной доставки и, таким образом, сохранить функции кардиомиоцита [40].
В работах Косарева В.В. и соавт. обобщен опыт применения триметазидина у больных с различными формами ИБС и хронической сердечной недостаточностью [38,40,41]. Показано, что добавление триметазидина к стандартной схеме терапии ИБС снижает частоту приступов стенокардии, немой ишемии миокарда по данным суточного ЭКГ мониторирования, повышает толерантность к физической нарузке. При инфаркте миокарда применение триметазидина способствует уменьшению числа зон акинеза и гипокинеза по результатам эхокардиографии (ЭхоКГ), снижению пиковой концентрации креатинкиназы, уменьшению выраженности патологического ремоделирования миокарда ЛЖ и частоты реперфузионных аритмий, в том числе, и при проведении коронарных вмешательств. Наиболее выраженный положительный эффект триметазидина отмечается у больных с мультиморбидностью (сахарный диабет, хроническая болезнь почек 3 и выше стадии, АГ). Использование триметазидина у пациентов с выраженными симптомами ХСН (класс III-IV по NYHA) способствует снижению выраженности одышки, уменьшению среднего объема сердца, а также повышению фракции изгнания.
В 2008 г. Кузнецов В.И. соавт. изучали эффективность добавления триметазидина к стандартной антиангинальной терапии у больных с хроническими формами ИБС. Было показано, что комбинированная терапия в течение одного мес приводит к достоверному уменьшению числа желудочковых экстрасистол, наджелудочковой экстрасистолии, а также эпизодов пароксизмальной наджелудочковой тахикардии. При этом положительный эффект триметазидина наиболее отчетливо наблюдался у пациентов со смещениями сегмента ST по данным Холтеровского мониторирования ЭКГ, подтверждая способность препарата уменьшать выраженность нарушений ритма, индуцированных ишемией [42].
Позднее Зайцева В.И. с соавт. анализировали эффективность добавления триметазидина к стандартной терапии больных АГ с нарушениями ритма. Было показано, что аддитивная метаболическая терапия на протяжении 3 мес способствует не только более выраженному уменьшению количества наджелудочковых и желудочковых экстрасистол, но также усилению обратного ремоделирования миокарда ЛЖ [39].
В проспективном двойном слепом исследовании Xu X. и соавт. (2014) в течение 2 лет изучали эффективность добавления триметазидина в стандартную схему терапии больных сахарным диабетом пожилого возраста, перенесших чрескожное коронарное вмешательство с постановкой стентов с лекарственным покрытием вследствие трехсосудистого атеросклеротического поражения коронарных артерий. Выявлено достоверное уменьшение частоты возникновения приступов стенокардии, немой ишемии миокарда при сохранении исходной систолической функции миокарда ЛЖ [43].
В этой связи триметазидин может быть назначен на любом этапе лечения стенокардии в составе комбинированной антиангинальной терапии для усиления эффективности блокаторов p-адренорецепторов, антагонистов кальция и нитратов у следующих категорий больных:
В настоящее время активно изучается возможность профилактического назначения триметазидина при различных состояниях. В 2014 г группой исследователей под руководством Akgullu C. в лабораторных условиях была впервые показана профилактическая польза от назначения триметазидина при проведении внутривенного контрастирования. Для выявления признаков поражения почек (контраст-индуцированной нефропатии) использовались расчётные соотношения оксидантов/антиоксидантов, а также патоморфологические индексы. В результате в группе лабораторных животных, которым контраст вводился совместно с триметазидином, изменения регистрируемых параметров оказались сравнимы с группой контроля (без введения препаратов), в отличие от группы, в которой контраст вводился изолированно [44].
Протективные свойства триметазидина в отношении возникновения рестенозов коронарных артерий после проведения ангиопластики со стентированием изучались группой исследователей под руководством Chen J. в 2013 г Было показано, что назначение триметазидина, по крайней мере, в течение 1 мес после операции приводит к снижению частоты рестенозов (4,2% против 11,1% в группе контроля, не принимавшей триметазидин в послеоперационном периоде; р=0,001). Прием триметазидина сопровождался увлечением фракции выброса ЛЖ, (65,4±10,7 в группе триметазидина против 63,1±10,4, в группе контроля; р=0,006). Годовое наблюдение за пациентами выявило снижение частоты наступления неблагоприятных сердечно-сосудистых событий в группе триметазидина [45].
В 2003 г. группа онкологов под руководством Tallarico D. оценивала возможность миокардиальной цитопротекции у пациенток с раком молочной железы. В исследование были включены 61 пациентка, рандомизированные на 3 группы: стандартный режим полихимиотерапии (ПХТ) с включением препаратов антрациклинового ряда+триметазидин и дексразоксан, ПХТ+триметазидин, ПХТ+дексразоксан. Продолжительность наблюдения составила 1 год, оценивались параметры диастолической дисфункции (ранние предикторы сердечной недостаточности) по ЭхоКГ К концу периода наблюдения ЭхоКГ параметры остались сохранными лишь в группах 1 и 2 (с добавлением триметазидина) и ухудшились в группе 3 (где добавлялся только дексразоксан) [46].
На фармацевтическом рынке РФ триметазидин представлен отечественным воспроизведенным препаратом Депренорм® МВ (КАНОНФАРМА ПРОДАКШН ЗАО, Россия). Клиническая эквивалентность оригинальных и воспроизведенных препаратов (дженериков), включая Депренорм, была доказана в исследовании «Кардиоканон», проведенном группой исследователей под руководством Марцевича С.Ю. в 2012 г Использованные в исследовании «Кардиоканон» дженерики с доказанной биоэквивалентностью в целом продемонстрировали свою клиническую эквивалентность оригинальным препаратам. Их использование у пациентов с ИБС может обеспечить такую же эффективность и качество терапии, как и при назначении оригинальных препаратов [47].
В работе Шостак Н.А. и соавт. (2009) изучалась целесообразность добавления триметазидина к стандартной схеме лечения больных ИБС. На фоне лечения отмечено уменьшение количества приступов стенокардии, значительное снижение числа таблеток изосорбида динитрата, потребовавшихся для купирования приступов стенокардии, а также уменьшение функционального класса стенокардии. Для лечения использовался Депренорм® МВ в дозе 35 мг 2 р/сут [48].
В ходе XIII конгресса терапевтов СЗФО (2014) в докладе профессора Афанасьева В.В. были представлены ключевые положения обоснованности назначения цитопротекторов при различных заболеваниях, доказательная база ведущих исследований, а также новые преимущества лекарственной формы Депреном® МВ 70 мг для однократного приема. Согласно мнению Европейского общества кардиологов, для триметазидина продемонстрирована возможность комбинированного применения с гемодинамически активными средствами (поскольку главный эффект триметазидина не опосредован снижением ЧСС или АД), а также возможность назначения в качестве дополнительной терапии в случае непереносимости традиционных антиангинальных препаратов [49]. Подчеркнута безопасность назначения препарата, в ходе терапии не зафиксировано изменений со стороны сердечно-сосудистой системы, отсутствовало проаритмогенное действие, не установлены нарушения гематологических параметров. Наиболее значимыми побочными эффектами явились жжение в эпигастральной области и единичные случаи паркинсонизма в пожилом возрасте.
Новая лекарственная форма (Депренорм® МВ 70 мг) является инновационным препаратом, в основе которого находится матрица с медленно высвобождающейся субстанцией. Преимущества указанной формы проявляются в снижении интракоронарной агрегации тромбоцитов вследствие уменьшения текучести поверхностного слоя мембран тромбоцитов, а также в большей приверженности пациентов к лечению благодаря возможности приема по 1 таблетке (70 мг) 1 р/сут (утром).
Все вышеперечисленные клинические эффекты триметазидина позволяют говорить о востребованности препарата у больных КАС. До настоящего времени КАС остается заболеванием с неуточненной этиологией, с высокой распространенностью и неуклонно увеличивающейся потребностью в кардиохирургическом лечении из-за старения человеческой популяции. В генезе заболевания наиболее часто обсуждаются 2 механизма, связанных с:
Способность триметазидина ускорять обновление фосфолипидов мембран клеток, а также тормозить окисление свободных жирных кислот, повышает устойчивость мембран клеток к действию повреждающих факторов и угнетает каскад воспалительных реакций, что может препятствовать возникновению порока.
Ключевым патогенетическим звеном прогрессирования порока является нарастание выраженности гипертрофии миокарда ЛЖ и ее дезадаптивный характер. Способность триметазидина уменьшать выраженность патологического ремоделирования, выявленная ранее у больных с гипертонической болезнью, востребована в категории пациентов с КАС [39].
При появлении симптомов заболевания важное место триметазидина определяется наличием стенокардии. Ее атипичный характер у половины пациентов, высокая частота «немой ишемии» по данным Холтеровского мониторирования, а также сочетание с кардиалгиями различной природы вследствие мультиморбидности пожилых больных, не только ухудшает качество жизни, но и способствует сокращению ее продолжительности. Особое внимание занимают нарушения ритма, нередко являющиеся непосредственной причиной внезапной смерти при КАС. Возможность уменьшения выраженности эктопий, наряду с интиишемическим и метаболическим действием на миокард, позволяет применять триметазидин и по данному показанию.
В целом ключевыми проблемами в ведении пациентов с КАС являются: снижение темпа прогрессирования порока от его начальной стадии, аортального склероза (стабилизация клеточных мембран, угнетение воспалительного каскада и перекисного окисления липидов), уменьшение выраженности клинических симптомов заболевания (большинство кардиологических препаратов противопоказаны больным КАС), предотвращение острых сердечно-сосудистых событий (антитромбоцитарные средства), а также улучшение функционального статуса пациентов, у которых планируется протезирование клапана аорты (иногда в сочетании с коронарным шунтированием) с целью последующего повышения качества и продолжительности жизни больных [51].
Заключение
Обладая всеми вышеперечисленными достоинствами, триметазидин может занять свою нишу в перечне лекарственных препаратов, доступных для лечения пациентов с аортальным стенозом в пожилом возрасте.
Конфликт интересов.
Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.