Цитостатическими препаратами что это
Цитостатики: одно лечат, другое калечат
Но есть группа противоопухолевых средств, при лечении которыми разрушение печени неизбежно! Это цитостатические препараты, вызывающие апоптоз (уничтожение) дефектных клеток. Они используются для лечения опухолей и других тяжелых заболеваний. Но цитостатики, как в народе говорится, одно лечат, а другое калечат. Излечивая от рака, они губят печень. Так же как и антибиотики, цитостатики, проходя через печень, образуют токсичные продукты обмена, которые выходят вместе с желчью. Это является неоспоримым фактом того, что цитостатики оказывают вредное воздействие на печень.
Пациенты, находящиеся на лечении цитостатическими препаратами после удаления опухолей, обычно находятся под медицинским контролем. Проверка крови становится регулярной процедурой. Необходимо постоянно отслеживать не возобновляет ли опухоль рост. Кроме того, обязательно нужно периодически проверять печень на предмет токсического поражения. В случае выявления этого заболевания, необходимо обратиться к врачу и провести лечения соответствующими лекарствами. Чаще всего в таких ситуациях применяется урсосан. Он улучшает состав желчи, нейтрализует и связывает токсические кислоты. Применение препарата приводит к стабилизации мембраны клеток. Различные исследования подтверждают эти свойства. Поэтому урсосан является стандартом лечения гепатита не только в России, но и во всем мире.
Запомните! Если вам необходимо принимать лекарственные препараты, которые могут оказать повреждающее действие на печень, обязательно проконсультируйтесь с врачом гастроэнтерологом/гепатологом.
Источник: Автор: Сергей Вялов, гастроэнтеролог, гепатолог, кандидат медицинских наук.
Цитостатическими препаратами что это
Препарат был разработан Леонидом Федоровичем Ларионовым – руководителем лаборатории экспериментальной терапии рака, созданной в 1945 году при поддержке директора Института Николая Николаевича Петрова, и профессором Ленинградского технологического института Вульфом Григорьевичем Немецем.
Под руководством Л.Ф. Ларионова и В.Г.Немеца был синтезирован целый ряд производных азотистых ипритов (хлорэтиламинов), в числе которых был и метил-бис-(?-хлорэтил)-амин, названный авторами эмбихин. Доступных сведений ни о методике лечения хлорэтиламинами в клинике, ни о дозах и способах их введения в то время не было. Доклиническое изучение противоопухолевых и токсических свойств эмбихина проводила сотрудница лаборатории экспериментальной терапии рака врач Лидия Леонидовна Малюгина, которая в 1947 году по категорическому требованию самого пациента, специальному разрешению правительственных и партийных инстанций и по просьбе Николая Николаевича Петрова впервые ввела больному лимфопролиферативным заболеванием противоопухолевый препарат эмбихин.
В монографии Л.Ф. Ларионова «Лечение белокровия и лимфогранулематоза эмбихином», вышедшей в 1951 году, описан этот случай:
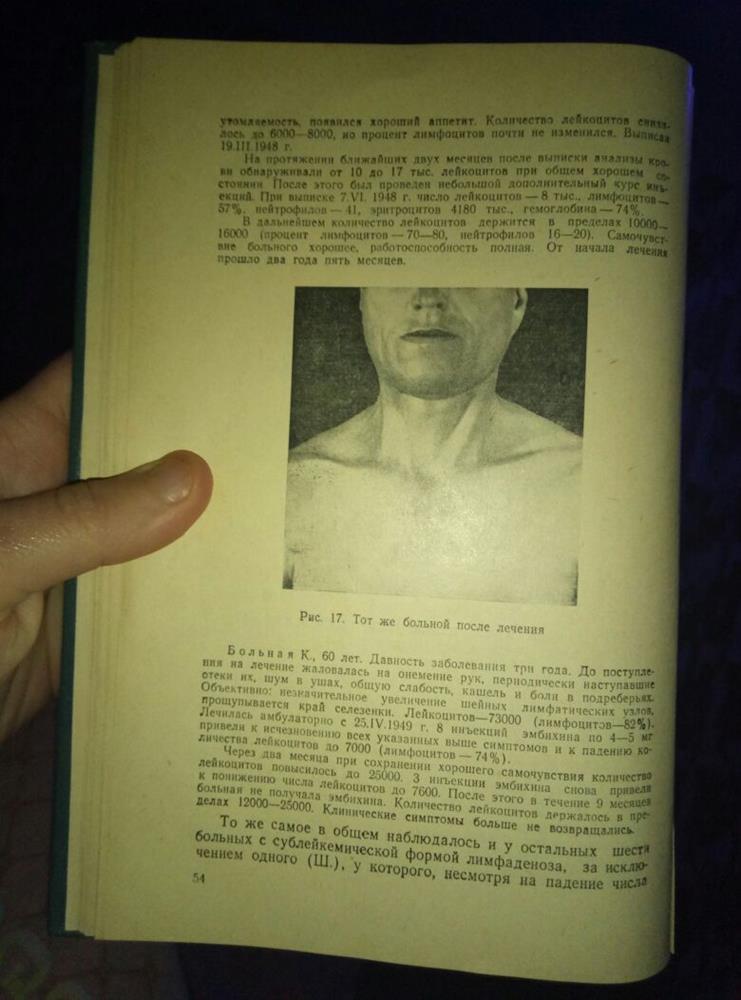
Клиническое наблюдение: «Больной С., 49 лет, поступил в НИИ онкологии 08.12.1947 года с жалобами на слабость, быструю утомляемость, значительную потливость и похудание. Периферические лимфатические узлы во всех областях (шейные, подчелюстные, подбородочные, подмышечные, паховые) увеличены, некоторые до 4 см в диаметре. Лейкоцитоз – 35 тыс. при 78% лимфоцитов. Гистологическое исследование удаленного узла подтвердило диагноз лимфаденоза. Больному было сделано 30 введений эмбихина по 3 раза в неделю в дозе 4-5 мг. Все лимфатические узлы значительно уменьшились, некоторые почти перестали прощупываться. Полностью прекратились клинические симптомы. Выписан 19.03.1948г. Затем через 2 месяца последовал очередной цикл химиотерапии. При выписке 07.06.1948 г. клинический анализ нормализовался. В дальнейшем число лейкоцитов держится в пределах 10.000-16.000 тыс. (процент лимфоцитов 70-80, нейтрофилов 16-20). От начала лечения прошло два года и пять месяцев».

Монохимиотерапия эмбихином больных «белокровием», лимфогранулематозом и некоторыми опухолями была продолжена в НИИ онкологии АМН СССР. В 1950 году Л.Ф. Ларионову и В.Г. Немецу «За разработку нового метода лечения лимфогранулематоза и белокровия препаратом «Эмбихин» и внедрение его в практику здравоохранения» была присуждена Сталинская премия.
В 1951 году Л.Ф.Ларионов был переведен на работу в Москву в недавно созданный институт экспериментальной и клинической онкологии АМН СССР, где он также организовал лабораторию экспериментальной химиотерапии опухолей, которой руководил до последних дней. Талант экспериментатора, сила научного предвидения, аналитический ум и широкая эрудиция, а также слаженная работа единомышленников (В.Г. Немеца, И.Я. Постовского, З.В. Пушкарева, И.Л. Кнунянц, О.Ф. Гинзбург, Л.Б. Радиной) позволили академику АМН СССР, профессору Л.Ф. Ларионову заложить более полувека назад фундамент всей современной лекарственной терапии злокачественных опухолей.
Основные принципы, сформулированные в трудах Л.Ф. Ларионова:

На протяжении последующих десятилетий в рамках отечественных и международных исследований в НИИ Петрова было изучено более 150 различных противоопухолевых препаратов и средств сопроводительной терапии, вошедших в практику современной онкологии и гематологии. Сегодня, базируясь на результатах фундаментальных и клинико-экспериментальных исследований, успешно изучаются и внедряются все новые подходы в системном лечении злокачественных опухолей, включающие таргетную терапию и иммунотерапию. Как результат, с помощью системной терапии онкологи научились полностью излечивать одни опухоли и переводить некогда инкурабельные заболевания в хронические.
Т.Ю.Семиглазова, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации,
врач высшей категории, доктор медицинских наук.
Глюкокортикоидная терапия сегодня: эффективность и безопасность
В каких случаях проводится терапия глюкокортикоидами? Какие виды гормональной терапии используются? История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была изве
В каких случаях проводится терапия глюкокортикоидами?
Какие виды гормональной терапии используются?
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов ХХ столетия. Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году всем троим была присуждена Нобелевская премия за «. открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов».
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией — кортизон и гидрокортизон (кортизол), так и их синтезированные аналоги — преднизон, преднизолон, метилпреднизолон и др., включая галогенированные (фторированные) производные — триамцинолон, дексаметазон, бетаметазон и др. Широкий спектр физиологических и фармакологических эффектов глюкокортикоидов (адаптогенный, противовоспалительный, обезболивающий и жаропонижающий, неспецифический мембраностабилизирующий и противоотечный, противоаллергический и иммуносупрессивный, гематологический, гемодинамический и противошоковый, антитоксический, противорвотный и др.) делает эти препараты чуть ли не универсальными лекарственными средствами, и сегодня трудно найти такое патологическое состояние, при котором на том или ином этапе развития они не были бы показаны. Среди показаний в первую очередь можно выделить так называемые ревматические заболевания, болезни почек, крови, аллергические заболевания, трансплантации, ургентные состояния.
В зависимости от цели различаются три варианта терапии ГКС; при этом любая из них может быть как ургентной, так и плановой.
В отличие от плановой терапии применение ГКС в ургентных ситуациях носит, как правило, симптоматический, реже патогенетический характер и не заменяет, а дополняет другие методы лечения. В рамках неотложной терапии ГКС применяются при острой надпочечниковой недостаточности, тиреотоксическом кризе, аллергических заболеваниях (сывороточная болезнь, анафилактический шок, бронхиальная астма, крапивница, отек Квинке), заболеваниях печени (печеночно-клеточная недостаточность), неврологических заболеваниях (туберкулезный и бактериальный менингит, некоторые формы отека мозга), различных видах шока (кроме кардиогенного).
Из-за обилия побочных эффектов терапия ГКС направлена в основном на достижение максимального эффекта при назначении минимальных доз, величина которых определяется заболеванием и не зависит от массы тела и возраста; доза корректируется в соответствии с индивидуальной реакцией. Приняты две принципиально разные схемы назначения ГКС:
В зависимости от суточной дозы (в пересчете на преднизолон) и длительности применения ГКС принято выделять несколько видов терапии, имеющих различные показания:
Результат терапии ГКС зависит не только от дозы, но и от режима дозирования. Наиболее перспективными можно считать прерывистые схемы применения, когда за счет увеличения суточной дозы препарат принимается не каждый день. Самой эффективной представляется внутривенная пульс-терапия максимальными дозами, однако она оказывается и самой небезопасной. Значительно более безопасным должен быть признан режим «мини-пульс», который, однако, уступает по эффективности пульс-терапии. Столь же эффективно назначение умеренной/высокой дозы, разделенной на несколько приемов; но по безопасности этот режим уступает «мини-пульсу». Далее по эффективности следуют альтернирующий режим (через день удвоенные суточные дозы с последующим постепенным уменьшением) и режим ежедневного однократного назначения умеренной/высокой дозы; первый из них безопаснее и по этому критерию приближается к «мини-пульсу». Наиболее безопасна терапия низкими дозами, которая, однако, обеспечивает лишь поддерживающий эффект. При всех ежедневных схемах ГКС следует назначать в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 — днем (около полудня). При любом режиме дозирования по достижении планируемого эффекта доза постепенно снижается до поддерживающей или препарат отменяется вовсе.
Важной проблемой терапии ГКС является выбор препарата. Фармакокинетические и фармакодинамические свойства ГКС, включая их побочные эффекты, существенно различаются у отдельных препаратов (табл. 1, табл. 2). Приняв за единицу выраженность различных эффектов гидрокортизона, можно получить количественные характеристики активности отдельных препаратов. При сравнении ГКС чаще всего анализируется противовоспалительное действие этих препаратов, в соответствии с которым и рассчитывается эквивалентная пероральная доза, снижающаяся по мере увеличения противовоспалительной активности. Ее возрастание, параллельное увеличению длительности действия отдельных ГКС, сопровождается уменьшением минералокортикоидной активности, которой у метилпреднизолона (солу-медрола) и фторированных соединений вообще можно пренебречь.
Соотношение терапевтического и побочных эффектов позволяет утверждать, что в настоящее время препаратом выбора для длительной и пожизненной терапии является метилпреднизолон (солу-медрол). В настоящий момент солу-медрол широко используется в лечении аутоиммунных заболеваний, в трансплантологии и интенсивной терапии. Многообразие форм выпуска позволяет использовать препарат во всех возрастных категориях в оптимальных дозировках.
Вторым по эффективности препаратом остается в большинстве случаев преднизолон. Во многих же ургентных ситуациях определенными достоинствами обладают фторированные соединения: дексаметазон (дексазон, дексона) и бетаметазон (целестон, дипроспан). Однако в случае неотложной терапии, при которой противовоспалительное действие не играет ведущей роли, сравнительная оценка эффективности и безопасности различных препаратов весьма затруднительна по крайней мере по двум причинам:
В связи с вышеуказанными трудностями была предложена условная эквивалентная единица (УЭЕ), за которую принимаются минимальные эффективные дозы. Показано, что выраженные в УЭЕ максимальные суточные эффективные дозы фторированных ГКС (дексаметазона и бетаметазона) в пять раз меньше, чем у негалогенированных препаратов. Это обеспечивает не только более высокую эффективность и безопасность данной группы препаратов, назначаемых в определенных ситуациях, но и их фармакоэкономические преимущества.
Как бы тщательно ни проводился выбор препарата, режима дозирования и вида терапии, полностью предотвратить развитие тех или иных побочных эффектов при применении ГКС не удается. Характер побочных реакций может зависеть от ряда причин (табл. 3).
Вероятность и выраженность подавления оси ГГКН с развитием вначале функциональной недостаточности, а позже и атрофии коры надпочечников определяются дозой и длительностью терапии. Прекращение глюкокортикоидной терапии почти всегда сопряжено с угрозой развития острой надпочечниковой недостаточности.
Частым побочным действием ГКС оказываются инфекционные осложнения, которые в этом случае протекают атипично, что связано с противовоспалительной, аналгетической и жаропонижающей активностью этих средств. Это затрудняет своевременную диагностику и требует проведения ряда профилактических мероприятий. Из-за склонности к генерализации, затяжному течению, тканевому распаду и резистентности к специфической терапии эти осложнения становятся особенно грозными. Столь же коварны и «стероидные язвы», отличающиеся бессимптомным течением и склонностью к кровотечениям и перфорациям. Между тем желудочный дискомфорт, тошнота, другие диспепсические жалобы на фоне приема ГКС чаще не связаны с поражением слизистой. Экзогенный синдром Кушинга как осложнение терапии ГКС встречается далеко не всегда, однако отдельные нарушения метаболизма, гормональной регуляции и деятельности тех или иных систем развиваются почти во всех случаях глюкокортикоидной терапии.
С сожалением приходится отметить, что утверждение Е. М. Тареева, назвавшего терапию ГКС трудной, сложной и опасной, до сих пор справедливо. Как писал Тареев, такую терапию гораздо легче начать, чем прекратить. Однако ответственный подход к лечению позволяет значительно повысить его безопасность. Это достигается благодаря строгому учету противопоказаний (абсолютных среди которых нет) и побочных эффектов ГКС (оценка отношения «ожидаемый эффект/предполагаемый риск»), а также проведению «терапии прикрытия» в группах риска (антибактериальные препараты при хронических очагах инфекции, коррекция доз сахароснижающих средств или переход на инсулин при сахарном диабете и др.). Особое место при длительном применении ГКС занимает метаболическая терапия, которая проводится в целях предупреждения и коррекции нарушений электролитного обмена и катаболических процессов в первую очередь в миокарде (дистрофия) и костной ткани (остеопороз). Однако наиболее надежным путем обеспечения безопасности терапии ГКС остается соблюдение основного принципа клинической фармакологии и фармакотерапии — назначение лечения по строгим показаниям.
В. В. Городецкий, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Медицинские интернет-конференции
Языки
ДЛИТЕЛЬНОЕ ТЕЧЕНИЕ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ У БОЛЬНОЙ С АНТИФОСФОЛИПИДНЫМ СИНДРОМОМ
Андриянова А.В., Фатуллаева Г.А., Александрова О.Л.
Резюме
Системная красная волчанка (СКВ) – это системное аутоиммунное заболевание, приводящее к поражению различных органов и тканей, которое может протекать с развитием антифосфолипидного синдрома (АФС). Представляем клиническое наблюдение больной М.,1965 года рождения с длительным, относительно благоприятным течением заболевания без поражения почек, гематологической патологии с наличием АФС.
Ключевые слова
Статья
Длительное течение системной красной волчанки у больной с антифосфолипидным синдромом
Научный руководитель: к.м.н., ассистент Александрова О.Л.
ФГБОУ ВО Саратовский ГМУ им. В. И. Разумовского Минздрава РФ
Кафедра госпитальной терапии
Системная красная волчанка (СКВ) – это системное аутоиммунное заболевание, для которого характерны потеря толерантности к ядерным антигенам, нарушение активации Т- и В-лимфоцитов с дальнейшей поликлональной активацией В-лимфоцитов, вырабатывающих антитела, образованием иммунных комплексов, приводящих к повреждению различных органов и тканей.
Несмотря на успехи и достижения в лечении этого заболевания, ведение многих больных СКВ остается достаточно сложной задачей, в их число входят пациенты с наличием АФС. АФС является приобретенной аутоиммунной тромбофилией и характеризуется рецидивирующими тромбозами, акушерской патологией, наличием в крови пациентов патогенных аутоантител, известных как антифосфолипидные антитела.
Представляем клиническое наблюдение больной М.,1965 года рождения с развитием антифосфолипидного синдрома в рамках СКВ.
Пациентка М. больна с весны 1999 г. (с 34-летнего возраста), когда после инсоляции стали отмечаться повышение температуры до субферильных цифр, боли, периодическая припухлость в суставах кисти, фотосенсибилизация (появление кожного зуда, гиперемии на открытых участках туловища).
При лабораторном исследовании были найдены LE-клетки, в общем анализе крови обнаружено повышение СОЭ до 22 мм/час, анемия легкой степени; в общем анализе мочи патологии выявлено не было. При инструментальных исследованиях (ЭКГ, ЭХОКГ) – патологические изменения отсутствовали.
В анамнезе было 4 беременности в возрасте 18-27 лет, из которых 2 закончились нормальными родами, 2 других – медицинскими абортами. Больной был выставлен диагноз СКВ, назначен преднизолон 20 мг в день. Эффект от лечения был положительным.
В общем анализе крови отмечалось незначительное повышение лейкоцитов крови (10,2 × 10 9 /л) при нормальном содержании палочко-ядерных клеток (5%), умеренное повышение СОЭ (28 мм/час). При исследовании биохимического анализа крови, общего анализа мочи патологии выявлено не было. С-реактивный белок, волчаночный антикоагулянт были отрицательны. Антитела к двуспиральной ДНК были умеренно повышены (110 ЕД/мл при норме 0-25 ЕД/мл).
Больной был назначен гепарин 12,5 ЕД×2 раза в день п/к под контролем активированного частичного тромбопластинового времени, антиагреганты (кардиомагнил 75 мг/день). Доза преднизолона была увеличена до 20 мг/день, назначены омепразол 20 мг /день, препараты кальция с витамином Д3 2 таблетки /день, эналаприл 10 мг/день. На фоне лечения состояние улучшилось: исчезла одышка при физической нагрузке, снизилось СДЛА до 26 мм рт.ст. по данным ЭХОКГ, нормализовались острофазовые показатели.
Через месяц рекомендовано постепенное снижение преднизолона до 10 мг/день, продолжение приема омепразола, препаратов кальция с витамином Д3, прием гидроксихлорохина 200 мг/день. Рекомендованный гидроксихлорохин не принимала по техническим причинам. В течение последующих 2,5 лет активность СКВ была преимущественно минимальной. Периодически пациентку беспокоили боли в суставах, субфебрилитет, общая слабость; при лабораторном исследовании отмечалось повышение СОЭ до 16-24 мм/час. Рецидивов тромбозов у больной не наблюдалось; волчаночный антикоагулянт, антитела к ДНК не исследовались.
Повышение АД до 180 и 110 мм рт. ст. по-прежнему рассматривались в рамках медикаментозного синдрома Иценко-Кушинга. С учетом рецидивирующего тромбоза вен левой голени, тромбоэмболии легочной артерии, положительного волчаночного антикоагулянта в динамике был выставлен антифосфолипидный синдром в рамках СКВ. В связи с прогрессированием СКВ доза преднизолона внутрь была увеличена до 25 мг/день, к лечению был добавлен метотрексат 7,5 мг/неделю, моноприл 10 мг/день, рекомендован прием варфарина 1,5 табл. в день с дальнейшим титрованием дозы под контролем МНО (целевой уровень МНО 2,0-3,0 МЕ).
В течение последующих 17 лет течение заболевания было относительно благоприятным. На фоне поддерживающих доз преднизолона 7,5 – 5,0 мг/день, метотрексата 7,5-5,0 мг/неделю, варфарина 2,5-5,0, мг/день активность СКВ была преимущественно минимальной. Изредка обнаруживался положительный волчаночный антикоагулянт, повышение уровня антител к ДНК в невысоких титрах. Тромбозы не рецидивировали. Периодически усиливались явления церебрального васкулита, стихающие после кратковременного повышения дозы преднизолона до 20 мг/день, приема препаратов, улучшающих функцию нервной системы.
На протяжении последних 5 лет на первый план в клинической картине вышли побочные эффекты иммуносупрессивной терапии. Побочными явлениями цитостатической терапии были частые обострения пиелонефрита, что привело к дополнительному назначению уросептиков, антибиотиков. Наиболее значимыми побочными эффектами глюкокортикоидной терапии у пациентки были вторичная артериальная гипертензия в рамках медикаментозного синдрома Иценко –Кушинга, нуждающаяся в частой коррекции, остеопороз с развитием компрессионных переломов позвоночника, потребовавший назначения антиостеопоретических средств (бисфосфонатов).
Особенностью течения заболевания в данном клиническом наблюдении явилось относительно благоприятное течение СКВ.
Спустя 6 месяцев с момента появления первых признаков СКВ у больной был диагностирован тромбоз вен левой голени с дальнейшим развитием тромбоэмболии легочной артерии. Диагноз АФС был поставлен через 2 года после появления его первых признаков на основании рецидива венозного тромбоза вен левой голени, обнаружения положительного волчаночного антикоагулянта при динамическом исследовании.
В описываемом нами случае течение АФС было также относительно благоприятным. Венозные тромбозы отмечались на протяжении первых 2 лет заболевания. После назначения варфарина в течение последующих 17 лет тромбозы не рецидивировали, периодически в крови обнаруживался положительный волчаночный антикоагулянт.
1. Применение варфарина в дозах, обеспечивающих целевое значение МНО, является профилактикой повторного тромбообразования.
2.Использование адекватных доз глюкокортикоидов и цитостатиков способствует стойкому улучшению состояния.
3.Для устранения побочных эффектов глюкокортикоидной терапии необходим постоянный контроль артериального давления и его коррекция, своевременное назначение препаратов кальция с витамином Д3, бисфосфонатов.
Литература
1.Российские клинические рекомендации. Ревматология/Под ред. Е.Л. Насонова. М.: ГЭОТАР – Медиа, 2017: 464 с.
2. Клюквина Н.Г., Насонов Е.Л.Особенности клинических и лабораторных проявлений системной красной волчанки. Современная ревматология, 2012;4: 40-48.