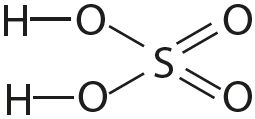
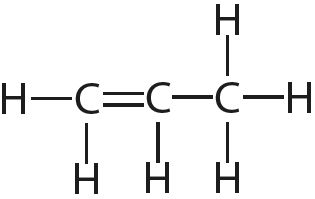
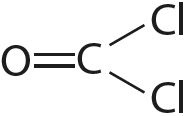
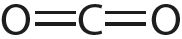Чем больше кратность связи тем ее длина
§ 14. Свойства химических связей
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 14. Свойства химических связей |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 5 Декабрь 2021, 13:41 |
Оглавление
Свойства веществ определяются не только их элементным составом, но и особенностями химических связей между атомами.
Свойства ковалентной связи
Ковалентная связь характеризуется длиной, энергией, кратностью, насыщаемостью, направленностью и полярностью.
Длина ковалентной связи — это расстояние между ядрами химически связанных атомов ( рис. 27 ). Длина ковалентной связи обычно немного отличается от суммы атомных радиусов из-за перераспределения электронной плотности и перекрывания электронных облаков ( рис. 27–29 ). Чем больше радиусы связанных атомов, тем больше длина связи ( табл. 12 ).
Таблица 12. Характеристика ковалентных связей в молекулах водорода и галогеноводородов
| Элемент | Радиус атома, нм | Молекула | Длина связи, нм | Eсвязи, кДж/моль | Δχ | Модель молекулы |
| Н | 0,037 | H2 | 0,074 | 436 | 0 |  |
| F | 0,071 | HF | 0,092 | 565 | 1,8 | 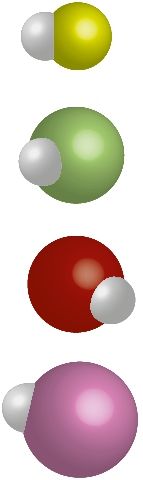 |
| Cl | 0,099 | HCl | 0,128 | 431 | 0,8 | |
| Br | 0,114 | HBr | 0,141 | 364 | 0,6 | |
| I | 0,133 | HI | 0,161 | 297 | 298 |
Энергия химической связи (Eсвязи) — это энергия, которую необходимо затратить на её разрыв. Как правило, чем прочнее связь, тем меньше её длина ( табл. 12 ).
Кратностью ковалентной связи называют число электронных пар, которые участвуют в образовании химической связи между двумя атомами.
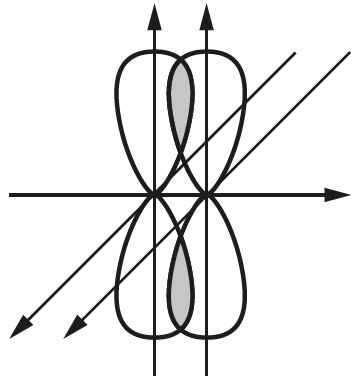
Различают одинарные ( ), двойные ( ) и тройные ( ) связи. При перекрывании орбиталей вдоль линии, соединяющей ядра атомов, образуются только σ-связи ( рис. 28 ).
Направленность ковалентных связей определяется ориентацией в пространстве атомных орбиталей, участвующих в образовании связи. Она обусловливает пространственную структуру молекул ( рис. 31 ).
Угол, образованный направлениями химических связей, исходящими из одного атома, называют валентным углом.
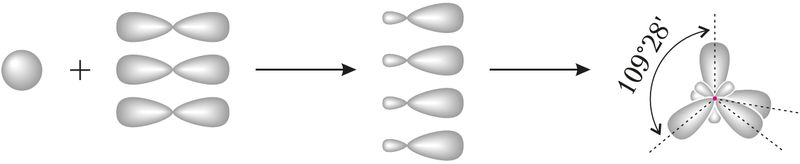
Например, вам известно, что в молекуле CH4 связи расположены под углом приблизительно 109°, в молекуле — 120°, в молекуле — 180°.
В молекулах Н2О и Н2S атомы кислорода и серы образуют две σ-связи с атомами водорода. В образовании этих связей участвуют p-орбитали внешнего энергетического уровня, которые ориентированы взаимно перпендикулярно. Это значит, что валентные углы между линиями связи О—Н или S—H должны быть близки к 90°. Однако реальные значения этих углов немного больше из-за взаимного отталкивания атомов водорода ( рис. 32 ). Так, в молекуле воды, находящейся в парах, этот угол равен 104,5°, а в молекуле Н2S — 92° (отталкивание слабее из-за большего радиуса атома серы).
Для прогнозирования и объяснения величины валентных углов во многих молекулах часто используют представления о гибридизации атомных орбиталей. Начальные представления о гибридизации вы получили в курсе органической химии в 10-м классе. С учётом гибридизации можно объяснить строение молекул СН4, NH3, H2O. При гибридизации атомных орбиталей атома, образующего связи с соседними атомами, происходит усреднение по форме и энергии электронной плотности близких по энергии орбиталей. Например, при усреднении энергии одной s-орбитали и трёх р-орбиталей данного атома углерода образуются четыре одинаковые гибридные орбитали, которые располагаются по направлению к вершинам тетраэдра:
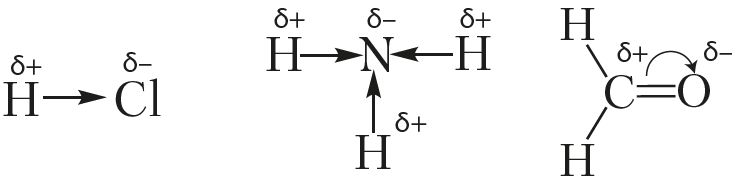
Смещение электронной плотности указывают в структурных формулах стрелками, направленными в сторону более электроотрицательного атома. Смещение электронной плотности при образовании σ-связи указывают прямой стрелкой, а π-связи — дугой:
Молекулу, электронное строение которой описывается как система из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определённом расстоянии друг от друга, называют диполем.
Молекулы, представляющие собой диполи, называют полярными. Полярными являются молекулы галогеноводородов, сероводорода, воды. Так, в молекуле воды электронная плотность от атомов водорода смещена к более электроотрицательному атому кислорода. Молекулы воды — это диполи ( рис. 33 ).
Свойства ионной и металлической связей
В отличие от ковалентной связи ионная связь ненаправленная и ненасыщаемая, поскольку ион может притягивать к себе ионы противоположного знака в любом направлении. Расположение и число соседних ионов определяется их размерами, силами притяжения и отталкивания между ионами разных знаков. Поэтому ионы располагаются в определённом порядке, образуя кристаллическую решётку.
Ковалентная связь характеризуется длиной, энергией, кратностью, направленностью и полярностью:
Ионная и металлическая связи ненаправленные и ненасыщаемые.
Вопросы, задания, задачи
1. Опишите, как образуется:
2. Заполните таблицу, поставив в ячейки под каждой химической связью подходящее значение энергии (167; 945; 418 кДж/моль ) и длины связи (0,145; 0,110; 0, 125 нм ). Объясните свой выбор.
| Связь |
| Энергия, кДж/моль |
| Длина, нм |
3. Укажите число одинарных и кратных связей в каждой молекуле:
4. Отметьте полярные и неполярные ковалентные связи:
5. Объясните, почему и как меняется длина связи между атомами в ряду:
7. Объясните уменьшение термической устойчивости соединений в ряду: Н2О, Н2S, Н2Se.
8. Объясните, почему молекулы водорода и фтора вступают во взаимодействие мгновенно, а для взаимодействия молекул водорода и азота нужны высокие температура и давление.
9. Нарисуйте схему перекрывания атомных 1s— и 3p-орбиталей в молекуле H2X, если относительная плотность этого газообразного соединения по водороду равна 17.
1. Направленностью и насыщаемостью характеризуется связь:
2. Две связывающие и две несвязывающие электронные пары содержат молекулы:
3. σ-Связи соответствует перекрывание орбиталей:
4. Длина связи в первой молекуле больше, чем во второй, в паре веществ:
Характеристики ковалентной связи
1. Длина ковалентной связи
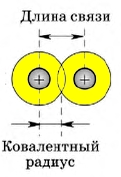
В симметричных молекулах (H2, F2, Cl2. ) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Энергии связи некоторых молекул (кДж/моль):
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз «крепче» молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
|---|---|---|---|
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
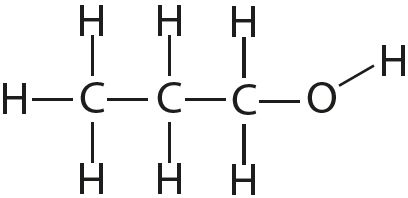
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.