Чем больше разность электроотрицательностей между двумя атомами тем полярность связи
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
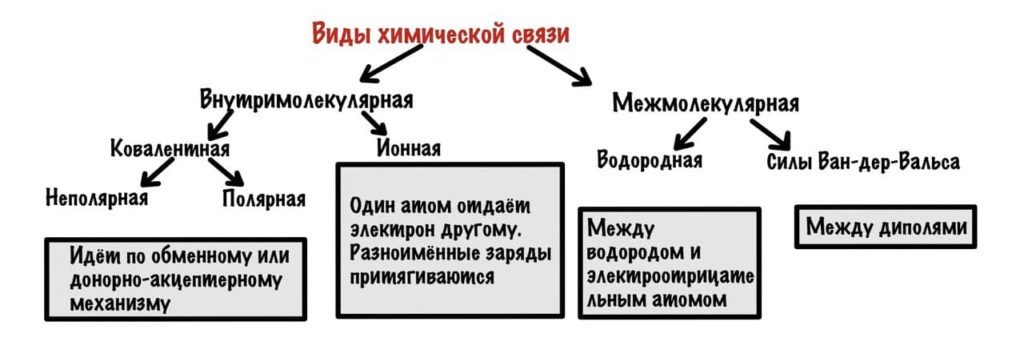
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Типы химической связи. Электроотрицательность и степень окисления, полярность связей
Часть 1. Типы химической связи. Электроотрицательность и степень окисления, полярность связей.
Ковалентная связь – связь между двумя атомами, которые соединяются друг с другом за счет образования ОБЩЕЙ электронной пары.
Существует два возможных механизма образования общей электронной пары:
· обменный механизм, когда каждый из взаимодействующих атомов предоставляет в пару по одному электрону,
· донорно-акцепторный механизм, если один из атомов предоставляет электронную ПАРУ, а другой – пустую (вакантную) орбиталь.
‼ По донорно-акцепторному механизму образованы связи в следующих веществах:
1. Все комплексные соединения;
3. Азотная кислота, оксид азота (V), нитраты
Электроотрицательность (ЭО) – способность атома притягивать электроны при образовании химической связи. Таким образом, электрон сместится к атому того элемента, который имеет большую электроотрицательность.
Возможно три случая для двух атомов А и В, образующих связь: А — В
1) ЭО (А) = ЭО(В) (разность электроотрицательностей равна нулю).
Общая электронная пара не смещена ни к одному из атомов. Не возникает ПОЛЮСОВ, электронная плотность у обоих атомов одинакова.
Это НЕПОЛЯРНАЯ ковалентная связь.
‼Примеры неполярной ковалентной связи: а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т. п.
При образовании ковалентной связи электронная пара смещена к более электроотрицательному атому А, на нём возникает частичный отрицательный заряд, а на В – частичный положительный.
Такая связь называется ковалентной ПОЛЯРНОЙ.
‼ Такой тип связи характерен для молекул (или частей молекул), состоящих из двух и более неметаллов (HCl, H2O, СН3СООН).
Чем больше разность ЭО, тем выше полярность связи (при этом электронная пара принадлежит обоим атомам). Например, в ряду НСl à HBr à HI полярность связи уменьшается.
Такая связь называется ИОННОЙ.
Ионная связь – предельный случай ковалентной полярной связи.
‼Такой тип связи характерен для соединений металлов с неметаллами, оксидов металлов, оснований и солей, в том числе солей органических и солей аммония.
В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака.
Ионная связь характеризуется ненаправленностью и ненасыщенностью. Вещества с ионной связью имеют ионную кристаллическую решетку.
‼Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3).
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в пространстве между катионами металлов и удерживают их вместе.
Водородная связь – это связь не внутри молекулы, а между молекулами или между независимыми частями молекул.
Водородная связь – возникает между сильно электроотрицательными атомами (обычно водорода или фтора, реже азота) и атомом водорода другой молекулы или части молекулы:
(сплошной чертой обозначена ковалентная связь, точками – водородная связь).
Наличие водородных связей приводят к аномальному повышению температур кипения у веществ, в которых она присутствует.
Температуры кипения водородных соединений неметаллов VIА группы
tкип, oС −2 −42 −60 +100
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений, например, для салициловой кислоты.
Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца.
Уксусная, муравьиная и другие карбоновые кислоты и в жидком, и в газообразном состоянии существуют в виде димеров:
Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты.
Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
‼ Вещества, между молекулами которых есть водородные связи:
2. Фтороводород, раствор фтороводорода (плавиковая кислота).
3. Растворы аммиака NH3 и аминов – между азотом аммиака (амина) и атомами водорода воды.
4. Органические вещества, имеющие гидроксильную группу: спирты, фенолы, карбоновые кислоты.
5. Растворы углеводов – моносахаридов и дисахаридов.
ВАЛЕНТНОСТЬ – число связей, образованных данным атомом в данной молекуле.
Например, в молекуле SO3 у серы 6 связей, т. е. сера в этой молекуле имеет валентность VI.
Валентные возможности атомов – весь набор возможных валентностей.
Они определяются числом неспаренных электронов и возможных донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру группы. Это правило не выполняется:
А) у элементов второго периода, начиная с азота (у них отсутствуют d-орбитали и нет возможности для распаривания электронов)
Б) у элементов 8 группы (в главной подгруппе для гелия, неона и в побочной подгруппе для элементов триад)
В) у элементов 1 группы побочной подгруппы (у них высшая валентность больше номера группы).
Пример: у серы на третьем внешнем слое есть 6 электронов.
В невозбуждённом (основном) состоянии она имеет валентность II:
При переходе одного электрона на d – оболочку она становится четырёхвалентной:
Электроотрицательность. Виды химических связей
Начнем с того, почему вообще важна электроотрицательность. Все химические связи образуются за счет нее. В зависимости от того, какие атомы вступают в образование химической связи, она делится на определенные виды. Поэтому для того, чтобы понять суть этого деления, нам нужно разобраться:
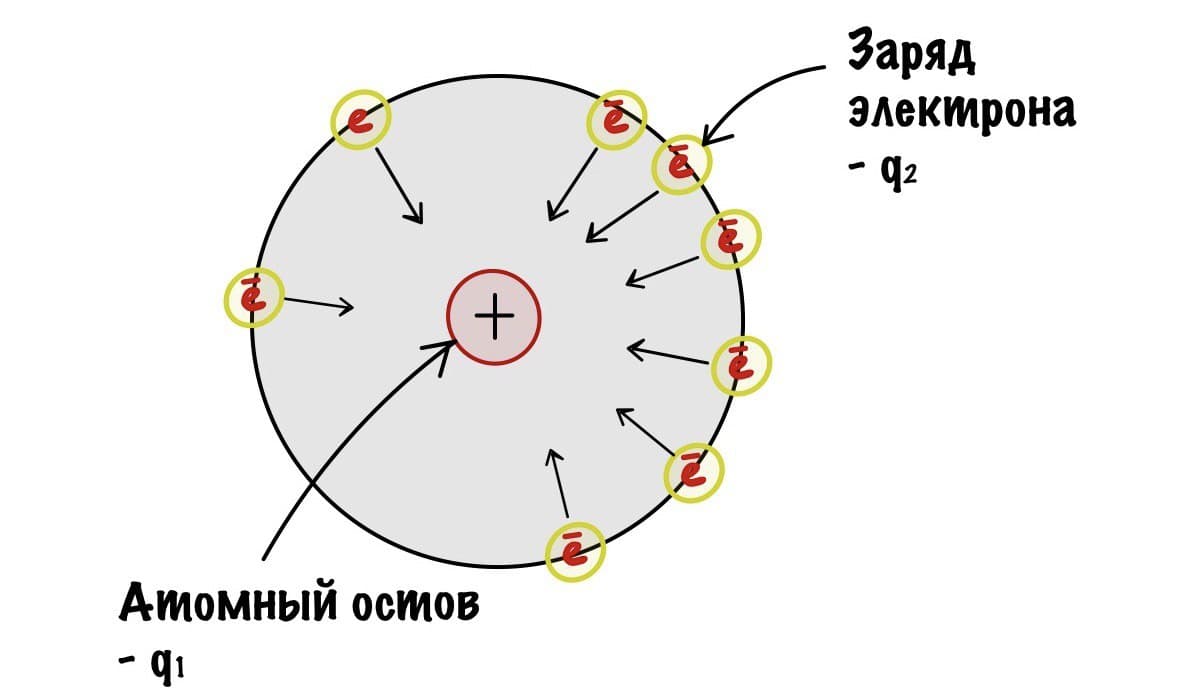
Для того чтобы понять это, нам понадобится понятие атомного остова из прошлой статьи.
Электроотрицательность
Электроотрицательность — это способность атома оттягивать на себя электроны с внешнего электронного слоя.
Да-да, ЕГЭ вы сдали хорошо — электроотрицательность увеличивается слева направо и сверху вниз, но почему? Выделим две причины, но для второй нам потребуется немного физики. Ну все, ты закрываешь статью и говоришь: «Какая физика?»
Так, начнем с закона Кулона — он показывает силу взаимодействия между двумя электрическими зарядами. Наши заряды разноименные. Атомный остов — положительный, а электрон — отрицательный. Значит они притягиваются друг к другу.
Сразу скажу, что ничего считать мы не будем. Коэффициент — k нас не интересует. Нам просто нужно понять, что чем больше q1 и q2, тем больше сила притяжения между зарядами. Радиус, как я писал до этого, примерно одинаковый в одном периоде. Теперь мы можем сравнить электроотрицательность атомов второго периода с помощью небольшого рисунка. Для этого мы предположим, что электроны находятся примерно на одном расстоянии атомного остова.
Получается, что q1 — это заряд атомного остова, а q2 — заряд электрона, который всегда одинаковый. Вот мы и нашли легкую зависимость — чем больше заряд атомного остова, тем с большей силой он притягивает электрон, и тем больше электроотрицательность. У кислорода заряд ядерного остова 6, а у азота только 5. Самый большой заряд у фтора — 7. С увеличением периода возрастает радиус атома — электроотрицательность становится меньше. Получается, что максимальная электроотрицательность у элементов второго периода и растет она слева направо, так как увеличивается заряд атомного остова.. Хоть мы это и знали, но прикольно же понять почему такое происходит?
Виды химических связей
Напишу про все, кроме металлической связи, она не особо интересует нас в биохимии. Химическая связь нужна для того, чтобы придать дополнительную стабильность системе. Что за система? Ну это просто атомы, которые вступают в образование связей — при образовании связи энергия системы уменьшается, и она становится стабильнее, а значит стабильнее и состояние атома.
Можно разделить химические связи на две группы: внутримолекулярные и межмолекулярные. Начнем с внутримолекулярных.
Внутримолекулярные химические связи
Всего два варианта: ионная и ковалентная. Правда последняя делится на две, но разберемся с этим в процессе.
Ковалентная химическая связь
Она возникает, если атомы образуют общие электронные пары. Может идти по двум механизмам: обменному и донорно-акцептерному.
Обменный механизм
У атомов на внешнем слое есть неспаренные электроны. Они решают поделиться ими с другими атомами и образовать связь.
Донорно-акцепторный механизм
У одного атома есть неподеленная электронная пара — два электрона на одной орбитали, а у другого есть пустая орбиталь. Если первый атом очень щедрый, то он может отдать свой электрон другому атому и образовать связь. Так образуются ионы аммония и гидроксония — аммиак и вода присоединяют протон водорода (у него нет электрона).
Ну это все понятно, но для чего нужна была электроотрицательность? А вот для чего — ковалентная связь бывает неполярной и полярной.
Ковалентная неполярная химическая связь
Здесь в образовании связи участвуют два атома с одинаковой электроотрицательностью, например — два водорода, два кислорода и так далее.
Нам подойдет один из прошлых рисунков с образованием водорода. Так как электроотрицательность у атомов одинаковая, то общая электронная пара не смещается к какому-либо атому, а лежит посерединке.
Ковалентная полярная химическая связь
После образования связи атом кислорода начинает тянуть электронную пару на себя. Она проводит больше времени с его стороны, так как у электронов отрицательный заряд, то и заряд на кислороде становится частично отрицательным — δ-заряд. Можно нарисовать это попроще.
Мы можем сделать вывод, что чем больше разность электроотрицательности у атомов, тем больше полярность связи. Если возьмем какой-нибудь оксид азота, то кислород будет меньше оттягивать на себя электроны, так как электроотрицательность у них не слишком различается. А это значит, что и дельта заряд на кислороде и азоте будет меньше.
Но если мы возьмем молекулу воды, то разница в электроотрицательности кислорода и водорода большая. Значит дельта заряды и полярность связи будут побольше
Полярность молекулы
Раз уж мы здесь, то давайте сразу определимся от чего зависит полярность молекулы. Это важно для понимания того, какие молекулы свободно пройдут через биологическую мембрану, а какие нет. Полярность молекулы зависит от полярности связей между атомами и геометрии молекулы. Если все связи в молекуле неполярные, то и молекула неполярная, например O2. Такие молекулы легко проходят через мембрану.
Посложнее с полярными связями. Здесь все зависит от геометрии молекулы. Геометрия молекулы может быть симметричной — у нее нет неподеленных электронных пар и неспаренных электронов, например CO2. Значит CO2 тоже легко пройдет через мембрану.
Но если у молекулы есть неподеленные электронные пары или неспаренные электроны, то она асимметрична. Значит она полярна, например H2O и NH3.
Такие молекулы будут хуже проходить через мембрану. Вода транспортируется через специальные белки — поры (аквапорины). Кстати, возможно аквапорины еще нужны потому, что вода в растворе переходит в ион гидроксония. Ион гидроксония — это полярная и заряженная молекула, которая практически не будет проходить через мембрану.
Ионная связь
Она образуется в случае, когда разница в электроотрицательности между двумя атомами просто огромная! Мы знаем, что атомы стараются полностью заполнить свои энергетические слои. Как это можно сделать? Можно отдать лишний электрон или присоединить электрон к себе. Когда два таких атома встречаются, то один из них отдает электроны, а другой принимает — отдает обычно щелочной/щелочно-земельный металл или водород. В итоге один атом становится заряжен отрицательно — анион, а другой положительно — катион. Они удерживаются друг с другом благодаря силам электростатического взаимодействия — разноименные заряды притягиваются. Да, да, я опять пишу эту банальщину.
Или вот ионная связь между молекулами аминокислот.
Сведем все в табличку.
Межмолекулярные химические связи
Здесь взаимодействуют не атомы, а молекулы. Капитан очевидность. В таких связях очень маленькое количество энергии, но их настолько много, что они придают стабильность большим системам — белок, ДНК. Два варианта — водородные связи и и силы Ван-дер-Ваальса.
Водородная связь
Водородная связь — это связь атома водорода одной молекулы с атомом другой молекулы. Звучит просто, но она может образоваться не всегда. Есть условия, о которых мы сейчас поговорим:
С помощью водородных связей образуются вторичная структура белка и вторичная структура ДНК.
Основной вклад в образование таких связей вносит электростатическое взаимодействие. Еще пишут про донорно-акцепторный механизм, но если бы он тут был, то образовывались ионы гидроксония, мы уже разобрали это выше.
Силы Ван-дер-Ваальса
Там три варианта, но я остановлюсь только на двух — ориентационных и индукционных взаимодействиях. Сначала ориентационные, с ними полегче. Проще будет просто показать это.
Такие молекулы называют диполями — у них есть положительно и отрицательно заряженные части. Молекулы ориентируются друг на друга: положительные части располагаются рядом с отрицательными и между ними образуются слабые связи. Ну вы поняли, что такая тема может идти только в соединениях с ковалентной полярной связью.
Теперь индукционные. Смотрите, есть одна молекула — HCl, у нее есть дельта-положительно заряженный водород. Вдруг такая молекула подходит к молекуле, где связь неполярная, например водороду. Что было дальше? А вот что, дельта-положительный водород начинает оттягивать на себя электронную пару из молекулы. Тут то и образуется диполь.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.