Чем выше физическая подготовленность тем уровень порога анаэробного обмена пано
Порог анаэробного обмена (ПАНО)
Содержание
Определение ПАНО у спортсменов [ править | править код ]
Источник:
Учебное пособие для ВУЗов «Спортивная физиология».
Автор: И.И. Земцова Изд.: Олимпийская лит-ра, 2010 год.
Понятие о пороге анаэробного обмена (ПАНО) было широко распространено в начале 1960-х годов. Сейчас также используется термин лактатный порог. В соответствии с начальными представлениями под ПАНО подразумевали интенсивность нагрузки, выше которой развивается метаболический ацидоз. Началом метаболического ацидоза стали считать резкое изменение динамики (излом графика) ряда показателей в случае повышения мощности работы (ЛВ, ДК, неметаболический избыток углекислоты и др.), которые коррелировали с показателем содержания лактата в крови (Биологический контроль спортсменов. 1996; Дубровский, 2005; Лактатный порог. 1997; Применение пульсометрии. 1996; Солодков, Сологуб, 2005; Шац, 1995).
Физиологическая характеристика аэробно-анаэробного перехода во время физической нагрузки [ править | править код ]
Фазы аэробно-анаэробного перехода
Анаэробный порог (ПАНО)
Основные энергетические субстраты, преимущественно затрачиваемые во время работы
Жирные кислоты, гликоген
Гликоген, жирные кислоты
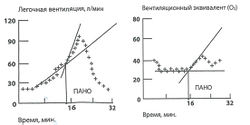
Существуют также термины — вентиляционный и лактатный пороги. Они отображают методы оценки ПАНО. В первом случае речь идет о его оценке по началу нелинейного прироста ЛВ и повышение вентиляционного эквивалента для O2 (ВЭ0), который отражает этот нелинейный прирост (отношение МОД к потреблению кислорода).
Термин лактатный порог используют, чтобы подчеркнуть способ определения ПАНО по критериям начала интенсивного прироста концентрации лактата в крови. Разные методы дают немного отличающиеся результаты.
Различают: 1) методы, требующие забора крови для определения в ней лактата и pH; 2) неинвазивные методы, базирующиеся на показателях внешнего дыхания, газообмена, ЧСС и др.
2. Неинвазивные методы определения ПАНО:
Для определения ПАНО1 предлагается использовать как дополнительные критерии три такие условия: начало устойчивого повышения РаO2 (напряжение 02 в артериальной крови), отсутствие при этом снижения РаCO2(напряжение СО, в артериальной крови) и достижение величины ДК (отношение выделившегося СO2 к потребленному 02) 0,90—0,95.
Вследствие этого нарастают явления метаболического ацидоза.
В основу дополнительных критериев определения ПАН02 можно положить начальные признаки реакции дыхательной компенсации метаболического ацидоза. Ведущим признаком этого является начало повышения вентиляционного эквивалента для С2 (отношение ЛВ к выделившемуся С2);
Оснащение: газоанализатор, тредбан (беговая дорожка).
После выполнения разминки у испытуемых разного уровня спортивной квалификации определяют ПАНО при помощи газоанализатора (например, «Охусоп Alpha») путем измерения неметаболического избытка С2 (ЕхсС2) во время нагрузок возрастающей мощности. Для расчета используют формулу;
Путем графического построения в системе координат «логарифм значения ЕхсС2—мощность» определяют начало избыточного выделения С2. Величину ПАНО выражают в абсолютных единицах мощности выполняемой работы, либо в значениях потребления кислорода, либо в относительных величинах (например, в % VO2max). Соответствующую уровню ПАНО мощность называют пороговой мощностью.
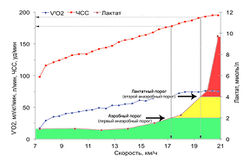
У нетренированных здоровых людей ПАНО колеблется в пределах 48— 65 % VO2max, а у спортсменов — 75—85 % VO2max, то есть ПАНО наблюдается во время работы большей мощности.
Оценка ПАНО по пороговому VO2, ммоль л- 1
Значения ПАНО, полученные у разных испытуемых, сравнивают между собой и с нормативными показателями и делают выводы об уровне их специальной работоспособности.
Определение порога анаэробного обмена [ править | править код ]
Обычно ПАНО определяют по началу резкого, крутого изменения (излома) целого ряда физиологических кривых на графике зависимости этих показателей от мощности выполненной нагрузки. К числу таких показателей относят содержание лактата, pH, содержание буферных оснований в крови, легочную вентиляцию, дыхательный коэффициент, «неметаболический излишек СO2» и др., которые коррелируют с содержанием лактата и буферных оснований в крови.
Из неинвазивных методик самым популярным методом определения ПАНО является резкое увеличение вентиляции или вентиляционного эквивалента по кислороду (рис. 1) на графике зависимости этих показателей от времени выполнения теста.
Определение ПАНО по уровню лактата [ править | править код ]
В покое у здорового человека концентрация лактата составляет 1-2 ммоль/л. Концентрация лактата на уровне 2-4 ммоль/л соответствует аэробноанаэробной транзитной зоне. При выполнении ступенчато-возрастающего теста превышение уровня 4 ммоль/л, как правило, свидетельствует о достижении ПАНО. Резкое увеличение концентрации лактата обычно коррелирует с неинвазивными методиками определения ПАНО по резкому увеличению вентиляции и вентиляционного эквивалента по кислороду.
Определение направленности тренировочного процесса по показателю ПАНО [ править | править код ]
Основная часть тренировочной программы спортсмена, тренирующегося на выносливость, должна выполняться на уровне пульса ПАНО, который определяется при спироэргометрии (концентрация лактата 2-4 ммоль/л), то есть не выше анаэробного порога. Во время восстановительных тренировок рекомендуемая ЧСС должна составлять 60-80% от пульса ПАНО, при этом уровень лактата не должен превышать 2 ммоль/л.
По результатам тестирования формулируется заключение, даются рекомендации по коррекции тренировочной нагрузки (аэробной или анаэробной направленности), а при необходимости назначаются восстановительные процедуры и необходимая фармакологическая поддержка.
Порог анаэробного обмена (ПАНО): что такое, как определить и как использовать

ПАНО (порог анаэробного обмена, лактатный порог) – нагрузка, при которой молочная кислота вырабатывается быстрее, чем успевает утилизироваться.
Лактат (или молочная кислота) имеет плохую репутацию, которая тянется еще 1970-х годов. Однако, она полезна для организма. Молочная кислота является источником энергии, а не только ограничителем работы мышц. Организм вырабатывает лактат при расщеплении глюкозы, во время нагрузки она снова перерабатывается в энергию, а побочные продукты утилизируются. Поэтому при балансе выработки и утилизации лактата организм может долго выдерживать нагрузку.
Когда выработка молочной кислоты превышает скорость утилизации, быстро наступает утомление. Организм переключается с преимущественно аэробного режима на анаэробный. Эту планку называют порогом анаэробного обмена или лактатным порогом. Конечно, химические процессы значительно сложнее, мы выразили только общую суть.
Другими словами ПАНО – то, что мы привыкли называть выносливостью. Самый быстрый темп, который возможен без превышения уровня лактата в крови. И чем выше лактатный порог, тем интенсивнее и дольше может работать организм.
Уровень ПАНО выражается в процентах от МПК или от максимальной ЧСС. При разном уровне физической подготовки ПАНО значительно отличается: у начинающих он находится на уровне 65-75% от максимальной ЧСС, у подготовленного спортсмена лактатный порог составляет около 85-95% от максимального пульса. Периодически замеряя лактатный порог, можно следить за эффективностью тренировок. Если порог растет – спортсмен прогрессирует, если снижается – нужно корректировать тренировочный план.
Как узнать свой лактатный порог

Эти тесты проводятся в лаборатории и стоят денег, поэтому доступны не всем. Мы рассмотрим более доступные для любителей тесты, которые можно провести самостоятельно и бесплатно:
Тест Конкони
Простой метод определить ПАНО, который можно проводить самостоятельно и бесплатно. Разработан итальянским врачом и физиологом Франческо Конкони. Тест не гарантирует точных лабораторных результатов, но позволяет узнать темп и пульс на уровне ПАНО. По нагрузке тестирование аналогично тяжелой тренировке, потому не стоит выполнять его на фоне усталости.
Тест можно выполнять на беговой дорожке или легкоатлетическом стадионе. Для теста понадобится пульсометр с функцией отсечек кругов. Если такой функции нет, подойдет самый простой пульсометр, а записывать данные попросите друга. Суть теста: бегать отрезки по 200 метров без остановки, увеличивая скорость каждого следующего отрезка.
Всего таких отрезков может быть 10-16.
Перед тестом проведите разминку как перед соревнованиями. Бегите первые 200 м с постоянной скоростью легким бегом. В конце отрезка фиксируйте время и пульс. Каждые следующие 200 м увеличивайте темп примерно на 2-3 сек. После каждого отрезка фиксируйте пульс и время отсечками (круги) в часах или попросите друга. Продолжайте бежать отрезки, увеличивать скорость и фиксировать данные пока не достигнете максимальной скорости.
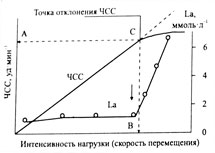
На основе этих данных строится график зависимости ЧСС от времени. Он выглядит почти как прямая линия с отклонением в конце графика (подробности на видео). Точка отклонения – и есть уровень ПАНО. Скорость и ЧСС в этой точке соответствуют порогу анаэробного обмена. Тест Конкони можно проводить раз в месяц, чтобы следить за ростом результатов.
Метод Джо Фрила
Известный американский тренер по триатлону Джо Фрил, автор книг «Библия триатлета» и «Библия велосипедиста» описывает простой способ определения величины ПАНО. Тест дает нагрузку, сопоставимую с соревнованиями, поэтому не выполняйте его на фоне усталости.
Разомнитесь как перед соревнованиями. После разминки пробегите по ровной поверхности 30 минут в соревновательном темпе. Можно бежать на беговой дорожке, тогда выставляйте уклон +1%, чтобы имитировать реальные условия. Бежать необходимо с соревновательной скоростью и держать ее на одном уровне до конца теста. Через 10 минут после старта начните фиксировать ЧСС. Среднее значение пульса за последние 20 минут гонки будет вашим уровнем ПАНО.
Беговой калькулятор
Калькулятор с сайта «mcmillanrunning» Самый простой, но менее точный метод. В верхнее поле калькулятора нужно ввести целевую дистанцию и результат, которого хотели бы достичь. Во второй строке введите дистанцию и результат последнего бегового старта. Затем введите свою почту и нажмите «calculate my paces».
Появится таблица с расчетами темпа на разные дистанции в текущей форме и такие же расчеты для целевого результата. Покатель vLT покажет темп ПАНО, показатель vVO2 – темп МПК. Таблица по умолчанию считает в милях, в правом верхнем углу есть переключатель на километры.
Как повысить лактатный порог
Высокий анаэробный порог позволяет дольше поддерживать соревновательную скорость. Поэтому, чтобы показывать хорошие результаты и прогрессировать в беге на длинные дистанции, стремитесь повысить свой ПАНО.
У начинающих ПАНО поднимается даже на обычных тренировках низкой и средней интенсивности, главное – регулярность занятий.
Опытным атлетам для поднятия анаэробного порога нужно проводить специальные тренировки – темповые и интервальные тренировки на уровне ПАНО или на 5% ниже. Проводите тренировки на лактатном пороге не более 1-2 раз в неделю, чтобы избежать перетренированности. Общий объем тренировок на уровне ПАНО должен составлять 10-15% от общего недельного объема.
Примеры тренировок, повышающих ПАНО. Все тренировки выполняются без остановки!
Особенности энергообмена у юных спортсменов
Н.В. РЫЛОВА, А.А. БИКТИМИРОВА
Поволжская государственная академия физической культуры, спорта и туризма, г. Казань
Казанский государственный медицинский университет
Казанская государственная медицинская академия
Рылова Наталья Викторовна
доктор медицинских наук, руководитель группы спортивной морфологии и диетологии учебно-научной лаборатории технологий подготовки спортивного резерва, доцент кафедры госпитальной педиатрии с курсами поликлинической педиатрии и постдипломного образования
420138, г. Казань, ул. Оренбургский Тракт, д. 101, тел. 8-917-397-33-93, e-mail: rilovanv@mail.ru
Проведен анализ отечественной и зарубежной литературы по изучению процессов энергообеспечения. В статье рассматриваются такие понятия, как энергодефицитный диатез, вторичные нарушения энергообмена и митохондриальные болезни. Представлены некоторые особенности физиологии юных спортсменов. Обозначена роль особенностей адаптации к физическим нагрузкам, что включает в себя изучение активности митохондриальных ферментов, порога анаэробного обмена, максимального потребления кислорода.
Ключевые слова: митохондриальная патология, юные спортсмены, максимальное потребление кислорода, анаэробный порог.
N.V. RYLOVA, A.A. BIKTIMIROVA
Povolzhskaya State Academy of Physical culture, sport and tourism, Kazan
Kazan State Medical University
Kazan State Medical Academy
Features of energy exchange in young sportsmen
The analysis of domestic and foreign literature was performed for the study of power supply processes. This article examines such concepts as energy deficient diathesis, secondary disturbances of energy exchange and mitochondrial diseases. Some features of physiology of young sportsmen are presented. The role of features of adaptation to physical activities in young athletes is specified. This includes studying of activity of mitochondrial enzymes, an anaerobic threshold and the maximal consumption of oxygen.
Key words: mitochondrial pathology, young sportsmen, maximal oxygen consumption, anaerobic threshold.
С развитием метаболического направления в медицине появилась возможность углубленного изучения процессов энергообеспечения. Особенно активно формируются представления о роли нарушений клеточной энергетики в течение самых разнообразных процессов [1, 2]. Энергообмен в клетках осуществляется за счет митохондрий — органелл энергообеспечения, в которых происходят основные метаболические процессы клетки [3]. Количество митохондрий в клетке составляет от 50 до 1000 и более. От остальных клеточных органелл митохондрии отличает наличие собственной ДНК, что определяет их способность к авторепродукции. Митохондриальная ДНК кодирует 13 из 83 полипептидов, представленных в дыхательной цепи [4]. В специализированных клетках митохондрии сосредоточены в тех участках, где имеется наибольшая потребность в энергии: например, в мышечных клетках большие количества митохондрий сосредоточены вдоль рабочих элементов — сократительных фибрилл.
В клетке митохондрии выполняют множество функций: цикл трикарбоновых кислот, карнитиновый цикл, окислительное фосфорилирование и транспорт электронов в дыхательной цепи. Установлено, что некоторые компоненты дыхательной цепи (коэнзим Q, цитохромоксидаза) наряду с переносом электронов по цепи осуществляют также перенос протонов из матрикса митохондрий в межмембранное пространство, в результате чего образуется протоновый градиент. В процессе обратного тока протонов из межмембранного пространства внутрь митохондриального матрикса происходит утилизация освобождаемой в дыхательной цепи энергии путем фосфорилирования АДФ в АТФ и другие макроэргические фосфаты, создается запас энергии биологического окисления. В митохондриях помимо транспорта электронов, окислительного фосфорилирования с вовлечением окислительно-восстановительных реакций происходит также процесс b-окисления жирных кислот. Свободные жирные кислоты трансформируются в ацетил-СоА и затем образуют эфиры с карнитином [5].
В условиях дефицита кислорода в клетках происходит накопление промежуточных продуктов обмена свободных жирных кислот: ацилкарнитина, ацил-КоА и др. Также угнетается действие фермента пируватдегидрогеназы, соответственно устраняется возможность утилизации пирувата, в результате чего он практически полностью превращается в лактат. Лактат накапливается в цитозоле клетки вместе с Н+, что приводит к снижению внутриклеточного рН и нарушению функции клетки. По мере нарастания степени ишемии клетки увеличивается и тяжесть ацидоза. Первоначально этот процесс приводит к функциональным нарушениям, а впоследствии и к гибели клеток тканей в результате повреждения мембраны [6]. Нарушение b-окисления жирных кислот в условиях дефицита кислорода сопряжено со снижением уровня карнитина. Происходит внутриклеточное накопление ацилкарнитинов, жирных кислот, ацил-КоА. Повышенное содержание ацил-КоА подавляет транспорт адениннуклеотидов в митохондриях, уменьшает активность ацил-КоА-синтетазы [7]. Многими исследователями установлено значение карнитина для процессов биологического окисления и поддержания митохондриальных функций в организме человека [4].
Митохондрии играют роль в таких процессах как: старение и гибель клетки, физиологическая адаптация организма к упражнениям на выносливость, развитие ряда патологических состояний. В митохондриях происходит также регуляция внутриклеточного распределения кальция, образование стероидов, регуляция процесса апоптоза [4]. В митохондриях интегрированы пути метаболизма белков, жиров и углеводов и осуществляются основные энергетические процессы: изменения работы митохондрий способны вызвать сложную цепь патологических процессов не только на уровне клетки, но и всего организма в целом [8]. Нет сомнений в том, что нарушения биоэнергетических систем клетки играют первостепенную роль в реализации повреждающих эффектов различных факторов. Митохондриальная дисфункция приводит к недостаточности энергообеспечения клеток, нарушению многих других важных обменных процессов, дальнейшему развитию клеточного повреждения, вплоть до гибели клетки [1]. Именно поэтому от состояния митохондрий зависит энергетическое состояние организма в целом.
В последние годы традиционные представления о митохондриях, как о статичных клетках, стало сменяться теорией ремоделирования. При определенных условиях меняется абсолютное количество этих органелл в клетке и они способны образовывать конгломераты или претерпевать процесс деления, сохраняя общую наружную мембрану [4]. Оценка тканевой адаптации к функциональной недостаточности органов и систем основана на выявлении увеличения абсолютного числа митохондрий в клетках соответствующих тканей с помощью цитохимических, гистохимических и электронно-микроскопических методов [1].
Большинство заболеваний, в основе которых лежит митохондриальная недостаточность, представляют собой наследственную патологию. К ним относятся наследственная атрофия зрительных нервов Лебера, синдром NARP (нейропатия, атаксия, пигментный ретинит), синдром MERRF (миоклонус эпилепсия с «рваными» красными волокнами в скелетных мышцах), синдром MELAS (митохондриальная энцефаломиопатия, лактат-ацидоз, инсультоподобные эпизоды) и многие другие [1]. Однако благодаря интенсивному изучению нарушений клеточной энергетики можно говорить о том, что распространенность состояний, связанных с митохондриальной недостаточностью, не ограничивается наследственными синдромами, вызываемыми мутациями митохондриальной ДНК [9, 10]. В патогенезе полисистемной митохондриальной недостаточности много неясного, что проявляется значительным полиморфизмом клинических проявлений. Клинический полиморфизм сам по себе может служить диагностическим критерием, так как он очень характерен для феномена митохондриальной недостаточности. Для большинства митохондриальных болезней характерно сочетание признаков поражения центральной (энцефалопатии) и периферической (полиневропатии, нарушения со стороны органов чувств) нервной систем, а также скелетной (миопатии) и сердечной (кардиопатии, нарушения проводимости) мышечной тканей. Именно подобное сочетание является одним из первых и очень значимым указанием на возможность ведущей роли митохондриальной недостаточности в патогенезе синдрома или нозологической формы [1, 9].
Митохондриальное заболевание может дебютировать с любого симптома в любом возрасте [10]. Класс состояний, характеризующихся митохондриальной недостаточностью, отнюдь не ограничивается «первичными» нарушениями генов митохондриальных белков. В некоторых случаях этот механизм будет являться вторичным звеном патогенеза, например, как для синдрома хронической усталости [1, 2]. Причинами «вторичного» угнетения митохондриальной активности могут являться в том числе и токсические агенты (продукты перекисного окисления липидов и др.) [1]. Без сомнения, чрезмерная активация перекисного окисления липидов является универсальным механизмом повреждения клеточных мембран, в том числе и при интенсивной физической нагрузке — спортивном стрессе [11].
На сегодняшний день широко используется понятие «энергодефицитный диатез». «Энергодефицитный диатез» — это скрытая форма относительной индивидуальной недостаточности цитоэнергетического статуса организма. Считается, что это состояние имеет влияние на течение различных болезней и требует специфической «энерготропной» терапии. Для пациентов с энергодефицитным диатезом характерно своеобразие индивидуального течения многих болезней, и в этих случаях обычное лечение оказывается недостаточно эффективным [1, 2, 12]. В широком смысле диатезы определяют как аномалии конституции, характеризующиеся предрасположенностью к некоторым болезням и определенному типу неадекватных реакций на обычные раздражители. Учение о диатезах продолжает формироваться. По мере развития медицинской науки конкретизировались представления о механизмах предрасположенности, что привело к выделению заболеваний, относящихся к ферментопатиям, мембранопатиям, иммунодефицитным состояниям, эмбриопатиям, фетопатиям вместо отдельных видов диатезов [13].
Помимо вклада в теоретическую патологию и медицинскую систематику одним из главных достижений медицинской «митохондриологии» и метаболического направления в целом явилось выделение клинических и параклинических критериев митохондриальной недостаточности, а также изучение биохимических, морфологических и молекулярно-генетических особенностей данного вида патологии. Это позволяет оценивать полисистемность нарушения клеточного энергообмена [1]. Нельзя забывать, что митохондриальные болезни могут дебютировать в любом возрасте. Параклинические методы, генетическое исследование позволяют поставить диагноз на ранних сроках, а также диагностировать митохондриальную патологию даже при бессимптомном ее течении [10, 14].
Таким образом, все нарушения энергообмена можно подразделить на три категории:
Метаболическое направление и митохондриальная патология достаточно хорошо изучены в педиатрическом аспекте. Митохондриальные нарушения могут проявляться практически во всех системах организма, они представляют интерес для медицинских специалистов самых различных областей. Однако приоритетной задачей на сегодняшний день является развитие профилактического направления.
В настоящее время в связи с возрождением детского и юношеского спорта в России, ранней спортивной специализацией, широким использованием интенсивных тренировочных нагрузок, а вместе с тем и накоплением знаний о влиянии генетических особенностей и внешних факторов на состояние здоровья спортсменов, проблемы спортивной патологии в юном возрасте стали звучать более актуально [11]. В условиях развития детско-юношеского спорта необходимо тщательно подходить к вопросу системности и адекватности тренировочного процесса, психосоматического благополучия юных спортсменов. Надо особо отметить, что общественная и/или эмоциональная жизнь подростка оказывает огромное влияние на его физическое здоровье и, наоборот, при наличии у него хронических заболеваний возможны серьезные психосоциальные проблемы и тревоги [15].
Период роста и формирования организма как никакой другой нуждается в строго индивидуальном подходе тренера и врача к тренирующимся спортсменам. Общий или стандартизированный подход к тренировкам может снижать их эффективность, приводить к физическим перегрузкам, эмоциональным срывам и, как следствие, потере интереса ребенка к занятиям или даже уходу из спорта. Темпы роста, созревания, функциональные и психологические особенности, скорость восстановительных и адаптивных процессов являются строго индивидуальными [16]. Так же остро стоит проблема повышения физической работоспособности и ускорения протекания восстановительных процессов после значительных физических напряжений, вопрос энергетического обеспечения и поддержания процесса мышечной деятельности [17].
К сожалению, проблема митохондриальной патологии применительно к спортивной медицине изучена недостаточно. В связи с этим необходимо расширить представления о роли митохондрий в физиологических и адаптационных регуляциях, о возможностях коррекции энергодефицитных состояний, о схемах применения энерготропной терапии. Многочисленные клинические исследования, проведенные в последние годы, свидетельствуют о том, что относительная недостаточность энергетического фона может наблюдаться и у практически здоровых лиц. Это особенно актуально для спортсменов, так как в ответ на интенсивные физические нагрузки даже при благоприятном соматическом состоянии развивается тканевая гипоксия и ишемия. В подобной ситуации может возникать широкий спектр метаболических функциональных нарушений из-за снижения активности ферментов митохондриальной дыхательной цепи [18]. Развитие митохондриального направления дает возможность изучить влияние нарушений клеточного энергообмена на механизмы адаптации у спортсменов. Необходимо отметить, что адаптационный синдром является одним из основных звеньев в патогенезе патологического процесса, формирующегося при действии стрессовых факторов [8].
В зависимости от типа и характера выполняемой физической (мышечной) работы различают следующие типы выносливости:
1. статическую и динамическую выносливость, т.е. способность длительно выполнять, соответственно, статическую или динамическую работу;
2. локальную и глобальную выносливость, т.е. способность длительно осуществлять, соответственно, локальную работу (с участием небольшого числа мышц) или глобальную работу (при участии больших мышечных групп — более половины мышечной массы);
3. силовую выносливость, т.е. способность многократно повторять упражнения, требующие проявления большой мышечной силы;
4. анаэробную и аэробную выносливость, т.е. способность длительно выполнять глобальную работу с преимущественно анаэробным или аэробным типом энергообеспечения.
В спортивной физиологии выделяют понятие выносливость и определяют ее как способность длительно выполнять глобальную мышечную работу преимущественно или исключительно аэробного характера [19]. Одним из свойств, характерных для механизма адаптации и роста выносливости к аэробным нагрузкам, является большее потребление кислорода скелетными мышцами — возрастание максимального потребления кислорода (МПК). МПК — это максимально возможная скорость потребления кислорода в единицу времени при выполнении физической нагрузки, выражается в л/мин или в мл/мин/кг [20]. Аэробная и анаэробная производительность зависит от пола, возраста, массы тела и даже от композиционного состава тела спортсмена, а также от уровня тренированности спортсмена [21]. Более низкая эффективность и экономичность кислородных режимов организма, связанная с физиологическими особенностями растущего организма, также отражается на адаптации юного спортсмена к физическим нагрузкам.
Наибольший годовой прирост аэробной производительности отмечается у мальчиков 13-14 лет (МПК на 28%, кислородный пульс на 24%), максимальный прирост абсолютной величины МПК наблюдается с 15 до 16 лет; у девочек наибольший прирост — в 12-13 лет (МПК на 17%, пульс на 18%). Максимальные абсолютные величины аэробной производительности у мальчиков достигаются к 18 годам, у девочек — к 15 [22]. Это позволяет нам говорить о лучшей переносимости аэробных нагрузок в пубертатный период. Максимальный прирост анаэробной работоспособности приходится на возраст 15 лет, что совпадает с увеличением количества гликолитических волокон в мышцах. Так, в многочисленных исследованиях было показано, что окончательный вариант типоспецифичности мышечного волокна устанавливается только после полового созревания, так как наиболее интенсивные изменения скорости ростовых процессов различных типов мышечных волокон и энергетического потенциала происходят в пубертатный период [22].
В последнее время количество исследований, посвященных возрастным особенностям энергообеспечения мышечной деятельности, значительно увеличивается. Все эти работы указывают на то, что в период от 7 до 17 лет происходит наиболее интенсивное развитие энергетики скелетных мышц и функциональных механизмов. Эти механизмы являются основой энергетического обеспечения физической активности и являются показателем совершенствования и целенаправленного развития двигательных качеств детей и подростков [23].
Уровень МПК также зависит от максимальных возможностей двух функциональных систем:
1) кислородтранспортной системы, абсорбирующей кислород из окружающего воздуха и транспортирующей его к работающим мышцам, другим активным органам и тканям тела;
2) системы утилизации кислорода, т. е. мышечной системы, экстрагирующей и
утилизирующей доставляемый кровью кислород.
У спортсменов, имеющих высокие показатели максимального потребления кислорода, обе эти системы обладают наибольшими функциональными возможностями [18]. Во многих исследованиях наблюдалась тесная связь между переносимостью аэробных нагрузок в течение длительного времени и активностью окислительных ферментов митохондрий.
В настоящее время для определения характеристик митохондриальных функций используются клинические, биохимические (оценка уровней пирувата и лактата, антиоксидантной активности, продуктов перекисного окисления липидов крови) и молекулярно-генетические методы (выявление мутаций митохондриальной ДНК и ядерных мутаций, приводящих к нарушению синтеза митохондриальных белков). Однако в современной диагностике митохондриальных нарушений ведущее место занимают морфологические методы исследования [24].
Активность митохондриальных ферментов (сукцинатдегидрогеназы, — СДГ, α-глицерофосфатдегидрогеназы — α-ГФДГ, лактатдегидрогеназы — ЛДГ) в мышечных волокнах является достаточно надежным показателем окислительного потенциала [25, 26]. СДГ — основной энергетический фермент, который катализирует окисление янтарной кислоты, позволяет с высокой степенью достоверности судить о функциональной активности всего митохондриального аппарата. Локализуется на внутренней мембране митохондрий. α-ГФДГ — фермент, отражающий работу глицерофосфатного челночного механизма по транспорту электрон-эквивалентов из цитоплазмы в митохондрии, а также обмен фосфолипидов. ЛДГ — фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной в процессе гликолиза. Доступными и информативными для динамической оценки интенсивности аэробных окислительных процессов в организме оказались цитохимические тесты на активность этих ферментов лимфоцитов периферической крови (количественный цитохимический метод, модифицированный Нарциссовым, 1969-1993 гг.). После ряда исследований получены данные о достоверной корреляции функциональной активности митохондрий лимфоцитов, отражающие полисистемную митохондриальную недостаточность с тестом на «рваные» красные волокна в биоптатах скелетных мышц [5].
Имеются данные, что ферментный статус лимфоцитов отражает состояние ферментного статуса клеток практически всех тканей организма: мозга, миокарда, печени, почек, селезенки, тимуса, мышц, слизистой оболочки желудка и кишечника [27]. Поэтому для исследования митохондриальной активности всех тканей организма возможно применение практически неинвазивной методики — цитохимического анализа активности митохондриальных ферментов, предложенного Нарциссовым Р.П. Увеличение абсолютного числа митохондрий в тканях, в частности феномен «рваных красных волокон» (RRF) в скелетных мышцах, является проявлением компенсаторных способностей организма, позволяющих справиться с тем или иным функциональным дефектом [1, 4].
По сравнению с исследованием биоптата определение ферментативной активности в лимфоцитах является неинвазивной методикой, что значительно облегчает ее применение в педиатрической и спортивной практике. Анализ гистохимических, гистологических показателей биоптатов скелетной мышцы, а также цитохимических характеристик ферментов биоэнергетического обмена лимфоцитов периферической крови показывает, что процесс пролиферации митохондрий является неспецифическим механизмом тканевой адаптации к функциональной недостаточности органов и систем [1, 9].
Окислительная способность мышц определяется как количеством митохондрий, так и активностью окислительных ферментов в них. Окислительный метаболизм клеток в конечном счете зависит от их адекватного снабжения кислородом. В состоянии покоя потребности организма в АТФ относительно невелики, поэтому потребность в кислороде также минимальна. Соответственно увеличению интенсивности нагрузки возрастает и потребность в энергии [25]. Для спортсменов, задействованных в тех видах спорта, которые требуют наибольшей мышечной работы и энергетических затрат, очень важным и информативным является показатель уровня, динамики лактата и пирувата до и после физической нагрузки. Содержание лактата и пирувата в биологических средах служит косвенным критерием энергетического гомеостаза, своего рода показателем направленности гликолитических превращений углеводов. Баланс указанных веществ определяет критерий соотношения (КС) — лактат/пируват — в биологических средах, а повышение показателя расценивается как свидетельство преобладания анаэробного гликолиза над аэробным [28].
В связи с этим целесообразно говорить о таком понятии, как порог лактата. Порог лактата — момент начала аккумуляции лактата в крови во время физической нагрузки, увеличивающейся интенсивности сверх уровней, характерных для состояния покоя. Порог лактата считается надежным показателем потенциальных возможностей спортсмена выполнять физические нагрузки, требующие проявления выносливости. Увеличение интенсивности физической нагрузки приводит к более быстрому накоплению лактата.
Согласно определению порог лактата должен отражать взаимодействие между аэробной и анаэробной энергетическими системами. По мнению некоторых исследователей, при помощи определения порога лактата возможно отследить значительный сдвиг в сторону анаэробного гликолиза, вследствие которого и образуется лактат. Поэтому значительное повышение уровня лактата крови при увеличении усилия называют анаэробным порогом или порогом анаэробного обмена (ПАНО) [25]. Наиболее важными для спортсменов являются процессы обратного превращения лактата в пируват. Это происходит с помощью фермента лактат-дегидрогеназы сердечного типа (ЛДГ-с), в состав которого входит витамин В1 (тиамин). В свою очередь пируват превращается в ацетил-коэнзим с помощью фермента пируват-дегидрогеназы (ПДГ). При недостатке указанных ферментов спортсмены могут выполнять длительные упражнения только на уровне аэробного порога и кратковременную работу на уровне анаэробного порога, при использовании жиров как источника энергообеспечения [1, 29].
При выполнении спортсменами упражнений преимущественно аэробного характера скорость потребления кислорода становится тем выше, чем больше мощность выполняемой нагрузки (скорость перемещения). Поэтому в тех видах спорта, которые требуют проявления большой выносливости, спортсмены должны обладать большими аэробными возможностями: 1) высокой максимальной скоростью потребления кислорода, т.е. большой аэробной «мощностью» и 2) способностью длительно поддерживать высокую скорость потребления кислорода (большой аэробной «емкостью») [19]. Существует три вида тренировок, направленных на развитие выносливости: интенсивная аэробная тренировка, промежуточная аэробная тренировка и экстенсивная аэробная тренировка. К аэробным нагрузкам также относят восстановительную тренировку [20].
В заключение можно отметить, что в настоящее время педиатрические аспекты спортивной патологии стали звучать более актуально. Развитие метаболического направления в профилактической медицине дает возможность изучить влияние нарушений клеточного энергообмена на механизмы адаптации, в том числе и у юных спортсменов.
1. Сухоруков В.С. Очерки митохондриальной патологии // Москва: Медпрактика-М, 2011.
2. Царегородцев А.Д., Сухоруков В.С. Митохондриальная медицина — проблемы и задачи // Российский вестник перинатологии и педиатрии. — 2012. — № 4-2. — С. 5-14.
3. Luft R. The development of mitochondrial Medicine // Proc. Natl. Acad. USA. — 1994. — Vol. 91. — Р. 8731-8738.
4. Nir Eynon, María Morán, Ruth Birk, etc The champions’ mitochondria: is it genetically determined? A review on mitochondrial DNA and elite athletic performance // Physiological Genomics. — 2011. — Vol. 43. — Р. 789-798.
5. Ершова С.А. Дисфункция митохондрий при нефропатиях у детей (Обзор литературы) // Нефрология и диализ. — 2003. — Т. 5, № 4. — С. 344-352.
6. Житникова Л.М. Триметазидин в метаболической терапии сердечно-сосудистых заболеваний // Русский медицинский журнал. Кардиология. — 2012, июнь. — № 14.
7. Леонтьева И.В., Николаева Е.А., Алимина Е.Г. и др. Клиническое значение оценки показателей карнитинового обмена при кардиомипатиях у детей // Практика педиатра. — 2012, октябрь. — С. 74-79.
8. Шабельникова Е.И. Морфофункциональные характеристики митохондрий лимфоцитов у детей при различных формах недостаточности клеточного энергообмена: автореф. дис. … канд. мед. наук. — М., 2005.
9. Леонтьева И.В., Сухоруков В.С., Ключников С.О. Митохондриальная дисфункция при кардиомиопатиях у детей // Лекции по педиатрии. Кардиология. — М., 2004. — Т. 4. — С. 399-413.
10. Richard H. Haas Mitochondrial Disease: A Practical Approach for Primary Care Physicians // Pediatrics. — 2007. — Vol. 6. — Р. 1326-1333.
11. Балыкова Л.А., Ивянский С.А., Макаров Л.М., и др. Перспективы метаболической терапии в детской спортивной кардиологии // Педиатрия. — 2009. — Т. 88, № 5. — C. 7-13.
12. Ключников С.О. Перспективы применения L-карнитина в педиатрии // Consilium Medicum Педиатрия. — 2007. — № 2. — C.116-119.
13. Вельтищев Ю.Е. Наследственное предрасположение к болезням, диатезы и пограничные состояния у детей // Педиатрия. — 1984. — № 12. — С. 3-9.
14. Tudor Rasanu, Teofil Mehedinti, Anca Hancu, et al. Mitochondrial myopathies: current diagnosis (ii) // Romanian journal of neurology. — 2011. — Vol. X, № 1.
15. Ключников С.О., Ильяшенко Д.А., Ключников М.С. Эффективность Карнитона и Кудесана у подростков. Клинико-функциональное и психологическое исследование // Практика педиатра. — 2009.
16. Граевская Н.Д., Долматова Т.И. Спортивная медицина // М., 2008. — С. 269.
17. Яценко Л.Г., Высочин Ю.В., Денисенко Ю.П. Физиологические механизмы срочной адаптации и экстренного повышения физической работоспособности // Вестник спортивной науки. — 2006. — № 2. — C. 3-6.
18. Рычкова Т.И., Остроухова И.П., Яцков С.А. и др. Методы коррекции функциональных изменений сердечно-сосудистой системы препаратом L-карнитина у детей и подростков с сочетанной патологией // Лечащий врач. — 2010. — № 8.
19. Коц Я.М. — Спортивная физиология. Учебник для институтов физической культуры // М.: Физкультура и спорт, 1986. — 240 с.
20. Янсен П. ЧСС, лактат и тренировки на выносливость / пер. с англ. / П. Янсен. — Мурманск: Тулома, 2006. — 160 с.
21. Claude Bouchard, Ping An, Treva Rice et al. Familial aggregation of V˙O2 max response to exercise training: results from the HERITAGE Family Study Journal of Applied Physiology. — 1999. — Vol. 3. — Р. 1003-1008.
22. Гольдберг Н.Д., Дондуковская Р.Р. Питание юных спортсменов // Советский спорт. — 2009.
23. Тамбовцева Р.В. Возрастные и типологические особенности энергетики мышечной деятельности: автореф. дис. … д-ра биол. наук. — М., 2003. — 50 с.
24. Меркурьева А.В., Сухоруков В.С., Смирнов А.В. и др. Комплексная гистологическая диагностика полисистемной митохондриальной недостаточности // Вестник РУДН, серия «Медицина». — 2003. — № 5 (24). — C. 50-53.
25. Уилмор Дж.Х., Костил Д.Л. Физиология спорта и двигательной активности // Киев, 1997. — C. 94, 99.
26. Wolf N.I., Smeitink A.M. Mitochondrial disorders: proposal for consensus diagnostic criteria in infants and children // Neurology. — 2002. — Vol. 59. — Р. 1402-1405.
27. Шищенко В.М., Крепей В.В., Петричук С.В., и др. Новые возможности цитохимического анализа в оценке состояния здоровья ребенка и прогнозе его развития // Педиатрия. — 1998. — № 4. — C. 96-101.
28. Рылова Н.В., Малиновская Ю.В., Хафизова Г.Н. Показатели энергетического обмена у детей с патологией органов пищеварения // Казанский медицинский журнал. — 2008. — Т. 89, № 2. — C. 195-196.
29. Заборова В.А. Энергообеспечение и питание в спорте // М., 2011. — С. 107.
1. Suhorukov V.S. Ocherki mitohondrial’noj patologii // Moskva: Medpraktika-M, 2011.
2. Caregorodcev A.D., Suhorukov V.S. Mitohondrial’naja medicina — problemy i zadachi // Rossijskij vestnik perinatologii i pediatrii. — 2012. — № 4-2. — S. 5-14.
3. Luft R. The development of mitochondrial Medicine // Proc. Natl. Acad. USA. — 1994. — Vol. 91. — P. 8731-8738.
4. Nir Eynon, María Morán, Ruth Birk, etc The champions’ mitochondria: is it genetically determined? A review on mitochondrial DNA and elite athletic performance // Physiological Genomics. — 2011. — Vol. 43. — P. 789-798.
5. Ershova S.A. Disfunkcija mitohondrij pri nefropatijah u detej (Obzor literatury) // Nefrologija i dializ. — 2003. — T. 5, № 4. — S. 344-352.
6. Zhitnikova L.M. Trimetazidin v metabolicheskoj terapii serdechno-sosudistyh zabolevanij // Russkij medicinskij zhurnal. Kardiologija. — 2012, ijun’. — № 14.
7. Leont’eva I.V., Nikolaeva E.A., Alimina E.G. i dr. Klinicheskoe znachenie ocenki pokazatelej karnitinovogo obmena pri kardiomipatijah u detej // Praktika pediatra. — 2012, oktjabr’. — S. 74-79.
8. Shabel’nikova E.I. Morfofunkcional’nye harakteristiki mitohondrij limfocitov u detej pri razlichnyh formah nedostatochnosti kletochnogo jenergoobmena: avtoref. dis. … kand. med. nauk. — M., 2005.
9. Leont’eva I.V., Suhorukov V.S., Kljuchnikov S.O. Mitohondrial’naja disfunkcija pri kardiomiopatijah u detej // Lekcii po pediatrii. Kardiologija. — M., 2004. — T. 4. — S. 399-413.
10. Richard H. Haas Mitochondrial Disease: A Practical Approach for Primary Care Physicians // Pediatrics. — 2007. — Vol. 6. — P. 1326-1333.
11. Balykova L.A., Ivjanskij S.A., Makarov L.M., i dr. Perspektivy metabolicheskoj terapii v detskoj sportivnoj kardiologii // Pediatrija. — 2009. — T. 88, № 5. — C. 7-13.
12. Kljuchnikov S.O. Perspektivy primenenija L-karnitina v pediatrii // Consilium Medicum Pediatrija. — 2007. — № 2. — C.116-119.
13. Vel’tishhev Ju.E. Nasledstvennoe predraspolozhenie k boleznjam, diatezy i pogranichnye sostojanija u detej // Pediatrija. — 1984. — № 12. — S. 3-9.
14. Tudor Rasanu, Teofil Mehedinti, Anca Hancu, et al. Mitochondrial myopathies: current diagnosis (ii) // Romanian journal of neurology. — 2011. — Vol. X, № 1.
15. Kljuchnikov S.O., Il’jashenko D.A., Kljuchnikov M.S. Jeffektivnost’ Karnitona i Kudesana u podrostkov. Kliniko-funkcional’noe i psihologicheskoe issledovanie // Praktika pediatra. — 2009.
16. Graevskaja N.D., Dolmatova T.I. Sportivnaja medicina // M., 2008. — S. 269.
17. Jacenko L.G., Vysochin Ju.V., Denisenko Ju.P. Fiziologicheskie mehanizmy srochnoj adaptacii i jekstrennogo povyshenija fizicheskoj rabotosposobnosti // Vestnik sportivnoj nauki. — 2006. — № 2. — S. 3-6.
18. Rychkova T.I., Ostrouhova I.P., Jackov S.A. i dr. Metody korrekcii funkcional’nyh izmenenij serdechno-sosudistoj sistemy preparatom L-karnitina u detej i podrostkov s sochetannoj patologiej // Lechashhij vrach. — 2010. — № 8.
19. Koc Ja.M. — Sportivnaja fiziologija. Uchebnik dlja institutov fizicheskoj kul’tury // M.: Fizkul’tura i sport, 1986. — 240 s.
20. Jansen P. ChSS, laktat i trenirovki na vynoslivost’ / per. s angl. / P. Jansen. — Murmansk: Tuloma, 2006. — 160 s.
21. Claude Bouchard, Ping An, Treva Rice et al. Familial aggregation of V˙O2 max response to exercise training: results from the HERITAGE Family Study Journal of Applied Physiology. — 1999. — Vol. 3. — P. 1003-1008.